第五单元第二节(第2课时化学方程式的书写)课件-2022-2023学年八年级化学鲁教版(五四学制)全一册(共21张PPT)
文档属性
| 名称 | 第五单元第二节(第2课时化学方程式的书写)课件-2022-2023学年八年级化学鲁教版(五四学制)全一册(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 305.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-24 11:59:26 | ||
图片预览








文档简介
(共21张PPT)
第2课时 化学方程式的书写
基础 主干落实
1.书写原则:
(1)必须以_________为依据。
(2)必须遵循_____________(即配平)。
客观事实
质量守恒定律
2.书写步骤:写、配、注、查(以过氧化氢分解制取氧气为例)
步骤 书写过程
(1)写:写出反应物与生成物的化学式 _______________
(2)配:配平,使反应前后各种元素的原子个数相等,把短线改为等号 __________________
(3)注:注明反应条件及生成物的状态 ____________________
(4)查:检查化学式是否正确;是否配平;反应条件是否注明正确;生成物状态是否漏标或多标
MnO2
====
H2O2——H2O+O2
2H2O2===2H2O+O2
2H2O2 2H2O+O2↑
【特别提醒】有气体生成的反应中,如果反应物和生成物都有气体,气体生成物不标“↑”;溶液中的反应如果反应物和生成物都有固体,固体生成物不标“↓”。
【导·思】
“配平就是改变化学方程式两边化学式中的数字,使各种原子的种类和数目前后相同”,这种说法是否正确?为什么?
_______________________________________________________________
_______________________________________________________________
提示:不正确。反应物与生成物的组成和结构都是固定的,一旦改变其中的数字,就不再表示原来的物质组成,甚至出现自然界根本不存在的物质,违背了客观事实。
重点 案例探析
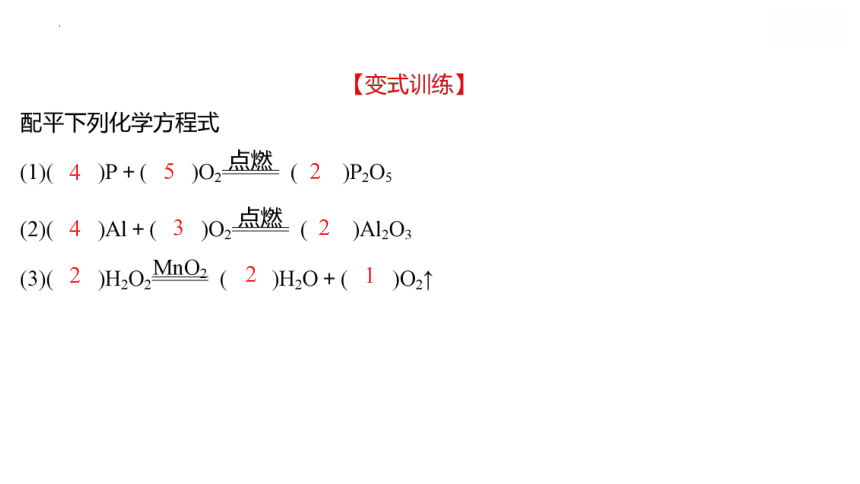
2
1
2
1
5
3
4
4
11
2
8
1
1
1
2
【解析】(1)可用最小公倍数法配平,化学计量数自左到右分别为2、1、2。
(2)可用定一法配平,先暂定C3H8前化学计量数为“1”,在水的化学式的前面加上化学计量数4,再依次配平碳元素、氧元素,化学计量数自左到右分别为1、5、3、4。(3)用奇数配偶法配平,先在三氧化二铁的前面加化学计量数2,再依次配平铁元素、硫元素,最后配平氧元素,化学计量数自左到右分别为4、11、2、8。(4)可用观察法配平,先在Cu2(OH)2CO3的前面加上化学计量数1,再依次配平其他元素,化学计量数自左到右分别为1、1、1、2。
4
5
2
4
3
2
2
2
1
【方法归纳】化学方程式的常见配平方法
1.观察法:全靠观察确定化学计量数,以配平化学方程式,它适用于简单的化学方程式的配平。
2.最小公倍数法:(1)选择左右只出现一次且个数最多的原子作起点,求其最小公倍数,(2)以最小公倍数分别除以该原子在不同化学式中的个数作为该化学式的化学计量数,(3)由该化学式的化学计量数推出其他化学计量数。
3.奇数配偶法:当某元素原子出现次数最多,且在左右两边一奇一偶时,常在奇数个原子对应的化学式前配一个2,再由此推出其他化学计量数。
【A层 基础必会】
1.(2022·淄博质检)下列关于化学方程式的书写说法正确的是( )
A.生成物中的气体一定要用“↑”标注
B.配平化学方程式可以改变化学式中元素符号右下角的数字
C.书写化学方程式要以客观事实为依据
D.化学方程式配平后的特征是化学方程式两端化学计量数之和相等
【解析】有气体生成的化学反应中,若反应物中有气体,生成物中的气体不用标“↑”,A错误;化学式中元素符号右下角的数字不可以改变,B错误;化学方程式的书写要以客观事实为依据,不能臆造,C正确;由质量守恒定律可知,反应前后各原子的数目不变,化学方程式配平后的特征是化学方程式两端各元素的原子总数相等,D错误。
素养 分层评价
C
C
B
A
D
B
【B层 能力进阶】
6.(2021·呼伦贝尔中考)如图是甲、乙两物质在点燃条件下发生化学反应的
示意图,下列分析不正确的是( )
A.反应前后原子种类和数目不变
B.该反应前后分子数目没有改变
C.反应的化学方程式为H2+Cl2===HCl
D.参加反应的甲、乙两物质质量比为2∶71
C
7.(2022·东营垦利区期末)请根据描述写出下列反应的化学方程式。
(1)工业上高温煅烧石灰石制取二氧化碳和氧化钙:
__________________________;
(2)高温条件下,一氧化碳和氧化铁反应生成铁和二氧化碳:
______________________________;
(3)在溶液中,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠:
_______________________________________;
(4)金属镁在二氧化碳中燃烧生成氧化镁和碳:
___________________________。
高温
====
高温
====
点燃
====
CaCO3 CaO+CO2↑
Fe2O3+3CO 2Fe+3CO2
2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
2Mg+CO2 2MgO+C
【解析】(1)反应条件:高温,反应物:石灰石,生成物:二氧化碳和氧化钙。(2)反应条件:高温,反应物:一氧化碳和氧化铁,生成物:铁和二氧化碳。(3)反应物:硫酸铜和氢氧化钠,生成物:氢氧化铜沉淀和硫酸钠。(4)反应条件:点燃,反应物:镁和二氧化碳,生成物:氧化镁和碳。
第2课时 化学方程式的书写
基础 主干落实
1.书写原则:
(1)必须以_________为依据。
(2)必须遵循_____________(即配平)。
客观事实
质量守恒定律
2.书写步骤:写、配、注、查(以过氧化氢分解制取氧气为例)
步骤 书写过程
(1)写:写出反应物与生成物的化学式 _______________
(2)配:配平,使反应前后各种元素的原子个数相等,把短线改为等号 __________________
(3)注:注明反应条件及生成物的状态 ____________________
(4)查:检查化学式是否正确;是否配平;反应条件是否注明正确;生成物状态是否漏标或多标
MnO2
====
H2O2——H2O+O2
2H2O2===2H2O+O2
2H2O2 2H2O+O2↑
【特别提醒】有气体生成的反应中,如果反应物和生成物都有气体,气体生成物不标“↑”;溶液中的反应如果反应物和生成物都有固体,固体生成物不标“↓”。
【导·思】
“配平就是改变化学方程式两边化学式中的数字,使各种原子的种类和数目前后相同”,这种说法是否正确?为什么?
_______________________________________________________________
_______________________________________________________________
提示:不正确。反应物与生成物的组成和结构都是固定的,一旦改变其中的数字,就不再表示原来的物质组成,甚至出现自然界根本不存在的物质,违背了客观事实。
重点 案例探析
2
1
2
1
5
3
4
4
11
2
8
1
1
1
2
【解析】(1)可用最小公倍数法配平,化学计量数自左到右分别为2、1、2。
(2)可用定一法配平,先暂定C3H8前化学计量数为“1”,在水的化学式的前面加上化学计量数4,再依次配平碳元素、氧元素,化学计量数自左到右分别为1、5、3、4。(3)用奇数配偶法配平,先在三氧化二铁的前面加化学计量数2,再依次配平铁元素、硫元素,最后配平氧元素,化学计量数自左到右分别为4、11、2、8。(4)可用观察法配平,先在Cu2(OH)2CO3的前面加上化学计量数1,再依次配平其他元素,化学计量数自左到右分别为1、1、1、2。
4
5
2
4
3
2
2
2
1
【方法归纳】化学方程式的常见配平方法
1.观察法:全靠观察确定化学计量数,以配平化学方程式,它适用于简单的化学方程式的配平。
2.最小公倍数法:(1)选择左右只出现一次且个数最多的原子作起点,求其最小公倍数,(2)以最小公倍数分别除以该原子在不同化学式中的个数作为该化学式的化学计量数,(3)由该化学式的化学计量数推出其他化学计量数。
3.奇数配偶法:当某元素原子出现次数最多,且在左右两边一奇一偶时,常在奇数个原子对应的化学式前配一个2,再由此推出其他化学计量数。
【A层 基础必会】
1.(2022·淄博质检)下列关于化学方程式的书写说法正确的是( )
A.生成物中的气体一定要用“↑”标注
B.配平化学方程式可以改变化学式中元素符号右下角的数字
C.书写化学方程式要以客观事实为依据
D.化学方程式配平后的特征是化学方程式两端化学计量数之和相等
【解析】有气体生成的化学反应中,若反应物中有气体,生成物中的气体不用标“↑”,A错误;化学式中元素符号右下角的数字不可以改变,B错误;化学方程式的书写要以客观事实为依据,不能臆造,C正确;由质量守恒定律可知,反应前后各原子的数目不变,化学方程式配平后的特征是化学方程式两端各元素的原子总数相等,D错误。
素养 分层评价
C
C
B
A
D
B
【B层 能力进阶】
6.(2021·呼伦贝尔中考)如图是甲、乙两物质在点燃条件下发生化学反应的
示意图,下列分析不正确的是( )
A.反应前后原子种类和数目不变
B.该反应前后分子数目没有改变
C.反应的化学方程式为H2+Cl2===HCl
D.参加反应的甲、乙两物质质量比为2∶71
C
7.(2022·东营垦利区期末)请根据描述写出下列反应的化学方程式。
(1)工业上高温煅烧石灰石制取二氧化碳和氧化钙:
__________________________;
(2)高温条件下,一氧化碳和氧化铁反应生成铁和二氧化碳:
______________________________;
(3)在溶液中,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠:
_______________________________________;
(4)金属镁在二氧化碳中燃烧生成氧化镁和碳:
___________________________。
高温
====
高温
====
点燃
====
CaCO3 CaO+CO2↑
Fe2O3+3CO 2Fe+3CO2
2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
2Mg+CO2 2MgO+C
【解析】(1)反应条件:高温,反应物:石灰石,生成物:二氧化碳和氧化钙。(2)反应条件:高温,反应物:一氧化碳和氧化铁,生成物:铁和二氧化碳。(3)反应物:硫酸铜和氢氧化钠,生成物:氢氧化铜沉淀和硫酸钠。(4)反应条件:点燃,反应物:镁和二氧化碳,生成物:氧化镁和碳。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
