中考二轮专题复习 化学实验综合题复习课 教案
文档属性
| 名称 | 中考二轮专题复习 化学实验综合题复习课 教案 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-24 21:18:12 | ||
图片预览

文档简介
化学实验综合题复习课教案
【教学目的】
巩固相关知识点
提高学生分析实验的能力
部分有能力的学生增强数据处理能力
【教学理念】
分层次教学,做到所有的学生有事可做。在课堂上有所得
增强复习课的容量
引入:每道题目分为四个组甲、乙、丙、丁,难度也不断增大,请每位同学根据自己的能力选择相关的题组完成。
一、学习碳酸钠知识时,老师做碳酸钠溶液和澄清石灰水反应演示实验,并对浑浊液过滤,得到澄清滤液。课堂上老师的提问和同学们的回答如下图所示。
甲组:
写出题目中涉及到的物质的俗名
你还能写出我们学过的哪些物质的俗名
初中化学中我们经常用澄清石灰水来检验二氧化碳气体,请写出化学方程式
这是碱与非金属氧化物反应生成盐和水,请写出同一类的化学方程式。比如二氧化硫与氢氧化钠反应等等。(请尽可能多写几个类似的化学方程式)
乙组:
(1)假设你是丁同学,请你提出一个与甲、乙、丙同学不同的猜想,你的猜想是 。(2)你认为甲、乙、丙同学的猜想都合理吗?如有不合理的,请说明理由 。
(3)请写出演示实验中发生反应的化学方程式,针对你的猜想请设计实验加以验证
丙组:
(1)甲同学针对自己的猜想进行了如下实验:
实验步骤 实验现象 实验结论
取样于试管中,滴入几滴稀盐酸 没有气体产生 猜想不成立
你认为甲同学的实验设计是否正确? ,其理由是 。
(2)请你设计实验方案确定滤液中溶质的组成 。
(3)若滤液含有Na+、OH-、和CO32-的混合溶液,某同学加适量的氯化钙除去碳酸根离子制得氢氧化钠溶液,该方法是否正确? 其理由是
丁组:
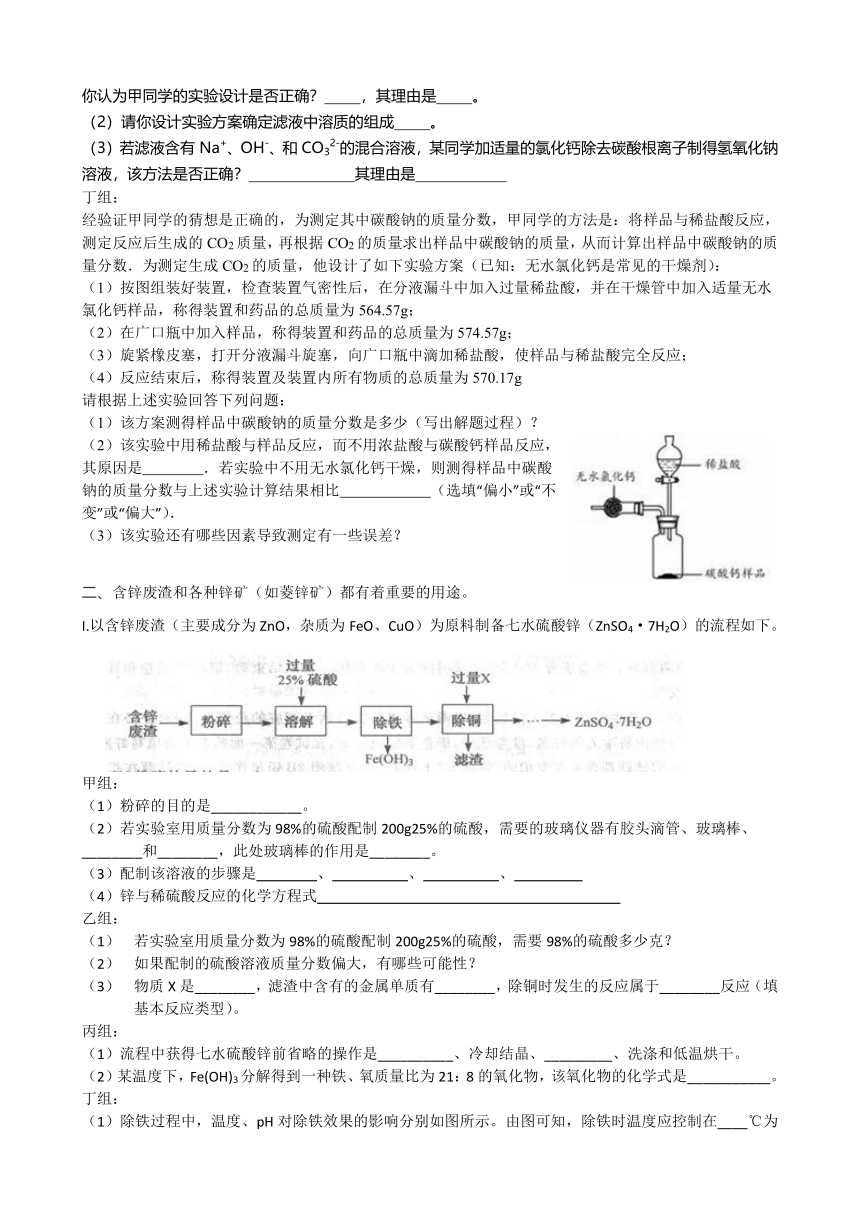
经验证甲同学的猜想是正确的,为测定其中碳酸钠的质量分数,甲同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钠的质量,从而计算出样品中碳酸钠的质量分数.为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
(1)按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;
(2)在广口瓶中加入样品,称得装置和药品的总质量为574.57g;
(3)旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
(4)反应结束后,称得装置及装置内所有物质的总质量为570.17g
请根据上述实验回答下列问题:
(1)该方案测得样品中碳酸钠的质量分数是多少(写出解题过程)?
(2)该实验中用稀盐酸与样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是 .若实验中不用无水氯化钙干燥,则测得样品中碳酸钠的质量分数与上述实验计算结果相比 (选填“偏小”或“不变”或“偏大”).
(3)该实验还有哪些因素导致测定有一些误差?
二、含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途。
I.以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
甲组:
(1)粉碎的目的是____________。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、________和________,此处玻璃棒的作用是________。
(3)配制该溶液的步骤是 、 、 、
(4)锌与稀硫酸反应的化学方程式
乙组:
若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸多少克?
如果配制的硫酸溶液质量分数偏大,有哪些可能性?
物质X是________,滤渣中含有的金属单质有________,除铜时发生的反应属于________反应(填基本反应类型)。
丙组:
(1)流程中获得七水硫酸锌前省略的操作是__________、冷却结晶、_________、洗涤和低温烘干。
(2)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化学式是___________。
丁组:
(1)除铁过程中,温度、pH对除铁效果的影响分别如图所示。由图可知,除铁时温度应控制在____℃为宜,pH应控制在____为宜。
II.以某菱锌矿(ZnCO3 含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):
ZnCO3 高温 ZnO + CO2↑ ZnO+CO高温Zn + CO2 。则100吨这样的菱锌矿理论上最多可制得锌多少吨?(写出计算过程)
三、材料是人类赖以身存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁。
甲组:
(一)铁材料的有关知识
人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是______________。
钢铁材料通常分为生铁和钢。右图是我国1997年发行的纪念钢产量首次突破1亿吨的邮票。邮票通常密封保存在聚乙烯塑料袋中。
①以上叙述中不涉及到的材料是________(填序号)
合金 B.无机非金属材料 C.有机合成材料
②以赤铁矿为原料也炼铁反应的化学方程式___________。
③钢铁露置在空气中易生锈,请提出防止生锈的一种措施_______________。
乙组:
(二)铁及其化合物的实验
将Fe粉溶于稀H2SO4,此反应属于_______(填基本反应类型)。用点燃法检验生成的H2前必须____________。
炼铁的原料有 ,其中提供还原剂的是
向上述反应后的溶液中滴加NaOH溶液,生成白色Fe(OH)2沉淀,随后沉淀变为灰绿色。
成Fe(OH)2反应的化学方程式______________。
丙组:
②白色沉淀变为灰绿色的原因之一是部分Fe(OH)2接触空气生成Fe(OH)3,反应的化学方程式______________。生成的Fe(OH)3分解为Fe2O3。
③过滤、洗涤、低温干燥得到灰绿色固体,其组成为2FeSO4·2Fe(OH)2·Fe2O3[相对分子质量为644]。能证明固体已洗干净的方法为_______________。
(三)灰绿色固体的热分解实验
兴趣小组称取此固体6.44g,在科研人员的指导下用下图装置进行热分解实验。
【查阅资料】①Fe(OH)2在150℃~200℃时完全分解FeO;
②FeSO4在450℃~500℃是完全分解为Fe2O3,
2FeSO4450℃~500℃Fe2O3+SO2↑+SO3↑
1.加热前后及过程中均通入N2,加热前通N2的目的是________________。
丁组:
2.控制温度在不同的范围对A中样品加热,测得剩余固体质量随温度的变化如右下图所示。B装置中硫酸只能吸收SO3和H2O,当加热到t1℃时,装置C中的现象为_____________。
①图中E点对应的m1=_____________。
②图中F点对物质中Fe2O3的质量为______________g。
③科研人员将F点所得剩余固体隔绝空气,在密闭容器中加热到1400℃,得到纯净的磁性Fe3O4。已知加热过程中发生两个反应,且反应前后固体总质量不变。请写出其中一个反应的化学方程式______________________。
【教学目的】
巩固相关知识点
提高学生分析实验的能力
部分有能力的学生增强数据处理能力
【教学理念】
分层次教学,做到所有的学生有事可做。在课堂上有所得
增强复习课的容量
引入:每道题目分为四个组甲、乙、丙、丁,难度也不断增大,请每位同学根据自己的能力选择相关的题组完成。
一、学习碳酸钠知识时,老师做碳酸钠溶液和澄清石灰水反应演示实验,并对浑浊液过滤,得到澄清滤液。课堂上老师的提问和同学们的回答如下图所示。
甲组:
写出题目中涉及到的物质的俗名
你还能写出我们学过的哪些物质的俗名
初中化学中我们经常用澄清石灰水来检验二氧化碳气体,请写出化学方程式
这是碱与非金属氧化物反应生成盐和水,请写出同一类的化学方程式。比如二氧化硫与氢氧化钠反应等等。(请尽可能多写几个类似的化学方程式)
乙组:
(1)假设你是丁同学,请你提出一个与甲、乙、丙同学不同的猜想,你的猜想是 。(2)你认为甲、乙、丙同学的猜想都合理吗?如有不合理的,请说明理由 。
(3)请写出演示实验中发生反应的化学方程式,针对你的猜想请设计实验加以验证
丙组:
(1)甲同学针对自己的猜想进行了如下实验:
实验步骤 实验现象 实验结论
取样于试管中,滴入几滴稀盐酸 没有气体产生 猜想不成立
你认为甲同学的实验设计是否正确? ,其理由是 。
(2)请你设计实验方案确定滤液中溶质的组成 。
(3)若滤液含有Na+、OH-、和CO32-的混合溶液,某同学加适量的氯化钙除去碳酸根离子制得氢氧化钠溶液,该方法是否正确? 其理由是
丁组:
经验证甲同学的猜想是正确的,为测定其中碳酸钠的质量分数,甲同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钠的质量,从而计算出样品中碳酸钠的质量分数.为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
(1)按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;
(2)在广口瓶中加入样品,称得装置和药品的总质量为574.57g;
(3)旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
(4)反应结束后,称得装置及装置内所有物质的总质量为570.17g
请根据上述实验回答下列问题:
(1)该方案测得样品中碳酸钠的质量分数是多少(写出解题过程)?
(2)该实验中用稀盐酸与样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是 .若实验中不用无水氯化钙干燥,则测得样品中碳酸钠的质量分数与上述实验计算结果相比 (选填“偏小”或“不变”或“偏大”).
(3)该实验还有哪些因素导致测定有一些误差?
二、含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途。
I.以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。
甲组:
(1)粉碎的目的是____________。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、________和________,此处玻璃棒的作用是________。
(3)配制该溶液的步骤是 、 、 、
(4)锌与稀硫酸反应的化学方程式
乙组:
若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸多少克?
如果配制的硫酸溶液质量分数偏大,有哪些可能性?
物质X是________,滤渣中含有的金属单质有________,除铜时发生的反应属于________反应(填基本反应类型)。
丙组:
(1)流程中获得七水硫酸锌前省略的操作是__________、冷却结晶、_________、洗涤和低温烘干。
(2)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化学式是___________。
丁组:
(1)除铁过程中,温度、pH对除铁效果的影响分别如图所示。由图可知,除铁时温度应控制在____℃为宜,pH应控制在____为宜。
II.以某菱锌矿(ZnCO3 含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):
ZnCO3 高温 ZnO + CO2↑ ZnO+CO高温Zn + CO2 。则100吨这样的菱锌矿理论上最多可制得锌多少吨?(写出计算过程)
三、材料是人类赖以身存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁。
甲组:
(一)铁材料的有关知识
人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是______________。
钢铁材料通常分为生铁和钢。右图是我国1997年发行的纪念钢产量首次突破1亿吨的邮票。邮票通常密封保存在聚乙烯塑料袋中。
①以上叙述中不涉及到的材料是________(填序号)
合金 B.无机非金属材料 C.有机合成材料
②以赤铁矿为原料也炼铁反应的化学方程式___________。
③钢铁露置在空气中易生锈,请提出防止生锈的一种措施_______________。
乙组:
(二)铁及其化合物的实验
将Fe粉溶于稀H2SO4,此反应属于_______(填基本反应类型)。用点燃法检验生成的H2前必须____________。
炼铁的原料有 ,其中提供还原剂的是
向上述反应后的溶液中滴加NaOH溶液,生成白色Fe(OH)2沉淀,随后沉淀变为灰绿色。
成Fe(OH)2反应的化学方程式______________。
丙组:
②白色沉淀变为灰绿色的原因之一是部分Fe(OH)2接触空气生成Fe(OH)3,反应的化学方程式______________。生成的Fe(OH)3分解为Fe2O3。
③过滤、洗涤、低温干燥得到灰绿色固体,其组成为2FeSO4·2Fe(OH)2·Fe2O3[相对分子质量为644]。能证明固体已洗干净的方法为_______________。
(三)灰绿色固体的热分解实验
兴趣小组称取此固体6.44g,在科研人员的指导下用下图装置进行热分解实验。
【查阅资料】①Fe(OH)2在150℃~200℃时完全分解FeO;
②FeSO4在450℃~500℃是完全分解为Fe2O3,
2FeSO4450℃~500℃Fe2O3+SO2↑+SO3↑
1.加热前后及过程中均通入N2,加热前通N2的目的是________________。
丁组:
2.控制温度在不同的范围对A中样品加热,测得剩余固体质量随温度的变化如右下图所示。B装置中硫酸只能吸收SO3和H2O,当加热到t1℃时,装置C中的现象为_____________。
①图中E点对应的m1=_____________。
②图中F点对物质中Fe2O3的质量为______________g。
③科研人员将F点所得剩余固体隔绝空气,在密闭容器中加热到1400℃,得到纯净的磁性Fe3O4。已知加热过程中发生两个反应,且反应前后固体总质量不变。请写出其中一个反应的化学方程式______________________。
同课章节目录
