浙教版2022-2023学年上学期九年级科学分类题型训练:第一章《物质及其变化》计算题(1)【word,含答案】
文档属性
| 名称 | 浙教版2022-2023学年上学期九年级科学分类题型训练:第一章《物质及其变化》计算题(1)【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 154.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-09-26 06:58:15 | ||
图片预览



文档简介
1.某样品为Cu和CuO的混合物,为测定样品中CuO的含量,甲、乙、丙、丁四位学生用同一种样品分别进行实验,测得的数据如表,分析实验数据,回答下列问题:
(1)求混合物中氧化铜的质量分数。
(2)求硫酸溶液中溶质的质量分数。
2.黄铜是铜和锌的合金(Cu-Zn),可用来制造电器零件及日用品。为测定某黄铜样品中铜的质量分数(不考虑黄铜中其他杂质),当向10g黄铜样品粉末中加入98g稀硫酸时恰好完全反应,称得烧杯中物质的质量为107.9g。请计算:
(1)反应生成氢气的质量为____g。
(2)此黄铜样品中铜的质量分数。
3.实验室有一瓶敞口放置一段时间的氢氧化钠固体,为测定这瓶样品中氢氧化钠的质量分数,做如下实验:现取瓶中17.3g样品溶于足量的水中,向所得溶液中逐滴加入200g一定溶质质量分数的稀盐酸。实验过程如图所示:试计算:
(1)恰好完全反应时,产生气体的质量是_________g。
(2)所加稀盐酸中的溶质的质量分数是多少?
(3)样品中氢氧化钠的质量分数是多少?(结果保留一位小数)
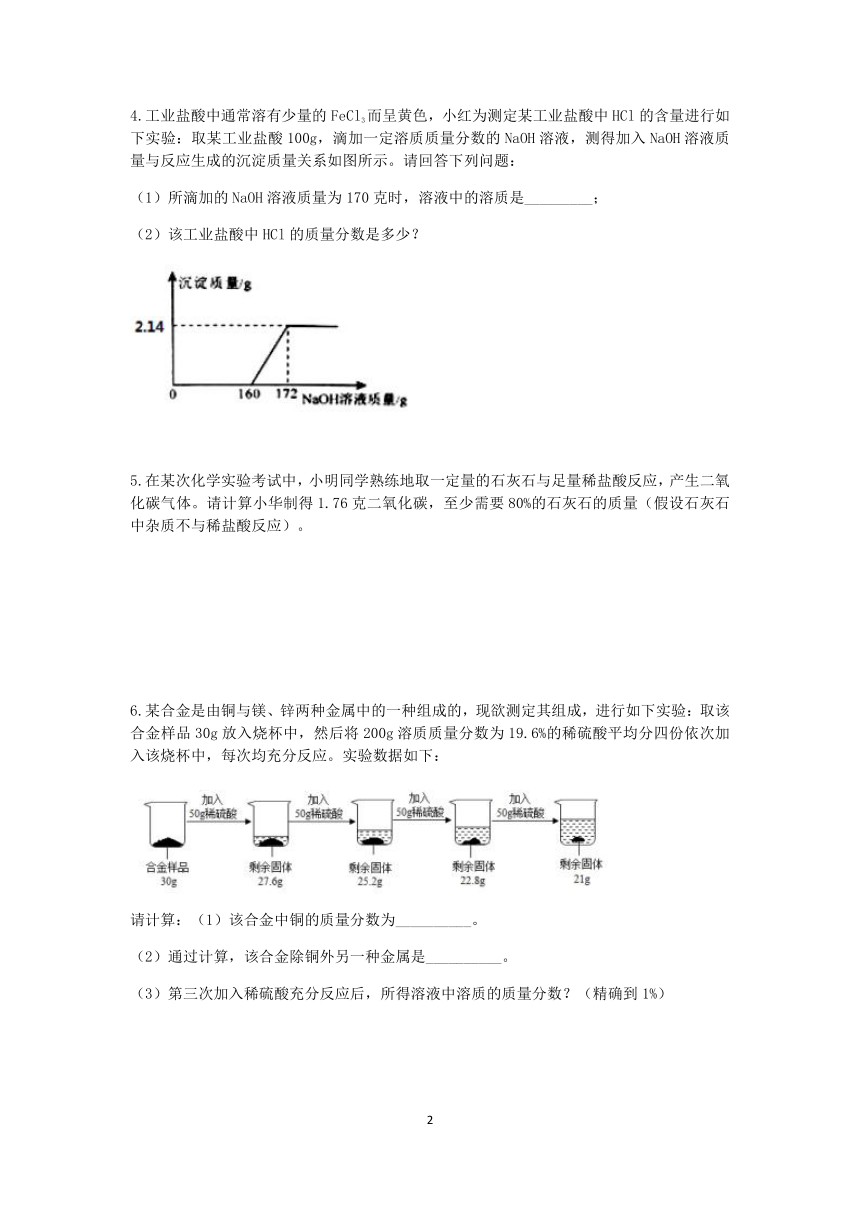
4.工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸100g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。请回答下列问题:
(1)所滴加的NaOH溶液质量为170克时,溶液中的溶质是_________;
(2)该工业盐酸中HCl的质量分数是多少?
5.在某次化学实验考试中,小明同学熟练地取一定量的石灰石与足量稀盐酸反应,产生二氧化碳气体。请计算小华制得1.76克二氧化碳,至少需要80%的石灰石的质量(假设石灰石中杂质不与稀盐酸反应)。
6.某合金是由铜与镁、锌两种金属中的一种组成的,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为19.6%的稀硫酸平均分四份依次加入该烧杯中,每次均充分反应。实验数据如下:
请计算:(1)该合金中铜的质量分数为__________。
(2)通过计算,该合金除铜外另一种金属是__________。
(3)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数?(精确到1%)
7.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请计算:
(1)若要清洗100kg的这种石油产品,需要多少千克的NaOH?
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理100kg这种产品,可以节约多少经费NaOH和Ca(OH)2的市场价格如下表:
8.为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为10%的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会儿氮气。(样品中其他成分不与稀硫酸反应)
(1)实验前,先往A装置通入一会儿氮气的目的是____________________。
(2)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱___________中碳酸钠的质量分数是多少?(碳酸钠与稀硫酸反应的化学方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑)
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由_________________。
9.小杭想测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是_________合金;
(2)老师又给了小杭一瓶硝酸银溶液,小杭取前一次无法测得结果的合金10g投入足量的硝酸银溶液中,充分反应后,经测定,固体质量变成了25.2g,求该合金中铜的质量分数。
10.10克碳酸钙与稀盐酸反应,加入稀盐酸的质量与生成气体的质量关系如图所示。
(1)当加入73克稀盐酸时,稀盐酸与碳酸钙恰好完全反应,求:反应生成的气体的质量是多少?反应后溶液中溶质的质量分数是多少?
(2)当加入120克稀盐酸时,经充分反应,溶液中溶质是________________。
11.为测定某黄铜(铜锌合金)样品中铜的含量,某化学活动小组分三次进行实验,实验数据如表,请回答下列问题:
(1)第____次实验中,药品成分恰好完全反应。
(2)黄铜样品中铜的质量分数是多少?
(3)恰好完全反应时所得溶液的溶质质量分数是多少?(精确到0.1%)
12.下列五种溶液:①NaOH溶液、②Ba(OH)2溶液、③Na2SO4溶液、④稀硝酸、⑤混有少量硝酸的MgSO4溶液。
(1)指出其中属于碱溶液的是_________(选填序号)
(2)若将Ba(OH)2溶液与Na2SO4溶液混合,产生沉淀质量是116.5克,需要20%的硫酸钠溶液多少克?
13.黄铜是铜、锌合金,它用于制造机器、电器零件等。为测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到100克稀硫酸中,恰好完全反应,产生氢气0.1g。试求:
(1)该黄铜样品中锌的质量。
(2)稀硫酸溶质的质量分数。
参考答案
1.(1)40% (2)9.8%
2.0.1克 67.5%
(1)分析图象可知,二氧化碳的最大质量是2.2g。
设生成2.2g二氧化碳消耗的盐酸的质量为x,消耗的碳酸钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
y x 2.2g
73/x=44/2.2g=106/y x=3.65g y=5.3g
所加稀盐酸中的溶质的质量分数是:3.65g/50g×100%=7.3%。
(3)样品中氢氧化钠的质量分数是:(17.3g 5.3g)/17.3g×100%≈69.4%
4.(1)NaCl、FeCl3
由图可知,与氯化铁反应的氢氧化钠溶液的质量为172g-160g=12g;
设消耗的氢氧化钠的质量为x
FeCl3+3NaOH═Fe(OH)3↓+3NaCl;
120 107
x 2.14g x=2.4g
氢氧化钠溶液的溶质质量分数=2.4/12=20%与盐酸反应的氢氧化钠的质量为:160g×20%=32g
HCl+NaOH═H2O+NaCl;
36.5 40
y 32g
y=29.2g
该工业盐酸中HCl的质量分数是=29.2/100=29.2%
解:设CaCO3质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.76g
100/x=44/1.76g x=4g m(石灰石)=4g/80%=5g
(1)70% (2)镁
设第三次所得溶液中MgSO4的质量为y,生成H2的质量为z。
Mg + H2SO4═ MgSO4 + H2↑
98 120 2
150g×19.6% y z
98/150g×19.6%=120/y 98/2=150g×19.6%/z y=36g z=0.6g
ZnSO4溶液中溶质质量分数=36g/(150g+7.2g 0.6g)×100%≈23%
解:(1)设需要NaOH的质量为x,则
NaOH+H2SO4==Na2SO4+2H2O
80 98
x 100kg×4.9% 80/98=x/100kg×4.9% 计算得出x=4kg
答:需要4千克的NaOH。
设改进后需要Ca(OH)2的质量为y,则
Ca(OH)2+H2SO4==CaSO4+2H2O
74 98
y 100kg×4.9% 74/98=y/100kg×4.9% 计算得出y=3.7kg
节约经费:4kg×24.00元/kg-3.7kg×6.00元/kg=73.8元
答:每处理100kg这种产品,可以节约73.8元。
(1)避免容器中的空气对实验干扰
(2)根据图乙可知,反应最终产生二氧化碳3.52g;设纯碱中碳酸钠的质量分数为x,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10g·x 3.52g
106/10g x=44/3.52g x=84.8%
(3)浓盐酸易挥发,挥发出的氯化氢气体能和氢氧化钠反应
9.
10.(1)4.4g 14.12%(2)氯化钙、氯化氢
11.(1)二
(2)2HCl+Zn==ZnCl2+H2↑
65 136 2
x y 0.2
65/x=2/0.2 x=6.5克 Cu%=(10-6.5)/10=35%
(3)136/y=2/0.2 Y=13.6克 溶液质量=6.5+100-0.2=106.3克
ZnCl2%=13.6/106.3=12.8%
12.(1)①②(2)355g
13.(1)3.25g(2)4.9%
《物质及其变化》计算训练(1)
(1)求混合物中氧化铜的质量分数。
(2)求硫酸溶液中溶质的质量分数。
2.黄铜是铜和锌的合金(Cu-Zn),可用来制造电器零件及日用品。为测定某黄铜样品中铜的质量分数(不考虑黄铜中其他杂质),当向10g黄铜样品粉末中加入98g稀硫酸时恰好完全反应,称得烧杯中物质的质量为107.9g。请计算:
(1)反应生成氢气的质量为____g。
(2)此黄铜样品中铜的质量分数。
3.实验室有一瓶敞口放置一段时间的氢氧化钠固体,为测定这瓶样品中氢氧化钠的质量分数,做如下实验:现取瓶中17.3g样品溶于足量的水中,向所得溶液中逐滴加入200g一定溶质质量分数的稀盐酸。实验过程如图所示:试计算:
(1)恰好完全反应时,产生气体的质量是_________g。
(2)所加稀盐酸中的溶质的质量分数是多少?
(3)样品中氢氧化钠的质量分数是多少?(结果保留一位小数)
4.工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸100g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。请回答下列问题:
(1)所滴加的NaOH溶液质量为170克时,溶液中的溶质是_________;
(2)该工业盐酸中HCl的质量分数是多少?
5.在某次化学实验考试中,小明同学熟练地取一定量的石灰石与足量稀盐酸反应,产生二氧化碳气体。请计算小华制得1.76克二氧化碳,至少需要80%的石灰石的质量(假设石灰石中杂质不与稀盐酸反应)。
6.某合金是由铜与镁、锌两种金属中的一种组成的,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为19.6%的稀硫酸平均分四份依次加入该烧杯中,每次均充分反应。实验数据如下:
请计算:(1)该合金中铜的质量分数为__________。
(2)通过计算,该合金除铜外另一种金属是__________。
(3)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数?(精确到1%)
7.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请计算:
(1)若要清洗100kg的这种石油产品,需要多少千克的NaOH?
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理100kg这种产品,可以节约多少经费NaOH和Ca(OH)2的市场价格如下表:
8.为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为10%的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会儿氮气。(样品中其他成分不与稀硫酸反应)
(1)实验前,先往A装置通入一会儿氮气的目的是____________________。
(2)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱___________中碳酸钠的质量分数是多少?(碳酸钠与稀硫酸反应的化学方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑)
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由_________________。
9.小杭想测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是_________合金;
(2)老师又给了小杭一瓶硝酸银溶液,小杭取前一次无法测得结果的合金10g投入足量的硝酸银溶液中,充分反应后,经测定,固体质量变成了25.2g,求该合金中铜的质量分数。
10.10克碳酸钙与稀盐酸反应,加入稀盐酸的质量与生成气体的质量关系如图所示。
(1)当加入73克稀盐酸时,稀盐酸与碳酸钙恰好完全反应,求:反应生成的气体的质量是多少?反应后溶液中溶质的质量分数是多少?
(2)当加入120克稀盐酸时,经充分反应,溶液中溶质是________________。
11.为测定某黄铜(铜锌合金)样品中铜的含量,某化学活动小组分三次进行实验,实验数据如表,请回答下列问题:
(1)第____次实验中,药品成分恰好完全反应。
(2)黄铜样品中铜的质量分数是多少?
(3)恰好完全反应时所得溶液的溶质质量分数是多少?(精确到0.1%)
12.下列五种溶液:①NaOH溶液、②Ba(OH)2溶液、③Na2SO4溶液、④稀硝酸、⑤混有少量硝酸的MgSO4溶液。
(1)指出其中属于碱溶液的是_________(选填序号)
(2)若将Ba(OH)2溶液与Na2SO4溶液混合,产生沉淀质量是116.5克,需要20%的硫酸钠溶液多少克?
13.黄铜是铜、锌合金,它用于制造机器、电器零件等。为测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到100克稀硫酸中,恰好完全反应,产生氢气0.1g。试求:
(1)该黄铜样品中锌的质量。
(2)稀硫酸溶质的质量分数。
参考答案
1.(1)40% (2)9.8%
2.0.1克 67.5%
(1)分析图象可知,二氧化碳的最大质量是2.2g。
设生成2.2g二氧化碳消耗的盐酸的质量为x,消耗的碳酸钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
y x 2.2g
73/x=44/2.2g=106/y x=3.65g y=5.3g
所加稀盐酸中的溶质的质量分数是:3.65g/50g×100%=7.3%。
(3)样品中氢氧化钠的质量分数是:(17.3g 5.3g)/17.3g×100%≈69.4%
4.(1)NaCl、FeCl3
由图可知,与氯化铁反应的氢氧化钠溶液的质量为172g-160g=12g;
设消耗的氢氧化钠的质量为x
FeCl3+3NaOH═Fe(OH)3↓+3NaCl;
120 107
x 2.14g x=2.4g
氢氧化钠溶液的溶质质量分数=2.4/12=20%与盐酸反应的氢氧化钠的质量为:160g×20%=32g
HCl+NaOH═H2O+NaCl;
36.5 40
y 32g
y=29.2g
该工业盐酸中HCl的质量分数是=29.2/100=29.2%
解:设CaCO3质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.76g
100/x=44/1.76g x=4g m(石灰石)=4g/80%=5g
(1)70% (2)镁
设第三次所得溶液中MgSO4的质量为y,生成H2的质量为z。
Mg + H2SO4═ MgSO4 + H2↑
98 120 2
150g×19.6% y z
98/150g×19.6%=120/y 98/2=150g×19.6%/z y=36g z=0.6g
ZnSO4溶液中溶质质量分数=36g/(150g+7.2g 0.6g)×100%≈23%
解:(1)设需要NaOH的质量为x,则
NaOH+H2SO4==Na2SO4+2H2O
80 98
x 100kg×4.9% 80/98=x/100kg×4.9% 计算得出x=4kg
答:需要4千克的NaOH。
设改进后需要Ca(OH)2的质量为y,则
Ca(OH)2+H2SO4==CaSO4+2H2O
74 98
y 100kg×4.9% 74/98=y/100kg×4.9% 计算得出y=3.7kg
节约经费:4kg×24.00元/kg-3.7kg×6.00元/kg=73.8元
答:每处理100kg这种产品,可以节约73.8元。
(1)避免容器中的空气对实验干扰
(2)根据图乙可知,反应最终产生二氧化碳3.52g;设纯碱中碳酸钠的质量分数为x,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10g·x 3.52g
106/10g x=44/3.52g x=84.8%
(3)浓盐酸易挥发,挥发出的氯化氢气体能和氢氧化钠反应
9.
10.(1)4.4g 14.12%(2)氯化钙、氯化氢
11.(1)二
(2)2HCl+Zn==ZnCl2+H2↑
65 136 2
x y 0.2
65/x=2/0.2 x=6.5克 Cu%=(10-6.5)/10=35%
(3)136/y=2/0.2 Y=13.6克 溶液质量=6.5+100-0.2=106.3克
ZnCl2%=13.6/106.3=12.8%
12.(1)①②(2)355g
13.(1)3.25g(2)4.9%
《物质及其变化》计算训练(1)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
