浙教版2022-2023学年上学期九年级科学分类题型训练:第一章《物质及其变化》计算题(2)【word,含答案】
文档属性
| 名称 | 浙教版2022-2023学年上学期九年级科学分类题型训练:第一章《物质及其变化》计算题(2)【word,含答案】 |

|
|
| 格式 | doc | ||
| 文件大小 | 170.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-09-26 00:00:00 | ||
图片预览



文档简介
1.某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。如图是反应过程中烧杯和混合物的总质量(m)与反应时间(t)的关系。求:
(1)生成CO2的质量。
(2)该纯碱样品中Na2CO3的质量分数。
(3)根据条件,此题还可求算出下列中的__________(只填字母标号)。
A.该纯碱样品中NaCl的质量 B.反应所用稀盐酸的溶质质量分数
C.反应后所得溶液中NaCl的质量分数 D.反应消耗稀盐酸的溶质质量
2.现有氧化铜和铜的混合物,对其成分进行分析。取10 g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:
(1)上述表格中m的值为__________,10g样品中CuO的质量为_____________g。
(2)计算所加入稀硫酸中溶质的质量分数.
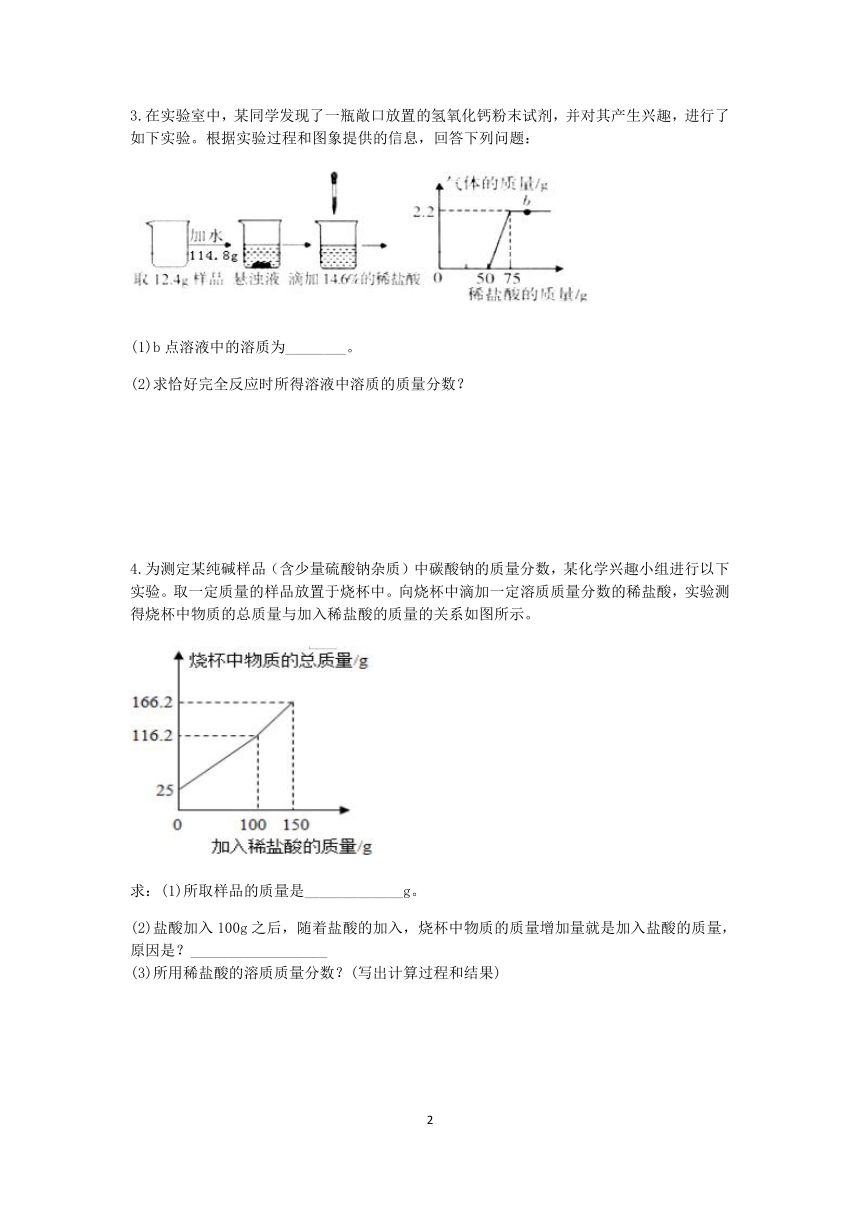
3.在实验室中,某同学发现了一瓶敞口放置的氢氧化钙粉末试剂,并对其产生兴趣,进行了如下实验。根据实验过程和图象提供的信息,回答下列问题:
(1)b点溶液中的溶质为________。
(2)求恰好完全反应时所得溶液中溶质的质量分数?
4.为测定某纯碱样品(含少量硫酸钠杂质)中碳酸钠的质量分数,某化学兴趣小组进行以下实验。取一定质量的样品放置于烧杯中。向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入稀盐酸的质量的关系如图所示。
求:(1)所取样品的质量是_____________g。
(2)盐酸加入100g之后,随着盐酸的加入,烧杯中物质的质量增加量就是加入盐酸的质量,原因是?__________________
(3)所用稀盐酸的溶质质量分数?(写出计算过程和结果)
5.若用20g表面部分已氧化的镁带,跟足量稀硫酸反应,生成氢气0.4g,则该镁带中单质镁的质量分数是多少?
6.10克碳酸钙与稀盐酸反应的关系如图。
(1)当加入73克稀盐酸时,稀盐酸与碳酸钙恰好完全反应。当加入73克稀盐酸时,反应后溶液中溶质的质量分数是多少?(精确到0.1%)
(2)当加入120克稀盐酸时,溶液中溶质是__________(写化学式)。
7.侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下:NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl,请计算:
(1)NaHCO3在物质的分类上属于_________(选填“酸”、“碱”、“盐”、“有机物”)
(2)生产8.4t碳酸氢钠,理论上需要氯化钠的质量。
8.小明同学取已部分变质的氢氧化钠固体样品若干克放入烧杯中,加水溶解,向其中滴加10%的稀盐酸,所加稀盐酸的质量和产生的二氧化碳气体的质量关系如图所示。
(1)当加入了50克盐酸时,溶液中含有的溶质有哪些_____________。
(2)实验所取的样品生成二氧化碳质量是多少?(列式计算)
9.某研究性学习小组的同学对某矿区的矿石中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(杂质不溶于水,不与盐酸反应)。
请计算:
(1)上表中的m=________。
(2)样品中的碳酸钙的质量分数是多少?
10.将体积为V1,质量分数为3.65%的HCl溶液逐滴滴入盛有体积为V2未知浓度的NaOH溶液的烧杯中(如图甲),测量并记录溶液的pH变化(如图乙)和温度变化(如图丙)。(实验中始终保持V1+V2=50.0mL且各种溶液密度均为1.0g/mL)
(1)图乙中V1=0时,图甲中烧杯内溶液的颜色显________色。
(2)实验中发生反应的化学方程式为________。
(3)图乙中的pH=7时,此时滴入的HCl溶液的体积V1=________mL。
(4)通过该实验给出的判断,其中正确的是________。
A.进行该实验时环境温度为22℃
B.该实验中的反应放出热量
C.该实验表明有水生成的反应都是放热反应
D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱
(5)实验中所用NaOH溶液的溶质质量分数为________。
11.精盐(NaCl)和纯碱(Na2CO3)是家庭厨房中的常见物质。
(1)用化学方法区别精盐和纯碱,可以选择下列物质中的( )
A白酒 B白醋 C纯净水 D酱油
(2)已知Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,现有精盐(NaCl)和纯碱(Na2CO3)的混合物53克,加入足量的稀硫酸,充分反应后,生成4.4克二氧化碳气体,则该固体混合物中纯碱(Na2CO3)的质量是多少克?氯化钠的质量分数又是多少?
12.某同学为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如表所示:
根据该同学的实验,试回答以下问题:
(1)表中第四次实验中合金里的铁恰好与稀硫酸完全反应,则其中X=__________,Y=________。
(2)该铁合金中铁的质量分数是多少?
13.科学兴趣小组的同学在老师的指导下,对用铁碳合金制作的校徽中单质铁的含量进行了测定。他们将几枚校徽样品进行粉碎处理,四组同学各取6.0克粉末样品置于烧杯中,然后加入不同体积的稀硫酸,完全反应后,对烧杯中剩余固体进行称量。相关的实验数据记录如下:
(1)判断第3次加入的稀硫酸有没有完全反应,并说明理由。
(2)6.0克样品与稀硫酸完全反应能产生氢气多少克?
参考答案
(1)根据质量守恒定律,生成二氧化碳的质量:172.5g-163.7g=8.8g
设:样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 8.8g
106/x=44/8.8g x=21.2g
Na2CO3%=21.2g/26.5g×100%=80%
(3)A D
2.(1)3;7 (2)12.25%
3.(1)CaCl2、HCl (2)8.325%
4.(1) 25 (2)碳酸钠已反应完全 (3)14.6%
5.解:(1)设生成二氧化碳质量为x,生成氯化钙质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
10g y x
100/10g=44/x解之得:x=4.4g 100/10g=111/y解之得:y=11.1g
反应后溶液中溶质的质量分数=11.1/(10g+73g 4.4g)×100%≈14.1%
答:当加入73克稀盐酸时,反应后溶液中溶质的质量分数是14.1%;
(2)CaCl2、HCl。
7.(1)盐(2)5.85吨
8.(1)氯化钠、氢氧化钠、碳酸钠 (2)4.4克
9.(1)3g(2)85%
10.(1)红(2)HCl+NaOH=NaCl+H2O(3)30(4)B(5)6%
11.(1)B
(2)解:设纯碱的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 4.4g
106/x=44/4.4g x=10.6g
m(NaCl)=53g-10.6g=42.4g
NaCl%=42.4g/53g×100%=80%
12.(1)240;0.6 (2)56%
13.(1)有(1分),每用10毫升稀硫酸就能消耗掉1.4克铁,第3次再多加10毫升稀硫酸时,剩余固体从1.8克减少到0.4克,恰好消耗1.4克铁。
(2) 解设:6克样品与稀硫酸完全反应生成氢气的质量为x
6克样品中含铁的质量:6g-0.4g=5.6g
Fe+H2SO4=FeSO4+H2↑
56 2
5.6g x
56/ 5.6g=2/x
x=0.2克
《物质及其变化》计算训练(2)
(1)生成CO2的质量。
(2)该纯碱样品中Na2CO3的质量分数。
(3)根据条件,此题还可求算出下列中的__________(只填字母标号)。
A.该纯碱样品中NaCl的质量 B.反应所用稀盐酸的溶质质量分数
C.反应后所得溶液中NaCl的质量分数 D.反应消耗稀盐酸的溶质质量
2.现有氧化铜和铜的混合物,对其成分进行分析。取10 g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题:
(1)上述表格中m的值为__________,10g样品中CuO的质量为_____________g。
(2)计算所加入稀硫酸中溶质的质量分数.
3.在实验室中,某同学发现了一瓶敞口放置的氢氧化钙粉末试剂,并对其产生兴趣,进行了如下实验。根据实验过程和图象提供的信息,回答下列问题:
(1)b点溶液中的溶质为________。
(2)求恰好完全反应时所得溶液中溶质的质量分数?
4.为测定某纯碱样品(含少量硫酸钠杂质)中碳酸钠的质量分数,某化学兴趣小组进行以下实验。取一定质量的样品放置于烧杯中。向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入稀盐酸的质量的关系如图所示。
求:(1)所取样品的质量是_____________g。
(2)盐酸加入100g之后,随着盐酸的加入,烧杯中物质的质量增加量就是加入盐酸的质量,原因是?__________________
(3)所用稀盐酸的溶质质量分数?(写出计算过程和结果)
5.若用20g表面部分已氧化的镁带,跟足量稀硫酸反应,生成氢气0.4g,则该镁带中单质镁的质量分数是多少?
6.10克碳酸钙与稀盐酸反应的关系如图。
(1)当加入73克稀盐酸时,稀盐酸与碳酸钙恰好完全反应。当加入73克稀盐酸时,反应后溶液中溶质的质量分数是多少?(精确到0.1%)
(2)当加入120克稀盐酸时,溶液中溶质是__________(写化学式)。
7.侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下:NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl,请计算:
(1)NaHCO3在物质的分类上属于_________(选填“酸”、“碱”、“盐”、“有机物”)
(2)生产8.4t碳酸氢钠,理论上需要氯化钠的质量。
8.小明同学取已部分变质的氢氧化钠固体样品若干克放入烧杯中,加水溶解,向其中滴加10%的稀盐酸,所加稀盐酸的质量和产生的二氧化碳气体的质量关系如图所示。
(1)当加入了50克盐酸时,溶液中含有的溶质有哪些_____________。
(2)实验所取的样品生成二氧化碳质量是多少?(列式计算)
9.某研究性学习小组的同学对某矿区的矿石中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(杂质不溶于水,不与盐酸反应)。
请计算:
(1)上表中的m=________。
(2)样品中的碳酸钙的质量分数是多少?
10.将体积为V1,质量分数为3.65%的HCl溶液逐滴滴入盛有体积为V2未知浓度的NaOH溶液的烧杯中(如图甲),测量并记录溶液的pH变化(如图乙)和温度变化(如图丙)。(实验中始终保持V1+V2=50.0mL且各种溶液密度均为1.0g/mL)
(1)图乙中V1=0时,图甲中烧杯内溶液的颜色显________色。
(2)实验中发生反应的化学方程式为________。
(3)图乙中的pH=7时,此时滴入的HCl溶液的体积V1=________mL。
(4)通过该实验给出的判断,其中正确的是________。
A.进行该实验时环境温度为22℃
B.该实验中的反应放出热量
C.该实验表明有水生成的反应都是放热反应
D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱
(5)实验中所用NaOH溶液的溶质质量分数为________。
11.精盐(NaCl)和纯碱(Na2CO3)是家庭厨房中的常见物质。
(1)用化学方法区别精盐和纯碱,可以选择下列物质中的( )
A白酒 B白醋 C纯净水 D酱油
(2)已知Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,现有精盐(NaCl)和纯碱(Na2CO3)的混合物53克,加入足量的稀硫酸,充分反应后,生成4.4克二氧化碳气体,则该固体混合物中纯碱(Na2CO3)的质量是多少克?氯化钠的质量分数又是多少?
12.某同学为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如表所示:
根据该同学的实验,试回答以下问题:
(1)表中第四次实验中合金里的铁恰好与稀硫酸完全反应,则其中X=__________,Y=________。
(2)该铁合金中铁的质量分数是多少?
13.科学兴趣小组的同学在老师的指导下,对用铁碳合金制作的校徽中单质铁的含量进行了测定。他们将几枚校徽样品进行粉碎处理,四组同学各取6.0克粉末样品置于烧杯中,然后加入不同体积的稀硫酸,完全反应后,对烧杯中剩余固体进行称量。相关的实验数据记录如下:
(1)判断第3次加入的稀硫酸有没有完全反应,并说明理由。
(2)6.0克样品与稀硫酸完全反应能产生氢气多少克?
参考答案
(1)根据质量守恒定律,生成二氧化碳的质量:172.5g-163.7g=8.8g
设:样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 8.8g
106/x=44/8.8g x=21.2g
Na2CO3%=21.2g/26.5g×100%=80%
(3)A D
2.(1)3;7 (2)12.25%
3.(1)CaCl2、HCl (2)8.325%
4.(1) 25 (2)碳酸钠已反应完全 (3)14.6%
5.解:(1)设生成二氧化碳质量为x,生成氯化钙质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
10g y x
100/10g=44/x解之得:x=4.4g 100/10g=111/y解之得:y=11.1g
反应后溶液中溶质的质量分数=11.1/(10g+73g 4.4g)×100%≈14.1%
答:当加入73克稀盐酸时,反应后溶液中溶质的质量分数是14.1%;
(2)CaCl2、HCl。
7.(1)盐(2)5.85吨
8.(1)氯化钠、氢氧化钠、碳酸钠 (2)4.4克
9.(1)3g(2)85%
10.(1)红(2)HCl+NaOH=NaCl+H2O(3)30(4)B(5)6%
11.(1)B
(2)解:设纯碱的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 4.4g
106/x=44/4.4g x=10.6g
m(NaCl)=53g-10.6g=42.4g
NaCl%=42.4g/53g×100%=80%
12.(1)240;0.6 (2)56%
13.(1)有(1分),每用10毫升稀硫酸就能消耗掉1.4克铁,第3次再多加10毫升稀硫酸时,剩余固体从1.8克减少到0.4克,恰好消耗1.4克铁。
(2) 解设:6克样品与稀硫酸完全反应生成氢气的质量为x
6克样品中含铁的质量:6g-0.4g=5.6g
Fe+H2SO4=FeSO4+H2↑
56 2
5.6g x
56/ 5.6g=2/x
x=0.2克
《物质及其变化》计算训练(2)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
