沪教版化学九年级上册 4.3 化学方程式的书写与应用 课件(共27张PPT)
文档属性
| 名称 | 沪教版化学九年级上册 4.3 化学方程式的书写与应用 课件(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-26 17:33:55 | ||
图片预览







文档简介
(共27张PPT)
第四章 认识化学变化
沪教版九年级上册化学课件
第三节
化学方程式的书写与应用
学习目标
学习目标
1.理解并能运用质量守恒定律;
2.能正确书写简单的化学反应方程式。
3. 认识定量研究对化学科学发展的意义。
4.在理解化学方程式的基础上,使学生掌握有关反应物、生成物质量的计算
新课讲解
新课讲解
知识点一
化学反应的表示方法
定义:用化学式来表示化学反应的式子。
表示的意义:
表示反应物、生成物以及反应条件。
表示反应物、生成物之间的质量关系(质量比)。
表示反应物、生成物之间的粒子个数关系。
(粒子个数比)(化学计量数之比)
新课讲解
读法:
碳和氧气在点燃的条件下生成二氧化碳。
1个碳原子和1个氧分子在点燃的条件下反应,生成1个二氧化碳分子。
例如:C + O2 CO2
每12份质量的碳和32份质量的氧气在点燃的条件下反应,生成44份质量的二氧化碳。
点燃
新课讲解
二是符合质量守恒定律。等号两边各种原子的种类和数目必须相同。
一是以客观事实为依据。写出反应物和生成物的化学式。
书写原则
新课讲解
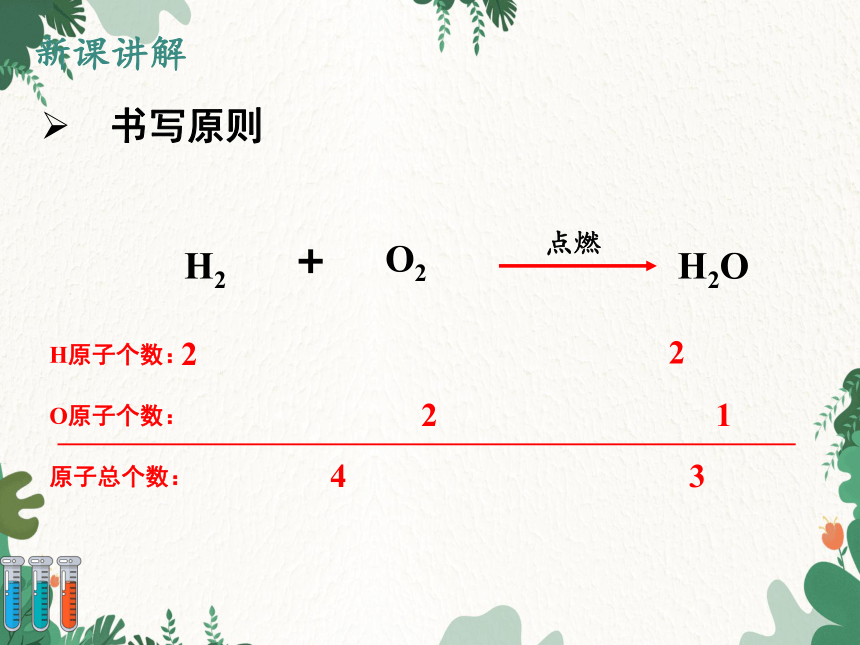
书写原则
H2
O2
+
点燃
H2O
H原子个数:
2
2
O原子个数:
2
1
4
3
原子总个数:
新课讲解
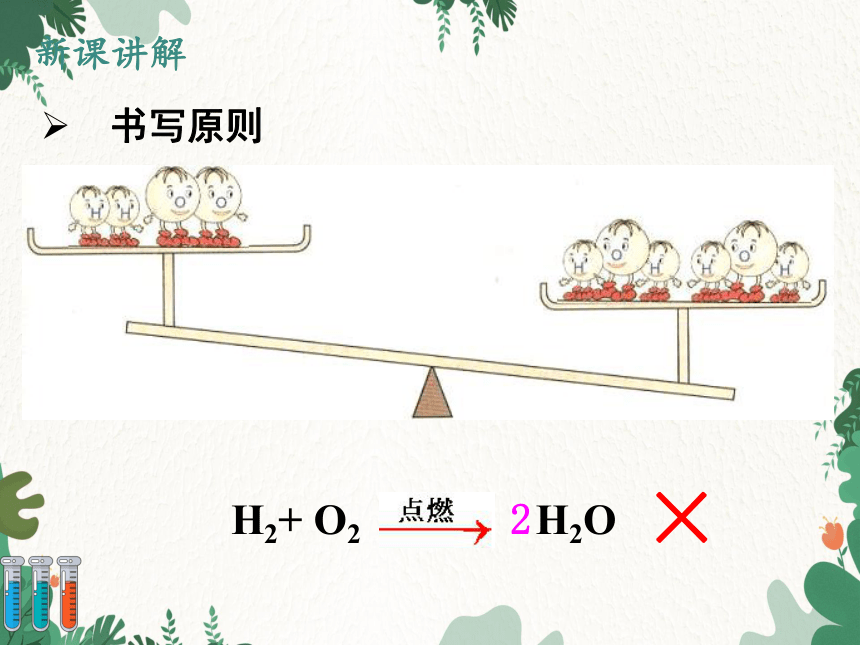
书写原则
H2+ O2 H2O
2
×
新课讲解
书写原则
H2+ O2 H2O
2
2
√
新课讲解
以磷在空气中燃烧生成五氧化二磷的反应为例:
P
O2
+
P2O5
左边写反应物化学式,
右边写生成物化学式,
式子两边用一条短线连接。
1.写:
书写化学方程式的步骤
新课讲解
书写化学方程式的步骤
2.配:
根据质量守恒定律,进行配平,即在化学式前配上适当的化学计量数,使反应前后各种元素的原子个数相等。
5O2
4P
+
2P2O5
新课讲解
3.标:
标明化学反应发生的条件,生成物的状态。
点燃
5O2
4P
+
2P2O5
书写化学方程式的步骤
新课讲解
书写化学方程式的步骤
左反右生一横线
配平以后加一线
等号上下注条件
箭号标气或沉淀
KClO3 KCl+ O2
2KClO3 2KCl+ 3O2
2KClO3 2KCl+ 3O2
2KClO3 2KCl+ 3O2
MnO2
MnO2
△
△
化学方程式的书写可归纳为:(以加热氯酸钾为例)
新课讲解
小结
(1)反应条件只有一个写在等号的上方;若需两个或多个条件,则分开写在等号上下方。
(2)点燃≠加热(△)
点燃≠燃烧(不能写燃烧)
高温≠加热(△)
(3)只有生成物中有气体时(反应物中没有气体),在 气体物质的化学式右边标注“↑”。
(4)在溶液中的反应,只有生成物中有难溶的固体物质
时(反应物无不溶性固体),在固体物质的化学式右边标注“ ↓”。
新课讲解
化学方程式书写完之后为使式子两边的每一种元素的原子的总数相等,就需要配平,即在式子两边的化学式前面配上适当的化学计量数。
化学方程式的配平方法
新课讲解
(1)观察法
配平下列反应的化学方程式
点 燃
3
2
Fe + O2 Fe3O4
点 燃
Fe + O2 Fe3O4
化学方程式的配平方法
新课讲解
(2)最小公倍数法
P + O2 P2O5
找出关键元素(是O)。反应前后该(氧)原子个数的最小公倍数是10,最小公倍数除以化学式中该原子的个数,把得到的数字写到化学式前面。在O2前面配上计量数5,在P2O5前面配上计量数2,再配平其他原子。前后磷原子个数的最小公倍数是4,在P前面配上计量数4 。
P + 5O2 2P2O5
4P + 5O2 2P2O5
反应前后原子数最多的原子
化学方程式的配平方法
新课讲解
化学方程式的配平方法
(3)奇数配偶法
H2S + O2 SO2 + H2O
偶数
偶数
奇数
×2
偶数
点 燃
2H2S + 3O2 2SO2 + 2H2O
点燃
新课讲解
化学方程式的配平方法
Na2CO3 + Ca(OH)2 CaCO3 + NaOH
2
Na2CO3 + HCl NaCl + H2O + CO2
H2CO3
2
2
新课讲解
知识点二
依据化学方程式的计算
1.根据化学方程式计算的四种类型
(1)已知反应物的质量求生成物的质量。
(2)已知生成物的质量求反应物的质量。
(3)已知一种反应物的质量求另一种反应物的质量。
(4)已知一种生成物的质量求另一种生成物的质量。
新课讲解
2.根据化学方程式计算的一般方法
掌握根据化学方程式计算各反应物和生成物之间的质量比是这类计算的关键。因此必须注意以下几点:
(1)认真审题,分析题目涉及到什么反应,已知物是什么,待求物是什么。
(2)正确书写出反应的化学方程式(这是正确解题的前提),因此在计算之前必须检查化学方程式是否正确。
(3)正确计算出反应中已知物质和待求物质的质量比。
(这是正确解题的关键)
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。
新课讲解
(3)找相关量,即列出跟计算相关的量;
(4)建立比例关系;
3.根据化学方程式进行计算的步骤
(1)设未知数;
(2)写出化学方程式;
(5)计算并作答。
新课讲解
4.根据化学方程式计算的注意事项
(1)所有代入化学方程式计算的量必须是纯净物的质量,如果是不纯物,则需要转换。
纯物质的质量=不纯物质的质量×纯度=
不纯物质的质量×(1-杂质的质量分数)
(2)气体、液体的体积,要换算成气体、液体的质量。
气体质量(g)= 气体体积(L)×密度(g/L)
液体质量(g)= 液体体积(mL)×密度(g/mL)
新课讲解
(3)若题目中只给出一种物质的质量,则另一种物质的用量往往用“足量”“适量”“过量”“完全反应”或“恰好完全反应”等来描述。如果同时知道两种反应物的质量,需要考虑过量问题。
(4)注意已知质量的单位;设未知数的时候要设某物质的质量为x,而不能设某物质的质量为x克;整个化学计算过程要带单位,最后求出的x的值后写上单位。(无说明则保留到小数点后一位)
新课讲解
5.在进行化学方程式计算时常会出现以下一些错误
(1)不认真审题,答非所问。
(2)元素符号或化学式写错。
(3)化学方程式写错或没配平。
(4)相对分子质量计算错误,导致质量比错误。
(5)同一种物质不用相同的单位或单位不统一。
(6)张冠李戴,物质的质量代错。
(7)把不纯物当做纯净物。
(8)把物质的体积直接代入化学方程式。
谢谢聆听
第四章 认识化学变化
沪教版九年级上册化学课件
第三节
化学方程式的书写与应用
学习目标
学习目标
1.理解并能运用质量守恒定律;
2.能正确书写简单的化学反应方程式。
3. 认识定量研究对化学科学发展的意义。
4.在理解化学方程式的基础上,使学生掌握有关反应物、生成物质量的计算
新课讲解
新课讲解
知识点一
化学反应的表示方法
定义:用化学式来表示化学反应的式子。
表示的意义:
表示反应物、生成物以及反应条件。
表示反应物、生成物之间的质量关系(质量比)。
表示反应物、生成物之间的粒子个数关系。
(粒子个数比)(化学计量数之比)
新课讲解
读法:
碳和氧气在点燃的条件下生成二氧化碳。
1个碳原子和1个氧分子在点燃的条件下反应,生成1个二氧化碳分子。
例如:C + O2 CO2
每12份质量的碳和32份质量的氧气在点燃的条件下反应,生成44份质量的二氧化碳。
点燃
新课讲解
二是符合质量守恒定律。等号两边各种原子的种类和数目必须相同。
一是以客观事实为依据。写出反应物和生成物的化学式。
书写原则
新课讲解
书写原则
H2
O2
+
点燃
H2O
H原子个数:
2
2
O原子个数:
2
1
4
3
原子总个数:
新课讲解
书写原则
H2+ O2 H2O
2
×
新课讲解
书写原则
H2+ O2 H2O
2
2
√
新课讲解
以磷在空气中燃烧生成五氧化二磷的反应为例:
P
O2
+
P2O5
左边写反应物化学式,
右边写生成物化学式,
式子两边用一条短线连接。
1.写:
书写化学方程式的步骤
新课讲解
书写化学方程式的步骤
2.配:
根据质量守恒定律,进行配平,即在化学式前配上适当的化学计量数,使反应前后各种元素的原子个数相等。
5O2
4P
+
2P2O5
新课讲解
3.标:
标明化学反应发生的条件,生成物的状态。
点燃
5O2
4P
+
2P2O5
书写化学方程式的步骤
新课讲解
书写化学方程式的步骤
左反右生一横线
配平以后加一线
等号上下注条件
箭号标气或沉淀
KClO3 KCl+ O2
2KClO3 2KCl+ 3O2
2KClO3 2KCl+ 3O2
2KClO3 2KCl+ 3O2
MnO2
MnO2
△
△
化学方程式的书写可归纳为:(以加热氯酸钾为例)
新课讲解
小结
(1)反应条件只有一个写在等号的上方;若需两个或多个条件,则分开写在等号上下方。
(2)点燃≠加热(△)
点燃≠燃烧(不能写燃烧)
高温≠加热(△)
(3)只有生成物中有气体时(反应物中没有气体),在 气体物质的化学式右边标注“↑”。
(4)在溶液中的反应,只有生成物中有难溶的固体物质
时(反应物无不溶性固体),在固体物质的化学式右边标注“ ↓”。
新课讲解
化学方程式书写完之后为使式子两边的每一种元素的原子的总数相等,就需要配平,即在式子两边的化学式前面配上适当的化学计量数。
化学方程式的配平方法
新课讲解
(1)观察法
配平下列反应的化学方程式
点 燃
3
2
Fe + O2 Fe3O4
点 燃
Fe + O2 Fe3O4
化学方程式的配平方法
新课讲解
(2)最小公倍数法
P + O2 P2O5
找出关键元素(是O)。反应前后该(氧)原子个数的最小公倍数是10,最小公倍数除以化学式中该原子的个数,把得到的数字写到化学式前面。在O2前面配上计量数5,在P2O5前面配上计量数2,再配平其他原子。前后磷原子个数的最小公倍数是4,在P前面配上计量数4 。
P + 5O2 2P2O5
4P + 5O2 2P2O5
反应前后原子数最多的原子
化学方程式的配平方法
新课讲解
化学方程式的配平方法
(3)奇数配偶法
H2S + O2 SO2 + H2O
偶数
偶数
奇数
×2
偶数
点 燃
2H2S + 3O2 2SO2 + 2H2O
点燃
新课讲解
化学方程式的配平方法
Na2CO3 + Ca(OH)2 CaCO3 + NaOH
2
Na2CO3 + HCl NaCl + H2O + CO2
H2CO3
2
2
新课讲解
知识点二
依据化学方程式的计算
1.根据化学方程式计算的四种类型
(1)已知反应物的质量求生成物的质量。
(2)已知生成物的质量求反应物的质量。
(3)已知一种反应物的质量求另一种反应物的质量。
(4)已知一种生成物的质量求另一种生成物的质量。
新课讲解
2.根据化学方程式计算的一般方法
掌握根据化学方程式计算各反应物和生成物之间的质量比是这类计算的关键。因此必须注意以下几点:
(1)认真审题,分析题目涉及到什么反应,已知物是什么,待求物是什么。
(2)正确书写出反应的化学方程式(这是正确解题的前提),因此在计算之前必须检查化学方程式是否正确。
(3)正确计算出反应中已知物质和待求物质的质量比。
(这是正确解题的关键)
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。
新课讲解
(3)找相关量,即列出跟计算相关的量;
(4)建立比例关系;
3.根据化学方程式进行计算的步骤
(1)设未知数;
(2)写出化学方程式;
(5)计算并作答。
新课讲解
4.根据化学方程式计算的注意事项
(1)所有代入化学方程式计算的量必须是纯净物的质量,如果是不纯物,则需要转换。
纯物质的质量=不纯物质的质量×纯度=
不纯物质的质量×(1-杂质的质量分数)
(2)气体、液体的体积,要换算成气体、液体的质量。
气体质量(g)= 气体体积(L)×密度(g/L)
液体质量(g)= 液体体积(mL)×密度(g/mL)
新课讲解
(3)若题目中只给出一种物质的质量,则另一种物质的用量往往用“足量”“适量”“过量”“完全反应”或“恰好完全反应”等来描述。如果同时知道两种反应物的质量,需要考虑过量问题。
(4)注意已知质量的单位;设未知数的时候要设某物质的质量为x,而不能设某物质的质量为x克;整个化学计算过程要带单位,最后求出的x的值后写上单位。(无说明则保留到小数点后一位)
新课讲解
5.在进行化学方程式计算时常会出现以下一些错误
(1)不认真审题,答非所问。
(2)元素符号或化学式写错。
(3)化学方程式写错或没配平。
(4)相对分子质量计算错误,导致质量比错误。
(5)同一种物质不用相同的单位或单位不统一。
(6)张冠李戴,物质的质量代错。
(7)把不纯物当做纯净物。
(8)把物质的体积直接代入化学方程式。
谢谢聆听
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
