高中化学人教版(2019)必修第一册1.3.2.氧化剂和还原剂(共25张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.3.2.氧化剂和还原剂(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 195.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-27 20:40:43 | ||
图片预览







文档简介
(共25张PPT)
旧知回顾
氧化还原反应的本质
第三节 氧化还原反应
第二课时 氧化剂和还原剂
学习目标
1.通过归纳总结,能够判断氧化剂、还原剂以及氧化产物、还原产物。
2.掌握氧化剂具有氧化性,还原剂具有还原性,知道常见的氧化剂和还原剂。
3.会画单线桥和双线桥。
重难点
重点:能够判断氧化剂与还原剂,并掌
握二者的性质
难点:单线桥和双线桥。
自主阅读课本23~24页,完成导纲上的相关内容。
思
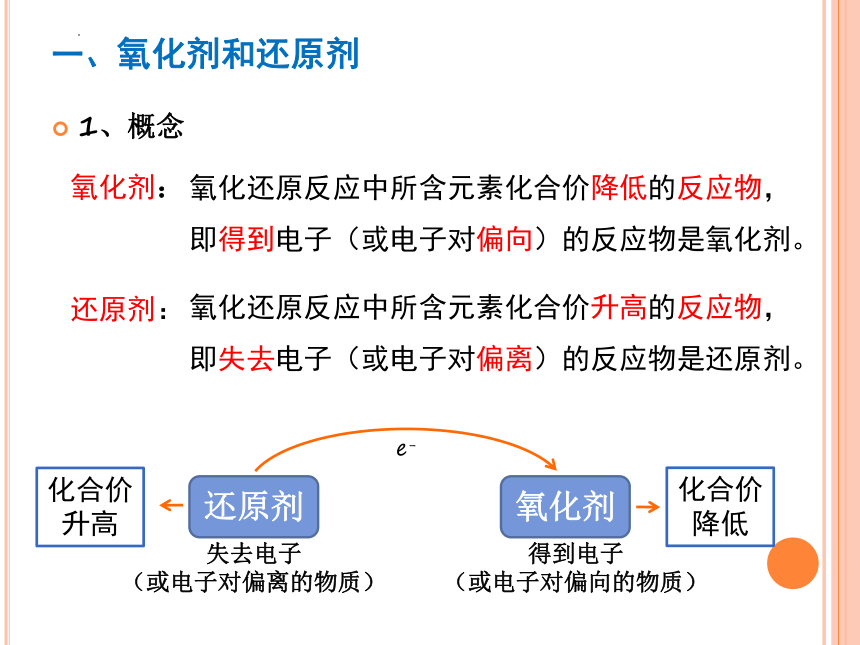
一、氧化剂和还原剂
1、概念
还原剂
氧化剂
e-
失去电子
(或电子对偏离的物质)
得到电子
(或电子对偏向的物质)
氧化还原反应中所含元素化合价降低的反应物,即得到电子(或电子对偏向)的反应物是氧化剂。
氧化剂:
还原剂:
氧化还原反应中所含元素化合价升高的反应物,即失去电子(或电子对偏离)的反应物是还原剂。
化合价升高
化合价降低
1、概念
还原剂发生氧化反应得到的生成物,即化合价升高的元素的产物。
氧化剂发生还原反应得到的生成物,即化合价降低的元素的产物。
氧化产物:
还原产物:
一、氧化剂和还原剂
得电子的能力。
氧化性:
还原性:
失电子的能力。
1、概念
得电子的能力。
失电子的能力。
氧化性:
还原性:
一、氧化剂和还原剂
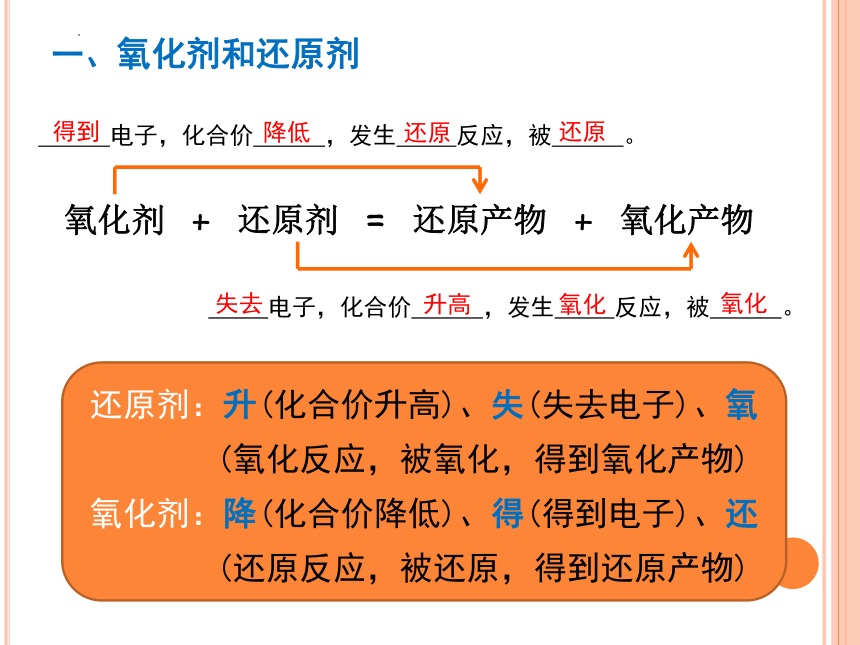
在氧化还原反应中,氧化剂具有氧化性,得到电子后,化合价降低,被还原,发生还原反应。
在氧化还原反应中,还原剂具有还原性,失去电子后,化合价升高,被氧化,发生氧化反应。
氧化剂 + 还原剂 = 还原产物 + 氧化产物
电子,化合价 ,发生 反应,被 。
电子,化合价 ,发生 反应,被 。
还原剂:升(化合价升高)、失(失去电子)、氧
(氧化反应,被氧化,得到氧化产物)
氧化剂:降(化合价降低)、得(得到电子)、还
(还原反应,被还原,得到还原产物)
一、氧化剂和还原剂
得到
降低
还原
失去
升高
氧化
还原
氧化
找出下列反应中的氧化剂、还原剂、氧化产物、还原产物
(1) Zn + H2SO4===ZnSO4 + H2↑
还原剂
氧化剂
氧化产物
还原产物
(2) 2H2O===2H2↑+O2↑
氧化剂
还原剂
氧化产物
还原产物
通电
(3) SO2+2H2S===3S↓+2H2O
氧化剂
还原剂
氧化产物
还原产物
注意:氧化剂和还原剂是针对反应物而言的。
还原剂
氧化剂
氧化产物
氧化产物
(4)4HCl(浓)+MnO2
==4MnCl2+2H2O+Cl2
1.氧化剂和还原剂一定是不同种物质吗?
在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂可以是不同种物质,也可以是同一种物质。
2.氧化产物和还原产物一定是不同种物质吗?
在氧化还原反应中一定有氧化产物和还原产物,但氧化产物和还原产物可以是不同种物质,也可以是同一种物质。
3.一种元素被氧化一定有另一种元素被还原吗?
在氧化还原反应中,一种元素被氧化不一定有另一种元素被还原。
如何表示氧化还原反应中电子转移的方向和数目呢?
氧化还原反应中电子转移的表示方法:
双线桥法
单线桥法
Fe+2HCl==FeCl2+H2↑
失去2e-
得到2×e-
0
+1
+2
0
双线桥法:
用双线桥法表示下列氧化还原反应中电子转移的方向和数目
(1) Zn + H2SO4===ZnSO4 + H2↑
(2) 2H2O===2H2↑+O2↑
通电
(3) SO2+2H2S===3S↓+2H2O
(4)MnO2+4HCl(浓) === MnCl2+Cl2↑+H2O
△
0
+2
失去2e-
得到2×e-
+1
0
+1
-2
0
0
+4
-2
0
+4
-1
+2
0
得到4×e-
失去2×2e-
得到4e-
失去2×2e-
得到2e-
失去2×e-
双线桥法:
表明反应前后同一元素原子或离子间的电子转移情况。
基本步骤:
标价态
连双线
注得失
检查
标明所有发生氧化还原反应的元素的化合价,化合价没有变化的元素不用标明
一条线由反应物中化合价降低的元素指向产物中化合价发生变化的相应元素,另一条线由反应物中化合价升高的元素指向产物中化合价发生变化的相应元素。
标出“失去”或“得到”电子的总数
检查得失电子总数是否相等,若不相等需重新分析
双线桥法:
一般模型:
氧化剂 + 还原剂==还原产物 + 氧化产物
得到a×be-
失去c×de-
(其中a×b=c×d)
a(c)为发生化合价变化的元素对应的原子个数;
b(d)为发生化合价变化的元素的一个原子得到(或失去)电子的数目;
当a=1时,直接写为“be-”,当b=1时,要写为“a×e-”
如:3Cl2 + 6KOH==5KCl + KClO3 +3H2O
△
0
-1
+5
双线桥法:
注意事项:
(1)箭头和箭尾必须连接同一元素,并且箭头指向生成物,
箭尾连接反应物。
(2)线桥上必须标明“得到”或“失去”。
(3)书写电子转移的数目时,要写成“得到a×be-”或“失去
c×de-”的形式。
失去5e-
得到5×e-
Fe+2HCl==FeCl2+H2↑
2e-
0
+1
+2
0
单线桥法:
用单线桥法表示下列氧化还原反应中电子转移的方向和数目
(1) Zn + H2SO4===ZnSO4 + H2↑
(2) 2H2O===2H2↑+O2↑
通电
(3) SO2+2H2S===3S↓+2H2O
(4)MnO2+4HCl(浓) === MnCl2+Cl2↑+H2O
△
0
+2
2e-
+1
0
+1
-2
0
0
+4
-2
0
+2
0
4e-
4e-
+4
-1
2e-
单线桥法:
表明反应前后元素原子间的电子转移情况。
基本步骤:
标价态
连单线
标电子
正确标明反应前后元素的化合价,判断升降,进而确定得失电子的原子对应的元素
连接方程式左边失去电子的原子对应的元素与得到电子原子对应的元素,箭头指向得到电子的原子对应的元素
标出转移电子的总数
单线桥法:
一般模型:
氧化剂 + 还原剂==还原产物 + 氧化产物
ne-
(1)线桥不能跨过“=”,也就是说箭头和箭尾所连接的都是反应物。
(2)箭头必须指向化合价降低的元素,箭尾连接化合价升高的元素。
(3)线桥上只能写“ne-”(即只能写电子转移的总数),不能写成“a×be-”的形式,也不能写“得到”或“失去”。
注意事项:
双线桥法与单线桥法的比较
1.双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
2.表示氧化还原反应中电子转移、化合价升降、物质被氧化或被还原等关系时,用双线桥比较方便;表示电子转移的方向和数目时,用单线桥比较方便。
小结:
(1)氧化剂和还原剂
(2)氧化还原反应中电子转移的表示方法
a 双线桥法
b 单线桥法
旧知回顾
氧化还原反应的本质
第三节 氧化还原反应
第二课时 氧化剂和还原剂
学习目标
1.通过归纳总结,能够判断氧化剂、还原剂以及氧化产物、还原产物。
2.掌握氧化剂具有氧化性,还原剂具有还原性,知道常见的氧化剂和还原剂。
3.会画单线桥和双线桥。
重难点
重点:能够判断氧化剂与还原剂,并掌
握二者的性质
难点:单线桥和双线桥。
自主阅读课本23~24页,完成导纲上的相关内容。
思
一、氧化剂和还原剂
1、概念
还原剂
氧化剂
e-
失去电子
(或电子对偏离的物质)
得到电子
(或电子对偏向的物质)
氧化还原反应中所含元素化合价降低的反应物,即得到电子(或电子对偏向)的反应物是氧化剂。
氧化剂:
还原剂:
氧化还原反应中所含元素化合价升高的反应物,即失去电子(或电子对偏离)的反应物是还原剂。
化合价升高
化合价降低
1、概念
还原剂发生氧化反应得到的生成物,即化合价升高的元素的产物。
氧化剂发生还原反应得到的生成物,即化合价降低的元素的产物。
氧化产物:
还原产物:
一、氧化剂和还原剂
得电子的能力。
氧化性:
还原性:
失电子的能力。
1、概念
得电子的能力。
失电子的能力。
氧化性:
还原性:
一、氧化剂和还原剂
在氧化还原反应中,氧化剂具有氧化性,得到电子后,化合价降低,被还原,发生还原反应。
在氧化还原反应中,还原剂具有还原性,失去电子后,化合价升高,被氧化,发生氧化反应。
氧化剂 + 还原剂 = 还原产物 + 氧化产物
电子,化合价 ,发生 反应,被 。
电子,化合价 ,发生 反应,被 。
还原剂:升(化合价升高)、失(失去电子)、氧
(氧化反应,被氧化,得到氧化产物)
氧化剂:降(化合价降低)、得(得到电子)、还
(还原反应,被还原,得到还原产物)
一、氧化剂和还原剂
得到
降低
还原
失去
升高
氧化
还原
氧化
找出下列反应中的氧化剂、还原剂、氧化产物、还原产物
(1) Zn + H2SO4===ZnSO4 + H2↑
还原剂
氧化剂
氧化产物
还原产物
(2) 2H2O===2H2↑+O2↑
氧化剂
还原剂
氧化产物
还原产物
通电
(3) SO2+2H2S===3S↓+2H2O
氧化剂
还原剂
氧化产物
还原产物
注意:氧化剂和还原剂是针对反应物而言的。
还原剂
氧化剂
氧化产物
氧化产物
(4)4HCl(浓)+MnO2
==4MnCl2+2H2O+Cl2
1.氧化剂和还原剂一定是不同种物质吗?
在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂可以是不同种物质,也可以是同一种物质。
2.氧化产物和还原产物一定是不同种物质吗?
在氧化还原反应中一定有氧化产物和还原产物,但氧化产物和还原产物可以是不同种物质,也可以是同一种物质。
3.一种元素被氧化一定有另一种元素被还原吗?
在氧化还原反应中,一种元素被氧化不一定有另一种元素被还原。
如何表示氧化还原反应中电子转移的方向和数目呢?
氧化还原反应中电子转移的表示方法:
双线桥法
单线桥法
Fe+2HCl==FeCl2+H2↑
失去2e-
得到2×e-
0
+1
+2
0
双线桥法:
用双线桥法表示下列氧化还原反应中电子转移的方向和数目
(1) Zn + H2SO4===ZnSO4 + H2↑
(2) 2H2O===2H2↑+O2↑
通电
(3) SO2+2H2S===3S↓+2H2O
(4)MnO2+4HCl(浓) === MnCl2+Cl2↑+H2O
△
0
+2
失去2e-
得到2×e-
+1
0
+1
-2
0
0
+4
-2
0
+4
-1
+2
0
得到4×e-
失去2×2e-
得到4e-
失去2×2e-
得到2e-
失去2×e-
双线桥法:
表明反应前后同一元素原子或离子间的电子转移情况。
基本步骤:
标价态
连双线
注得失
检查
标明所有发生氧化还原反应的元素的化合价,化合价没有变化的元素不用标明
一条线由反应物中化合价降低的元素指向产物中化合价发生变化的相应元素,另一条线由反应物中化合价升高的元素指向产物中化合价发生变化的相应元素。
标出“失去”或“得到”电子的总数
检查得失电子总数是否相等,若不相等需重新分析
双线桥法:
一般模型:
氧化剂 + 还原剂==还原产物 + 氧化产物
得到a×be-
失去c×de-
(其中a×b=c×d)
a(c)为发生化合价变化的元素对应的原子个数;
b(d)为发生化合价变化的元素的一个原子得到(或失去)电子的数目;
当a=1时,直接写为“be-”,当b=1时,要写为“a×e-”
如:3Cl2 + 6KOH==5KCl + KClO3 +3H2O
△
0
-1
+5
双线桥法:
注意事项:
(1)箭头和箭尾必须连接同一元素,并且箭头指向生成物,
箭尾连接反应物。
(2)线桥上必须标明“得到”或“失去”。
(3)书写电子转移的数目时,要写成“得到a×be-”或“失去
c×de-”的形式。
失去5e-
得到5×e-
Fe+2HCl==FeCl2+H2↑
2e-
0
+1
+2
0
单线桥法:
用单线桥法表示下列氧化还原反应中电子转移的方向和数目
(1) Zn + H2SO4===ZnSO4 + H2↑
(2) 2H2O===2H2↑+O2↑
通电
(3) SO2+2H2S===3S↓+2H2O
(4)MnO2+4HCl(浓) === MnCl2+Cl2↑+H2O
△
0
+2
2e-
+1
0
+1
-2
0
0
+4
-2
0
+2
0
4e-
4e-
+4
-1
2e-
单线桥法:
表明反应前后元素原子间的电子转移情况。
基本步骤:
标价态
连单线
标电子
正确标明反应前后元素的化合价,判断升降,进而确定得失电子的原子对应的元素
连接方程式左边失去电子的原子对应的元素与得到电子原子对应的元素,箭头指向得到电子的原子对应的元素
标出转移电子的总数
单线桥法:
一般模型:
氧化剂 + 还原剂==还原产物 + 氧化产物
ne-
(1)线桥不能跨过“=”,也就是说箭头和箭尾所连接的都是反应物。
(2)箭头必须指向化合价降低的元素,箭尾连接化合价升高的元素。
(3)线桥上只能写“ne-”(即只能写电子转移的总数),不能写成“a×be-”的形式,也不能写“得到”或“失去”。
注意事项:
双线桥法与单线桥法的比较
1.双线桥法的“线桥”从反应物到产物,单线桥法的“线桥”只连反应物。
2.表示氧化还原反应中电子转移、化合价升降、物质被氧化或被还原等关系时,用双线桥比较方便;表示电子转移的方向和数目时,用单线桥比较方便。
小结:
(1)氧化剂和还原剂
(2)氧化还原反应中电子转移的表示方法
a 双线桥法
b 单线桥法
