化学人教版(2019)选择性必修1 2.2.3.影响化学平衡的因素(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.2.3.影响化学平衡的因素(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-27 21:38:38 | ||
图片预览





文档简介
(共17张PPT)
知识回顾
N2(g) + 3H2(g) 2NH3(g) H = -92.4kJ/mol
【回忆】速率:影响化学反应速率的外界因素主要有哪些?
【迁移】产率:通过那些途径可以提高合成氨的限度呢?
第三课时 影响化学平衡的因素
学习目标一:利用对照实验探究掌握外界因素
(浓度、温度、压强)对化学平衡移动的影响规律。
学习目标二:学会利用速率-时间图像(v-t图像)模型,描述不同因素对v正,v逆影响,判断对化学平衡的影响。
一、浓度对化学平衡的影响
【实验2-1】
Fe3+ + 3SCN- Fe(SCN)3(红色)
红色
溶液红色变浅
溶液红色加深
加入少量铁粉
滴加1mol/L KSCN溶液
2Fe3+ + Fe = 2Fe2+
增大c(反应物)或减小c(生成物),会使平衡向正反应方向移动;
减小c(反应物)或增大c(生成物),会使平衡向逆反应方向移动。
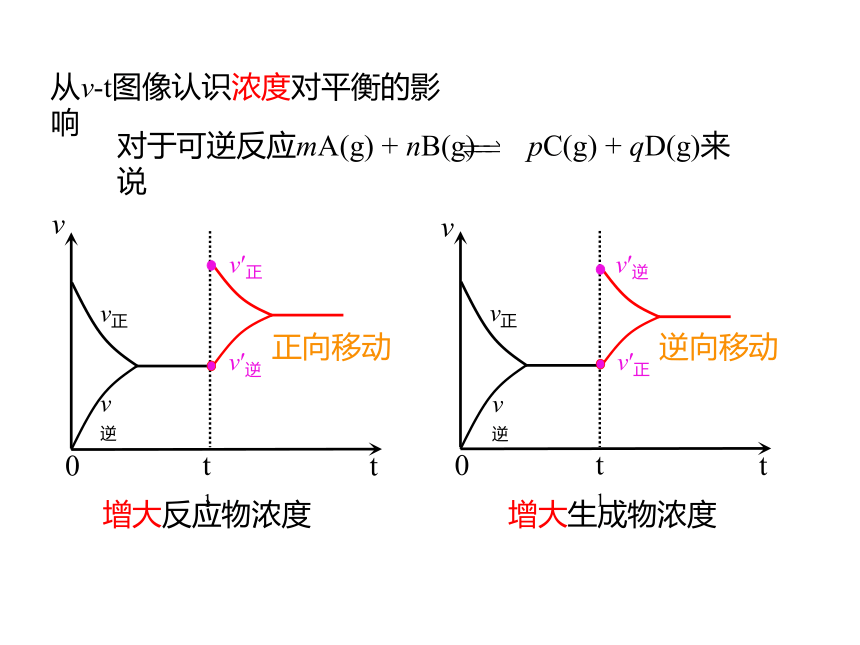
从v t图像认识浓度对平衡的影响
正向移动
增大反应物浓度
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
对于可逆反应mA(g) + nB(g) pC(g) + qD(g)来说
增大生成物浓度
逆向移动
v′正
v′逆
v′逆
v′正
逆向移动
减小反应物浓度
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
减小生成物浓度
正向移动
v′逆
v′正
v′正
v′逆
浓度对化学平衡的影响,没改变浓度的方向的速率是连续不变的。
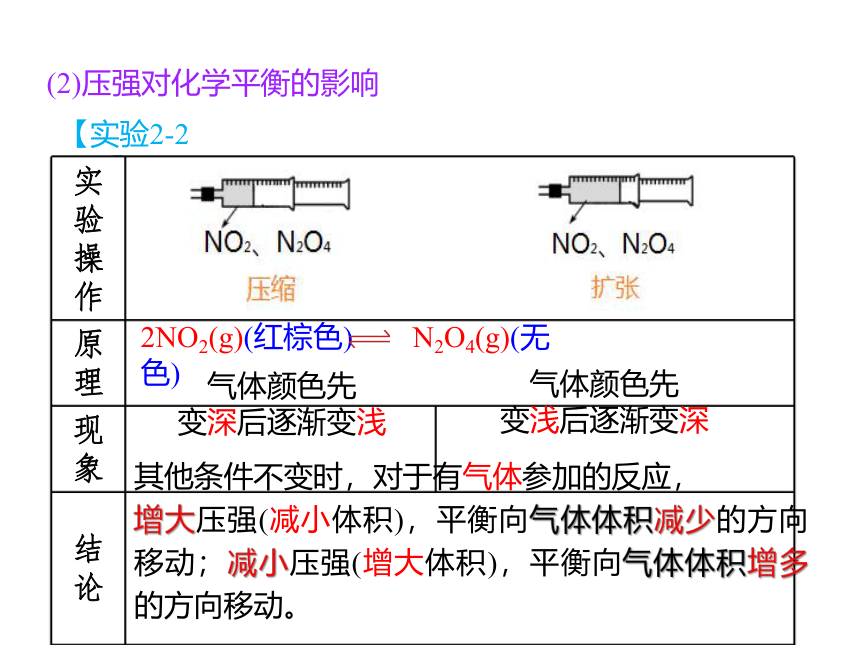
(2)压强对化学平衡的影响
【实验2-2】
2NO2(g)(红棕色) N2O4(g)(无色)
气体颜色先
变深后逐渐变浅
气体颜色先
变浅后逐渐变深
其他条件不变时,对于有气体参加的反应,
增大压强(减小体积),平衡向气体体积减少的方向移动;减小压强(增大体积),平衡向气体体积增多的方向移动。
从v t图像认识压强对平衡的影响
对于可逆反应mA(g) + nB(g) pC(g) + qD(g)来说
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
若满足:m + n > p + q
增大压强(减小体积)
正向移动
逆向移动
v′正
v′逆
v′逆
v′正
减小压强(增大体积)
若满足:m + n = p + q
不移动
增大压强(减小体积)
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
不移动
v′正 = v′逆
减小压强(增大体积)
对于可逆反应mA(g) + nB(g) pC(g) + qD(g)来说
v′正 = v′逆
练习一:在密闭容器中,反应xA(g) + yB(g) zC(g),达到平衡后测得A气体的浓度为0.5mol/L。保持温度不变,将密闭容器的容积增加一倍,当达到新的平衡时,测得A的浓度为0.3mol/L,则下列叙述中正确的是( )
A. 平衡向正反应方向运动
B. x + y > z
C. 物质C的体积分数增大
D. 物质B的转化率增大
B
(3)温度对化学平衡的影响
【实验2-3】
2NO2(g)(红棕色) N2O4(g)(无色) ΔH=-56.9 kJ/mol
混合气体颜色变深
混合气体颜色变浅
升高温度,化学平衡向吸热ΔH>0反应的方向移动;
降低温度,化学平衡向放热ΔH<0反应的方向移动。
从v t图像认识温度对平衡的影响
对于可逆反应mA(g) + nB(g) pC(g) + qD(g) ΔH > 0 来说
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
升高温度
正向移动
逆向移动
v′正
v′逆
v′逆
v′正
降低温度
对于可逆反应mA(g) + nB(g) pC(g) + qD(g) ΔH < 0 来说
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
升高温度
逆向移动
正向移动
v′逆
v′正
v′正
v′逆
降低温度
影响化学平衡的因素
浓度
压强
温度
增大C反应物 或
减小C生成物
减小C反应物 或
增大C生成物
平衡正方向移动
平衡逆方向移动
催化剂
不影响平衡移动
升高温度
降低温度
平衡向吸热方向移动
平衡向放热方向移动
增大压强
减小压强
平衡向气体体积减小方向移动
平衡向气体体积增大方向移动
平衡移动原理的应用
已知反应N2(g) + 3H2(g) 2NH3(g) H = -92.4kJ/mol
在工业生产中通过以下途径提高合成氨的产率
1.向反应器中注入过量N2 ,及时分离NH3
2.在1x107~1x108 Pa的压强下进行反应
3.在500℃温度下进行反应
化学平衡移动原理是经过反复验证的,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。
(4)催化剂对化学平衡的影响
Ea
E′a
分析:催化剂是通过改变反应的活化能从而影响反应速率。
正反应活化能
【结论】催化剂能同等程度的改变正、逆反应速率,
因此加入催化剂平衡不移动,但能缩短达到平衡所需的时间。
不移动
v
t
t1
0
v正
v逆
从v t图像认识催化剂对平衡的影响
v′正 = v′逆
课堂练习二
在1L密闭容器中, 进行反应:X(g) + 3Y(g) 2Z(g)
达到平衡后,其他条件不变时,加入X,重新达到平衡后,下列叙述正确的是( )
A. 正反应速率增大,逆反应速率减小
B. X的转化率变大
C. Y的转化率变大
D. 正、逆反应速率都将减小
C
浓度与转化率问题:
其他条件不变时,向某平衡反应中加入其中一种反应物(或生成物),重新达到平衡后,该反应物本身转化率相比原来减小,而另一种反应物(或生成物)的转化率相比原来增大。
知识回顾
N2(g) + 3H2(g) 2NH3(g) H = -92.4kJ/mol
【回忆】速率:影响化学反应速率的外界因素主要有哪些?
【迁移】产率:通过那些途径可以提高合成氨的限度呢?
第三课时 影响化学平衡的因素
学习目标一:利用对照实验探究掌握外界因素
(浓度、温度、压强)对化学平衡移动的影响规律。
学习目标二:学会利用速率-时间图像(v-t图像)模型,描述不同因素对v正,v逆影响,判断对化学平衡的影响。
一、浓度对化学平衡的影响
【实验2-1】
Fe3+ + 3SCN- Fe(SCN)3(红色)
红色
溶液红色变浅
溶液红色加深
加入少量铁粉
滴加1mol/L KSCN溶液
2Fe3+ + Fe = 2Fe2+
增大c(反应物)或减小c(生成物),会使平衡向正反应方向移动;
减小c(反应物)或增大c(生成物),会使平衡向逆反应方向移动。
从v t图像认识浓度对平衡的影响
正向移动
增大反应物浓度
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
对于可逆反应mA(g) + nB(g) pC(g) + qD(g)来说
增大生成物浓度
逆向移动
v′正
v′逆
v′逆
v′正
逆向移动
减小反应物浓度
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
减小生成物浓度
正向移动
v′逆
v′正
v′正
v′逆
浓度对化学平衡的影响,没改变浓度的方向的速率是连续不变的。
(2)压强对化学平衡的影响
【实验2-2】
2NO2(g)(红棕色) N2O4(g)(无色)
气体颜色先
变深后逐渐变浅
气体颜色先
变浅后逐渐变深
其他条件不变时,对于有气体参加的反应,
增大压强(减小体积),平衡向气体体积减少的方向移动;减小压强(增大体积),平衡向气体体积增多的方向移动。
从v t图像认识压强对平衡的影响
对于可逆反应mA(g) + nB(g) pC(g) + qD(g)来说
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
若满足:m + n > p + q
增大压强(减小体积)
正向移动
逆向移动
v′正
v′逆
v′逆
v′正
减小压强(增大体积)
若满足:m + n = p + q
不移动
增大压强(减小体积)
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
不移动
v′正 = v′逆
减小压强(增大体积)
对于可逆反应mA(g) + nB(g) pC(g) + qD(g)来说
v′正 = v′逆
练习一:在密闭容器中,反应xA(g) + yB(g) zC(g),达到平衡后测得A气体的浓度为0.5mol/L。保持温度不变,将密闭容器的容积增加一倍,当达到新的平衡时,测得A的浓度为0.3mol/L,则下列叙述中正确的是( )
A. 平衡向正反应方向运动
B. x + y > z
C. 物质C的体积分数增大
D. 物质B的转化率增大
B
(3)温度对化学平衡的影响
【实验2-3】
2NO2(g)(红棕色) N2O4(g)(无色) ΔH=-56.9 kJ/mol
混合气体颜色变深
混合气体颜色变浅
升高温度,化学平衡向吸热ΔH>0反应的方向移动;
降低温度,化学平衡向放热ΔH<0反应的方向移动。
从v t图像认识温度对平衡的影响
对于可逆反应mA(g) + nB(g) pC(g) + qD(g) ΔH > 0 来说
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
升高温度
正向移动
逆向移动
v′正
v′逆
v′逆
v′正
降低温度
对于可逆反应mA(g) + nB(g) pC(g) + qD(g) ΔH < 0 来说
v
t
t1
0
v正
v逆
v
t
t1
0
v正
v逆
升高温度
逆向移动
正向移动
v′逆
v′正
v′正
v′逆
降低温度
影响化学平衡的因素
浓度
压强
温度
增大C反应物 或
减小C生成物
减小C反应物 或
增大C生成物
平衡正方向移动
平衡逆方向移动
催化剂
不影响平衡移动
升高温度
降低温度
平衡向吸热方向移动
平衡向放热方向移动
增大压强
减小压强
平衡向气体体积减小方向移动
平衡向气体体积增大方向移动
平衡移动原理的应用
已知反应N2(g) + 3H2(g) 2NH3(g) H = -92.4kJ/mol
在工业生产中通过以下途径提高合成氨的产率
1.向反应器中注入过量N2 ,及时分离NH3
2.在1x107~1x108 Pa的压强下进行反应
3.在500℃温度下进行反应
化学平衡移动原理是经过反复验证的,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。
(4)催化剂对化学平衡的影响
Ea
E′a
分析:催化剂是通过改变反应的活化能从而影响反应速率。
正反应活化能
【结论】催化剂能同等程度的改变正、逆反应速率,
因此加入催化剂平衡不移动,但能缩短达到平衡所需的时间。
不移动
v
t
t1
0
v正
v逆
从v t图像认识催化剂对平衡的影响
v′正 = v′逆
课堂练习二
在1L密闭容器中, 进行反应:X(g) + 3Y(g) 2Z(g)
达到平衡后,其他条件不变时,加入X,重新达到平衡后,下列叙述正确的是( )
A. 正反应速率增大,逆反应速率减小
B. X的转化率变大
C. Y的转化率变大
D. 正、逆反应速率都将减小
C
浓度与转化率问题:
其他条件不变时,向某平衡反应中加入其中一种反应物(或生成物),重新达到平衡后,该反应物本身转化率相比原来减小,而另一种反应物(或生成物)的转化率相比原来增大。
