3.2.1.水的电离课件2022-2023学年上学期高二化学人教版(2019)选择性必修1(共25页)
文档属性
| 名称 | 3.2.1.水的电离课件2022-2023学年上学期高二化学人教版(2019)选择性必修1(共25页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-28 10:06:35 | ||
图片预览







文档简介
(共25张PPT)
3.2.1 水的电离
人教版(2019)高中化学
选择性必修一
H2O H++OH-
围绕水的电离思考:
(1)纯水中,C(H+)和C(OH-)浓度大小关系
(2)25℃,C(H+)和C(OH-)浓度为多少 此时pH=
(3)25℃,此时为酸性、碱性还是中性?
(4)100 ℃水中,C(H+)和C(OH-)浓度大小关系
(5)100℃,C(H+)和C(OH-)浓度为多少 此时pH=
(6)100℃,此时为酸性、碱性还是中性?
(7)回顾从PH值角度判断酸、碱、中性的方法?
(8)酸、碱、中性的实质是什么?与pH值有何关系
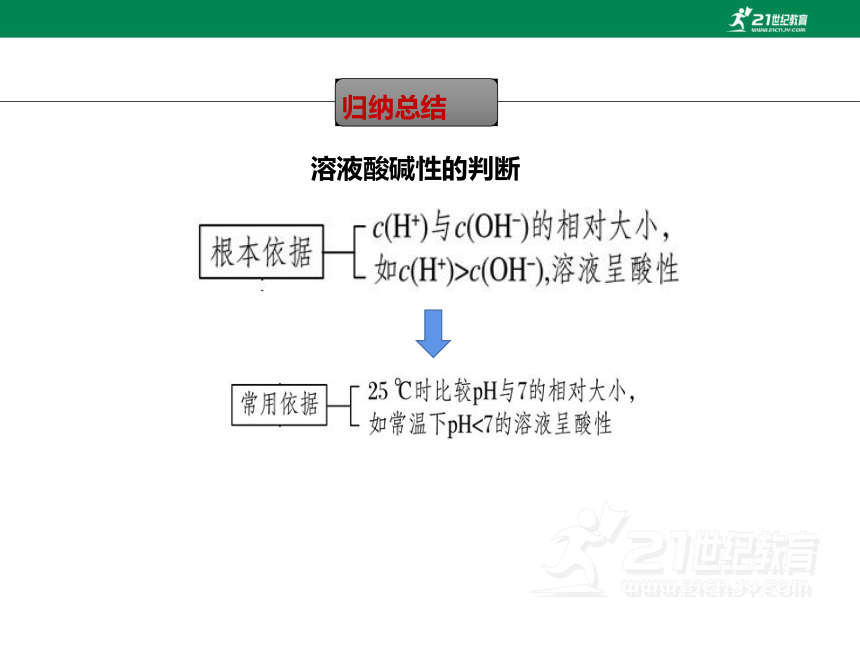
归纳总结
溶液酸碱性的判断
1.溶液的酸碱性与c(H+)和c(OH-)的关系
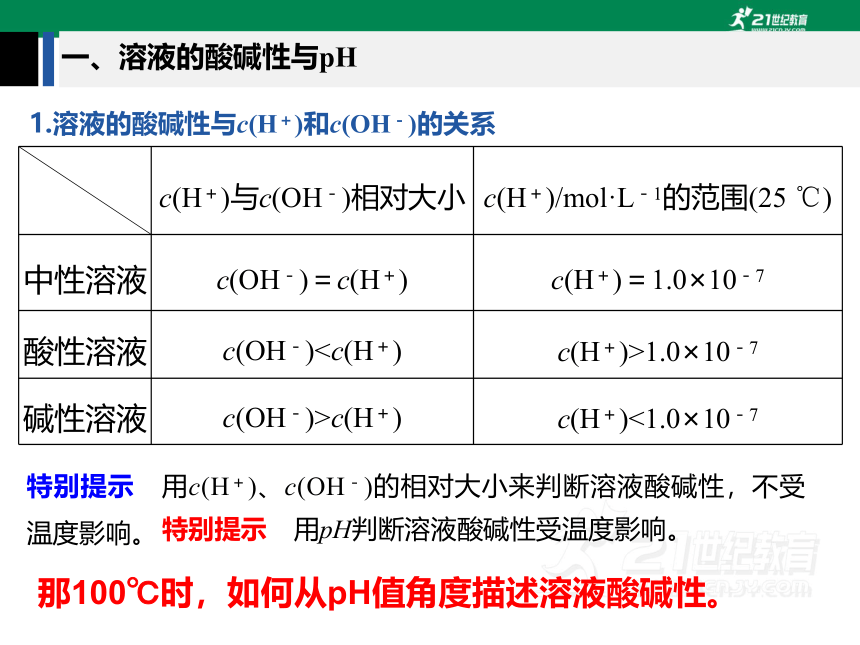
一、溶液的酸碱性与pH
c(H+)与c(OH-)相对大小 c(H+)/mol·L-1的范围(25 ℃)
中性溶液 c(OH-)=c(H+) c(H+)=1.0×10-7
酸性溶液 c(OH-)1.0×10-7
碱性溶液 c(OH-)>c(H+) c(H+)<1.0×10-7
特别提示 用c(H+)、c(OH-)的相对大小来判断溶液酸碱性,不受温度影响。
特别提示 用pH判断溶液酸碱性受温度影响。
那100℃时,如何从pH值角度描述溶液酸碱性。
例1 下列溶液一定显酸性的是
A.溶液中c(OH-)>c(H+)
B.滴加紫色石蕊溶液后变红色的溶液
C.溶液中c(H+)=10-6 mol·L-1
D.常温时,溶液中由水电离的c(H+)=10-9 mol·L-1
√
思考:还有什么方法确定溶液的酸碱性?
酸碱指示剂
pH试纸
2.溶液酸碱性的测定方法
(1)酸碱指示剂法(只能测定溶液的pH范围):常见酸碱指示剂的变色范围:
指示剂 变色范围(颜色与pH的关系)
石蕊 <5.0红色 5.0~8.0紫色 >8.0 色
酚酞 <8.2无色 8.2~10.0浅红色 >10.0 色
甲基橙 <3.1 色 3.1~4.4橙色 >4.4 色
蓝
红
红
黄
(2)利用pH试纸测定。使用pH试纸的正确操作为取一小块pH试纸于干燥洁净的 , 用干燥洁净的玻璃棒蘸取试液点在试纸上,当试纸颜色变化稳定后迅速与 对照,读出pH。
(3)利用pH计测定。仪器pH计可精确测定试液的pH(读至小数点后2位)。
玻璃片或表面皿上
标准比色卡
H2O H++OH-
围绕水的电离思考:
(1)往纯水中,通入HCl气体,对水的电离有何影响 此时Kw如何变化?此时溶液酸碱性如何?从酸碱性本质上解释原因?
(2)25℃,往1L水中通入1molHCl气体(忽略溶液体积变化),
求此时:溶液中的 C(H+)和C(OH-)浓度为多少
水电离出来的 C(H+)和C(OH-)浓度为多少
溶液中的pH值为多少?
H2O H++OH-
围绕水的电离思考:
(1)往纯水中,加入NaOH固体,对水的电离有何影响 此时Kw如何变化?此时溶液酸碱性如何?从酸碱性本质上解释原因?
(2)25℃,往1L水中通入NaOH固体(忽略溶液体积变化),
求此时:溶液中的 C(H+)和C(OH-)浓度为多少
水电离出来的 C(H+)和C(OH-)浓度为多少
溶液中的pH值为多少?
H2O H++OH-
围绕水的电离思考:
(1)往纯水中,加入Na单质,对水的电离有何影响 此时Kw如何变化?此时溶液酸碱性如何?从酸碱性本质上解释原因?
(2)往纯水中,加入CH3COONa固体,对水的电离有何影响 此时Kw如何变化?此时溶液酸碱性如何?从酸碱性本质上解释原因?
(3)pH=3的氯化铵溶液, 溶液中C(H+)和C(OH-)浓度为多少?
水电离出的C(H+)和C(OH-)浓度为多少?
归纳:
影响水电离的外界因素有哪些?
对于水溶液中,溶液中的C(H+)和C(OH-)浓度有什么定量关系?
水电离出的C(H+)和C(OH-)浓度有什么定量关系?
某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
2×10-7 mol/L
8×10-9 mol/L
2.溶液的pH与c(H+)及酸碱性的关系
(1)pH是c(H+)的负对数,其表达式是pH= 。
(2)溶液的pH、c(H+)及酸碱性的关系图(25 ℃):
(3)pH的适用范围:1×10-14 mol·L-1≤c(H+)≤1 mol·L-1。
-lg c(H+)
溶液pH的计算
(1)单一溶液pH的计算
相关链接
溶液类型 相关计算
强酸HnA溶液 设HnA的浓度为c mol·L-1,则c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg nc
强碱B(OH)n 溶液 设B(OH)n的浓度为c mol·L-1,则c(OH-)=nc mol·L-1,c(H+)= mol·L-1,pH=-lg c(H+)=14+lg nc
稀释问题
(1)pH=3的HCl稀释100倍,pH=?
有何规律?
(2)pH=5的HCl稀释10倍,pH=?稀释1000倍pH=?
无限稀释?
(3)pH=13的NaOH稀释100倍,pH=?
有何规律?
(4)pH=10的HCl稀释10倍,pH=?稀释1000倍pH=?
无限稀释?
(5)pH=3的CH3COOH稀释100倍,pH=?
可否求出范围?
(6)pH=3的CH3COOH和HCl溶液都稀释100倍,以加水体积横坐标,
pH为纵坐标,做出PH随加水体积的变化图像。
(7)pH=12的NH3 H2O稀释100倍,pH=?
可否求出范围?
(8)pH=12的NH3 H2O和NaOH溶液都稀释100倍,以加水体积横坐标,pH为纵坐标,做出PH随加水体积的变化图像。
pH=3的两种酸HA和HB,加水稀释后PH值变化如图所示,根据图像回答下列问题:
(2)HA、HB分别属于强酸还是弱酸?
(3)若HA也属于弱酸,a的取值范围?
(1)比较两种酸酸性强弱?
(4)若两种酸起始浓度均为0.1mol/L,
a=3,求HB的电离平衡常数 ?
pH相等的酸或碱溶液稀释后溶液pH的变化示意图
归纳总结
图示
混合问题
例 常温下,将pH=8和pH=10的两种强碱溶液等体积混合,则混合溶液的pH为
A.8.3 B.9
C.9.7 D.无法确定
√
解析 由于两种溶液均为强碱溶液,故应先求溶液中的c(OH-),再求c(H+)和pH。
例6 在25 ℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该HCl溶液用该NaOH溶液中和,需Vb L NaOH溶液。请回答下列问题:
(1)若a+b=14,则Va∶Vb= 。
(2)若a+b=13,则Va∶Vb= 。
(3)若a+b>14,则Va∶Vb= ,且Va (填“>”“<”或“=”)Vb。
1∶1
1∶10
10a+b-14
>
已知水在25℃和95℃时,电离平衡曲线如图所示
(1)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液呈中性,则a与b之间应该满足的关系是?
(2)25℃时,等体积的pH=3的盐酸溶液与pH=11的氢氧化钠溶液混合,混合后溶液呈什么性?
(3)25℃时,等体积的pH=3的盐酸溶液与pH=11的氨水混合,混合后溶液呈什么性?
(4)25℃时,等体积的pH=3的醋酸溶液与pH=11的氢氧化钠溶液混合,混合后溶液呈什么性?
(5)曲线B对应的温度下,等体积的pH=3的盐酸溶液和pH=9的BOH溶液
①比较两份溶液中水的电离程度大小?
②将两者等体积混合,混合后溶液呈什么性?请说 明你判断的理由?
(6)25℃时,向amol/L醋酸溶液中加入等体积的氢氧化钠bmol/L,得到中性溶液,求醋酸溶液的电离平衡常数。
3.2.1 水的电离
人教版(2019)高中化学
选择性必修一
H2O H++OH-
围绕水的电离思考:
(1)纯水中,C(H+)和C(OH-)浓度大小关系
(2)25℃,C(H+)和C(OH-)浓度为多少 此时pH=
(3)25℃,此时为酸性、碱性还是中性?
(4)100 ℃水中,C(H+)和C(OH-)浓度大小关系
(5)100℃,C(H+)和C(OH-)浓度为多少 此时pH=
(6)100℃,此时为酸性、碱性还是中性?
(7)回顾从PH值角度判断酸、碱、中性的方法?
(8)酸、碱、中性的实质是什么?与pH值有何关系
归纳总结
溶液酸碱性的判断
1.溶液的酸碱性与c(H+)和c(OH-)的关系
一、溶液的酸碱性与pH
c(H+)与c(OH-)相对大小 c(H+)/mol·L-1的范围(25 ℃)
中性溶液 c(OH-)=c(H+) c(H+)=1.0×10-7
酸性溶液 c(OH-)
碱性溶液 c(OH-)>c(H+) c(H+)<1.0×10-7
特别提示 用c(H+)、c(OH-)的相对大小来判断溶液酸碱性,不受温度影响。
特别提示 用pH判断溶液酸碱性受温度影响。
那100℃时,如何从pH值角度描述溶液酸碱性。
例1 下列溶液一定显酸性的是
A.溶液中c(OH-)>c(H+)
B.滴加紫色石蕊溶液后变红色的溶液
C.溶液中c(H+)=10-6 mol·L-1
D.常温时,溶液中由水电离的c(H+)=10-9 mol·L-1
√
思考:还有什么方法确定溶液的酸碱性?
酸碱指示剂
pH试纸
2.溶液酸碱性的测定方法
(1)酸碱指示剂法(只能测定溶液的pH范围):常见酸碱指示剂的变色范围:
指示剂 变色范围(颜色与pH的关系)
石蕊 <5.0红色 5.0~8.0紫色 >8.0 色
酚酞 <8.2无色 8.2~10.0浅红色 >10.0 色
甲基橙 <3.1 色 3.1~4.4橙色 >4.4 色
蓝
红
红
黄
(2)利用pH试纸测定。使用pH试纸的正确操作为取一小块pH试纸于干燥洁净的 , 用干燥洁净的玻璃棒蘸取试液点在试纸上,当试纸颜色变化稳定后迅速与 对照,读出pH。
(3)利用pH计测定。仪器pH计可精确测定试液的pH(读至小数点后2位)。
玻璃片或表面皿上
标准比色卡
H2O H++OH-
围绕水的电离思考:
(1)往纯水中,通入HCl气体,对水的电离有何影响 此时Kw如何变化?此时溶液酸碱性如何?从酸碱性本质上解释原因?
(2)25℃,往1L水中通入1molHCl气体(忽略溶液体积变化),
求此时:溶液中的 C(H+)和C(OH-)浓度为多少
水电离出来的 C(H+)和C(OH-)浓度为多少
溶液中的pH值为多少?
H2O H++OH-
围绕水的电离思考:
(1)往纯水中,加入NaOH固体,对水的电离有何影响 此时Kw如何变化?此时溶液酸碱性如何?从酸碱性本质上解释原因?
(2)25℃,往1L水中通入NaOH固体(忽略溶液体积变化),
求此时:溶液中的 C(H+)和C(OH-)浓度为多少
水电离出来的 C(H+)和C(OH-)浓度为多少
溶液中的pH值为多少?
H2O H++OH-
围绕水的电离思考:
(1)往纯水中,加入Na单质,对水的电离有何影响 此时Kw如何变化?此时溶液酸碱性如何?从酸碱性本质上解释原因?
(2)往纯水中,加入CH3COONa固体,对水的电离有何影响 此时Kw如何变化?此时溶液酸碱性如何?从酸碱性本质上解释原因?
(3)pH=3的氯化铵溶液, 溶液中C(H+)和C(OH-)浓度为多少?
水电离出的C(H+)和C(OH-)浓度为多少?
归纳:
影响水电离的外界因素有哪些?
对于水溶液中,溶液中的C(H+)和C(OH-)浓度有什么定量关系?
水电离出的C(H+)和C(OH-)浓度有什么定量关系?
某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
2×10-7 mol/L
8×10-9 mol/L
2.溶液的pH与c(H+)及酸碱性的关系
(1)pH是c(H+)的负对数,其表达式是pH= 。
(2)溶液的pH、c(H+)及酸碱性的关系图(25 ℃):
(3)pH的适用范围:1×10-14 mol·L-1≤c(H+)≤1 mol·L-1。
-lg c(H+)
溶液pH的计算
(1)单一溶液pH的计算
相关链接
溶液类型 相关计算
强酸HnA溶液 设HnA的浓度为c mol·L-1,则c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg nc
强碱B(OH)n 溶液 设B(OH)n的浓度为c mol·L-1,则c(OH-)=nc mol·L-1,c(H+)= mol·L-1,pH=-lg c(H+)=14+lg nc
稀释问题
(1)pH=3的HCl稀释100倍,pH=?
有何规律?
(2)pH=5的HCl稀释10倍,pH=?稀释1000倍pH=?
无限稀释?
(3)pH=13的NaOH稀释100倍,pH=?
有何规律?
(4)pH=10的HCl稀释10倍,pH=?稀释1000倍pH=?
无限稀释?
(5)pH=3的CH3COOH稀释100倍,pH=?
可否求出范围?
(6)pH=3的CH3COOH和HCl溶液都稀释100倍,以加水体积横坐标,
pH为纵坐标,做出PH随加水体积的变化图像。
(7)pH=12的NH3 H2O稀释100倍,pH=?
可否求出范围?
(8)pH=12的NH3 H2O和NaOH溶液都稀释100倍,以加水体积横坐标,pH为纵坐标,做出PH随加水体积的变化图像。
pH=3的两种酸HA和HB,加水稀释后PH值变化如图所示,根据图像回答下列问题:
(2)HA、HB分别属于强酸还是弱酸?
(3)若HA也属于弱酸,a的取值范围?
(1)比较两种酸酸性强弱?
(4)若两种酸起始浓度均为0.1mol/L,
a=3,求HB的电离平衡常数 ?
pH相等的酸或碱溶液稀释后溶液pH的变化示意图
归纳总结
图示
混合问题
例 常温下,将pH=8和pH=10的两种强碱溶液等体积混合,则混合溶液的pH为
A.8.3 B.9
C.9.7 D.无法确定
√
解析 由于两种溶液均为强碱溶液,故应先求溶液中的c(OH-),再求c(H+)和pH。
例6 在25 ℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该HCl溶液用该NaOH溶液中和,需Vb L NaOH溶液。请回答下列问题:
(1)若a+b=14,则Va∶Vb= 。
(2)若a+b=13,则Va∶Vb= 。
(3)若a+b>14,则Va∶Vb= ,且Va (填“>”“<”或“=”)Vb。
1∶1
1∶10
10a+b-14
>
已知水在25℃和95℃时,电离平衡曲线如图所示
(1)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液呈中性,则a与b之间应该满足的关系是?
(2)25℃时,等体积的pH=3的盐酸溶液与pH=11的氢氧化钠溶液混合,混合后溶液呈什么性?
(3)25℃时,等体积的pH=3的盐酸溶液与pH=11的氨水混合,混合后溶液呈什么性?
(4)25℃时,等体积的pH=3的醋酸溶液与pH=11的氢氧化钠溶液混合,混合后溶液呈什么性?
(5)曲线B对应的温度下,等体积的pH=3的盐酸溶液和pH=9的BOH溶液
①比较两份溶液中水的电离程度大小?
②将两者等体积混合,混合后溶液呈什么性?请说 明你判断的理由?
(6)25℃时,向amol/L醋酸溶液中加入等体积的氢氧化钠bmol/L,得到中性溶液,求醋酸溶液的电离平衡常数。
