2022-2023学年高二上学期化学人教版(2019)选择性必修1-2.4化学反应的调控 课件 (25张ppt)
文档属性
| 名称 | 2022-2023学年高二上学期化学人教版(2019)选择性必修1-2.4化学反应的调控 课件 (25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-27 22:18:04 | ||
图片预览







文档简介
(共25张PPT)
化学反应的调控
引入
新课引入
我们对化学反应的调控并不陌生。
例如,为了灭火,可以采取隔离可燃物、隔绝空气或降低温度等措施;
为了延长食物储存时间,可以将它们保存在冰箱中。
【学习任务一】合成氨知识回顾
1.合成氨的应用(固氮):18世纪末,英国化学家克鲁克斯“先天下之忧而忧”,率先发出为了使子孙后代免于饥饿“向空气要氮肥”的号召。
信息资料
应用探究
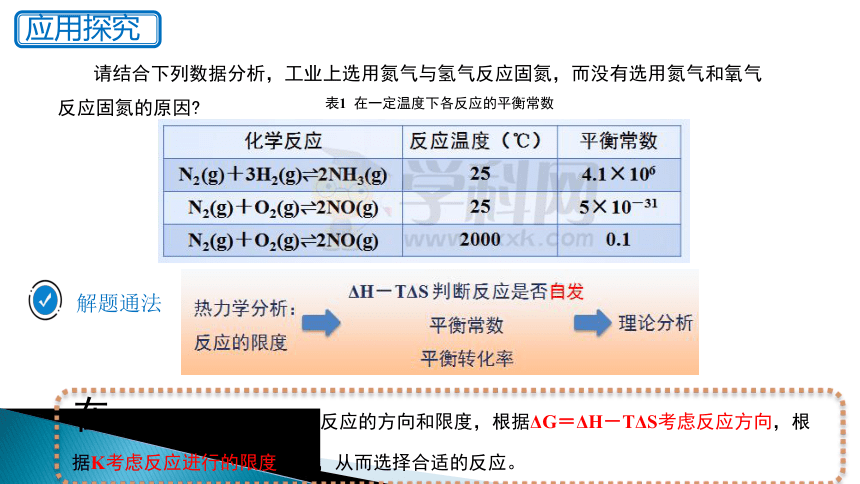
请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因
表1 在一定温度下各反应的平衡常数
解题通法
在选择反应时,首先要考虑反应的方向和限度,根据ΔG=ΔH-TΔS考虑反应方向,根据K考虑反应进行的限度问题,从而选择合适的反应。
从化学平衡的视角分析,合成氨应该可行!
氧化法:N2(g) + O2(g) 2NO(g) 常温 K=5×10-31
2.固氮的可行性分析:(1)从化学平衡的视角
还原法:N2(g) + 3H2(g) 2NH3(g) 常温 K=5.0×108
(2)从化学反应的方向性视角:
N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1
自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行
【学习任务一】合成氨知识回顾
信息资料
德国化学家哈伯向合成氨发起冲击。1908年7月,他在实验室用氮气和氢气在600 ℃、20 MPa下得到了氨,但是产率只有2%。
哈伯合成氨所用装置
冷却室
反应器
出水口
干燥室
液态NH3
出口
进水口
未反应气体通过循环泵返回
压缩N2和H2进口
18世纪末,有人试图在常温常压下合成氨,也有人在常温加压下进行实验。——都失败了
如何通过选择反应条件提高平衡混合物中氨的含量?
合成氨反应:N2(g)+3H2(g) 2NH3(g)。
已知298 K时:ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1。
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:ΔH<0,熵变:ΔS<0。
(4)自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行。
1.合成氨反应的特点
【学习任务二 】寻找工业合成氨的适宜条件
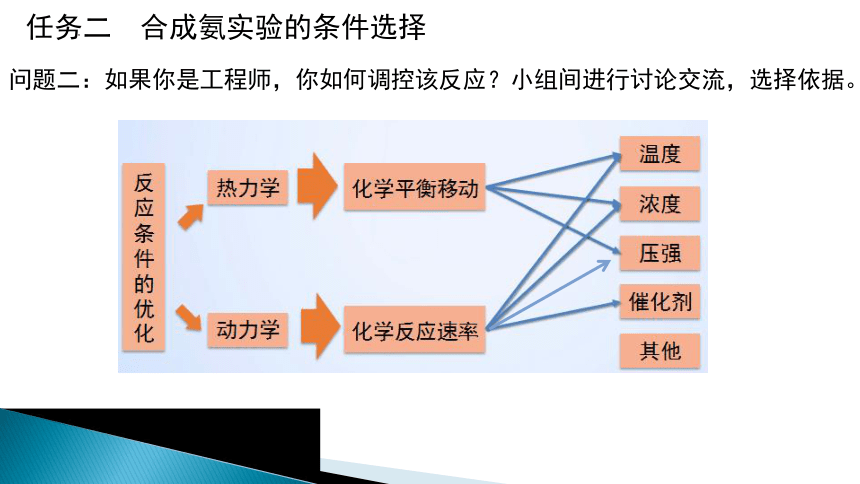
任务二 合成氨实验的条件选择
问题二:如果你是工程师,你如何调控该反应?小组间进行讨论交流,选择依据。
思考与交流2:理论分析——通过合成氨反应的特点。如何通过选择反应条件提高平衡混合物中氨的含量?
2.从化学平衡分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
对合成氨 反应的影响 影响因素 浓度 温度 压强
提高平衡混合物中NH3的含量
增大反应为浓度
及时移走产生的氨
降低
增大
从化学平衡分析,合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
2.从化学平衡分析合成氨的适宜条件
通过实验验证理论
采用控制变量的方法:
300℃ 10MPa
①浓度
n(N2):n(H2) ≈ 1:3时,平衡时氨气
体积分数最大
理论分析:
①温度
理论分析:
低温可以提高平衡混合物中NH3的含量
实验结果:与理论预期一致
通过实验验证理论
采用控制变量的方法:
n(N2):n(H2) ≈ 1:3 10 MPa
2.从化学平衡分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
②压强
理论分析:
加压可以提高平衡混合物中NH3的含量
实验结果:与理论预期一致
通过实验验证理论
采用控制变量的方法:
n(N2):n(H2) ≈ 1:3 400 ℃
2.从化学平衡分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
小结:从化学平衡看,合成氨的适宜条件:
原料气 n(N2):n(H2)≈1:3
及时移走产生的氨
低温
高压
2.从化学平衡分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
三、工业合成氨的实际条件控制
合成氨反应为什么慢?
——活化能高
怎样降低反应的活化能?
——改变反应历程
从化学反应速率分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
思考与交流4:如何显著增大合成氨的化学反应速率?
思考与交流3:为什么没有在常温合成氨?合成氨难在哪儿?还有什么因素制约氨的合成?
常温下合成氨化学反应速率很小!
使用催化剂
即使在高温、高压下,N2和H2的化合反应仍然进行得十分缓慢。通常采用加放入催化剂的方法,改变反应历程,降低反应的活化能,使反应物在较低温度时能较快地发生反应。目前,合成氨工业中普遍使用的是以铁为主的多成分催化剂,又称铁触媒。
【信息资料】
思考与交流3:
为什么不选择更高的压强合成氨?
压强越大,速率、转化率都大,但对材料的强度和设备的制造要求越高,需要的动力越大,这将会大大增加生产投资,降低综合经济效益。
浓度
①原理分析:为提高平衡转化率,工业上采取迅速冷却的方法,使氨气变成液氨并及时分离减小生成物浓度,平衡向正向移动,提高氨的产率。
②实际分析:分离后的原料气N2和H2,并及时补充循环使用,使反应物保持一定的浓度。
4.工业合成氨生成条件的选择
二、寻找工业合成氨的适宜条件
合成氨常用的生产条件
压强:
温度:
催化剂:
浓度:
原料气:
合成氨工业流程
小结一:
使用铁触媒
400~500 ℃
10 MPa~30 MPa
循环使用
将氨液化及时分离
哈伯(德)(1918年)申请循环法合成氨专利
合成氨与三次诺贝尔化学奖
博施(德)
(1931年)
实现了合成氨的工业化
埃特尔(德) (2007年)
揭开了合成氨的“机理”
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa 。
弗兰克(德)(1898年)氮 气、碳化钙、水蒸气制氨
哈伯-博施合成法
埃特尔合成氨催化剂表面化学过程模型
合成氨机理图
①
②
③
④
⑤
⑥
①
②
⑥
③
④
⑤
① N2 (g)+ H2 (g)= N2 (吸)+ H2(吸)
② N2 (吸)+ H2(吸) =N(吸)+3H(吸)
③N(吸)+3H(吸) =NH(吸)+ 2H(吸)
④NH (吸)+2H(吸) =NH2(吸)+ H(吸)
⑤NH2 (吸)+H(吸) =NH3(吸)
⑥NH3 (吸)=NH3(g)
(决速步骤,活化能最大)
(吸附)
(解吸)
N2 (g)+ H2 (g)= NH3(g) =-46kJ/mol
总反应:
【分析】
① N2、H2物质的量之比为1 : 3时氨气平衡时百分含量最高,但反应速率不大,
② N2、H2物质的量之比为1 : 2.8时,通过提高N2的含量来提高N2的吸附速率,使反应速率增大。
1、影响化学反应进行的因素
(1)内因:参加反应的物质的组成、结构和性质等本身因素;
(2)外因:温度、压强、浓度、催化剂等反应条件。
四、化学反应条件的控制
2、化学反应的调控
(1)含义:通过改变反应条件使一个可能发生的反应按照某一方向进行。
(2)考虑实际因素
a.结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找合适的生产条件。
b.根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
明确目的
可行性
确定
反应
原理分析
实验摸索
找条件
设备可行
成本核算
如何为一个化学反应选择适宜的生产条件?
影响因素
调控反应
化学平衡
反应速率
最佳效果
四、总结:化学反应的调控
化学反应的调控
引入
新课引入
我们对化学反应的调控并不陌生。
例如,为了灭火,可以采取隔离可燃物、隔绝空气或降低温度等措施;
为了延长食物储存时间,可以将它们保存在冰箱中。
【学习任务一】合成氨知识回顾
1.合成氨的应用(固氮):18世纪末,英国化学家克鲁克斯“先天下之忧而忧”,率先发出为了使子孙后代免于饥饿“向空气要氮肥”的号召。
信息资料
应用探究
请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因
表1 在一定温度下各反应的平衡常数
解题通法
在选择反应时,首先要考虑反应的方向和限度,根据ΔG=ΔH-TΔS考虑反应方向,根据K考虑反应进行的限度问题,从而选择合适的反应。
从化学平衡的视角分析,合成氨应该可行!
氧化法:N2(g) + O2(g) 2NO(g) 常温 K=5×10-31
2.固氮的可行性分析:(1)从化学平衡的视角
还原法:N2(g) + 3H2(g) 2NH3(g) 常温 K=5.0×108
(2)从化学反应的方向性视角:
N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1
自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行
【学习任务一】合成氨知识回顾
信息资料
德国化学家哈伯向合成氨发起冲击。1908年7月,他在实验室用氮气和氢气在600 ℃、20 MPa下得到了氨,但是产率只有2%。
哈伯合成氨所用装置
冷却室
反应器
出水口
干燥室
液态NH3
出口
进水口
未反应气体通过循环泵返回
压缩N2和H2进口
18世纪末,有人试图在常温常压下合成氨,也有人在常温加压下进行实验。——都失败了
如何通过选择反应条件提高平衡混合物中氨的含量?
合成氨反应:N2(g)+3H2(g) 2NH3(g)。
已知298 K时:ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1。
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:ΔH<0,熵变:ΔS<0。
(4)自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行。
1.合成氨反应的特点
【学习任务二 】寻找工业合成氨的适宜条件
任务二 合成氨实验的条件选择
问题二:如果你是工程师,你如何调控该反应?小组间进行讨论交流,选择依据。
思考与交流2:理论分析——通过合成氨反应的特点。如何通过选择反应条件提高平衡混合物中氨的含量?
2.从化学平衡分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
N2(g) + 3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
对合成氨 反应的影响 影响因素 浓度 温度 压强
提高平衡混合物中NH3的含量
增大反应为浓度
及时移走产生的氨
降低
增大
从化学平衡分析,合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
2.从化学平衡分析合成氨的适宜条件
通过实验验证理论
采用控制变量的方法:
300℃ 10MPa
①浓度
n(N2):n(H2) ≈ 1:3时,平衡时氨气
体积分数最大
理论分析:
①温度
理论分析:
低温可以提高平衡混合物中NH3的含量
实验结果:与理论预期一致
通过实验验证理论
采用控制变量的方法:
n(N2):n(H2) ≈ 1:3 10 MPa
2.从化学平衡分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
②压强
理论分析:
加压可以提高平衡混合物中NH3的含量
实验结果:与理论预期一致
通过实验验证理论
采用控制变量的方法:
n(N2):n(H2) ≈ 1:3 400 ℃
2.从化学平衡分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
小结:从化学平衡看,合成氨的适宜条件:
原料气 n(N2):n(H2)≈1:3
及时移走产生的氨
低温
高压
2.从化学平衡分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
三、工业合成氨的实际条件控制
合成氨反应为什么慢?
——活化能高
怎样降低反应的活化能?
——改变反应历程
从化学反应速率分析合成氨的适宜条件
【学习任务二 】寻找工业合成氨的适宜条件
思考与交流4:如何显著增大合成氨的化学反应速率?
思考与交流3:为什么没有在常温合成氨?合成氨难在哪儿?还有什么因素制约氨的合成?
常温下合成氨化学反应速率很小!
使用催化剂
即使在高温、高压下,N2和H2的化合反应仍然进行得十分缓慢。通常采用加放入催化剂的方法,改变反应历程,降低反应的活化能,使反应物在较低温度时能较快地发生反应。目前,合成氨工业中普遍使用的是以铁为主的多成分催化剂,又称铁触媒。
【信息资料】
思考与交流3:
为什么不选择更高的压强合成氨?
压强越大,速率、转化率都大,但对材料的强度和设备的制造要求越高,需要的动力越大,这将会大大增加生产投资,降低综合经济效益。
浓度
①原理分析:为提高平衡转化率,工业上采取迅速冷却的方法,使氨气变成液氨并及时分离减小生成物浓度,平衡向正向移动,提高氨的产率。
②实际分析:分离后的原料气N2和H2,并及时补充循环使用,使反应物保持一定的浓度。
4.工业合成氨生成条件的选择
二、寻找工业合成氨的适宜条件
合成氨常用的生产条件
压强:
温度:
催化剂:
浓度:
原料气:
合成氨工业流程
小结一:
使用铁触媒
400~500 ℃
10 MPa~30 MPa
循环使用
将氨液化及时分离
哈伯(德)(1918年)申请循环法合成氨专利
合成氨与三次诺贝尔化学奖
博施(德)
(1931年)
实现了合成氨的工业化
埃特尔(德) (2007年)
揭开了合成氨的“机理”
“合成氨”里的中国人:2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa 。
弗兰克(德)(1898年)氮 气、碳化钙、水蒸气制氨
哈伯-博施合成法
埃特尔合成氨催化剂表面化学过程模型
合成氨机理图
①
②
③
④
⑤
⑥
①
②
⑥
③
④
⑤
① N2 (g)+ H2 (g)= N2 (吸)+ H2(吸)
② N2 (吸)+ H2(吸) =N(吸)+3H(吸)
③N(吸)+3H(吸) =NH(吸)+ 2H(吸)
④NH (吸)+2H(吸) =NH2(吸)+ H(吸)
⑤NH2 (吸)+H(吸) =NH3(吸)
⑥NH3 (吸)=NH3(g)
(决速步骤,活化能最大)
(吸附)
(解吸)
N2 (g)+ H2 (g)= NH3(g) =-46kJ/mol
总反应:
【分析】
① N2、H2物质的量之比为1 : 3时氨气平衡时百分含量最高,但反应速率不大,
② N2、H2物质的量之比为1 : 2.8时,通过提高N2的含量来提高N2的吸附速率,使反应速率增大。
1、影响化学反应进行的因素
(1)内因:参加反应的物质的组成、结构和性质等本身因素;
(2)外因:温度、压强、浓度、催化剂等反应条件。
四、化学反应条件的控制
2、化学反应的调控
(1)含义:通过改变反应条件使一个可能发生的反应按照某一方向进行。
(2)考虑实际因素
a.结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找合适的生产条件。
b.根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
明确目的
可行性
确定
反应
原理分析
实验摸索
找条件
设备可行
成本核算
如何为一个化学反应选择适宜的生产条件?
影响因素
调控反应
化学平衡
反应速率
最佳效果
四、总结:化学反应的调控
