专题2《化学反应速率与化学平衡》检测题2022-2023学年上学期苏教版(2020)高中化学选择性必修1(Word含答案)
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》检测题2022-2023学年上学期苏教版(2020)高中化学选择性必修1(Word含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 596.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-28 16:26:10 | ||
图片预览




文档简介
专题2《化学反应速率与化学平衡》检测题
一、单选题
1.下列不属于自发进行的变化是
A.红墨水加到清水使整杯水变红 B.冰在室温下融化成水
C.电解饱和食盐水 D.铁器在潮湿的空气中生锈
2.某温度时,在催化剂作用下,2 L恒容密闭容器中发生反应I2(g)+H2(g)2HI(g),部分数据如表:
t/min 0 2.0 4.0 6.0 8.0
n(HI)/mol 0 0.18 0.35 0.50 0.62
则2~6 min内,以H2的物质的量浓度变化表示的反应速率为A.0.02 mol L-1 min-1 B.0.04 mol L-1 min-1
C.0.08 mol L-1 min-1 D.0.16 mol L-1 min-1
3.开发催化加氢合成甲醇技术是有效利用资源,实现“碳达峰、碳中和”目标的重要途径。某温度下,在恒容密闭容器中发生反应: 。下列有关说法正确的是
A.加入合适的催化剂,能提高单位时间内的产量
B.升高反应温度有利于提高的平衡转化率
C.平衡后再通入适量,平衡常数K增大
D.增大体系的压强,平衡不发生移动
4.合成氨反应,达到平衡后,改变下列条件后,对正反应速率影响大于逆反应速率的是
A.减小生成物浓度 B.减小压强
C.升高温度 D.加入催化剂
5.已知反应在四种不同情况下的反应速率分别如下:
①v(A)=0.1 mol·L-1·min-1
②v(B)=0.15 mol·L-1·min-1
③
④v(D=0.1 mol·L-1·min-1
则该反应进行速率快慢顺序正确的是
A.①>②>③>④ B.②>①=④>③
C.③>①>②>④ D.④>③>①>②
6.以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
相关反应的热化学方程式为
反应I:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1=-213kJ/mol
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+O2(g) △H2=+327 kJ/mol
反应Ⅲ:2HI(aq)=H2(g)+I2(g) △H3=+172kJ/mol
下列说法不正确的是
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学力程式为2H2O(l)=2H2(g)+O2(g) △H=+286kJ/mol
D.该过程使水分解制氢反应更加容易发生,但总反应的△H不变
7.反应2NO2(g)N2O4(g) △H=-57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.T1>T2 B.X、Y两点的反应速率:X>Y
C.X、Z两点气体的颜色:X深,Z浅 D.X、Z两点气体的平均相对分子质量:X>Z
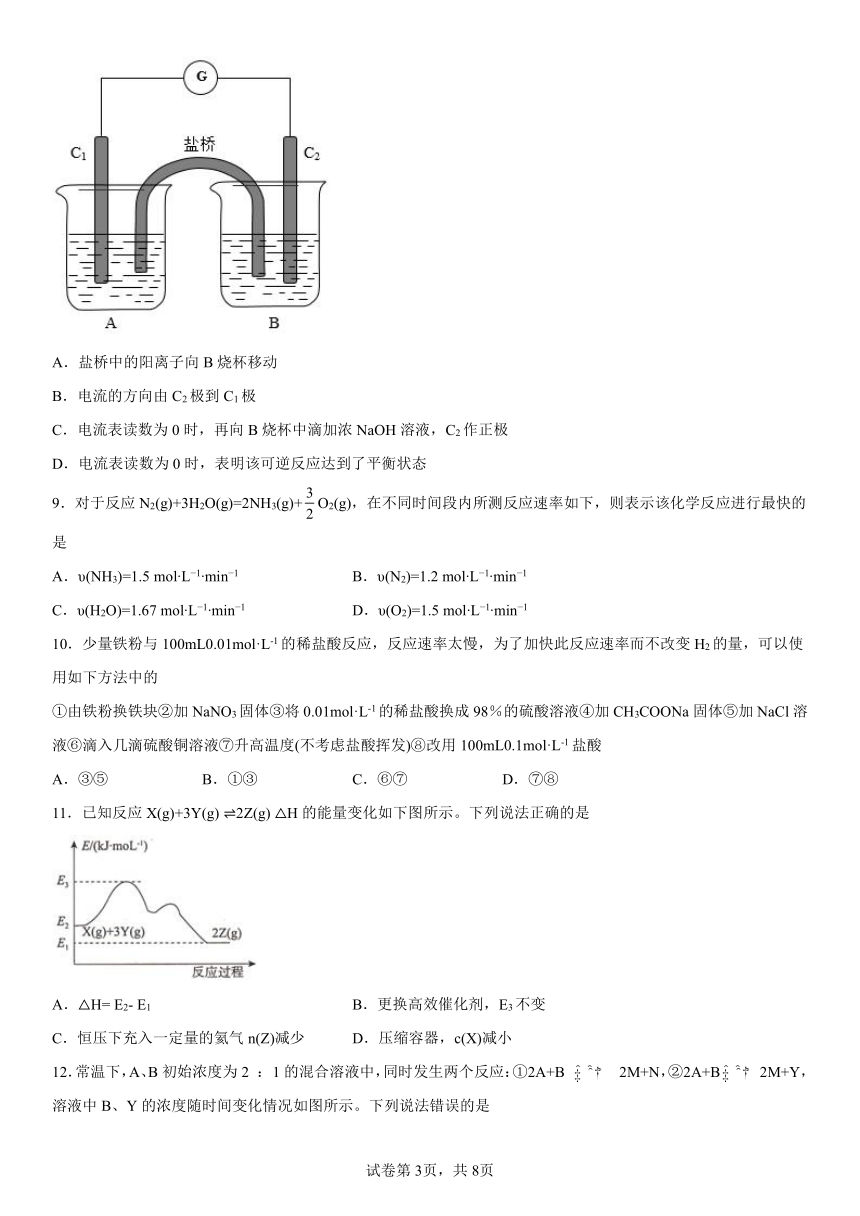
8.已知可逆反应:AsO+2I-+2H+AsO+I2+H2O。据此设计出如图所示的实验装置,其中C1、C2均为铂电极,A烧杯中为KI溶液,B烧杯中为Na3AsO4溶液。以下关于该装置的说法错误的是
A.盐桥中的阳离子向B烧杯移动
B.电流的方向由C2极到C1极
C.电流表读数为0时,再向B烧杯中滴加浓NaOH溶液,C2作正极
D.电流表读数为0时,表明该可逆反应达到了平衡状态
9.对于反应N2(g)+3H2O(g)=2NH3(g)+O2(g),在不同时间段内所测反应速率如下,则表示该化学反应进行最快的是
A.υ(NH3)=1.5 mol L 1 min 1 B.υ(N2)=1.2 mol L 1 min 1
C.υ(H2O)=1.67 mol L 1 min 1 D.υ(O2)=1.5 mol L 1 min 1
10.少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①由铁粉换铁块②加NaNO3固体③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用100mL0.1mol·L-1盐酸
A.③⑤ B.①③ C.⑥⑦ D.⑦⑧
11.已知反应X(g)+3Y(g) 2Z(g) △H的能量变化如下图所示。下列说法正确的是
A.△H= E2- E1 B.更换高效催化剂,E3不变
C.恒压下充入一定量的氦气n(Z)减少 D.压缩容器,c(X)减小
12.常温下,A、B初始浓度为2 : 1的混合溶液中,同时发生两个反应:①2A+B 2M+N,②2A+B2M+Y,溶液中B、Y的浓度随时间变化情况如图所示。下列说法错误的是
A.溶液中c(M)=c(N)+c(Y)
B.0~ 10min内,A的平均反应速率为0.04mol/(L·min)
C.18min时,反应①与反应②中B的转化率之比为2∶3
D.反应①的活化能比反应②的活化能大
二、填空题
13.CO2是一种廉价的碳资源,其综合利用具有重要意义。在容积为1L的恒容密闭容器中,充入1.00molCO2(g)和3.00molH2(g),一定条件下发生反应得到CH3OH(g)和H2O(g),测得反应物X和CH3OH(g)的浓度随时间的变化如图所示。
(1)0~3min内,v(CH3OH)=_______(保留三位有效数字)mol·L-1·min-1。
(2)该反应的化学方程式为_______。
(3)X代表的物质为_______(填化学式),理由是_______。
(4)9min后,保持其他条件不变,向容器中再通入1.00molCO2(g)和3.00molH2(g),则该反应的速率将_______(填“增大”、“减小”或“不变”)。
(5)下列可以作为该反应已达到平衡的判据的是_______(填标号)。
A.气体的压强不变 B.v正(CO2)=v逆(H2O)
C.CH3OH(g)与H2O(g)的浓度相同 D.容器内气体的密度不变
14.在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)
(1)保持容器容积不变,向其中充入1 mol H2,反应速率_________。
(2)升高温度,反应速率________。
(3)扩大容器体积,反应速率______。
(4)保持容器内气体压强不变,向其中充入1 mol H2(g)和1 mol I2(g),反应速率________。
(5)保持容器体积不变,向其中充入1 mol N2,反应速率________。
(6)保持容器内气体压强不变,向其中充入1 mol N2,反应速率________。
15.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______mol·L-1·min-1(用含t1的代数式表示);
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________(用图中a、b、c、d表示),理由是___________
(3)在该温度下,反应的标准平衡常数Kθ=____。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g) Kθ=,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
16.地下水中的氮污染主要是由引起的,人们对的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,将硝酸盐还原成氮气:。
(1)下列说法错误的是_______(填序号)。
A.氮肥溶于水的过程中熵值增大
B.在酸性条件下,活泼金属与反应属于自发反应
C.Pd/Cu双金属催化剂是该反应是否能自发发生的决定因素
(2)已知:的,(a、b均为正值),该反应_______(填“能”“不能”或“无法判断是否能”)自发进行。
17.某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表示]化学平衡的影响,得到如图所示图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
分析图像,回答下列问题:
(1)在图像反应Ⅰ中,若p1>p2,则此正反应为_______(填“吸热”或“放热”)反应,也是一个气体分子数_______(填“减少”或“增大”)的反应。
(2)在图像反应Ⅱ中,T1_______T2(填“>”“<”或“=”),该正反应为_______(填“吸热”或“放热”)反应。
(3)在图像反应Ⅲ中,若T2>T1,则此正反应为_______(填“吸热”或“放热”)反应。
(4)在图像反应Ⅳ中,若T1>T2,则该反应_______(填“能”或“不能”)自发进行。
18.反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,回答下列问题:
(1)增加Fe的量,其反应速率_______(填“增大”、“不变”或“减小”,下同);
(2)将容器的体积缩小一半,其反应速率_______;
(3)保持体积不变,充入N2使体系压强增大,其反应速率_______;
(4)保持压强不变,充入N2使容器的体积增大,其反应速率_______;
(5)在一定温度下,将一定量反应物充入该密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_______(填序号)。
a.容器中Fe、H2O、Fe3O4、H2共存
b.H2O、H2的物质的量之比为1:1
c.容器中的压强不随时间变化
d.容器中混合气体的平均相对分子质量保持不变
e.断裂4molH-O键的同时断裂4molH-H键
三、工业流程题
19.铬是一种重要的金属材料,被广泛用于冶金、化工、耐火材料等行业。某铬铁矿的主要成分为Cr2O3、Fe2O3、FeO,还有少量 MgO、Al2O3和杂质SiO2等,利用其制备多种铬产品和其他金属产品的工艺流程如下:
已知:Al2O3+Na2CO32NaAlO2+CO2↑ SiO2+Na2CO3Na2SiO3+CO2↑
回答下列问题:
(1)步骤①发生的主要反应为2FeO+Cr2O3+2Na2CO3+4NaNO32Na2CrO4+Fe2O3+4NaNO2+2A↑,反应时应选用何种材质的容器?_______(填字母)。
A.塑料 B.刚玉 C.铁 D.石英
(2)步骤②的操作是_______,“滤渣 2”是Al(OH)3和_______。 写出过量物质A与“滤液1"中溶质生成Al(OH)3 的离子方程式:_______。
(3)“滤液2”中的Na2CrO4需要用H2SO4酸化,用离子方程式表示该反应:_______。
(4)制取高纯铬常用电解法和铝热法,铝热法的缺点是_______。步骤④是在隔绝空气条件下,除生成Cr2O3 外,还生成了Na2CO3和CO,若该反应中有3 molNa2Cr2O7 参加反应,则转移的电子为_______mol。
(5)“滤渣1”中铁元素含量较高,具有回收价值。为回收金属,需要将含Fe3+的有机相进行反萃取,当反萃取剂的浓度均为0.5 mol L-1 时,反萃取效果最好的物质是_______(填化学式)。
20.工业上以碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)为主要原料生产锰酸锂(LiMn2O4)的工艺流程如下:
(1)为了提高碳酸锰矿浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③___________等。
(2)“除铁”时,加入CaO的目的是___________。
(3)“合成MnO2”的化学方程式为___________。
(4)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。
①升温到515℃时,开始有CO2产生,比预计碳酸锂的分解温度(723℃)低得多。可能的原因是___________。
②写出该反应的化学方程式:___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.扩散现象,是熵增加的自发过程,A不符合题意;
B.冰的熔点为0℃,水常温是液体,冰在室温下融化成水,是熵增加的自发过程,B不符合题意;
C.电解饱和食盐水,是在外电场的作用下强制发生的氧化还原反应,不是自发过程,C符合题意;
D.铁在潮湿的空气中生锈是发生了自发的氧化还原反应,属于电化学腐蚀,是自发进行的化学过程,D不符合题意;
综上所述答案为C。
2.A
【详解】2-6 min内,HI的物质的量由0.18 mol变为0.50 mol,△n(HI)=0.50 mol-0.18 mol=0.32 mol,根据方程式可知H2、HI变化的物质的量的比是1:2,则在这段时间内H2的物质的量改变了△n(H2)=△n(HI)=0.16 mol,故以H2的物质的量浓度变化表示的反应速率v(H2)== 0.02 mol L-1 min-1,故合理选项是A。
3.A
【详解】A.加入合适的催化剂,能降低反应的活化能,加快反应速率,提高单位时间内甲醇的产量,故A正确;
B.该反应是放热反应,升高温度,平衡向逆反应方向移动,氢气的转化率减小,故B错误;
C.平衡常数是温度函数,温度不变,平衡常数不变,所以平衡后再通入适量氢气,平衡常数K不变,故C错误;
D.该反应是气体体积减小的反应,增大体系的压强,平衡向正反应方向移动,故D错误;
故选A。
4.B
【分析】由N2+3H22NH3 △H<0可知,该反应为气体体积减小、且放热的反应,升高温度平衡逆向移动,增大压强平衡正向移动,减小生成物浓度平衡正向移动,结合升高温度、增大压强、增大浓度、使用催化剂均加快反应速率,据此分析解题。
【详解】A.减小生成物浓度平衡正向移动,反应速率减小,瞬间正反应速率不变,逆反应速率减小,则对逆反应的反应速率影响更大,A不合题意;
B.该反应为气体体积减小的反应,减小压强正、逆反应速率均减小,但平衡逆向移动,则对正反应的反应速率影响更大,B符合题意;
C.该反应为放热反应,升高温度正、逆反应速率均增大,但平衡逆向移动,对逆反应的反应速率影响更大,C不合题意;
D.加入催化剂,同等程度地改变正、逆反应速率,平衡不移动,D不合题意;
故答案为:B。
5.C
【详解】在单位相同的条件下,将不同物质的反应速率除以其计量数,得到的数值越大说明该反应速率越大,①v(A)=0.1 mol·L-1·min-1,②v(B)=mol·L-1·min-1,③,④v(D=mol·L-1·min-1,反应速率:③>①>②>④,故选C。
6.C
【详解】A.由图可知利用太阳能使化学反应发生,则太阳能转化为化学能,A正确;
B.由图可知总反应为水分解生成氧气、氢气,则SO2和I2对总反应起到了催化剂的作用,B正确;
C.由盖斯定律可知,I+II+III得到H2O(l)═H2 (g)+O2(g) △H=(-213kJ mol-1)+(+327kJ mol-1)+(+172kJ mol-1)=+286 kJ mol-1,C错误;
D.催化剂降低反应的活化能,不影响焓变,则该过程降低了水分解制氢反应的活化能,但总反应的△H不变,D正确;
故答案为:C。
7.B
【详解】A.升高温度,化学平衡逆向移动,的体积分数增大,Y点的体积分数小,则,A错误;
B.由选项A分析可知,X点的温度大于Y点的温度,温度越高,化学反应速率越快,所以反应速率X>Y,B正确;
C.X、Z两点温度相同,但压强不同,为红棕色气体,增大压强,平衡右移,但是气体的体积变小,浓度增大的影响较大,气体的颜色加深,则X、Z两点气体的颜色:X浅,Z深,C错误;
D.X、Z两点都在等温线上,X的压强小,增大压强,化学平衡正向移动,Z点时气体的物质的量小,则平均相对分子质量变大,即平均相对分子质量:X故选B。
8.C
【详解】A.AsO得到电子,碘离子失去电子,所以C1极是负极,C2极是正极,因此盐桥中的阳离子向B烧杯移动,故A正确;
B.C1极是负极,C2极是正极,因此电流的方向由C2极到C1极,故B正确;
C.电流表读数为0时,再向B烧杯中滴加浓NaOH溶液,氢离子浓度减小,反应逆向进行,单质碘作氧化剂,所以C1极是正极,C2作负极,故C错误;
D.该反应为可逆反应,当反应达到平衡状态时,各物质的浓度不再改变,则没有电流通过电流计,所以电流计读数为零,故D正确;
故选C。
9.B
【详解】根据速率与计量系数之比分析,比值越大速率越快,、、、,则比值最大即υ(N2)=1.2 mol L 1 min 1表示该化学反应进行最快,故B符合题意。
综上所述,答案为B。
10.D
【详解】①由铁粉换铁块,反应速率减慢,故错误;②加NaNO3固体与酸形成硝酸,不产生氢气,故错误;③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液,发生钝化现象,故错误;④加CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减慢,故错误;⑤加NaCl溶液,氢离子浓度减小,反应速率减慢,故错误;⑥滴入几滴硫酸铜溶液,铁置换出铜,构成原电池,反应速率加快,但Fe少量,导致生成的氢气减少,故错误;⑦升高温度(不考虑盐酸挥发),反应速率加快,故正确;⑧改用100mL0.1mol·L-1盐酸,氢离子浓度增大,反应速率加快,故正确;故选D。
11.C
【详解】A.△H=生成物的总能量-反应物的总能量=E1-E2,故A错误;
B.更换高效催化剂,降低反应活化能,反应速率加快,该反应中(E3-E2)为活化能,E2为反应物的能量,E2不变,活化能降低,则E3减小,故B错误;
C.恒压下充入一定量的氦气,容器体积增大,反应体系的分压减小,平衡向气体增多的方向移动,则n(Z)减少,故C正确;
D.压缩容器体积,压强增大,平衡向右移动,n(X)减小,体积减小,各物质的浓度都增大,平衡移动只能减弱这种改变,而不能消除,故c(X)还是比原来大,故D错误;
故选C。
12.A
【详解】A.以10min为例,设容器体积为VL,10min时生成Y0.12Vmol,则根据反应2A+B2M+Y,消耗B0.12Vmol,生成M0.24Vmol,10min时共消耗B0.2Vmol,则反应2A+B2M+N消耗B0.08Vmol,则生成N0.08Vmol,生成M0.16Vmol,共生成M0.4Vmol,c(M)=0.4mol/L,c(N)=0.08mol/L,c(Y)=0.12mol/L,A错误;
B.10min内B的浓度变化为0.2mol/L,根据反应①和②可知,0-10minA的浓度变化为0.4mol/L,则A的平均反应速率为,B正确;
C.18min时Y的浓度为0.15mol/L,则反应②消耗B的浓度为0.15mol/L,反应②B的转化率为30%,共消耗B的浓度为0.25mol/L,则反应①消耗B浓度为0.1mol/L,反应①B的转化率为20%,反应①和反应②中B的转化率之比为2∶3,C正确;
D.以10min内反应为例,反应①中B的反应速率为,反应②中B的反应速率为,反应②速率更快,活化能更小,D正确;
故答案选A。
13. 0.167 CO2(g)+3H2(g) CH3OH(g)+H2O(g) CO2 CO2与CH3OH的反应速率相同或X的减小量与甲醇的增加量一样 增大 AB
【分析】CO2(g)和H2(g)的初始浓度分别为1.00mol/L、3.00mol/L,由图可知,X的初始浓度为1.00mol/L、则X为CO2(g)。
【详解】(1)0~3min内, 。
(2)已知 CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g),按元素质量守恒,该反应的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
(3) 反应速率之比等于化学计量数之比,则X代表的物质为CO2,理由是CO2与CH3OH的反应速率相同X的减小量与甲醇的增加量一样;
(4)9min后,保持其他条件不变,向容器中再通入1.00molCO2(g)和3.00molH2(g),则反应物浓度增加,则该反应的速率将增大。
(5)A.反应中,气体的物质的量、压强会随着反应而变化,故容器内压强不随时间的变化,说明气体的物质的量不随时间变化,则说明反应已达平衡,A正确;
B.反应速率之比等于化学计量数之比,v正(CO2) =v正(H2O)=v逆(H2O) ,则说明反应已达平衡,B正确;
C.由方程式可知,CH3OH(g)与H2O(g)的浓度相同始终相同,故不能说明已平衡,选项C不正确;
D.密闭容器中, ,气体质量守恒,容积体积的不变,故不能说明已平衡,选项D不正确;
答案为AB。
14. 增大 增大 减小 不变 不变 减小
【详解】(1)在容器容积不变时,充入1 mol H2即c(H2)增大,反应物浓度增大,化学反应速率增大;
(2)升高温度,活化分子百分数增加,有效碰撞次数增多,反应速率增大;
(3)扩大容器体积,相当于减小各成分浓度,反应速率减小,
(4)保持容器内气体压强不变,保持充入1 mol H2(g)和1 mol I2(g),压强未变,体积增大,浓度也不变,则速率不变;
(5)保持容器容积不变,充入1mol N2,N2不参与反应,参与反应的各成分浓度未变,则反应速率不变;
(6)保持容器压强不变,充入N2,体积增大,各成分浓度减小,则反应速率减小。
15.(1)
(2) b 容器容积迅速缩小至原来的一半时,N2分压变为原来的2倍;其他条件不变时,容器容积减小,压强增大,平衡向气体体积减小的方向移动,即该平衡逆向移动,所以N2分压先变为原来的2倍,后逐渐减小
(3)0.48
【解析】(1)
密闭容器中0.1mol NH3总压为200kPa,则如图t1时H2的分压为120kPa,则H2的物质的量n(H2)=,则用H2的浓度变化表示的反应速率v(H2)=;
(2)
t2时刻容器体积迅速缩小到原来的一半,则N2的分压迅速增大到原来的2倍,则cd错误;压强增大,化学平衡向气体总体积减小的方向移动,即化学平衡逆向移动,导致N2的分压应比原来2倍小,则b正确,a错误,故合理选项是b;
(3)
在该温度下,达到平衡时,p(N2)=40kPa=0.4pθ、p(H2)=120kPa=1.2pθ、p(NH3)=120kPa=1.2pθ,则Kθ=。
16. C 无法判断是否能
【详解】(1) A.溶于水时混乱度增大,其熵值增大,A项正确;
B.活泼金属易失去电子,酸性条件下具有强氧化性,二者反应属于自发反应,B项正确;
C.决定反应是否为自发反应的因素是反应物自身的性质,C项错误;
故答案为:C;
(2),由于无法判断a和bT值的相对大小,故无法确定是大于0还是小于0,所以无法判断该反应是否能自发进行,故答案为:无法判断是否能。
17. 放热 减少 < 放热 放热 不能自发进行
【详解】(1)在图像反应Ⅰ中,升高温度,A的转化率减小,平衡逆向移动,则此正反应为放热反应;若p1>p2,增大压强,A的转化率增大,平衡正向移动,反应是一个气体分子数减少的反应。
(2)在图像反应Ⅱ中,T2温度下反应先达到平衡,反应速率快,T1(3)在图像反应Ⅲ中,若T2>T1,升高温度,C的体积分数减小,平衡逆向移动,则此正反应为放热反应。
(4)在图像反应Ⅳ中,增大压强,A的转化率不变,说明反应前后气体分子数相同,若T1>T2,升高温度,A的转化率增大,说明正反应吸热,根据 ,该反应不能自发进行。
18.(1)不变
(2)增大
(3)不变
(4)减小
(5)d
【分析】(1)
因铁是固体,增加铁的量,没有增加铁的浓度,所以不能改变反应速率;
(2)
容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快;
(3)
体积不变,充入N2使体系压强增大,但各物质的浓度不变,所以反应速率不变;
(4)
压强不变,充入N2使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小;
(5)
在一定温度下,将一定量反应物充入该密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是:
a.可逆反应不能进行到底,无论反应进行到何种程度,容器中Fe、H2O、Fe3O4、H2四种物质都会共存,因此不能说明该反应达到平衡状态,a错误;
b.H2O、H2的物质的量之比与投料有关,不能说明该反应达到平衡状态,b错误;
c.由于左右化学计量数之和相等,故容器中的压强不随时间变化,不能说明该反应达到平衡状态,c错误;
d.气体质量为变量,物质的量不变,容器中混合气体的平均相对分子质量保持不变,说明该反应达到平衡状态,d正确;
e.断裂4molH-O键的同时生成4molH-H键,说明该反应达到平衡状态,e错误;
故选d。
19.(1)C
(2) 水浸、过滤 H2SiO3 +CO2 +2H2O=Al(OH)3↓+
(3)2+2H+ =+H2O
(4) 能耗大或者产品纯度较低 18
(5)(NH4)2HPO4
【分析】铬铁矿的主要成分为Cr2O3、Fe2O3、FeO,还有少量 MgO、Al2O3和杂质SiO2等,加入Na2CO3、NaNO3进行熔融、氧化,发生反应2FeO+Cr2O3+2Na2CO3+4NaNO32Na2CrO4+Fe2O3+4NaNO2+2CO2↑、Al2O3+Na2CO32NaAlO2+CO2↑、SiO2+Na2CO3Na2SiO3+CO2↑,所得产物进行水浸、过滤,得到的滤渣1主要为Fe2O3、 MgO,滤液1中含Na2CrO4、NaNO2、NaAlO2、Na2SiO3、Na2CO3、NaNO3,滤渣1加硫酸进行酸溶、加过氧化氢进行氧化,所得溶液加有机萃取剂进行萃取分液,得到含有铁离子的有机相,经过一系列处理得到铁离子,向滤液1中通入过量的二氧化碳,二氧化碳和NaAlO2反应生成Al(OH)3沉淀、和Na2SiO3反应生成H2SiO3沉淀,因此滤渣2的主要成分为Al(OH)3和H2SiO3,经过一系列处理得到含铝产品,滤液2中Na2CrO4经过酸化得到Na2Cr2O7,Na2Cr2O7与焦炭在高温条件下反应得到Cr2O3,Cr2O3经处理得到Cr。
(1)
A.塑料不耐高温,A错误;
B.刚玉主要成分为氧化铝,氧化铝高温条件下能和碳酸钠反应生成偏铝酸钠和二氧化碳,B错误;
C.铁不与上述反应过程中的物质反应,C正确;
D.石英主要成分为二氧化硅,二氧化硅和碳酸钠高温条件下反应生成硅酸钠和二氧化碳,D错误;
答案选C。
(2)
熔块经处理得到滤渣和滤液,因此步骤②为水浸、过滤,由分析可知,滤渣2是Al(OH)3和H2SiO3,步骤①发生的主要反应为2FeO+Cr2O3+2Na2CO3+4NaNO32Na2CrO4+Fe2O3+4NaNO2+2A↑,依据原子守恒可知,A为CO2,过量的CO2与“滤液1"中的NaAlO2反应生成Al(OH)3沉淀,反应的离子方程式为:+CO2 +2H2O=Al(OH)3↓+。
(3)
“滤液2”中的Na2CrO4经H2SO4酸化得到Na2Cr2O7,离子方程式为:2+2H+ =+H2O。
(4)
铝热法制高纯铬,铝热反应的耗能大,得到产品的纯度低,Na2Cr2O7与焦炭在高温条件下除生成Cr2O3 外,还生成了Na2CO3和CO,铬元素化合价由+6价降低到+3价,若该反应中有3 molNa2Cr2O7 参加反应,则转移电子的物质的量为3mol=18mol。
(5)
由图像可知,当反萃取剂的浓度均为0.5 mol L-1 时,(NH4)2HPO4的反萃取效果最好。
20.(1)增大硫酸的浓度(或将碳酸锰矿研成粉末等)
(2)调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而除去
(3)MnSO4+K2S2O8+2H2O=MnO2↓+K2SO4+2H2SO4
(4) MnO2是催化剂,加快了碳酸锂分解 8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑
【分析】向碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)其中加入硫酸,发生MnCO3+H2SO4=MnSO4+CO2↑+H2O,且三种氧化物均溶解转化为硫酸盐,向其中加高锰酸钾可氧化亚铁离子,将亚铁离子氧化为铁离子,加CaO调节pH可使铁离子转化为氢氧化铁沉淀,过滤后,向滤液中MnF2是为了除去溶液中的Ca2+,过滤后发生MnSO4+K2S2O8+2H2O=MnO2↓+K2SO4+2H2SO4,最后发生8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑,据此分析解题。
(1)
为了提高碳酸锰矿浸出的速率,可以从浓度、温度、固体表面积等方面思考,因此在“酸浸”时可采取的措施还有:适当增大硫酸的浓度(或将碳酸锰矿研成粉末等);故答案为:增大硫酸的浓度(或将碳酸锰矿研成粉末等)。
(2)
“除铁”时,加入CaO的目的是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而除去;故答案为:调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而除去。
(3)
根据流程图分析可知滤液中MnSO4被K2S2O8氧化生成MnO2,MnSO4中S化合价升高变为MnO2,K2S2O8中部分 1价的O化合价降低变为 2价,再根据得失电子守恒和质量守恒配平,得到“合成MnO2”的化学方程式为:MnSO4+K2S2O8+2H2O=MnO2↓+K2SO4+2H2SO4;故答案为:MnSO4+K2S2O8+2H2O=MnO2↓+K2SO4+2H2SO4。
(4)
①可能的原因是MnO2是催化剂,降低反应所需活化能,加快了碳酸锂分解;故答案为:MnO2是催化剂,加快了碳酸锂分解。
②MnO2中Mn化合价降低,则反应中只有氧化合价升高,变为氧气,因此该反应的化学方程式为:8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑;故答案为:8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列不属于自发进行的变化是
A.红墨水加到清水使整杯水变红 B.冰在室温下融化成水
C.电解饱和食盐水 D.铁器在潮湿的空气中生锈
2.某温度时,在催化剂作用下,2 L恒容密闭容器中发生反应I2(g)+H2(g)2HI(g),部分数据如表:
t/min 0 2.0 4.0 6.0 8.0
n(HI)/mol 0 0.18 0.35 0.50 0.62
则2~6 min内,以H2的物质的量浓度变化表示的反应速率为A.0.02 mol L-1 min-1 B.0.04 mol L-1 min-1
C.0.08 mol L-1 min-1 D.0.16 mol L-1 min-1
3.开发催化加氢合成甲醇技术是有效利用资源,实现“碳达峰、碳中和”目标的重要途径。某温度下,在恒容密闭容器中发生反应: 。下列有关说法正确的是
A.加入合适的催化剂,能提高单位时间内的产量
B.升高反应温度有利于提高的平衡转化率
C.平衡后再通入适量,平衡常数K增大
D.增大体系的压强,平衡不发生移动
4.合成氨反应,达到平衡后,改变下列条件后,对正反应速率影响大于逆反应速率的是
A.减小生成物浓度 B.减小压强
C.升高温度 D.加入催化剂
5.已知反应在四种不同情况下的反应速率分别如下:
①v(A)=0.1 mol·L-1·min-1
②v(B)=0.15 mol·L-1·min-1
③
④v(D=0.1 mol·L-1·min-1
则该反应进行速率快慢顺序正确的是
A.①>②>③>④ B.②>①=④>③
C.③>①>②>④ D.④>③>①>②
6.以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
相关反应的热化学方程式为
反应I:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) △H1=-213kJ/mol
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+O2(g) △H2=+327 kJ/mol
反应Ⅲ:2HI(aq)=H2(g)+I2(g) △H3=+172kJ/mol
下列说法不正确的是
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学力程式为2H2O(l)=2H2(g)+O2(g) △H=+286kJ/mol
D.该过程使水分解制氢反应更加容易发生,但总反应的△H不变
7.反应2NO2(g)N2O4(g) △H=-57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.T1>T2 B.X、Y两点的反应速率:X>Y
C.X、Z两点气体的颜色:X深,Z浅 D.X、Z两点气体的平均相对分子质量:X>Z
8.已知可逆反应:AsO+2I-+2H+AsO+I2+H2O。据此设计出如图所示的实验装置,其中C1、C2均为铂电极,A烧杯中为KI溶液,B烧杯中为Na3AsO4溶液。以下关于该装置的说法错误的是
A.盐桥中的阳离子向B烧杯移动
B.电流的方向由C2极到C1极
C.电流表读数为0时,再向B烧杯中滴加浓NaOH溶液,C2作正极
D.电流表读数为0时,表明该可逆反应达到了平衡状态
9.对于反应N2(g)+3H2O(g)=2NH3(g)+O2(g),在不同时间段内所测反应速率如下,则表示该化学反应进行最快的是
A.υ(NH3)=1.5 mol L 1 min 1 B.υ(N2)=1.2 mol L 1 min 1
C.υ(H2O)=1.67 mol L 1 min 1 D.υ(O2)=1.5 mol L 1 min 1
10.少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的量,可以使用如下方法中的
①由铁粉换铁块②加NaNO3固体③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用100mL0.1mol·L-1盐酸
A.③⑤ B.①③ C.⑥⑦ D.⑦⑧
11.已知反应X(g)+3Y(g) 2Z(g) △H的能量变化如下图所示。下列说法正确的是
A.△H= E2- E1 B.更换高效催化剂,E3不变
C.恒压下充入一定量的氦气n(Z)减少 D.压缩容器,c(X)减小
12.常温下,A、B初始浓度为2 : 1的混合溶液中,同时发生两个反应:①2A+B 2M+N,②2A+B2M+Y,溶液中B、Y的浓度随时间变化情况如图所示。下列说法错误的是
A.溶液中c(M)=c(N)+c(Y)
B.0~ 10min内,A的平均反应速率为0.04mol/(L·min)
C.18min时,反应①与反应②中B的转化率之比为2∶3
D.反应①的活化能比反应②的活化能大
二、填空题
13.CO2是一种廉价的碳资源,其综合利用具有重要意义。在容积为1L的恒容密闭容器中,充入1.00molCO2(g)和3.00molH2(g),一定条件下发生反应得到CH3OH(g)和H2O(g),测得反应物X和CH3OH(g)的浓度随时间的变化如图所示。
(1)0~3min内,v(CH3OH)=_______(保留三位有效数字)mol·L-1·min-1。
(2)该反应的化学方程式为_______。
(3)X代表的物质为_______(填化学式),理由是_______。
(4)9min后,保持其他条件不变,向容器中再通入1.00molCO2(g)和3.00molH2(g),则该反应的速率将_______(填“增大”、“减小”或“不变”)。
(5)下列可以作为该反应已达到平衡的判据的是_______(填标号)。
A.气体的压强不变 B.v正(CO2)=v逆(H2O)
C.CH3OH(g)与H2O(g)的浓度相同 D.容器内气体的密度不变
14.在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)
(1)保持容器容积不变,向其中充入1 mol H2,反应速率_________。
(2)升高温度,反应速率________。
(3)扩大容器体积,反应速率______。
(4)保持容器内气体压强不变,向其中充入1 mol H2(g)和1 mol I2(g),反应速率________。
(5)保持容器体积不变,向其中充入1 mol N2,反应速率________。
(6)保持容器内气体压强不变,向其中充入1 mol N2,反应速率________。
15.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______mol·L-1·min-1(用含t1的代数式表示);
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________(用图中a、b、c、d表示),理由是___________
(3)在该温度下,反应的标准平衡常数Kθ=____。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g) Kθ=,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
16.地下水中的氮污染主要是由引起的,人们对的转化进行了长时间的研究,目前主要有物理方法、化学方法和生物方法,其中化学方法主要包含活泼金属还原法和催化反硝化法。催化反硝化法是一种经济可行的脱氮方法,其原理是在Pd/Cu双金属催化剂作用下,将硝酸盐还原成氮气:。
(1)下列说法错误的是_______(填序号)。
A.氮肥溶于水的过程中熵值增大
B.在酸性条件下,活泼金属与反应属于自发反应
C.Pd/Cu双金属催化剂是该反应是否能自发发生的决定因素
(2)已知:的,(a、b均为正值),该反应_______(填“能”“不能”或“无法判断是否能”)自发进行。
17.某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表示]化学平衡的影响,得到如图所示图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
分析图像,回答下列问题:
(1)在图像反应Ⅰ中,若p1>p2,则此正反应为_______(填“吸热”或“放热”)反应,也是一个气体分子数_______(填“减少”或“增大”)的反应。
(2)在图像反应Ⅱ中,T1_______T2(填“>”“<”或“=”),该正反应为_______(填“吸热”或“放热”)反应。
(3)在图像反应Ⅲ中,若T2>T1,则此正反应为_______(填“吸热”或“放热”)反应。
(4)在图像反应Ⅳ中,若T1>T2,则该反应_______(填“能”或“不能”)自发进行。
18.反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,回答下列问题:
(1)增加Fe的量,其反应速率_______(填“增大”、“不变”或“减小”,下同);
(2)将容器的体积缩小一半,其反应速率_______;
(3)保持体积不变,充入N2使体系压强增大,其反应速率_______;
(4)保持压强不变,充入N2使容器的体积增大,其反应速率_______;
(5)在一定温度下,将一定量反应物充入该密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_______(填序号)。
a.容器中Fe、H2O、Fe3O4、H2共存
b.H2O、H2的物质的量之比为1:1
c.容器中的压强不随时间变化
d.容器中混合气体的平均相对分子质量保持不变
e.断裂4molH-O键的同时断裂4molH-H键
三、工业流程题
19.铬是一种重要的金属材料,被广泛用于冶金、化工、耐火材料等行业。某铬铁矿的主要成分为Cr2O3、Fe2O3、FeO,还有少量 MgO、Al2O3和杂质SiO2等,利用其制备多种铬产品和其他金属产品的工艺流程如下:
已知:Al2O3+Na2CO32NaAlO2+CO2↑ SiO2+Na2CO3Na2SiO3+CO2↑
回答下列问题:
(1)步骤①发生的主要反应为2FeO+Cr2O3+2Na2CO3+4NaNO32Na2CrO4+Fe2O3+4NaNO2+2A↑,反应时应选用何种材质的容器?_______(填字母)。
A.塑料 B.刚玉 C.铁 D.石英
(2)步骤②的操作是_______,“滤渣 2”是Al(OH)3和_______。 写出过量物质A与“滤液1"中溶质生成Al(OH)3 的离子方程式:_______。
(3)“滤液2”中的Na2CrO4需要用H2SO4酸化,用离子方程式表示该反应:_______。
(4)制取高纯铬常用电解法和铝热法,铝热法的缺点是_______。步骤④是在隔绝空气条件下,除生成Cr2O3 外,还生成了Na2CO3和CO,若该反应中有3 molNa2Cr2O7 参加反应,则转移的电子为_______mol。
(5)“滤渣1”中铁元素含量较高,具有回收价值。为回收金属,需要将含Fe3+的有机相进行反萃取,当反萃取剂的浓度均为0.5 mol L-1 时,反萃取效果最好的物质是_______(填化学式)。
20.工业上以碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)为主要原料生产锰酸锂(LiMn2O4)的工艺流程如下:
(1)为了提高碳酸锰矿浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③___________等。
(2)“除铁”时,加入CaO的目的是___________。
(3)“合成MnO2”的化学方程式为___________。
(4)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。
①升温到515℃时,开始有CO2产生,比预计碳酸锂的分解温度(723℃)低得多。可能的原因是___________。
②写出该反应的化学方程式:___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.扩散现象,是熵增加的自发过程,A不符合题意;
B.冰的熔点为0℃,水常温是液体,冰在室温下融化成水,是熵增加的自发过程,B不符合题意;
C.电解饱和食盐水,是在外电场的作用下强制发生的氧化还原反应,不是自发过程,C符合题意;
D.铁在潮湿的空气中生锈是发生了自发的氧化还原反应,属于电化学腐蚀,是自发进行的化学过程,D不符合题意;
综上所述答案为C。
2.A
【详解】2-6 min内,HI的物质的量由0.18 mol变为0.50 mol,△n(HI)=0.50 mol-0.18 mol=0.32 mol,根据方程式可知H2、HI变化的物质的量的比是1:2,则在这段时间内H2的物质的量改变了△n(H2)=△n(HI)=0.16 mol,故以H2的物质的量浓度变化表示的反应速率v(H2)== 0.02 mol L-1 min-1,故合理选项是A。
3.A
【详解】A.加入合适的催化剂,能降低反应的活化能,加快反应速率,提高单位时间内甲醇的产量,故A正确;
B.该反应是放热反应,升高温度,平衡向逆反应方向移动,氢气的转化率减小,故B错误;
C.平衡常数是温度函数,温度不变,平衡常数不变,所以平衡后再通入适量氢气,平衡常数K不变,故C错误;
D.该反应是气体体积减小的反应,增大体系的压强,平衡向正反应方向移动,故D错误;
故选A。
4.B
【分析】由N2+3H22NH3 △H<0可知,该反应为气体体积减小、且放热的反应,升高温度平衡逆向移动,增大压强平衡正向移动,减小生成物浓度平衡正向移动,结合升高温度、增大压强、增大浓度、使用催化剂均加快反应速率,据此分析解题。
【详解】A.减小生成物浓度平衡正向移动,反应速率减小,瞬间正反应速率不变,逆反应速率减小,则对逆反应的反应速率影响更大,A不合题意;
B.该反应为气体体积减小的反应,减小压强正、逆反应速率均减小,但平衡逆向移动,则对正反应的反应速率影响更大,B符合题意;
C.该反应为放热反应,升高温度正、逆反应速率均增大,但平衡逆向移动,对逆反应的反应速率影响更大,C不合题意;
D.加入催化剂,同等程度地改变正、逆反应速率,平衡不移动,D不合题意;
故答案为:B。
5.C
【详解】在单位相同的条件下,将不同物质的反应速率除以其计量数,得到的数值越大说明该反应速率越大,①v(A)=0.1 mol·L-1·min-1,②v(B)=mol·L-1·min-1,③,④v(D=mol·L-1·min-1,反应速率:③>①>②>④,故选C。
6.C
【详解】A.由图可知利用太阳能使化学反应发生,则太阳能转化为化学能,A正确;
B.由图可知总反应为水分解生成氧气、氢气,则SO2和I2对总反应起到了催化剂的作用,B正确;
C.由盖斯定律可知,I+II+III得到H2O(l)═H2 (g)+O2(g) △H=(-213kJ mol-1)+(+327kJ mol-1)+(+172kJ mol-1)=+286 kJ mol-1,C错误;
D.催化剂降低反应的活化能,不影响焓变,则该过程降低了水分解制氢反应的活化能,但总反应的△H不变,D正确;
故答案为:C。
7.B
【详解】A.升高温度,化学平衡逆向移动,的体积分数增大,Y点的体积分数小,则,A错误;
B.由选项A分析可知,X点的温度大于Y点的温度,温度越高,化学反应速率越快,所以反应速率X>Y,B正确;
C.X、Z两点温度相同,但压强不同,为红棕色气体,增大压强,平衡右移,但是气体的体积变小,浓度增大的影响较大,气体的颜色加深,则X、Z两点气体的颜色:X浅,Z深,C错误;
D.X、Z两点都在等温线上,X的压强小,增大压强,化学平衡正向移动,Z点时气体的物质的量小,则平均相对分子质量变大,即平均相对分子质量:X
8.C
【详解】A.AsO得到电子,碘离子失去电子,所以C1极是负极,C2极是正极,因此盐桥中的阳离子向B烧杯移动,故A正确;
B.C1极是负极,C2极是正极,因此电流的方向由C2极到C1极,故B正确;
C.电流表读数为0时,再向B烧杯中滴加浓NaOH溶液,氢离子浓度减小,反应逆向进行,单质碘作氧化剂,所以C1极是正极,C2作负极,故C错误;
D.该反应为可逆反应,当反应达到平衡状态时,各物质的浓度不再改变,则没有电流通过电流计,所以电流计读数为零,故D正确;
故选C。
9.B
【详解】根据速率与计量系数之比分析,比值越大速率越快,、、、,则比值最大即υ(N2)=1.2 mol L 1 min 1表示该化学反应进行最快,故B符合题意。
综上所述,答案为B。
10.D
【详解】①由铁粉换铁块,反应速率减慢,故错误;②加NaNO3固体与酸形成硝酸,不产生氢气,故错误;③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液,发生钝化现象,故错误;④加CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减慢,故错误;⑤加NaCl溶液,氢离子浓度减小,反应速率减慢,故错误;⑥滴入几滴硫酸铜溶液,铁置换出铜,构成原电池,反应速率加快,但Fe少量,导致生成的氢气减少,故错误;⑦升高温度(不考虑盐酸挥发),反应速率加快,故正确;⑧改用100mL0.1mol·L-1盐酸,氢离子浓度增大,反应速率加快,故正确;故选D。
11.C
【详解】A.△H=生成物的总能量-反应物的总能量=E1-E2,故A错误;
B.更换高效催化剂,降低反应活化能,反应速率加快,该反应中(E3-E2)为活化能,E2为反应物的能量,E2不变,活化能降低,则E3减小,故B错误;
C.恒压下充入一定量的氦气,容器体积增大,反应体系的分压减小,平衡向气体增多的方向移动,则n(Z)减少,故C正确;
D.压缩容器体积,压强增大,平衡向右移动,n(X)减小,体积减小,各物质的浓度都增大,平衡移动只能减弱这种改变,而不能消除,故c(X)还是比原来大,故D错误;
故选C。
12.A
【详解】A.以10min为例,设容器体积为VL,10min时生成Y0.12Vmol,则根据反应2A+B2M+Y,消耗B0.12Vmol,生成M0.24Vmol,10min时共消耗B0.2Vmol,则反应2A+B2M+N消耗B0.08Vmol,则生成N0.08Vmol,生成M0.16Vmol,共生成M0.4Vmol,c(M)=0.4mol/L,c(N)=0.08mol/L,c(Y)=0.12mol/L,A错误;
B.10min内B的浓度变化为0.2mol/L,根据反应①和②可知,0-10minA的浓度变化为0.4mol/L,则A的平均反应速率为,B正确;
C.18min时Y的浓度为0.15mol/L,则反应②消耗B的浓度为0.15mol/L,反应②B的转化率为30%,共消耗B的浓度为0.25mol/L,则反应①消耗B浓度为0.1mol/L,反应①B的转化率为20%,反应①和反应②中B的转化率之比为2∶3,C正确;
D.以10min内反应为例,反应①中B的反应速率为,反应②中B的反应速率为,反应②速率更快,活化能更小,D正确;
故答案选A。
13. 0.167 CO2(g)+3H2(g) CH3OH(g)+H2O(g) CO2 CO2与CH3OH的反应速率相同或X的减小量与甲醇的增加量一样 增大 AB
【分析】CO2(g)和H2(g)的初始浓度分别为1.00mol/L、3.00mol/L,由图可知,X的初始浓度为1.00mol/L、则X为CO2(g)。
【详解】(1)0~3min内, 。
(2)已知 CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g),按元素质量守恒,该反应的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
(3) 反应速率之比等于化学计量数之比,则X代表的物质为CO2,理由是CO2与CH3OH的反应速率相同X的减小量与甲醇的增加量一样;
(4)9min后,保持其他条件不变,向容器中再通入1.00molCO2(g)和3.00molH2(g),则反应物浓度增加,则该反应的速率将增大。
(5)A.反应中,气体的物质的量、压强会随着反应而变化,故容器内压强不随时间的变化,说明气体的物质的量不随时间变化,则说明反应已达平衡,A正确;
B.反应速率之比等于化学计量数之比,v正(CO2) =v正(H2O)=v逆(H2O) ,则说明反应已达平衡,B正确;
C.由方程式可知,CH3OH(g)与H2O(g)的浓度相同始终相同,故不能说明已平衡,选项C不正确;
D.密闭容器中, ,气体质量守恒,容积体积的不变,故不能说明已平衡,选项D不正确;
答案为AB。
14. 增大 增大 减小 不变 不变 减小
【详解】(1)在容器容积不变时,充入1 mol H2即c(H2)增大,反应物浓度增大,化学反应速率增大;
(2)升高温度,活化分子百分数增加,有效碰撞次数增多,反应速率增大;
(3)扩大容器体积,相当于减小各成分浓度,反应速率减小,
(4)保持容器内气体压强不变,保持充入1 mol H2(g)和1 mol I2(g),压强未变,体积增大,浓度也不变,则速率不变;
(5)保持容器容积不变,充入1mol N2,N2不参与反应,参与反应的各成分浓度未变,则反应速率不变;
(6)保持容器压强不变,充入N2,体积增大,各成分浓度减小,则反应速率减小。
15.(1)
(2) b 容器容积迅速缩小至原来的一半时,N2分压变为原来的2倍;其他条件不变时,容器容积减小,压强增大,平衡向气体体积减小的方向移动,即该平衡逆向移动,所以N2分压先变为原来的2倍,后逐渐减小
(3)0.48
【解析】(1)
密闭容器中0.1mol NH3总压为200kPa,则如图t1时H2的分压为120kPa,则H2的物质的量n(H2)=,则用H2的浓度变化表示的反应速率v(H2)=;
(2)
t2时刻容器体积迅速缩小到原来的一半,则N2的分压迅速增大到原来的2倍,则cd错误;压强增大,化学平衡向气体总体积减小的方向移动,即化学平衡逆向移动,导致N2的分压应比原来2倍小,则b正确,a错误,故合理选项是b;
(3)
在该温度下,达到平衡时,p(N2)=40kPa=0.4pθ、p(H2)=120kPa=1.2pθ、p(NH3)=120kPa=1.2pθ,则Kθ=。
16. C 无法判断是否能
【详解】(1) A.溶于水时混乱度增大,其熵值增大,A项正确;
B.活泼金属易失去电子,酸性条件下具有强氧化性,二者反应属于自发反应,B项正确;
C.决定反应是否为自发反应的因素是反应物自身的性质,C项错误;
故答案为:C;
(2),由于无法判断a和bT值的相对大小,故无法确定是大于0还是小于0,所以无法判断该反应是否能自发进行,故答案为:无法判断是否能。
17. 放热 减少 < 放热 放热 不能自发进行
【详解】(1)在图像反应Ⅰ中,升高温度,A的转化率减小,平衡逆向移动,则此正反应为放热反应;若p1>p2,增大压强,A的转化率增大,平衡正向移动,反应是一个气体分子数减少的反应。
(2)在图像反应Ⅱ中,T2温度下反应先达到平衡,反应速率快,T1
(4)在图像反应Ⅳ中,增大压强,A的转化率不变,说明反应前后气体分子数相同,若T1>T2,升高温度,A的转化率增大,说明正反应吸热,根据 ,该反应不能自发进行。
18.(1)不变
(2)增大
(3)不变
(4)减小
(5)d
【分析】(1)
因铁是固体,增加铁的量,没有增加铁的浓度,所以不能改变反应速率;
(2)
容器的体积缩小,容器内各物质的浓度都增大,浓度越大,化学反应速率越快;
(3)
体积不变,充入N2使体系压强增大,但各物质的浓度不变,所以反应速率不变;
(4)
压强不变,充入N2使容器的体积增大,但各物质的浓度都减小,浓度越小,反应速率越小;
(5)
在一定温度下,将一定量反应物充入该密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是:
a.可逆反应不能进行到底,无论反应进行到何种程度,容器中Fe、H2O、Fe3O4、H2四种物质都会共存,因此不能说明该反应达到平衡状态,a错误;
b.H2O、H2的物质的量之比与投料有关,不能说明该反应达到平衡状态,b错误;
c.由于左右化学计量数之和相等,故容器中的压强不随时间变化,不能说明该反应达到平衡状态,c错误;
d.气体质量为变量,物质的量不变,容器中混合气体的平均相对分子质量保持不变,说明该反应达到平衡状态,d正确;
e.断裂4molH-O键的同时生成4molH-H键,说明该反应达到平衡状态,e错误;
故选d。
19.(1)C
(2) 水浸、过滤 H2SiO3 +CO2 +2H2O=Al(OH)3↓+
(3)2+2H+ =+H2O
(4) 能耗大或者产品纯度较低 18
(5)(NH4)2HPO4
【分析】铬铁矿的主要成分为Cr2O3、Fe2O3、FeO,还有少量 MgO、Al2O3和杂质SiO2等,加入Na2CO3、NaNO3进行熔融、氧化,发生反应2FeO+Cr2O3+2Na2CO3+4NaNO32Na2CrO4+Fe2O3+4NaNO2+2CO2↑、Al2O3+Na2CO32NaAlO2+CO2↑、SiO2+Na2CO3Na2SiO3+CO2↑,所得产物进行水浸、过滤,得到的滤渣1主要为Fe2O3、 MgO,滤液1中含Na2CrO4、NaNO2、NaAlO2、Na2SiO3、Na2CO3、NaNO3,滤渣1加硫酸进行酸溶、加过氧化氢进行氧化,所得溶液加有机萃取剂进行萃取分液,得到含有铁离子的有机相,经过一系列处理得到铁离子,向滤液1中通入过量的二氧化碳,二氧化碳和NaAlO2反应生成Al(OH)3沉淀、和Na2SiO3反应生成H2SiO3沉淀,因此滤渣2的主要成分为Al(OH)3和H2SiO3,经过一系列处理得到含铝产品,滤液2中Na2CrO4经过酸化得到Na2Cr2O7,Na2Cr2O7与焦炭在高温条件下反应得到Cr2O3,Cr2O3经处理得到Cr。
(1)
A.塑料不耐高温,A错误;
B.刚玉主要成分为氧化铝,氧化铝高温条件下能和碳酸钠反应生成偏铝酸钠和二氧化碳,B错误;
C.铁不与上述反应过程中的物质反应,C正确;
D.石英主要成分为二氧化硅,二氧化硅和碳酸钠高温条件下反应生成硅酸钠和二氧化碳,D错误;
答案选C。
(2)
熔块经处理得到滤渣和滤液,因此步骤②为水浸、过滤,由分析可知,滤渣2是Al(OH)3和H2SiO3,步骤①发生的主要反应为2FeO+Cr2O3+2Na2CO3+4NaNO32Na2CrO4+Fe2O3+4NaNO2+2A↑,依据原子守恒可知,A为CO2,过量的CO2与“滤液1"中的NaAlO2反应生成Al(OH)3沉淀,反应的离子方程式为:+CO2 +2H2O=Al(OH)3↓+。
(3)
“滤液2”中的Na2CrO4经H2SO4酸化得到Na2Cr2O7,离子方程式为:2+2H+ =+H2O。
(4)
铝热法制高纯铬,铝热反应的耗能大,得到产品的纯度低,Na2Cr2O7与焦炭在高温条件下除生成Cr2O3 外,还生成了Na2CO3和CO,铬元素化合价由+6价降低到+3价,若该反应中有3 molNa2Cr2O7 参加反应,则转移电子的物质的量为3mol=18mol。
(5)
由图像可知,当反萃取剂的浓度均为0.5 mol L-1 时,(NH4)2HPO4的反萃取效果最好。
20.(1)增大硫酸的浓度(或将碳酸锰矿研成粉末等)
(2)调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而除去
(3)MnSO4+K2S2O8+2H2O=MnO2↓+K2SO4+2H2SO4
(4) MnO2是催化剂,加快了碳酸锂分解 8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑
【分析】向碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)其中加入硫酸,发生MnCO3+H2SO4=MnSO4+CO2↑+H2O,且三种氧化物均溶解转化为硫酸盐,向其中加高锰酸钾可氧化亚铁离子,将亚铁离子氧化为铁离子,加CaO调节pH可使铁离子转化为氢氧化铁沉淀,过滤后,向滤液中MnF2是为了除去溶液中的Ca2+,过滤后发生MnSO4+K2S2O8+2H2O=MnO2↓+K2SO4+2H2SO4,最后发生8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑,据此分析解题。
(1)
为了提高碳酸锰矿浸出的速率,可以从浓度、温度、固体表面积等方面思考,因此在“酸浸”时可采取的措施还有:适当增大硫酸的浓度(或将碳酸锰矿研成粉末等);故答案为:增大硫酸的浓度(或将碳酸锰矿研成粉末等)。
(2)
“除铁”时,加入CaO的目的是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而除去;故答案为:调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而除去。
(3)
根据流程图分析可知滤液中MnSO4被K2S2O8氧化生成MnO2,MnSO4中S化合价升高变为MnO2,K2S2O8中部分 1价的O化合价降低变为 2价,再根据得失电子守恒和质量守恒配平,得到“合成MnO2”的化学方程式为:MnSO4+K2S2O8+2H2O=MnO2↓+K2SO4+2H2SO4;故答案为:MnSO4+K2S2O8+2H2O=MnO2↓+K2SO4+2H2SO4。
(4)
①可能的原因是MnO2是催化剂,降低反应所需活化能,加快了碳酸锂分解;故答案为:MnO2是催化剂,加快了碳酸锂分解。
②MnO2中Mn化合价降低,则反应中只有氧化合价升高,变为氧气,因此该反应的化学方程式为:8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑;故答案为:8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑。
答案第1页,共2页
答案第1页,共2页
