专题5药物合成的重要原料-卤代烃胺酰胺基础巩固2022-2023学年高中化学苏教版(2020)选择性必修3(word版含解析)
文档属性
| 名称 | 专题5药物合成的重要原料-卤代烃胺酰胺基础巩固2022-2023学年高中化学苏教版(2020)选择性必修3(word版含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 945.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-29 10:12:02 | ||
图片预览



文档简介
专题5药物合成的重要原料-卤代烃胺酰胺基础巩固
一、单选题(共13小题)
1.一种活性物质的结构简式为,下列有关该物质的叙述正确的是
A.能发生取代反应,不能发生加成反应
B.既是乙醇的同系物也是乙酸的同系物
C.与互为同分异构体
D.该物质与碳酸钠反应得
2.有关的说法不正确的是
A.含有两种官能团
B.该有机物所有碳原子不可能共平面
C.1mol该有机物在足量NaOH溶液中完全水解消耗5molNaOH
D.该有机物在酸性条件下水解产物之一可作去角质杀菌、消炎的药物
3.某化合物的结构(键线式)及球棍模型如下
该有机分子的核磁共振氢谱图如下图:
下列关于该有机物的叙述正确的是
A.该有机物不同化学环境的氢原子有6种
B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为
D.184g该有机物在一定条件下完全燃烧消耗氧气的物质的量至少为10mol
4.柠檬烯是一种食用香料,其结构简式如下图所示。下列有关柠檬烯的分析正确的是
A.它的一氯代物有9种
B.它和丁基苯()互为同分异构体
C.它的分子中所有的碳原子一定在同一平面上
D.一定条件下,它分别可以发生加成、取代、氧化、加聚等反应
5.一种药物合成中间体结构简式如图。关于该化合物,下列说法正确的是
A.属于芳香烃
B.分子中所有碳原子不可能共平面
C.苯环上的一氯代物有4种(不考虑立体异构)
D.分子中含有两种官能团
6.某烃的含氧衍生物M的分子结构模型如图所示,下列关于M的说法错误的是
A.与足量Na反应生成
B.在铜作催化剂、加热条件下与发生氧化反应生成
C.与乙醇发生酯化反应生成
D.与M互为同分异构体且含有相同官能团的有机物有1种(不考虑立体异构)
7.1-氯丙烷和2-氯丙烷分别与NaOH的乙醇溶液共热反应,下列叙述正确的是
A.主要产物相同 B.产物互为同分异构体
C.碳氢键断裂的位置相同 D.产生的官能团不同
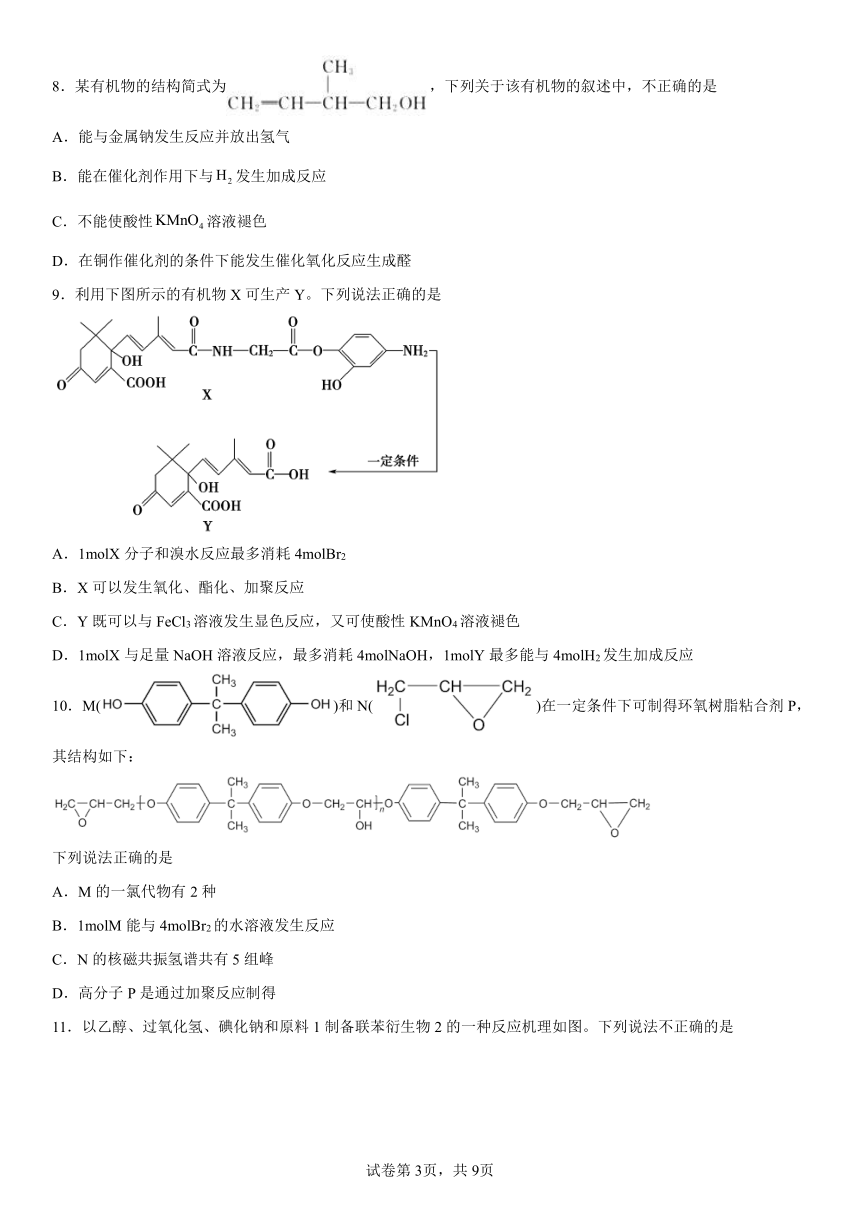
8.某有机物的结构简式为,下列关于该有机物的叙述中,不正确的是
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与发生加成反应
C.不能使酸性溶液褪色
D.在铜作催化剂的条件下能发生催化氧化反应生成醛
9.利用下图所示的有机物X可生产Y。下列说法正确的是
A.1molX分子和溴水反应最多消耗4molBr2
B.X可以发生氧化、酯化、加聚反应
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1molX与足量NaOH溶液反应,最多消耗4molNaOH,1molY最多能与4molH2发生加成反应
10.M()和N()在一定条件下可制得环氧树脂粘合剂P,其结构如下:
下列说法正确的是
A.M的一氯代物有2种
B.1molM能与4molBr2的水溶液发生反应
C.N的核磁共振氢谱共有5组峰
D.高分子P是通过加聚反应制得
11.以乙醇、过氧化氢、碘化钠和原料1制备联苯衍生物2的一种反应机理如图。下列说法不正确的是
A.反应过程的催化剂是 B.涉及的有机反应只有取代、消去、还原
C.化合物4和5互为同分异构体 D.反应过程中反应液可能保持不变
12.胺是指烃基取代氨分子中的氢原子而形成的化合物,下列关于胺的说法错误的是
A.甲胺是甲基取代氨分子中的一个氢原子形成的
B.胺类化合物含有的官能团均只有—NH2
C.苯胺与盐酸反应的化学方程式为+HCl→
D.三聚氰胺( )具有碱性
13.拟除虫菊酯类农药是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示:
下列关于该化合物的叙述不正确的是
A.该化合物的分子式为C22H19NO3Br2
B.该化合物属于烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
二、填空题(共4小题)
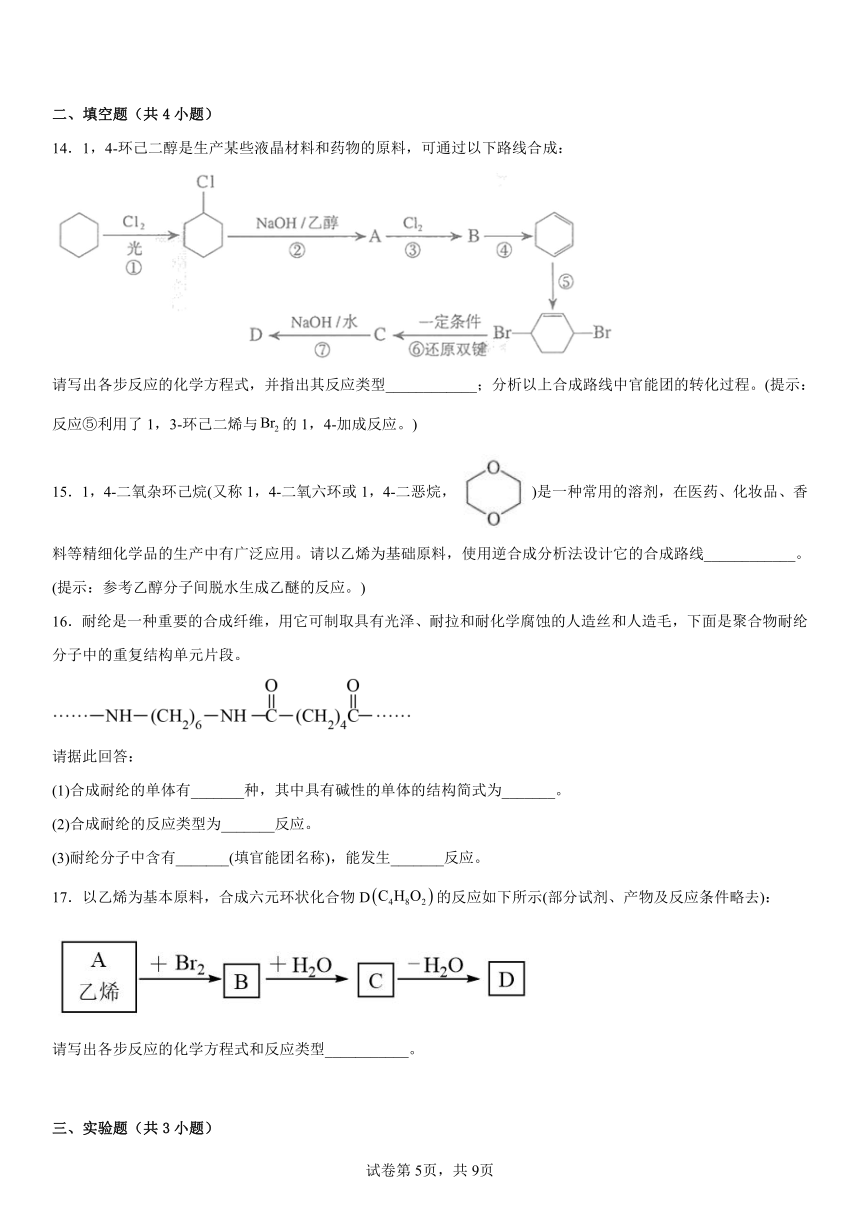
14.1,4-环己二醇是生产某些液晶材料和药物的原料,可通过以下路线合成:
请写出各步反应的化学方程式,并指出其反应类型____________;分析以上合成路线中官能团的转化过程。(提示:反应⑤利用了1,3-环己二烯与的1,4-加成反应。)
15.1,4-二氧杂环己烷(又称1,4-二氧六环或1,4-二恶烷,)是一种常用的溶剂,在医药、化妆品、香料等精细化学品的生产中有广泛应用。请以乙烯为基础原料,使用逆合成分析法设计它的合成路线____________。(提示:参考乙醇分子间脱水生成乙醚的反应。)
16.耐纶是一种重要的合成纤维,用它可制取具有光泽、耐拉和耐化学腐蚀的人造丝和人造毛,下面是聚合物耐纶分子中的重复结构单元片段。
请据此回答:
(1)合成耐纶的单体有_______种,其中具有碱性的单体的结构简式为_______。
(2)合成耐纶的反应类型为_______反应。
(3)耐纶分子中含有_______(填官能团名称),能发生_______反应。
17.以乙烯为基本原料,合成六元环状化合物D的反应如下所示(部分试剂、产物及反应条件略去):
请写出各步反应的化学方程式和反应类型___________。
三、实验题(共3小题)
18.已知1,2-二氯乙烷在常温下为无色液体,沸点为83.5℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂;乙醇的沸点为78℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置。请回答下列问题:
(1)为了检查整套装置的气密性,某同学将导管末端插入盛有水的烧杯中,用双手捂着装置A中大试管,但该方法并不能准确说明装置的气密性是否良好。则正确检查整套装置气密性的方法是___________。
(2)向装置A中大试管里先加入1,2-二氯乙烷和NaOH的乙醇溶液,再加入___________,目的是___________,并向装置C中试管里加入适量溴水。
(3)为了使反应在75℃左右进行,常用的方法是___________。
(4)与装置A中大试管相连接的长玻璃导管的作用是___________。
(5)能证明1,2-二氯乙烷已发生消去反应的实验现象是___________,装置A、C中发生反应的化学方程式分别为___________、___________。
19.阿司匹林是人类历史上第一种重要的人工合成药物,它与青霉素、安定并称为“医药史上三大经典药物”。下面是它的一种实验室合成方法:
制备阿司匹林的装置图如下图所示
已知:
①副反应
②水杨酸聚合物不能溶于溶液。
③pH=3-4时,可认为阿司匹林沉淀完全。
④合成阿司匹林相关物质的性质特点如下表
名称 性状 熔沸点/℃ 在水中的溶解能力
水杨酸 无色针状晶体 熔点158 微溶
乙酸酐 无色透明液体 沸点139 溶于水形成乙酸
阿司匹林 白色晶体 熔点136 微溶(溶解度比水杨酸更小)
水杨酸聚合物 白色晶体 —— 难溶
实验步骤:
①制备阿司匹林粗产品:向69g的水杨酸中加入稍过量的乙酸酐,再加入几滴浓硫酸,控制温度85—90℃,加热5—10分钟,冷却,加入一定量的冰水,抽滤,并用冰水洗涤沉淀2—3次,低温干燥,可得阿司匹林的粗产品。
②阿司匹林的提纯:向粗阿司匹林中缓慢加入饱和碳酸氢钠溶液,并不断搅拌至无气泡产生。抽滤,用蒸镏水洗涤沉淀,并将洗涤液与滤液合并。_______,便可析出晶体,抽滤,冰水洗涤,低温干燥。
回答下列问题:
(1)装置中仪器c的名称是_______,其作用是_______。
(2)步骤①乙酸酐稍过量的目的是_______,加热方式是_______;步骤①②加入冰水,并且用冰水洗涤,目的是为了_______。
(3)请补充阿司匹林提纯中的实验操作_______。
(4)最终得到72g纯品,则阿司匹林的产率是_______。
20.1,6-己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇硝酸为反应物制备1,6-己二酸。反应原理为:
+2HNO3+2NO2↑+2H2O
+6HNO3HOOC(CH2)4COOH+6NO2↑+3H2O
相关物质的物理性质见下表:
试剂 相对分子质量 密度/(g mL-1) 熔点/℃ 沸点/℃ 溶解性
环己醇 100 0.962 25.9 161.8 可溶于水、乙醇、乙醚
1,6-己二酸 146 1.360 152 330.5 微溶于冷水,易溶于乙醇
NH4VO3 117 2.326 210(分解) —— 微溶于冷水,易溶于热水
实验步骤如下:
I.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇。
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕。
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,_______,干燥,得到粗产品。
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为_______,其作用是_______
(2)B中发生反应的离子方程式为_______(其中一种产物为亚硝酸盐)
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为_______。滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应的 H_______0(填“>”或“<”)。
(4)将步骤Ⅲ补充完整:_______。步骤IV提纯方法的名称为_______。如图为1,6-已二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为ρg mL-1;该溶液的物质的量浓度为_______。
(5)最终得到1,6-己二酸产品4.810g,则1,6-己二酸的产率为_______。
A.46.07% B.57. 08% C.63.03% D.74. 61%
四、计算题(共2小题)
21.(1)0.2mol某烃在氧气中完全燃烧,生成17.6gCO2和7.2gH2O,该有机化合物的分子式为___,结构简式为___,官能团名称是___。
(2)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中烯烃分子式为___,烷烃分子式为___,烯烃与烷烃的体积比为___。
22.由一种气态烷烃和一种气态单烯烃组成的混合气体,它对氢气的相对密度是13.2,将1 L的混合气体和4 L氧气在容积固定的密闭容器中完全燃烧并保持原来的温度(120 ℃),测得密闭容器内压强比反应前增加了4%。
(1)写出混合气体中两种烃的分子式______。
(2)计算混合气体中两种烃的体积比______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【解析】A.该物质含有羟基、羧基、碳碳双键,能发生取代反应和加成反应,故A错误;
B.同系物是结构相似,分子式相差1个或n个CH2的有机物,该物质的分子式为C10H18O3,而且与乙醇、乙酸结构不相似,故B错误;
C.该物质的分子式为C10H18O3,的分子式为C10H18O3,所以二者的分子式相同,结构式不同,互为同分异构体,故C正确;
D.该物质只含有一个羧基,1mol该物质与碳酸钠反应,最多生成0.5mol二氧化碳,最大质量为22g,故D错误;
故选C。
2.B
【解析】A.该有机物中含有酯基、肽键两种官能团,A项正确;
B.该有机物中两个苯环上的碳原子可能在同一个平面上,羰基与其连接的碳原子处于同一个平面,单键可以旋转,则所有碳原子可能共面,B项错误;
C.该分子中含有2个酯基和1个肽键,且酯基水解生成酚羟基,水解时消耗,所以该有机物在足量溶液中完全水解消耗,C项正确;
D.该有机物在酸性条件下的水解产物水杨酸可作去角质、杀菌、消炎的药物,D项正确;
答案选B。
3.D
【解析】A.由谱图可知有8种不同环境的氢原子,A错误;
B.由键线式可看出,该物质中无苯环,不属于芳香化合物,B错误;
C.由键线式可看出,Et为—CH2CH3,C错误;
D.该有机物燃烧方程式为 ,故184g该有机物完全燃烧需要10mol氧气,D正确;
答案选D。
4.D
【解析】A.该物质结构不对称,共有8种位置的H原子,则它的一氯代物有8种,故A错误;
B.丁基苯的分子式为C10H14,柠檬烯的分子式为C10H16,二者分子式不同,不互为同分异构体,故B错误;
C.环状结构中含饱和碳原子,为四面体结构,分子中所有碳原子不可能在同一个平面内,故C错误;
D.含C=C,能发生加成、加聚、氧化,含H原子,能在一定条件下发生取代,则一定条件下,它可以分别发生加成、取代和氧化、加聚反应,故D正确;
故选D。
5.D
【解析】A.分子中含有氧元素,属于烃的衍生物,不属于烃,A项错误;
B.乙烯属于平面结构,单键可以旋转,两个苯环和侧链的平面均可以通过旋转单键处于同一平面,因此分子中所有碳原子可以共平面,B项错误;
C.该分子不存在对称结构,苯环上存在7种不同化学环境的氢,其苯环上的一氯代物有7种(不考虑立体异构),C项错误;
D.分子中含有碳碳双键、羟基两种官能团,D项正确。
故选D。
6.C
【解析】A.根据有机物成键特点可知M为(乳酸),羟基和羧基都可以与Na反应,故M与足量Na反应生成,A项正确;
B.M中的羟基可以发生催化氧化,生成,B项正确;
C.M可以与乙醇反应生成,C项错误;
D.与M互为同分异构体且含有相同官能团的有机物有1种,即,D项正确。
故选C。
7.A
【解析】卤代烃在NaOH乙醇溶液条件下发生消去反应,卤代烃能够发生消去的条件为:连卤原子的碳原子邻位碳原子上有氢原子, 1-氯丙烷发生消去反应的方程式为:CH3CH2CH2Cl+NaOHCH2CH=CH2↑+NaCl+H2O,2-氯丙烷发生消去反应的方程式为:CH3CHClCH3+NaOHCH2CH=CH2↑+NaCl+H2O,以此解答该题。
【解析】A.由分析可知,产生的官能团相同,均为碳碳双键,产物均为丙烯,故A正确;
B.由分析可知,产物相同,故B错误;
C.由分析可知,碳氢键断键位置不同,故C错误;
D.由分析可知,产生的官能团相同,均为碳碳双键,故D错误;
故先A。
8.C
【解析】A.该有机物分子中含有—OH官能团,其中—OH能和Na反应放出H2,A正确;
B.该有机物分子中含有,能在催化剂条件下与H2发生加成反应,B正确;
C.有机物分子中含有C=C,能使酸性KMnO4溶液褪色,C错误;
D.该有机物分子中含有—OH官能团,能在铜作催化剂条件下发生催化氧化反应生成醛,D正确;
故选C。
9.B
【解析】A.1molX中含有3mol碳碳双键,可以与3molBr2发生加成反应;此外酚羟基的邻、对位氢原子可与Br2发生取代反应,则1molX与溴水反应最多消耗5molBr2,A错误;
B.X中含有碳碳双键、醇羟基、酚羟基,均可被氧化,含有羟基和羧基,可以发生酯化反应,含有碳碳双键,可以发生加聚反应,B正确;
C.Y中不含酚羟基,不能与FeCl3溶液发生显色反应,C错误;
D.1molX含有1mol—COOH、1mol酰胺基、1mol酚羟基与羧基形成的酯基、1mol酚羟基,则1molX最多消耗5molNaOH,D错误;
答案选B。
10.B
【解析】A.M()苯环上有两种不同化学环境下的氢,两个甲基在对称位,也有一种化学环境的氢,则M的一氯代物有3种,选项A错误;
B.M的酚羟基上的邻位还有4个H能与溴发生取代反应,故1molM能与4molBr2的水溶液发生反应,选项B正确;
C.N()有3种不同化学环境的氢,故核磁共振氢谱共有3组峰,选项C错误;
D.高分子P是通过缩聚反应制得的,选项D错误;
答案选B。
11.B
【解析】A.由图可知,碘化钠开始加入,最终未被消耗,则在反应过程的催化剂是,A项正确;
B.该过程中化合物1转化为化合物3为取代反应,化合物3转化为化合物4为消去反应,化合物4、5互为同分异构体,化合物4、5之间的转化为异构化反应,化合物5转化为化合物2为取代反应,乙醇与HI发生取代反应生成C2H5I,B项错误;
C.化合物4和5的分子式相同,但结构不同,互为同分异构体,C项正确;
D.反应过程中,生成的氢氧化钠和碘化氢均会被消耗,则反应液可能保持不变,D项正确;
答案选B。
12.B
【解析】A.胺可看作烃分子中的烃基取代氨分子中的氢原子得到的化合物,故A正确; C、D正确。
B.胺类化合物中除含氨基外,还可能含有碳碳双键等官能团,故B错误;
C.胺类化合物具有碱性,能与盐酸反应,故C正确;
D.三聚氰胺存在氨基,具有碱性,故D正确;
故选:B。
13.B
【解析】A.根据结构简式,该化合物的分子式为C22H19NO3Br2,A叙述正确;
B.溴氰菊酯中除含有碳、氢元素外,还含有氮、氧、溴元素,不属于烃,B叙述错误;
C.该化合物中含有酯基,具有酯的性质,在碱性条件下水解而失去药效,C叙述正确;
D.该化合物中含有碳碳双键,能发生加成反应:D叙述正确;
答案为B。
14.①+Cl2+HCl,取代反应;
②+NaOH+NaCl+H2O,消去反应;
③+Cl2,加成反应;
④+2NaOH+2NaCl+2H2O,消去反应;
⑤+Br2,加成反应;
⑥+H2,加成反应;
⑦+2NaOH+2NaBr,取代反应
【解析】根据题中有机合成的路线可知,环己烷与氯气在光照的条件下发生取代生成一氯环己烷,一氯环己烷发生消去反应生成A为环己烯,环己烯与氯气发生加成反应生成B为1,2-二氯环己烷,1,2-二氯环己烷再发生消去反应生成1,3-环已二烯,1,3-环已二烯与溴发生1,4加成生成,与氢气发生加成反应生成1,4-二溴环己烷,1,4-二溴环己烷再在碱性溶液中发生水解生成1,4-环已二醇,所以流程中涉及的反应方程式和反应类型为:
①+Cl2+HCl,取代反应;
②+NaOH+NaCl+H2O,消去反应;
③+Cl2,加成反应;
④+2NaOH+2NaCl+2H2O,消去反应;
⑤+Br2,加成反应;
⑥+H2,加成反应;
⑦+2NaOH+2NaBr,取代反应。
15.CH2=CH2CH2BrCH2BrHOCH2CH2OH
【解析】以乙烯为原料制备1,4-二氧六环,可由乙二醇发生取代反应得到,乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成乙二醇,其合成路线为CH2=CH2CH2BrCH2BrHOCH2CH2OH。
16.(1) 2 H2N(CH2)6NH2
(2)缩聚
(3) 肽键(或酰胺键) 水解
【解析】(1)
耐纶分子中含有肽键,,属于酰胺键,从N—C键处断开补加氢原子和羟基得到2种单体,分别为H2N(CH2)6NH2和HOOC(CH2)4COOH,-NH2具有碱性,因此具有碱性的单体的结构简式为H2N(CH2)6NH2;
(2)
缩聚反应是指由一种或多种单体相互缩合生成高分子的反应,其主产物称为缩聚物,缩聚反应的单体为带有2个(或以上)反应官能团的化合物聚合时脱去小分子形成聚合物,因此该反应为缩聚反应;
(3)
由图像可知,耐纶含有肽键,肽键属于酰胺键,能发生水解反应。
17.A→B:CH2=CH2+Br2CH2BrCH2Br,加成反应;B→C:CH2BrCH2Br+2 H2O CH2OHCH2OH+2HBr,取代反应;C→D:2 CH2OHCH2OH +H2O,取代反应
【解析】乙烯与溴发生加成反应生成1,2-二溴乙烷,反应的化学方程式:CH2=CH2+Br2CH2BrCH2Br,再发生水解反应生成乙二醇,反应的化学方程式:CH2BrCH2Br+2 H2O CH2OHCH2OH+2HBr,最后2个乙二醇自身发生取代反应脱去1个水生成醚键,反应的化学方程式:2CH2OHCH2OH +H2O。
18. 将导气管末端插入盛有水的烧杯中,用酒精灯微热装置A中大试管,若导气管末端有气泡产生,且移开酒精灯一会儿后,导气管口出现一段稳定的水柱,则证明整套装置不漏气 碎瓷片 防止暴沸 水浴加热 冷凝、回流 装置C中溴水褪色 或 (或、)
【解析】该实验是探究1,2-二氯乙烷的消去反应,发生消去反应可能生成、或二者的混合物,它们均能与溴水反应并使溴水褪色。
【解析】(1)由于装置比较多,可选取酒精灯对装置A中大试管进行加热,并将导管末端插入水中,依据最终能否观察到一段稳定的水柱判断整套装置气密性是否良好,故答案为:将导气管末端插入盛有水的烧杯中,用酒精灯微热装置A中大试管,若导气管末端有气泡产生,且移开酒精灯一会儿后,导气管口出现一段稳定的水柱,则证明整套装置不漏气。
(2)为了防止暴沸,应向装置A的大试管中加入几片碎瓷片,故答案为:碎瓷片、防止暴沸。
(3)为了便于控制温度,提供稳定热源,100℃及以下温度常选水浴加热的方法,故答案为:水浴加热。
(4)长玻璃导管起到冷凝、回流的作用,目的是提高原料的利用率,减少1,二氯乙烷、乙醇等的挥发,故答案为:冷凝、回流。
(5)发生消去反应可能生成、或二者的混合物,它们均能与溴水反应并使溴水褪色,故答案为:装置C中溴水褪色、或、(或、)。
19.(1) 球形冷凝管 冷凝回流
(2) 提高水杨酸的转化率,增大阿司匹林的产率 水浴加热 降低阿司匹林的溶解度,减少阿司匹林的损耗
(3)向混合液中缓慢滴加盐酸溶液至pH=3—4
(4)80%
【解析】稍过量的乙酸酐和水杨酸在浓硫酸作用下,控温在100℃以下,发生酯化反应生成阿司匹林,阿司匹林溶解度较小,加入冰水,乙酸酐和水反应生成在水中溶解度很大的乙酸,抽滤得到含水杨酸、水杨酸聚合物杂质的阿司匹林粗产品,加入饱和碳酸氢钠溶液,碳酸氢钠和水杨酸反应,同时水杨酸聚合物不能溶于 NaHCO3 溶液,过滤除去水杨酸聚合物,滤液加盐酸调节溶液的pH=3-4时,阿司匹林沉淀完全,过滤得到阿司匹林。
(1)
根据仪器构造可知,装置中仪器c为球形冷凝管,其作用是冷凝回流易挥发的反应物乙酸酐,提高反应物的利用率。
(2)
合成阿司匹林有两种反应物乙酸酐和水杨酸,使用稍过量的乙酸酐,可以提高水杨酸的转化率,增大阿司匹林的产率;加热温度为85—90℃,则采取加热均匀且易控制温度的水浴加热方式;阿司匹林微溶于水,为了降低阿司匹林的溶解度,减少阿司匹林的损耗,步骤①②加入冰水,并且用冰水洗涤。
(3)
根据给出的信息③可知,在pH=3-4时,可认为阿司匹林沉淀完全。将洗涤液与滤液合并后向混合液中缓慢滴加盐酸溶液至pH=3-4,便可析出阿司匹林晶体,抽滤,冰水洗涤,低温干燥。
(4)
69g水杨酸的物质的量为0.5mol,根据反应方程式可知,理论上生成的阿司匹林的物质的量也是0.5mol,则生成的阿司匹林的质量为0.5mol×180g/mol=90g,则阿司匹林的产率是=80%。
20. 球形冷凝管 冷凝回流,减少反应物损失,导出气体 2NO2+2OH =++ H2O 浓硝酸在加热时分解生成NO2 < 用冷水洗涤晶体2~3次 重结晶 2.89ρmol L-1 B
【解析】向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),为了让完全反应,向恒压滴液漏斗中加入6mL环己醇。将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,发生反应:+2HNO3+2NO2↑+2H2O,开始慢慢加入余下的环己醇,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕,将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,发生反应+6HNO3HOOC(CH2)4COOH+6NO2↑+3H2O,实验中的尾气为二氧化氮,用氢氧化钠溶液来吸收,用倒扣的漏斗防止倒吸,由此分析。
【解析】(1)根据仪器A的形状可知,仪器A的名称为球形冷凝管,其作用是冷凝回流,减少反应物损失,导出气体;
(2)B中发生反应为二氧化氮和氢氧化钠的反应,生成硝酸钠、亚硝酸钠和水,离子方程式为2NO2+2OH =++ H2O;
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为浓硝酸具有不稳定性,在加热时分解生成NO2、水和氧气;
滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应放热, H<0;
(4)由于1,6-已二酸微溶于冷水,用冷水洗涤晶体2~3次,减少洗涤时的损耗;
将1,6-己二酸粗产品进行提纯提纯,由于1,6-己二酸在冰水中的溶解度小于常温下的水,为了减小损失,步骤IV提纯方法的名称为重结晶;
根据图中1,6-已二酸在水中的溶解度曲线,80℃时1,6-己二酸的溶解度为0.73g,根据质量分数为=42.2%,溶液的密度为ρg mL-1;该溶液的物质的量浓度为=2.89ρmol L-1;
(5)由表中数据可知,6mL环己醇的密度为0.962g mL-1,摩尔质量为100,得到质量为6mL×0.962g mL-1≈5.772g,根据+2HNO3+2NO2↑+2H2O,+6HNO3HOOC(CH2)4COOH+6NO2↑+3H2O,得到~~HOOC(CH2)4COOH,设HOOC(CH2)4COOH的质量的x,,计算得到HOOC(CH2)4COOH的理论质量为8.427g,最终得到1,6-己二酸产品4.810g,则1,6-己二酸的产率为≈57. 08%。
【点睛】80℃时1,6-己二酸的溶解度为0.73g,计算质量分数时=42.2%,为易错点,要仔细观察题中有效信息。
21. C2H4 CH2=CH2 碳碳双键 C3H6 CH4 2:3
【解析】(1)0.2mol某烃在氧气中完全燃烧,生成17.6gCO2和7.2gH2O,二者的物质的量分别是17.6g÷44g/mol=0.4mol、7.2g÷18g/mol=0.4mol,所以含有碳原子的个数是0.4mol÷0.2mol=2,含有氢原子个数是0.8mol÷0.2mol=4,则该有机化合物的分子式为C2H4,是乙烯,结构简式为CH2=CH2,官能团名称是碳碳双键;
(2)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍,混合气体的平均相对分子质量是13.2×2=26.4,由于相对分子质量小于26.4的烃只有甲烷,因此含有的烷烃是甲烷,分子式为CH4;在标准状况下将4.48L即0.2mol混合气体通过足量的溴水,结果溴水增重3.36g,这说明烯烃的质量是3.36g,甲烷的质量是0.2mol×26.4g/mol-3.36g=1.92g,物质的量是1.92g÷16g/mol=0.12mol,所以烯烃的物质的量是0.2mol-0.12mol=0.08mol,相对分子质量是3.36÷0.08=42,烯烃的通式是CnH2n,则14n=42,解得n=3,所以原混合气体中烯烃分子式为C3H6,烯烃与烷烃的体积比为0.08:0.12=2:3。
22. CH4、C3H6 3∶2
【解析】混合气体平均摩尔质量为13.2×M(H2)=13.2×2g/mol=26.4g/mol,则两种气态物质相对分子质量一个大于26.4,一个小于26.4,所以一定有甲烷;对于甲烷而言,燃烧后(高于水的沸点)气体体积不变,充分燃烧说明产物只有二氧化碳和水;同温同压下,气体的体积比和物质的量成正比,反应前充入气体为5 mol,反应后增加4%,变为5.2mol,气体物质的量增加0.2mol,设烯烃中碳原子数为n、在1mol 混合气(混合气体1体积)中物质的量为xmol,甲烷为(1-x)mol;根据,可知物质的量变化(2 n-1-1.5n)=0.5n-1,列方程求出x=0.2÷(0.5n-1),所以n(甲烷)=(1-x)=(5n-12)÷(5n-10),又1mol混合气质量为26.4g,所以16×[(5n-12)÷(5n-10)]+14n×0.2÷(0.5n-1)=26.4,计算得出n=3,烯烃为丙烯,丙烯物质的量x=0.2÷(0.5n-1)=0.4,所以百分含量0.4÷1×100%=40%,甲烷60%,甲烷和丙烯的体积之比是3:2;综上分析可知:
(1)混合气体中两种烃的分子式分别为:CH4、C3H6;
(2)混合气体中甲烷和丙烯的体积比3∶2。
答案第1页,共2页
答案第1页,共2页
一、单选题(共13小题)
1.一种活性物质的结构简式为,下列有关该物质的叙述正确的是
A.能发生取代反应,不能发生加成反应
B.既是乙醇的同系物也是乙酸的同系物
C.与互为同分异构体
D.该物质与碳酸钠反应得
2.有关的说法不正确的是
A.含有两种官能团
B.该有机物所有碳原子不可能共平面
C.1mol该有机物在足量NaOH溶液中完全水解消耗5molNaOH
D.该有机物在酸性条件下水解产物之一可作去角质杀菌、消炎的药物
3.某化合物的结构(键线式)及球棍模型如下
该有机分子的核磁共振氢谱图如下图:
下列关于该有机物的叙述正确的是
A.该有机物不同化学环境的氢原子有6种
B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为
D.184g该有机物在一定条件下完全燃烧消耗氧气的物质的量至少为10mol
4.柠檬烯是一种食用香料,其结构简式如下图所示。下列有关柠檬烯的分析正确的是
A.它的一氯代物有9种
B.它和丁基苯()互为同分异构体
C.它的分子中所有的碳原子一定在同一平面上
D.一定条件下,它分别可以发生加成、取代、氧化、加聚等反应
5.一种药物合成中间体结构简式如图。关于该化合物,下列说法正确的是
A.属于芳香烃
B.分子中所有碳原子不可能共平面
C.苯环上的一氯代物有4种(不考虑立体异构)
D.分子中含有两种官能团
6.某烃的含氧衍生物M的分子结构模型如图所示,下列关于M的说法错误的是
A.与足量Na反应生成
B.在铜作催化剂、加热条件下与发生氧化反应生成
C.与乙醇发生酯化反应生成
D.与M互为同分异构体且含有相同官能团的有机物有1种(不考虑立体异构)
7.1-氯丙烷和2-氯丙烷分别与NaOH的乙醇溶液共热反应,下列叙述正确的是
A.主要产物相同 B.产物互为同分异构体
C.碳氢键断裂的位置相同 D.产生的官能团不同
8.某有机物的结构简式为,下列关于该有机物的叙述中,不正确的是
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与发生加成反应
C.不能使酸性溶液褪色
D.在铜作催化剂的条件下能发生催化氧化反应生成醛
9.利用下图所示的有机物X可生产Y。下列说法正确的是
A.1molX分子和溴水反应最多消耗4molBr2
B.X可以发生氧化、酯化、加聚反应
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1molX与足量NaOH溶液反应,最多消耗4molNaOH,1molY最多能与4molH2发生加成反应
10.M()和N()在一定条件下可制得环氧树脂粘合剂P,其结构如下:
下列说法正确的是
A.M的一氯代物有2种
B.1molM能与4molBr2的水溶液发生反应
C.N的核磁共振氢谱共有5组峰
D.高分子P是通过加聚反应制得
11.以乙醇、过氧化氢、碘化钠和原料1制备联苯衍生物2的一种反应机理如图。下列说法不正确的是
A.反应过程的催化剂是 B.涉及的有机反应只有取代、消去、还原
C.化合物4和5互为同分异构体 D.反应过程中反应液可能保持不变
12.胺是指烃基取代氨分子中的氢原子而形成的化合物,下列关于胺的说法错误的是
A.甲胺是甲基取代氨分子中的一个氢原子形成的
B.胺类化合物含有的官能团均只有—NH2
C.苯胺与盐酸反应的化学方程式为+HCl→
D.三聚氰胺( )具有碱性
13.拟除虫菊酯类农药是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图所示:
下列关于该化合物的叙述不正确的是
A.该化合物的分子式为C22H19NO3Br2
B.该化合物属于烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
二、填空题(共4小题)
14.1,4-环己二醇是生产某些液晶材料和药物的原料,可通过以下路线合成:
请写出各步反应的化学方程式,并指出其反应类型____________;分析以上合成路线中官能团的转化过程。(提示:反应⑤利用了1,3-环己二烯与的1,4-加成反应。)
15.1,4-二氧杂环己烷(又称1,4-二氧六环或1,4-二恶烷,)是一种常用的溶剂,在医药、化妆品、香料等精细化学品的生产中有广泛应用。请以乙烯为基础原料,使用逆合成分析法设计它的合成路线____________。(提示:参考乙醇分子间脱水生成乙醚的反应。)
16.耐纶是一种重要的合成纤维,用它可制取具有光泽、耐拉和耐化学腐蚀的人造丝和人造毛,下面是聚合物耐纶分子中的重复结构单元片段。
请据此回答:
(1)合成耐纶的单体有_______种,其中具有碱性的单体的结构简式为_______。
(2)合成耐纶的反应类型为_______反应。
(3)耐纶分子中含有_______(填官能团名称),能发生_______反应。
17.以乙烯为基本原料,合成六元环状化合物D的反应如下所示(部分试剂、产物及反应条件略去):
请写出各步反应的化学方程式和反应类型___________。
三、实验题(共3小题)
18.已知1,2-二氯乙烷在常温下为无色液体,沸点为83.5℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂;乙醇的沸点为78℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置。请回答下列问题:
(1)为了检查整套装置的气密性,某同学将导管末端插入盛有水的烧杯中,用双手捂着装置A中大试管,但该方法并不能准确说明装置的气密性是否良好。则正确检查整套装置气密性的方法是___________。
(2)向装置A中大试管里先加入1,2-二氯乙烷和NaOH的乙醇溶液,再加入___________,目的是___________,并向装置C中试管里加入适量溴水。
(3)为了使反应在75℃左右进行,常用的方法是___________。
(4)与装置A中大试管相连接的长玻璃导管的作用是___________。
(5)能证明1,2-二氯乙烷已发生消去反应的实验现象是___________,装置A、C中发生反应的化学方程式分别为___________、___________。
19.阿司匹林是人类历史上第一种重要的人工合成药物,它与青霉素、安定并称为“医药史上三大经典药物”。下面是它的一种实验室合成方法:
制备阿司匹林的装置图如下图所示
已知:
①副反应
②水杨酸聚合物不能溶于溶液。
③pH=3-4时,可认为阿司匹林沉淀完全。
④合成阿司匹林相关物质的性质特点如下表
名称 性状 熔沸点/℃ 在水中的溶解能力
水杨酸 无色针状晶体 熔点158 微溶
乙酸酐 无色透明液体 沸点139 溶于水形成乙酸
阿司匹林 白色晶体 熔点136 微溶(溶解度比水杨酸更小)
水杨酸聚合物 白色晶体 —— 难溶
实验步骤:
①制备阿司匹林粗产品:向69g的水杨酸中加入稍过量的乙酸酐,再加入几滴浓硫酸,控制温度85—90℃,加热5—10分钟,冷却,加入一定量的冰水,抽滤,并用冰水洗涤沉淀2—3次,低温干燥,可得阿司匹林的粗产品。
②阿司匹林的提纯:向粗阿司匹林中缓慢加入饱和碳酸氢钠溶液,并不断搅拌至无气泡产生。抽滤,用蒸镏水洗涤沉淀,并将洗涤液与滤液合并。_______,便可析出晶体,抽滤,冰水洗涤,低温干燥。
回答下列问题:
(1)装置中仪器c的名称是_______,其作用是_______。
(2)步骤①乙酸酐稍过量的目的是_______,加热方式是_______;步骤①②加入冰水,并且用冰水洗涤,目的是为了_______。
(3)请补充阿司匹林提纯中的实验操作_______。
(4)最终得到72g纯品,则阿司匹林的产率是_______。
20.1,6-己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇硝酸为反应物制备1,6-己二酸。反应原理为:
+2HNO3+2NO2↑+2H2O
+6HNO3HOOC(CH2)4COOH+6NO2↑+3H2O
相关物质的物理性质见下表:
试剂 相对分子质量 密度/(g mL-1) 熔点/℃ 沸点/℃ 溶解性
环己醇 100 0.962 25.9 161.8 可溶于水、乙醇、乙醚
1,6-己二酸 146 1.360 152 330.5 微溶于冷水,易溶于乙醇
NH4VO3 117 2.326 210(分解) —— 微溶于冷水,易溶于热水
实验步骤如下:
I.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇。
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕。
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,_______,干燥,得到粗产品。
Ⅳ.1,6-己二酸粗产品的提纯
(1)仪器A的名称为_______,其作用是_______
(2)B中发生反应的离子方程式为_______(其中一种产物为亚硝酸盐)
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为_______。滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应的 H_______0(填“>”或“<”)。
(4)将步骤Ⅲ补充完整:_______。步骤IV提纯方法的名称为_______。如图为1,6-已二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为ρg mL-1;该溶液的物质的量浓度为_______。
(5)最终得到1,6-己二酸产品4.810g,则1,6-己二酸的产率为_______。
A.46.07% B.57. 08% C.63.03% D.74. 61%
四、计算题(共2小题)
21.(1)0.2mol某烃在氧气中完全燃烧,生成17.6gCO2和7.2gH2O,该有机化合物的分子式为___,结构简式为___,官能团名称是___。
(2)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中烯烃分子式为___,烷烃分子式为___,烯烃与烷烃的体积比为___。
22.由一种气态烷烃和一种气态单烯烃组成的混合气体,它对氢气的相对密度是13.2,将1 L的混合气体和4 L氧气在容积固定的密闭容器中完全燃烧并保持原来的温度(120 ℃),测得密闭容器内压强比反应前增加了4%。
(1)写出混合气体中两种烃的分子式______。
(2)计算混合气体中两种烃的体积比______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【解析】A.该物质含有羟基、羧基、碳碳双键,能发生取代反应和加成反应,故A错误;
B.同系物是结构相似,分子式相差1个或n个CH2的有机物,该物质的分子式为C10H18O3,而且与乙醇、乙酸结构不相似,故B错误;
C.该物质的分子式为C10H18O3,的分子式为C10H18O3,所以二者的分子式相同,结构式不同,互为同分异构体,故C正确;
D.该物质只含有一个羧基,1mol该物质与碳酸钠反应,最多生成0.5mol二氧化碳,最大质量为22g,故D错误;
故选C。
2.B
【解析】A.该有机物中含有酯基、肽键两种官能团,A项正确;
B.该有机物中两个苯环上的碳原子可能在同一个平面上,羰基与其连接的碳原子处于同一个平面,单键可以旋转,则所有碳原子可能共面,B项错误;
C.该分子中含有2个酯基和1个肽键,且酯基水解生成酚羟基,水解时消耗,所以该有机物在足量溶液中完全水解消耗,C项正确;
D.该有机物在酸性条件下的水解产物水杨酸可作去角质、杀菌、消炎的药物,D项正确;
答案选B。
3.D
【解析】A.由谱图可知有8种不同环境的氢原子,A错误;
B.由键线式可看出,该物质中无苯环,不属于芳香化合物,B错误;
C.由键线式可看出,Et为—CH2CH3,C错误;
D.该有机物燃烧方程式为 ,故184g该有机物完全燃烧需要10mol氧气,D正确;
答案选D。
4.D
【解析】A.该物质结构不对称,共有8种位置的H原子,则它的一氯代物有8种,故A错误;
B.丁基苯的分子式为C10H14,柠檬烯的分子式为C10H16,二者分子式不同,不互为同分异构体,故B错误;
C.环状结构中含饱和碳原子,为四面体结构,分子中所有碳原子不可能在同一个平面内,故C错误;
D.含C=C,能发生加成、加聚、氧化,含H原子,能在一定条件下发生取代,则一定条件下,它可以分别发生加成、取代和氧化、加聚反应,故D正确;
故选D。
5.D
【解析】A.分子中含有氧元素,属于烃的衍生物,不属于烃,A项错误;
B.乙烯属于平面结构,单键可以旋转,两个苯环和侧链的平面均可以通过旋转单键处于同一平面,因此分子中所有碳原子可以共平面,B项错误;
C.该分子不存在对称结构,苯环上存在7种不同化学环境的氢,其苯环上的一氯代物有7种(不考虑立体异构),C项错误;
D.分子中含有碳碳双键、羟基两种官能团,D项正确。
故选D。
6.C
【解析】A.根据有机物成键特点可知M为(乳酸),羟基和羧基都可以与Na反应,故M与足量Na反应生成,A项正确;
B.M中的羟基可以发生催化氧化,生成,B项正确;
C.M可以与乙醇反应生成,C项错误;
D.与M互为同分异构体且含有相同官能团的有机物有1种,即,D项正确。
故选C。
7.A
【解析】卤代烃在NaOH乙醇溶液条件下发生消去反应,卤代烃能够发生消去的条件为:连卤原子的碳原子邻位碳原子上有氢原子, 1-氯丙烷发生消去反应的方程式为:CH3CH2CH2Cl+NaOHCH2CH=CH2↑+NaCl+H2O,2-氯丙烷发生消去反应的方程式为:CH3CHClCH3+NaOHCH2CH=CH2↑+NaCl+H2O,以此解答该题。
【解析】A.由分析可知,产生的官能团相同,均为碳碳双键,产物均为丙烯,故A正确;
B.由分析可知,产物相同,故B错误;
C.由分析可知,碳氢键断键位置不同,故C错误;
D.由分析可知,产生的官能团相同,均为碳碳双键,故D错误;
故先A。
8.C
【解析】A.该有机物分子中含有—OH官能团,其中—OH能和Na反应放出H2,A正确;
B.该有机物分子中含有,能在催化剂条件下与H2发生加成反应,B正确;
C.有机物分子中含有C=C,能使酸性KMnO4溶液褪色,C错误;
D.该有机物分子中含有—OH官能团,能在铜作催化剂条件下发生催化氧化反应生成醛,D正确;
故选C。
9.B
【解析】A.1molX中含有3mol碳碳双键,可以与3molBr2发生加成反应;此外酚羟基的邻、对位氢原子可与Br2发生取代反应,则1molX与溴水反应最多消耗5molBr2,A错误;
B.X中含有碳碳双键、醇羟基、酚羟基,均可被氧化,含有羟基和羧基,可以发生酯化反应,含有碳碳双键,可以发生加聚反应,B正确;
C.Y中不含酚羟基,不能与FeCl3溶液发生显色反应,C错误;
D.1molX含有1mol—COOH、1mol酰胺基、1mol酚羟基与羧基形成的酯基、1mol酚羟基,则1molX最多消耗5molNaOH,D错误;
答案选B。
10.B
【解析】A.M()苯环上有两种不同化学环境下的氢,两个甲基在对称位,也有一种化学环境的氢,则M的一氯代物有3种,选项A错误;
B.M的酚羟基上的邻位还有4个H能与溴发生取代反应,故1molM能与4molBr2的水溶液发生反应,选项B正确;
C.N()有3种不同化学环境的氢,故核磁共振氢谱共有3组峰,选项C错误;
D.高分子P是通过缩聚反应制得的,选项D错误;
答案选B。
11.B
【解析】A.由图可知,碘化钠开始加入,最终未被消耗,则在反应过程的催化剂是,A项正确;
B.该过程中化合物1转化为化合物3为取代反应,化合物3转化为化合物4为消去反应,化合物4、5互为同分异构体,化合物4、5之间的转化为异构化反应,化合物5转化为化合物2为取代反应,乙醇与HI发生取代反应生成C2H5I,B项错误;
C.化合物4和5的分子式相同,但结构不同,互为同分异构体,C项正确;
D.反应过程中,生成的氢氧化钠和碘化氢均会被消耗,则反应液可能保持不变,D项正确;
答案选B。
12.B
【解析】A.胺可看作烃分子中的烃基取代氨分子中的氢原子得到的化合物,故A正确; C、D正确。
B.胺类化合物中除含氨基外,还可能含有碳碳双键等官能团,故B错误;
C.胺类化合物具有碱性,能与盐酸反应,故C正确;
D.三聚氰胺存在氨基,具有碱性,故D正确;
故选:B。
13.B
【解析】A.根据结构简式,该化合物的分子式为C22H19NO3Br2,A叙述正确;
B.溴氰菊酯中除含有碳、氢元素外,还含有氮、氧、溴元素,不属于烃,B叙述错误;
C.该化合物中含有酯基,具有酯的性质,在碱性条件下水解而失去药效,C叙述正确;
D.该化合物中含有碳碳双键,能发生加成反应:D叙述正确;
答案为B。
14.①+Cl2+HCl,取代反应;
②+NaOH+NaCl+H2O,消去反应;
③+Cl2,加成反应;
④+2NaOH+2NaCl+2H2O,消去反应;
⑤+Br2,加成反应;
⑥+H2,加成反应;
⑦+2NaOH+2NaBr,取代反应
【解析】根据题中有机合成的路线可知,环己烷与氯气在光照的条件下发生取代生成一氯环己烷,一氯环己烷发生消去反应生成A为环己烯,环己烯与氯气发生加成反应生成B为1,2-二氯环己烷,1,2-二氯环己烷再发生消去反应生成1,3-环已二烯,1,3-环已二烯与溴发生1,4加成生成,与氢气发生加成反应生成1,4-二溴环己烷,1,4-二溴环己烷再在碱性溶液中发生水解生成1,4-环已二醇,所以流程中涉及的反应方程式和反应类型为:
①+Cl2+HCl,取代反应;
②+NaOH+NaCl+H2O,消去反应;
③+Cl2,加成反应;
④+2NaOH+2NaCl+2H2O,消去反应;
⑤+Br2,加成反应;
⑥+H2,加成反应;
⑦+2NaOH+2NaBr,取代反应。
15.CH2=CH2CH2BrCH2BrHOCH2CH2OH
【解析】以乙烯为原料制备1,4-二氧六环,可由乙二醇发生取代反应得到,乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成乙二醇,其合成路线为CH2=CH2CH2BrCH2BrHOCH2CH2OH。
16.(1) 2 H2N(CH2)6NH2
(2)缩聚
(3) 肽键(或酰胺键) 水解
【解析】(1)
耐纶分子中含有肽键,,属于酰胺键,从N—C键处断开补加氢原子和羟基得到2种单体,分别为H2N(CH2)6NH2和HOOC(CH2)4COOH,-NH2具有碱性,因此具有碱性的单体的结构简式为H2N(CH2)6NH2;
(2)
缩聚反应是指由一种或多种单体相互缩合生成高分子的反应,其主产物称为缩聚物,缩聚反应的单体为带有2个(或以上)反应官能团的化合物聚合时脱去小分子形成聚合物,因此该反应为缩聚反应;
(3)
由图像可知,耐纶含有肽键,肽键属于酰胺键,能发生水解反应。
17.A→B:CH2=CH2+Br2CH2BrCH2Br,加成反应;B→C:CH2BrCH2Br+2 H2O CH2OHCH2OH+2HBr,取代反应;C→D:2 CH2OHCH2OH +H2O,取代反应
【解析】乙烯与溴发生加成反应生成1,2-二溴乙烷,反应的化学方程式:CH2=CH2+Br2CH2BrCH2Br,再发生水解反应生成乙二醇,反应的化学方程式:CH2BrCH2Br+2 H2O CH2OHCH2OH+2HBr,最后2个乙二醇自身发生取代反应脱去1个水生成醚键,反应的化学方程式:2CH2OHCH2OH +H2O。
18. 将导气管末端插入盛有水的烧杯中,用酒精灯微热装置A中大试管,若导气管末端有气泡产生,且移开酒精灯一会儿后,导气管口出现一段稳定的水柱,则证明整套装置不漏气 碎瓷片 防止暴沸 水浴加热 冷凝、回流 装置C中溴水褪色 或 (或、)
【解析】该实验是探究1,2-二氯乙烷的消去反应,发生消去反应可能生成、或二者的混合物,它们均能与溴水反应并使溴水褪色。
【解析】(1)由于装置比较多,可选取酒精灯对装置A中大试管进行加热,并将导管末端插入水中,依据最终能否观察到一段稳定的水柱判断整套装置气密性是否良好,故答案为:将导气管末端插入盛有水的烧杯中,用酒精灯微热装置A中大试管,若导气管末端有气泡产生,且移开酒精灯一会儿后,导气管口出现一段稳定的水柱,则证明整套装置不漏气。
(2)为了防止暴沸,应向装置A的大试管中加入几片碎瓷片,故答案为:碎瓷片、防止暴沸。
(3)为了便于控制温度,提供稳定热源,100℃及以下温度常选水浴加热的方法,故答案为:水浴加热。
(4)长玻璃导管起到冷凝、回流的作用,目的是提高原料的利用率,减少1,二氯乙烷、乙醇等的挥发,故答案为:冷凝、回流。
(5)发生消去反应可能生成、或二者的混合物,它们均能与溴水反应并使溴水褪色,故答案为:装置C中溴水褪色、或、(或、)。
19.(1) 球形冷凝管 冷凝回流
(2) 提高水杨酸的转化率,增大阿司匹林的产率 水浴加热 降低阿司匹林的溶解度,减少阿司匹林的损耗
(3)向混合液中缓慢滴加盐酸溶液至pH=3—4
(4)80%
【解析】稍过量的乙酸酐和水杨酸在浓硫酸作用下,控温在100℃以下,发生酯化反应生成阿司匹林,阿司匹林溶解度较小,加入冰水,乙酸酐和水反应生成在水中溶解度很大的乙酸,抽滤得到含水杨酸、水杨酸聚合物杂质的阿司匹林粗产品,加入饱和碳酸氢钠溶液,碳酸氢钠和水杨酸反应,同时水杨酸聚合物不能溶于 NaHCO3 溶液,过滤除去水杨酸聚合物,滤液加盐酸调节溶液的pH=3-4时,阿司匹林沉淀完全,过滤得到阿司匹林。
(1)
根据仪器构造可知,装置中仪器c为球形冷凝管,其作用是冷凝回流易挥发的反应物乙酸酐,提高反应物的利用率。
(2)
合成阿司匹林有两种反应物乙酸酐和水杨酸,使用稍过量的乙酸酐,可以提高水杨酸的转化率,增大阿司匹林的产率;加热温度为85—90℃,则采取加热均匀且易控制温度的水浴加热方式;阿司匹林微溶于水,为了降低阿司匹林的溶解度,减少阿司匹林的损耗,步骤①②加入冰水,并且用冰水洗涤。
(3)
根据给出的信息③可知,在pH=3-4时,可认为阿司匹林沉淀完全。将洗涤液与滤液合并后向混合液中缓慢滴加盐酸溶液至pH=3-4,便可析出阿司匹林晶体,抽滤,冰水洗涤,低温干燥。
(4)
69g水杨酸的物质的量为0.5mol,根据反应方程式可知,理论上生成的阿司匹林的物质的量也是0.5mol,则生成的阿司匹林的质量为0.5mol×180g/mol=90g,则阿司匹林的产率是=80%。
20. 球形冷凝管 冷凝回流,减少反应物损失,导出气体 2NO2+2OH =++ H2O 浓硝酸在加热时分解生成NO2 < 用冷水洗涤晶体2~3次 重结晶 2.89ρmol L-1 B
【解析】向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),为了让完全反应,向恒压滴液漏斗中加入6mL环己醇。将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,发生反应:+2HNO3+2NO2↑+2H2O,开始慢慢加入余下的环己醇,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕,将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,发生反应+6HNO3HOOC(CH2)4COOH+6NO2↑+3H2O,实验中的尾气为二氧化氮,用氢氧化钠溶液来吸收,用倒扣的漏斗防止倒吸,由此分析。
【解析】(1)根据仪器A的形状可知,仪器A的名称为球形冷凝管,其作用是冷凝回流,减少反应物损失,导出气体;
(2)B中发生反应为二氧化氮和氢氧化钠的反应,生成硝酸钠、亚硝酸钠和水,离子方程式为2NO2+2OH =++ H2O;
(3)若步骤Ⅱ中控制水浴温度不当,未滴加环己醇前就会观察到红棕色气体生成,原因为浓硝酸具有不稳定性,在加热时分解生成NO2、水和氧气;
滴加环己醇的过程中,若温度过高,可用冷水浴冷却维持50~60℃,说明该反应放热, H<0;
(4)由于1,6-已二酸微溶于冷水,用冷水洗涤晶体2~3次,减少洗涤时的损耗;
将1,6-己二酸粗产品进行提纯提纯,由于1,6-己二酸在冰水中的溶解度小于常温下的水,为了减小损失,步骤IV提纯方法的名称为重结晶;
根据图中1,6-已二酸在水中的溶解度曲线,80℃时1,6-己二酸的溶解度为0.73g,根据质量分数为=42.2%,溶液的密度为ρg mL-1;该溶液的物质的量浓度为=2.89ρmol L-1;
(5)由表中数据可知,6mL环己醇的密度为0.962g mL-1,摩尔质量为100,得到质量为6mL×0.962g mL-1≈5.772g,根据+2HNO3+2NO2↑+2H2O,+6HNO3HOOC(CH2)4COOH+6NO2↑+3H2O,得到~~HOOC(CH2)4COOH,设HOOC(CH2)4COOH的质量的x,,计算得到HOOC(CH2)4COOH的理论质量为8.427g,最终得到1,6-己二酸产品4.810g,则1,6-己二酸的产率为≈57. 08%。
【点睛】80℃时1,6-己二酸的溶解度为0.73g,计算质量分数时=42.2%,为易错点,要仔细观察题中有效信息。
21. C2H4 CH2=CH2 碳碳双键 C3H6 CH4 2:3
【解析】(1)0.2mol某烃在氧气中完全燃烧,生成17.6gCO2和7.2gH2O,二者的物质的量分别是17.6g÷44g/mol=0.4mol、7.2g÷18g/mol=0.4mol,所以含有碳原子的个数是0.4mol÷0.2mol=2,含有氢原子个数是0.8mol÷0.2mol=4,则该有机化合物的分子式为C2H4,是乙烯,结构简式为CH2=CH2,官能团名称是碳碳双键;
(2)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍,混合气体的平均相对分子质量是13.2×2=26.4,由于相对分子质量小于26.4的烃只有甲烷,因此含有的烷烃是甲烷,分子式为CH4;在标准状况下将4.48L即0.2mol混合气体通过足量的溴水,结果溴水增重3.36g,这说明烯烃的质量是3.36g,甲烷的质量是0.2mol×26.4g/mol-3.36g=1.92g,物质的量是1.92g÷16g/mol=0.12mol,所以烯烃的物质的量是0.2mol-0.12mol=0.08mol,相对分子质量是3.36÷0.08=42,烯烃的通式是CnH2n,则14n=42,解得n=3,所以原混合气体中烯烃分子式为C3H6,烯烃与烷烃的体积比为0.08:0.12=2:3。
22. CH4、C3H6 3∶2
【解析】混合气体平均摩尔质量为13.2×M(H2)=13.2×2g/mol=26.4g/mol,则两种气态物质相对分子质量一个大于26.4,一个小于26.4,所以一定有甲烷;对于甲烷而言,燃烧后(高于水的沸点)气体体积不变,充分燃烧说明产物只有二氧化碳和水;同温同压下,气体的体积比和物质的量成正比,反应前充入气体为5 mol,反应后增加4%,变为5.2mol,气体物质的量增加0.2mol,设烯烃中碳原子数为n、在1mol 混合气(混合气体1体积)中物质的量为xmol,甲烷为(1-x)mol;根据,可知物质的量变化(2 n-1-1.5n)=0.5n-1,列方程求出x=0.2÷(0.5n-1),所以n(甲烷)=(1-x)=(5n-12)÷(5n-10),又1mol混合气质量为26.4g,所以16×[(5n-12)÷(5n-10)]+14n×0.2÷(0.5n-1)=26.4,计算得出n=3,烯烃为丙烯,丙烯物质的量x=0.2÷(0.5n-1)=0.4,所以百分含量0.4÷1×100%=40%,甲烷60%,甲烷和丙烯的体积之比是3:2;综上分析可知:
(1)混合气体中两种烃的分子式分别为:CH4、C3H6;
(2)混合气体中甲烷和丙烯的体积比3∶2。
答案第1页,共2页
答案第1页,共2页
