第四单元:自然界的水复习(课件33页)
图片预览










文档简介
(共33张PPT)
第四单元 自然界的水
复习课
一、本单元知识脉络:
世界水资源状况
我国水资源状况
提高水的利用率
自然界的水
防止浪费
农业上:
生活中:
工业上:
措施:
使用节水器具
污染源:
危害:
防止措施:
水中杂质
自来水净化
净化方法
静置沉淀
操作要点及原因
过滤
吸附沉淀
吸附剂、
吸附原理
适用范围
仪器
操作失败原因
蒸馏
可吸附的物质
概念、仪器、
操作要点
概念、危害、区别方法
转化方法
氢气
物性
化性
验纯方法
用途
物性
水的电解
装置及注意事项
现象
原理
结论
二、基本概念
物 质
混合物
化合物
单质
纯净物
物质种类
元素种类
氧化物
非氧化物
氧元素,两种元素
金属单质
稀有气体单质
非金属单质
1、单质
2、化合物
3、氧化物
三、物质分类
气态非金属单质
液态非金属单质
固态非金属单质
分类依据:
知识清单·理脉络
一、爱护水资源
1.水资源现状:水的总储量_________,淡水资源_________。
2.爱护水资源:
一方面要节约用水,另一方面要防治水体污染。
(1)节约用水的措施。
生活中 提倡_____________,使用节水型器具
农业上 改大水漫灌为_______________
工业上 提倡对水重复利用、循环利用
丰富
短缺
一水多用
喷灌、滴灌
(2)水体污染的来源及防治措施。
污染源 防治措施
工业污染(工业“三废”:废水、废气、废渣) 废水处理达标后再排放,应用新技术、新工艺减少污染的产生
农业污染(农药、化肥的不合理使用) 合理使用化肥和农药,提倡使用农家肥
生活污染(生活污水的随意排放、含磷洗涤剂的使用) 减少含磷洗涤剂的使用,生活污水应逐步实现集中处理和排放
净化 方法 原理 作用
沉淀 静置,使不溶性大颗粒物质沉淀下来,与水分离 除去大颗粒不溶性物质
过滤 把不溶于水的固体物质与水进行分离 除去_____________
物质
二、水的净化
不溶于水的固体
3.常用的净水方法
1.纯水是________、________、清澈透明的液体,属于纯净物;自然界中的水如雨水、河水、湖水、海水、矿泉水等都是________物。
2.自来水净水过程:取水→沉淀→过滤→吸附→消毒→配水。
无色
无臭
混合
净化 方法 原理 作用
吸附 利用活性炭的_______作用除去自然界水中的一些色素和异味 除去色素和异味
消毒 利用杀菌剂的强氧化性杀死水中病毒、细菌 杀死水中的病毒、细菌
蒸馏 利用混合物中各成分的沸点不同将其分离 除去各种杂质(净化程度最高)
吸附
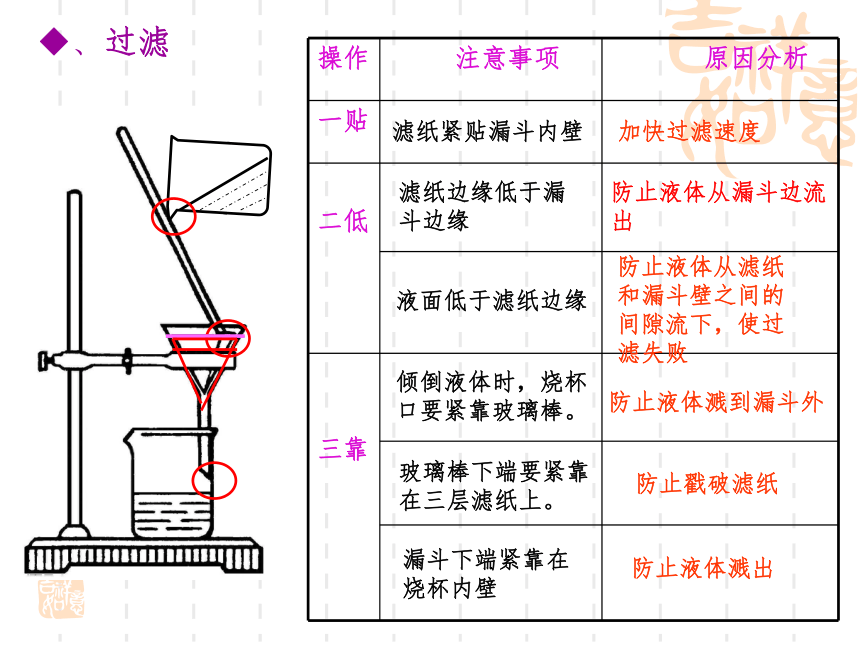
操作 注意事项 原因分析
一贴
二低
三靠
加快过滤速度
防止液体从滤纸和漏斗壁之间的间隙流下,使过滤失败
防止液体溅到漏斗外
防止戳破滤纸
防止液体溅出
防止液体从漏斗边流出
滤纸紧贴漏斗内壁
滤纸边缘低于漏斗边缘
液面低于滤纸边缘
倾倒液体时,烧杯
口要紧靠玻璃棒。
玻璃棒下端要紧靠
在三层滤纸上。
漏斗下端紧靠在
烧杯内壁
、过滤
常用的吸附剂:
活性炭、木炭:
溶于水生成胶状物对悬浮物吸附,使杂质沉降
明矾:
疏松多孔结构(接触面积大),可吸附部分可溶性杂质,还可吸附颜色、气味、气体。
过滤后,滤液仍然浑浊可能的原因有那些?
查明原因,重新过滤,直到液体澄清为止。
(1)、滤纸破损
(2)、滤液边缘高于滤纸边缘
(3)、仪器不干净等
简易净水器
4.硬水与软水:
硬水 软水
概念 含有_________可溶性钙、镁化合物的水 _______或含有较少可溶性钙镁化合物的水
鉴别 加入肥皂水 产生泡沫较___,浮渣较___ 产生泡沫较___,浮渣较___
软化方法 生活中:_____(除去一部分钙镁化合物) 实验室中:_____(除去所有钙镁化合物)
危害 用硬水洗涤衣物既浪费肥皂,又不易洗净,时间长了还会使衣物变硬;锅炉用硬水,易使炉内结垢,不仅浪费燃料,而且可能引起爆炸;长期饮用硬水,不利于身体健康
较多
不含
少
多
多
少
煮沸
蒸馏
.蒸馏 (如右图所示)
(1)原理:通过加热的方法使水变成
水蒸气后再冷凝成水。
(2)注意事项:
①蒸馏烧瓶下面应垫上石棉网。
蒸馏烧瓶中所盛放液体不能超过其
容积的2/3,也不能少于1/3。
②在蒸馏烧瓶中要加几粒沸石(或碎瓷片),以防加热时暴沸。
③温度计的水银球应对着蒸馏烧瓶的支管口。
④冷凝水从下口进,从上口出。
⑤先通冷凝水,再点燃酒精灯;实验结束时先撤酒精灯,再停止通冷凝水。
⑥液体不可蒸干。
1. 烧杯中冷水的作用?
2. 长导管的作用?
使水蒸气冷凝
导气和冷凝
3. 得到的蒸馏水是软水还是硬水?
软水(不含可溶性钙镁化合物)
4. 得到的蒸馏水是纯净物
还是混合物?
纯净物
.蒸馏简易装置
①.物理性质:无色、无臭、难溶于水,密度最小的气体
三、水的组成
1.氢气
(1)氢气的性质与用途
②.化学性质:可燃性
氧气
氧气
氢气
氢气
点燃
+
H2
O2
水
H2O
现象:
产生淡蓝色火焰,放出大量的热,烧杯内壁有水雾。
①操作(如右图所示):收集一小试管氢气,用拇指堵住试管口,靠近酒精灯火焰,移开拇指点火。
②结论:发出尖锐爆鸣声表明氢气不纯,声音很小则表明氢气较纯。
(2)氢气的验纯
注意:氢气是可燃性气体,与空气混合后可能发生爆炸,因此氢气在点燃前一定要验纯。
2.验证水的组成实验
1∶2
水的生成 水的电解
实验装置
实验现象 产生淡蓝色火焰;烧杯内壁有无色液滴生成,烧杯变热 两电极上都产生无色气泡,且与正极和负极相连的玻璃管中产生的气体体积之比约为②________
水的生成 水的电解
实验装置
水的电解 产物检验 (1)正极:将燃着的木条放在玻璃管尖嘴处,木条燃烧得更旺,证明该气体是氧气; (2)负极:将燃着的木条放在玻璃管尖嘴处,气体被引燃,产生淡蓝色火焰,证明该气体是氢气。 简记为:正氧负氢、氢二氧一
水的生成 水的电解
实验装置
实验结论 (1)水是由③________和④________组成的化合物; (2)水分子是由⑤__________和⑥__________构成的
拓展 (1)水的电解实验中常向水中加入少量硫酸钠或氢氧化钠,其目的是⑦______________; (2)通过计算可得出水的电解实验中负极得到的气体(H2 )和正极得到的气体(O2 )的质量比为⑧________
氢元素
氧元素
氢原子
氧原子
增强导电性
1∶8
四、纯净物的分类
单质(同种元素组成的纯净物)
物质
纯净物
混合物
氧化物:由两种元素组成的化合物,
其中一种元素是氧
如:氧气(O2)、氮气(N2)、铁(Fe)
水(H2O) 、氯化钠(NaCl)
化合物
如:空气、溶液、合金
如:H2O、CO2、P2O5
其他化合物(酸、碱、盐)
不同种元素组成的纯净物
由同种元素组成的物质不一定都是单质。
如:O2和O3的混合物;金刚石和石墨的混合物
含有氧元素的化合物不一定都是氧化物。
如:KMnO4、KClO3
五、化学式与化合价
2.化学式的意义
该物质一个分子的构成
(表示水这种物质)
一种物质
物质的元素组成
该物质的一个分子
(水由氢元素和氧元素组成)
(一个水分子由2个氢原子和1个氧原子构成)
(一个水分子)
宏观
微观
H2O
1. 概念:
用元素符号和数字的组合表示物质组成的式子,叫做化学式。
3.化学式周围数字的意义
H2O
1个/第个水分子中含有2个氢原子
2
两个水分子
注意与“2H”的区别
化学用语
元素符号的书写及其意义
离子符号的书写及其意义
化学式及其意义
原子(离子)结构示意图
表示粒子个数
表示元素的正负化合价
一个离子所带的正负电荷值
一个分子中所含原子的个数
+
(-)
m
α
n
+
(-)
b
R
原子、分子、离子、元素、物质的表示方法:
1.原子用元素符号表示,多个原子的个数加在元素符号之前;
2.分子用化学式表示,多个分子的个数加在化学式之前;
3.离子用离子符号表示,多个离子的个数加在离子符号之前;
4.元素用元素符号表示;
5.物质用化学式表示。
1.一种分子中不含另一种分子
(1)1个水分子(H2O)是由1个氢分子(H2)和1个氧原子(O)构成的。
(2) 过氧化氢分子(H2O2)中含有氢分子(H2)和氧分子(O2)。
2.宏(物质)→宏(元素),微(分子)→微(原子),前个数→后个数
(1)水是由氢元素和氧元素组成的;水是由水分子构成的。
(2)水分子是由氢元素和氧元素构成的。
(3)水分子(H2O)是由氢原子和氧原子构成的。
(4)1个水分子(H2O)是由2个氢原子和1个氧原子构成的。
(5)1个水分子(H2O)中含有3个原子。
练习
金属 铜 Cu 铁 Fe 汞 Hg
“石”旁 碳 C 硅 Si
稀有气体 氦气 He 氖气 Ne
4.化学式的读写
单
质
(1)由原子直接构成的单质,直接用元素符号表示,
读元素的名称。
(2)由分子构成的单质,在符号右下角写出分子中
所含原子个数。
氢气 氧气 臭氧 氮气 氯气
O2
H2
O3
N2
Cl2
(1)氧化物(氧元素写在后面,从后向前读)
一氧化碳 二氧化碳 二氧化硫 五氧化二磷 四氧化三铁
CO2
CO
SO2
P2O5
Fe3O4
(2)金属+非金属(非金属写在后面,从后向前读)
氯化钠 氯化钾 氯化氢 氯化银 氯化钡
KCl
NaCl
HCl
AgCl
BaCl2
化合物
一般从右往左读作:“某化某”或“几某化几某”。
用以表示元素原子之间相互化合的数目,元素的化合价有_________和________之分。
正价
负价
正上方
六、化合价
1.意义:
2.表示方法:
通常在元素符号或原子团的___________用“+n”或“-n”表示,n为1时不能省略。
(1)、化合价有正价和负价。
(2)、在化合物里:
A、氧元素通常显-2价;氢元素通常显+1价。
B、金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
C、一些元素在不同种物质中可显不同的化合价。
(3)、在化合物里正负化合价的代数和为0。(化合价法则)
(4)、在单质分子里,元素的化合价为0。
(元素的化合价是元素的原子在形成化合物时表现出来的一种性质)。
3.化合价一般规律:
4.化合价与离子符号的区别
化合价 离子符号
举 例
区 别 意义 ①整体:表示1个离子
②数字:离子所带电荷
写法 ______不同,______相反; 数值相等,正负相同
“1” 省略
Mg
+2
Na+
不省略
Na
+1
Mg2+
正二价的镁元素
位置
顺序
元素 元素符号 常见化合价 元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氯 Cl -1.+1.+5.+7
钙 Ca +2 溴 Br -1
镁 Mg +2 氧 O -2
钡 Ba +2 硫 S -2、+4、+6
铜 Cu +1、+2 碳 C +2、+4
铁 Fe +2、+3 硅 Si +4
铝 Al +3 氮 N -3 .+1 +2.+3.+4.+5
锰 Mn +2.+4.+6.+7 磷 P -3、+3、+5
锌 Zn +2
钾钠银氢正一价
钙钡镁锌正二价
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全
铜汞二价最常见
条件不同价不同
单质为零和为零
5、常见元素化合价口诀:
一些常见原子团的化合价
负一硝酸氢氧根
根的名称 根的符号 常见化合价
氢氧根 OH -1
硝酸根 NO3 -1
硫酸根 SO4 -2
碳酸根 CO3 -2
铵根 NH4 +1
2-
2-
-
-
+
负二硫酸碳酸根
正一价的是铵根
①正前负后,标价态:P O
(1)十字交叉法
约简:把原子个数约成最简比。
如:C2O4 CO2
6.化合价的应用
+5 -2
②约简交叉:P O
+5 -2
2
5
P2O5
例外:H2O2不用约简
+4 -2
约简交叉
考点七、化学式的相关计算
相对分子质量
1.知识梳理
第四单元 自然界的水
复习课
一、本单元知识脉络:
世界水资源状况
我国水资源状况
提高水的利用率
自然界的水
防止浪费
农业上:
生活中:
工业上:
措施:
使用节水器具
污染源:
危害:
防止措施:
水中杂质
自来水净化
净化方法
静置沉淀
操作要点及原因
过滤
吸附沉淀
吸附剂、
吸附原理
适用范围
仪器
操作失败原因
蒸馏
可吸附的物质
概念、仪器、
操作要点
概念、危害、区别方法
转化方法
氢气
物性
化性
验纯方法
用途
物性
水的电解
装置及注意事项
现象
原理
结论
二、基本概念
物 质
混合物
化合物
单质
纯净物
物质种类
元素种类
氧化物
非氧化物
氧元素,两种元素
金属单质
稀有气体单质
非金属单质
1、单质
2、化合物
3、氧化物
三、物质分类
气态非金属单质
液态非金属单质
固态非金属单质
分类依据:
知识清单·理脉络
一、爱护水资源
1.水资源现状:水的总储量_________,淡水资源_________。
2.爱护水资源:
一方面要节约用水,另一方面要防治水体污染。
(1)节约用水的措施。
生活中 提倡_____________,使用节水型器具
农业上 改大水漫灌为_______________
工业上 提倡对水重复利用、循环利用
丰富
短缺
一水多用
喷灌、滴灌
(2)水体污染的来源及防治措施。
污染源 防治措施
工业污染(工业“三废”:废水、废气、废渣) 废水处理达标后再排放,应用新技术、新工艺减少污染的产生
农业污染(农药、化肥的不合理使用) 合理使用化肥和农药,提倡使用农家肥
生活污染(生活污水的随意排放、含磷洗涤剂的使用) 减少含磷洗涤剂的使用,生活污水应逐步实现集中处理和排放
净化 方法 原理 作用
沉淀 静置,使不溶性大颗粒物质沉淀下来,与水分离 除去大颗粒不溶性物质
过滤 把不溶于水的固体物质与水进行分离 除去_____________
物质
二、水的净化
不溶于水的固体
3.常用的净水方法
1.纯水是________、________、清澈透明的液体,属于纯净物;自然界中的水如雨水、河水、湖水、海水、矿泉水等都是________物。
2.自来水净水过程:取水→沉淀→过滤→吸附→消毒→配水。
无色
无臭
混合
净化 方法 原理 作用
吸附 利用活性炭的_______作用除去自然界水中的一些色素和异味 除去色素和异味
消毒 利用杀菌剂的强氧化性杀死水中病毒、细菌 杀死水中的病毒、细菌
蒸馏 利用混合物中各成分的沸点不同将其分离 除去各种杂质(净化程度最高)
吸附
操作 注意事项 原因分析
一贴
二低
三靠
加快过滤速度
防止液体从滤纸和漏斗壁之间的间隙流下,使过滤失败
防止液体溅到漏斗外
防止戳破滤纸
防止液体溅出
防止液体从漏斗边流出
滤纸紧贴漏斗内壁
滤纸边缘低于漏斗边缘
液面低于滤纸边缘
倾倒液体时,烧杯
口要紧靠玻璃棒。
玻璃棒下端要紧靠
在三层滤纸上。
漏斗下端紧靠在
烧杯内壁
、过滤
常用的吸附剂:
活性炭、木炭:
溶于水生成胶状物对悬浮物吸附,使杂质沉降
明矾:
疏松多孔结构(接触面积大),可吸附部分可溶性杂质,还可吸附颜色、气味、气体。
过滤后,滤液仍然浑浊可能的原因有那些?
查明原因,重新过滤,直到液体澄清为止。
(1)、滤纸破损
(2)、滤液边缘高于滤纸边缘
(3)、仪器不干净等
简易净水器
4.硬水与软水:
硬水 软水
概念 含有_________可溶性钙、镁化合物的水 _______或含有较少可溶性钙镁化合物的水
鉴别 加入肥皂水 产生泡沫较___,浮渣较___ 产生泡沫较___,浮渣较___
软化方法 生活中:_____(除去一部分钙镁化合物) 实验室中:_____(除去所有钙镁化合物)
危害 用硬水洗涤衣物既浪费肥皂,又不易洗净,时间长了还会使衣物变硬;锅炉用硬水,易使炉内结垢,不仅浪费燃料,而且可能引起爆炸;长期饮用硬水,不利于身体健康
较多
不含
少
多
多
少
煮沸
蒸馏
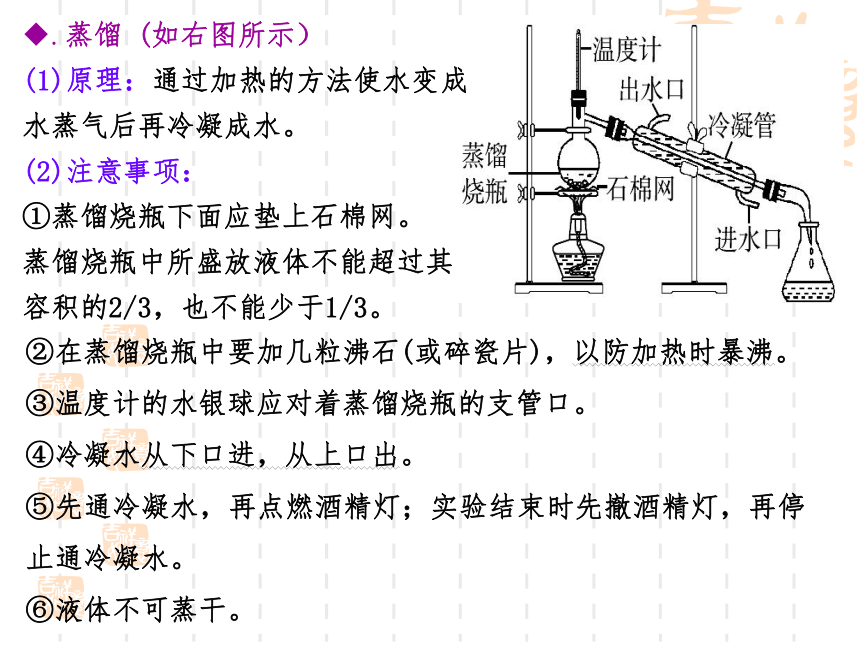
.蒸馏 (如右图所示)
(1)原理:通过加热的方法使水变成
水蒸气后再冷凝成水。
(2)注意事项:
①蒸馏烧瓶下面应垫上石棉网。
蒸馏烧瓶中所盛放液体不能超过其
容积的2/3,也不能少于1/3。
②在蒸馏烧瓶中要加几粒沸石(或碎瓷片),以防加热时暴沸。
③温度计的水银球应对着蒸馏烧瓶的支管口。
④冷凝水从下口进,从上口出。
⑤先通冷凝水,再点燃酒精灯;实验结束时先撤酒精灯,再停止通冷凝水。
⑥液体不可蒸干。
1. 烧杯中冷水的作用?
2. 长导管的作用?
使水蒸气冷凝
导气和冷凝
3. 得到的蒸馏水是软水还是硬水?
软水(不含可溶性钙镁化合物)
4. 得到的蒸馏水是纯净物
还是混合物?
纯净物
.蒸馏简易装置
①.物理性质:无色、无臭、难溶于水,密度最小的气体
三、水的组成
1.氢气
(1)氢气的性质与用途
②.化学性质:可燃性
氧气
氧气
氢气
氢气
点燃
+
H2
O2
水
H2O
现象:
产生淡蓝色火焰,放出大量的热,烧杯内壁有水雾。
①操作(如右图所示):收集一小试管氢气,用拇指堵住试管口,靠近酒精灯火焰,移开拇指点火。
②结论:发出尖锐爆鸣声表明氢气不纯,声音很小则表明氢气较纯。
(2)氢气的验纯
注意:氢气是可燃性气体,与空气混合后可能发生爆炸,因此氢气在点燃前一定要验纯。
2.验证水的组成实验
1∶2
水的生成 水的电解
实验装置
实验现象 产生淡蓝色火焰;烧杯内壁有无色液滴生成,烧杯变热 两电极上都产生无色气泡,且与正极和负极相连的玻璃管中产生的气体体积之比约为②________
水的生成 水的电解
实验装置
水的电解 产物检验 (1)正极:将燃着的木条放在玻璃管尖嘴处,木条燃烧得更旺,证明该气体是氧气; (2)负极:将燃着的木条放在玻璃管尖嘴处,气体被引燃,产生淡蓝色火焰,证明该气体是氢气。 简记为:正氧负氢、氢二氧一
水的生成 水的电解
实验装置
实验结论 (1)水是由③________和④________组成的化合物; (2)水分子是由⑤__________和⑥__________构成的
拓展 (1)水的电解实验中常向水中加入少量硫酸钠或氢氧化钠,其目的是⑦______________; (2)通过计算可得出水的电解实验中负极得到的气体(H2 )和正极得到的气体(O2 )的质量比为⑧________
氢元素
氧元素
氢原子
氧原子
增强导电性
1∶8
四、纯净物的分类
单质(同种元素组成的纯净物)
物质
纯净物
混合物
氧化物:由两种元素组成的化合物,
其中一种元素是氧
如:氧气(O2)、氮气(N2)、铁(Fe)
水(H2O) 、氯化钠(NaCl)
化合物
如:空气、溶液、合金
如:H2O、CO2、P2O5
其他化合物(酸、碱、盐)
不同种元素组成的纯净物
由同种元素组成的物质不一定都是单质。
如:O2和O3的混合物;金刚石和石墨的混合物
含有氧元素的化合物不一定都是氧化物。
如:KMnO4、KClO3
五、化学式与化合价
2.化学式的意义
该物质一个分子的构成
(表示水这种物质)
一种物质
物质的元素组成
该物质的一个分子
(水由氢元素和氧元素组成)
(一个水分子由2个氢原子和1个氧原子构成)
(一个水分子)
宏观
微观
H2O
1. 概念:
用元素符号和数字的组合表示物质组成的式子,叫做化学式。
3.化学式周围数字的意义
H2O
1个/第个水分子中含有2个氢原子
2
两个水分子
注意与“2H”的区别
化学用语
元素符号的书写及其意义
离子符号的书写及其意义
化学式及其意义
原子(离子)结构示意图
表示粒子个数
表示元素的正负化合价
一个离子所带的正负电荷值
一个分子中所含原子的个数
+
(-)
m
α
n
+
(-)
b
R
原子、分子、离子、元素、物质的表示方法:
1.原子用元素符号表示,多个原子的个数加在元素符号之前;
2.分子用化学式表示,多个分子的个数加在化学式之前;
3.离子用离子符号表示,多个离子的个数加在离子符号之前;
4.元素用元素符号表示;
5.物质用化学式表示。
1.一种分子中不含另一种分子
(1)1个水分子(H2O)是由1个氢分子(H2)和1个氧原子(O)构成的。
(2) 过氧化氢分子(H2O2)中含有氢分子(H2)和氧分子(O2)。
2.宏(物质)→宏(元素),微(分子)→微(原子),前个数→后个数
(1)水是由氢元素和氧元素组成的;水是由水分子构成的。
(2)水分子是由氢元素和氧元素构成的。
(3)水分子(H2O)是由氢原子和氧原子构成的。
(4)1个水分子(H2O)是由2个氢原子和1个氧原子构成的。
(5)1个水分子(H2O)中含有3个原子。
练习
金属 铜 Cu 铁 Fe 汞 Hg
“石”旁 碳 C 硅 Si
稀有气体 氦气 He 氖气 Ne
4.化学式的读写
单
质
(1)由原子直接构成的单质,直接用元素符号表示,
读元素的名称。
(2)由分子构成的单质,在符号右下角写出分子中
所含原子个数。
氢气 氧气 臭氧 氮气 氯气
O2
H2
O3
N2
Cl2
(1)氧化物(氧元素写在后面,从后向前读)
一氧化碳 二氧化碳 二氧化硫 五氧化二磷 四氧化三铁
CO2
CO
SO2
P2O5
Fe3O4
(2)金属+非金属(非金属写在后面,从后向前读)
氯化钠 氯化钾 氯化氢 氯化银 氯化钡
KCl
NaCl
HCl
AgCl
BaCl2
化合物
一般从右往左读作:“某化某”或“几某化几某”。
用以表示元素原子之间相互化合的数目,元素的化合价有_________和________之分。
正价
负价
正上方
六、化合价
1.意义:
2.表示方法:
通常在元素符号或原子团的___________用“+n”或“-n”表示,n为1时不能省略。
(1)、化合价有正价和负价。
(2)、在化合物里:
A、氧元素通常显-2价;氢元素通常显+1价。
B、金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
C、一些元素在不同种物质中可显不同的化合价。
(3)、在化合物里正负化合价的代数和为0。(化合价法则)
(4)、在单质分子里,元素的化合价为0。
(元素的化合价是元素的原子在形成化合物时表现出来的一种性质)。
3.化合价一般规律:
4.化合价与离子符号的区别
化合价 离子符号
举 例
区 别 意义 ①整体:表示1个离子
②数字:离子所带电荷
写法 ______不同,______相反; 数值相等,正负相同
“1” 省略
Mg
+2
Na+
不省略
Na
+1
Mg2+
正二价的镁元素
位置
顺序
元素 元素符号 常见化合价 元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氯 Cl -1.+1.+5.+7
钙 Ca +2 溴 Br -1
镁 Mg +2 氧 O -2
钡 Ba +2 硫 S -2、+4、+6
铜 Cu +1、+2 碳 C +2、+4
铁 Fe +2、+3 硅 Si +4
铝 Al +3 氮 N -3 .+1 +2.+3.+4.+5
锰 Mn +2.+4.+6.+7 磷 P -3、+3、+5
锌 Zn +2
钾钠银氢正一价
钙钡镁锌正二价
三铝四硅五价磷
二三铁,二四碳
二四六硫都齐全
铜汞二价最常见
条件不同价不同
单质为零和为零
5、常见元素化合价口诀:
一些常见原子团的化合价
负一硝酸氢氧根
根的名称 根的符号 常见化合价
氢氧根 OH -1
硝酸根 NO3 -1
硫酸根 SO4 -2
碳酸根 CO3 -2
铵根 NH4 +1
2-
2-
-
-
+
负二硫酸碳酸根
正一价的是铵根
①正前负后,标价态:P O
(1)十字交叉法
约简:把原子个数约成最简比。
如:C2O4 CO2
6.化合价的应用
+5 -2
②约简交叉:P O
+5 -2
2
5
P2O5
例外:H2O2不用约简
+4 -2
约简交叉
考点七、化学式的相关计算
相对分子质量
1.知识梳理
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
