浙教版2022-2023学年上学期九年级科学分类题型训练:第二章《物质转化与材料利用》填空题(7)【word,含答案】
文档属性
| 名称 | 浙教版2022-2023学年上学期九年级科学分类题型训练:第二章《物质转化与材料利用》填空题(7)【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 257.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-09-29 07:16:56 | ||
图片预览


文档简介
1.(1)现有4.6克某有机物在空气中完全燃烧,生成了8.8克CO2和5.4克水,该有机物中所含的元素为__________。
(2)“假酒中毒”事件时有发生。“假酒”一般是由工业酒精加水配制而成的,它含有一定量的甲醇(CH3OH),请写出甲醇燃烧的化学方程式:__________。
2.有A、B、C、D四种物质,它们之间的转化关系可用下列方程式表示:
A+HCl→B+H2O A+H2→C+H2O B+NaOH→D↓+NaCl
(1)若D为蓝色沉淀,则A是__________,C是__________;
(2)若D为红褐色沉淀,则A是__________,B是__________。
3.如图是我市一些街道边新安装的“太阳能垃圾箱”。该垃圾箱“头顶”光电池板,“腰挎”广告灯箱,“脚踩”垃圾桶。
(1)太阳能电池板的主要材料为硅,硅属于__________(选填“金属”或 “非金属”)
(2)白天,太阳能电池板给蓄电池充电,将__________能先转化为__________能,再转化为化学能。
(3)废电池应该投入到其中的__________垃圾桶(选填“可回收”、“有害垃圾”、“厨余垃圾”或“其他 垃圾”),以防渗漏出的汞、镉、铅等重金属离子对土壤和水源造成污染。
4.物质王国举行一场趣味篮球赛。某队由铁、二氧化碳、硫酸、氢氧化钙、氯化铜五名“队员”组 成,比赛中,由氯化铜“队员”发球,“队员”间传接球,最后由D位置“队员”投篮进球完成一次有效进攻。场上“队员”位置及传球路线如图所示。
(1)已知D位置上投篮的“队员”是个灭火“能手”,则D位置 “队员”代表的物质是__________;
(2)写出连线④代表的物质间发生反应的化学方程式__________。
5.鉴别稀盐酸、稀硫酸、Ba(OH)2溶液、Na2CO3溶液和NaCl溶液五瓶无标签的溶液时,将它们随意编号为A、B、C、D、E后进行如下实验:
(1)鉴别后把所有物质混合倒入同一烧杯中,发现混合物呈浑浊状,过滤后,滤液呈红色,说明滤液呈__________性,则滤渣的成分是__________。
(2)为了防止滤液污染环境,向滤液中逐滴加入过量的Na2CO3溶液时,发现先有气泡产生,后有白色沉淀生成。综合以上实验过程判断,加入Na2CO3溶液前,滤液中含有的溶质除石蕊外,一定还有__________。
6.我国科研团队首次合成了单原子铂催化剂,率先提出“单原子催化”概念。下图是单原子催化剂用于合成气制造燃料甲醇(CH3OH)的微观示意图。
(1)根据上图物质转化的微观示意图,判断下列有关说法错误的是__________(填字母序号)。
A.使用单原子催化剂能提高生成物的产量 B.该反应前后原子的种类没有变化
C.生成物甲醇属于有机物 D.反应物和生成物都由分子构成
(2)合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质。如果仅用合成气为原料不可能得到的物质是__________(填字母序号)。
A.尿素[CO(NH2)2] B.葡萄糖(C6H12O6) C.甲醛(CH2O)
7.目前,市场上出现的木糖醇(化学式为C5H12O5)是一种新型甜味剂,它不能被细菌分解,添加在口香糖里取代糖份,可以防止蛀牙。试回答下列问题:
(1)木糖醇属于__________(填“有机物”或“无机物”);
(2)木糖醇中碳元素质量分数是__________。(精确到0.1%)
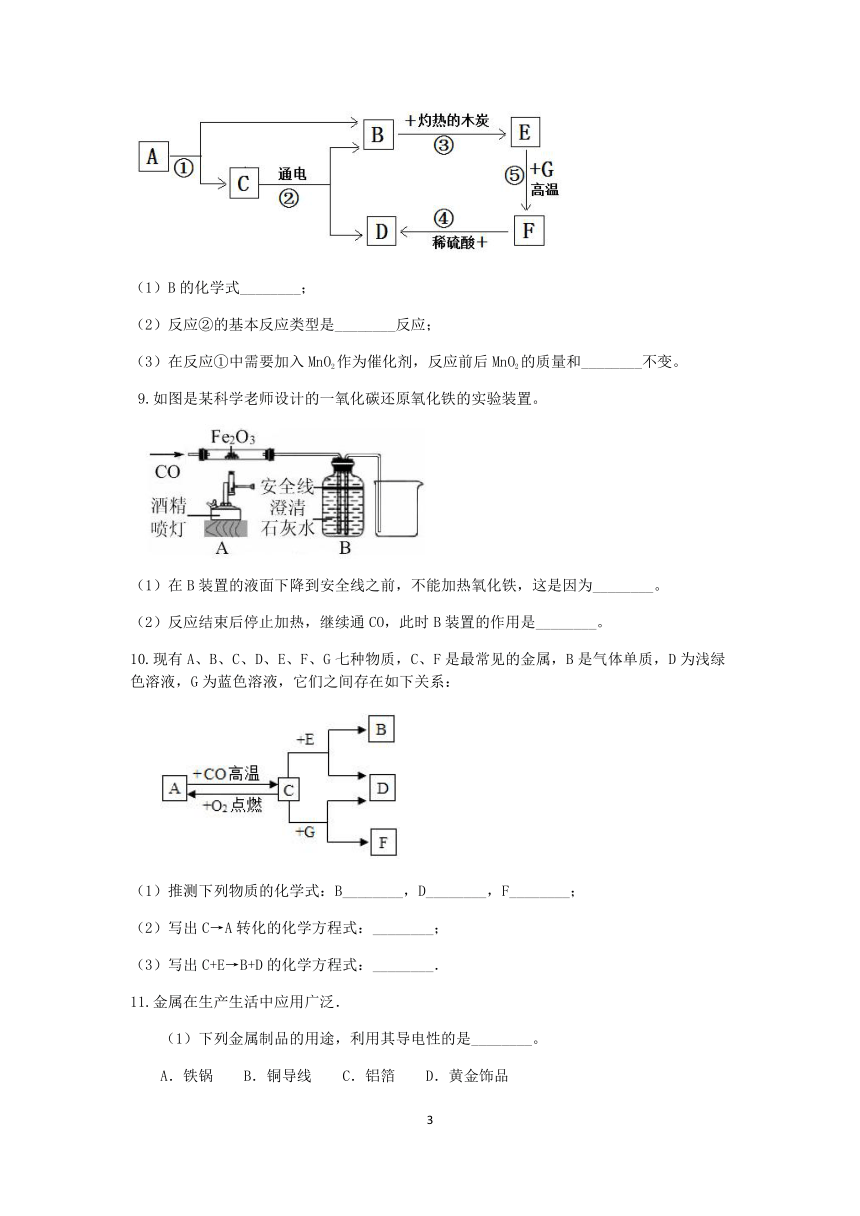
8.如图是常见物质间的相互转化关系,A与C都是由相同两种元素组成的液体,A、C、E、G为化合物,G为红色粉末,F为常见金属单质,其余反应条件、反应物和生成物均已省略。
(1)B的化学式________;
(2)反应②的基本反应类型是________反应;
(3)在反应①中需要加入MnO2作为催化剂,反应前后MnO2的质量和________不变。
9.如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。
(1)在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为________。
(2)反应结束后停止加热,继续通CO,此时B装置的作用是________。
10.现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:
(1)推测下列物质的化学式:B________,D________,F________;
(2)写出C→A转化的化学方程式:________;
(3)写出C+E→B+D的化学方程式:________.
11.金属在生产生活中应用广泛.
(1)下列金属制品的用途,利用其导电性的是________。
A.铁锅 B.铜导线 C.铝箔 D.黄金饰品
(2)合金性能优于单一金属,因而被广泛应用.焊锡(主要含锡、铅)与其组成金属相比具有________________的特性,可用于焊接电子元件;
(3)金属是一种有限资源,需要保护和回收利用.
黄铜( 铜锌合金)用作弹壳的制造.现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示.
【收集资料】弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应.(提示:E为过量的锌)
a.写出弹壳上的锈与稀硫酸反应的化学方程式__________________________。
b.固体D为________.
12.向一定量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图,请回答下列问题(用符号表示)。
(1)在a点所发生反应产生的单质是________。
(2)在bc段(不含两端点)的溶液中含有的离子为________________________。
(3)在d点时存在的固体有________________________。
Ag;Cu2+、Zn2+、NO3﹣;Ag、Cu、Zn。
13.金属在日常生活中有着广泛的用途,常见金属的活动性顺序如图:
请回答下面问题:
(1)金属活动性顺序表中的X是________元素。
(2)把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过了一会儿,观察到的现象有________,该反应的化学方程式为________。
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图所示,图中B点溶液中含有的溶质有________。
14.实验室的某一废液中含有Cu(NO3)2、NaNO3和AgNO3三种溶质。小科同学设计了如下实验方案来分离、回收废液中的金属铜和银。根据以下实验过程和现象回答问题:
(1)加入适量铜粉后,废液中发生反应的化学方程式是________。
(2)滤液D中的溶质有________。
15.金属在生产生活中应用广泛.
(1)下列金属制品的用途,利用其导电性的是________。
A.铁锅 B.铜导线 C.铝箔 D.黄金饰品
(2)合金性能优于单一金属,因而被广泛应用.焊锡(主要含锡、铅)与其组成金属相比具有________________的特性,可用于焊接电子元件;
(3)金属是一种有限资源,需要保护和回收利用.
黄铜( 铜锌合金)用作弹壳的制造.现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示.
【收集资料】弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应.(提示:E为过量的锌)
a.写出弹壳上的锈与稀硫酸反应的化学方程式______________________。
b.固体D为________.
参考答案
1.(1)C、H、O(2)2CH3OH+3O22CO2+4H2O
2.(1)CuO;Cu;(2)Fe2O3;FeCl3
3.(1)非金属;(2)太阳;电;化学;(3)可回收
4.(1) CO2 (或二氧化碳) (2)CO2+Ca(OH)2=CaCO3↓+H2O
5.(1)酸;硫酸钡;(2)氯化氢、氯化钡和氯化钠
6.(1)A (2)A
7.(1)有机物 (2)39.5%
8.(1)O2(2)分解(3)化学性质
9.(1)CO和空气混合,加热可能会发生爆炸(2)收集CO,防止污染空气
10.(1)H2;FeSO4;Cu (2)3Fe+2O2 点燃 Fe3O4 (3)Fe+H2SO4=FeSO4+H2↑
11.(1)B (2)熔点低 (3)a.Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑;b.锌、铜.
12.Ag;Cu2+、Zn2+、NO3﹣;Ag、Cu、Zn。
13.(1)Hg
(2)铝丝上附着红色固体,溶液蓝色变浅;2Al+3CuSO4=3Cu+Al2(SO4)3
(3)Cu(NO3)2、Zn(NO3)2
14.(1)Cu+2AgNO3=Cu(NO3)2+2Ag (2)Fe(NO3)2、NaNO3
15.(1)B (2)熔点低 (3)a.Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑;b.锌、铜.
《物质转化与材料利用》填空训练(7)
(2)“假酒中毒”事件时有发生。“假酒”一般是由工业酒精加水配制而成的,它含有一定量的甲醇(CH3OH),请写出甲醇燃烧的化学方程式:__________。
2.有A、B、C、D四种物质,它们之间的转化关系可用下列方程式表示:
A+HCl→B+H2O A+H2→C+H2O B+NaOH→D↓+NaCl
(1)若D为蓝色沉淀,则A是__________,C是__________;
(2)若D为红褐色沉淀,则A是__________,B是__________。
3.如图是我市一些街道边新安装的“太阳能垃圾箱”。该垃圾箱“头顶”光电池板,“腰挎”广告灯箱,“脚踩”垃圾桶。
(1)太阳能电池板的主要材料为硅,硅属于__________(选填“金属”或 “非金属”)
(2)白天,太阳能电池板给蓄电池充电,将__________能先转化为__________能,再转化为化学能。
(3)废电池应该投入到其中的__________垃圾桶(选填“可回收”、“有害垃圾”、“厨余垃圾”或“其他 垃圾”),以防渗漏出的汞、镉、铅等重金属离子对土壤和水源造成污染。
4.物质王国举行一场趣味篮球赛。某队由铁、二氧化碳、硫酸、氢氧化钙、氯化铜五名“队员”组 成,比赛中,由氯化铜“队员”发球,“队员”间传接球,最后由D位置“队员”投篮进球完成一次有效进攻。场上“队员”位置及传球路线如图所示。
(1)已知D位置上投篮的“队员”是个灭火“能手”,则D位置 “队员”代表的物质是__________;
(2)写出连线④代表的物质间发生反应的化学方程式__________。
5.鉴别稀盐酸、稀硫酸、Ba(OH)2溶液、Na2CO3溶液和NaCl溶液五瓶无标签的溶液时,将它们随意编号为A、B、C、D、E后进行如下实验:
(1)鉴别后把所有物质混合倒入同一烧杯中,发现混合物呈浑浊状,过滤后,滤液呈红色,说明滤液呈__________性,则滤渣的成分是__________。
(2)为了防止滤液污染环境,向滤液中逐滴加入过量的Na2CO3溶液时,发现先有气泡产生,后有白色沉淀生成。综合以上实验过程判断,加入Na2CO3溶液前,滤液中含有的溶质除石蕊外,一定还有__________。
6.我国科研团队首次合成了单原子铂催化剂,率先提出“单原子催化”概念。下图是单原子催化剂用于合成气制造燃料甲醇(CH3OH)的微观示意图。
(1)根据上图物质转化的微观示意图,判断下列有关说法错误的是__________(填字母序号)。
A.使用单原子催化剂能提高生成物的产量 B.该反应前后原子的种类没有变化
C.生成物甲醇属于有机物 D.反应物和生成物都由分子构成
(2)合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质。如果仅用合成气为原料不可能得到的物质是__________(填字母序号)。
A.尿素[CO(NH2)2] B.葡萄糖(C6H12O6) C.甲醛(CH2O)
7.目前,市场上出现的木糖醇(化学式为C5H12O5)是一种新型甜味剂,它不能被细菌分解,添加在口香糖里取代糖份,可以防止蛀牙。试回答下列问题:
(1)木糖醇属于__________(填“有机物”或“无机物”);
(2)木糖醇中碳元素质量分数是__________。(精确到0.1%)
8.如图是常见物质间的相互转化关系,A与C都是由相同两种元素组成的液体,A、C、E、G为化合物,G为红色粉末,F为常见金属单质,其余反应条件、反应物和生成物均已省略。
(1)B的化学式________;
(2)反应②的基本反应类型是________反应;
(3)在反应①中需要加入MnO2作为催化剂,反应前后MnO2的质量和________不变。
9.如图是某科学老师设计的一氧化碳还原氧化铁的实验装置。
(1)在B装置的液面下降到安全线之前,不能加热氧化铁,这是因为________。
(2)反应结束后停止加热,继续通CO,此时B装置的作用是________。
10.现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:
(1)推测下列物质的化学式:B________,D________,F________;
(2)写出C→A转化的化学方程式:________;
(3)写出C+E→B+D的化学方程式:________.
11.金属在生产生活中应用广泛.
(1)下列金属制品的用途,利用其导电性的是________。
A.铁锅 B.铜导线 C.铝箔 D.黄金饰品
(2)合金性能优于单一金属,因而被广泛应用.焊锡(主要含锡、铅)与其组成金属相比具有________________的特性,可用于焊接电子元件;
(3)金属是一种有限资源,需要保护和回收利用.
黄铜( 铜锌合金)用作弹壳的制造.现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示.
【收集资料】弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应.(提示:E为过量的锌)
a.写出弹壳上的锈与稀硫酸反应的化学方程式__________________________。
b.固体D为________.
12.向一定量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图,请回答下列问题(用符号表示)。
(1)在a点所发生反应产生的单质是________。
(2)在bc段(不含两端点)的溶液中含有的离子为________________________。
(3)在d点时存在的固体有________________________。
Ag;Cu2+、Zn2+、NO3﹣;Ag、Cu、Zn。
13.金属在日常生活中有着广泛的用途,常见金属的活动性顺序如图:
请回答下面问题:
(1)金属活动性顺序表中的X是________元素。
(2)把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过了一会儿,观察到的现象有________,该反应的化学方程式为________。
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图所示,图中B点溶液中含有的溶质有________。
14.实验室的某一废液中含有Cu(NO3)2、NaNO3和AgNO3三种溶质。小科同学设计了如下实验方案来分离、回收废液中的金属铜和银。根据以下实验过程和现象回答问题:
(1)加入适量铜粉后,废液中发生反应的化学方程式是________。
(2)滤液D中的溶质有________。
15.金属在生产生活中应用广泛.
(1)下列金属制品的用途,利用其导电性的是________。
A.铁锅 B.铜导线 C.铝箔 D.黄金饰品
(2)合金性能优于单一金属,因而被广泛应用.焊锡(主要含锡、铅)与其组成金属相比具有________________的特性,可用于焊接电子元件;
(3)金属是一种有限资源,需要保护和回收利用.
黄铜( 铜锌合金)用作弹壳的制造.现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示.
【收集资料】弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应.(提示:E为过量的锌)
a.写出弹壳上的锈与稀硫酸反应的化学方程式______________________。
b.固体D为________.
参考答案
1.(1)C、H、O(2)2CH3OH+3O22CO2+4H2O
2.(1)CuO;Cu;(2)Fe2O3;FeCl3
3.(1)非金属;(2)太阳;电;化学;(3)可回收
4.(1) CO2 (或二氧化碳) (2)CO2+Ca(OH)2=CaCO3↓+H2O
5.(1)酸;硫酸钡;(2)氯化氢、氯化钡和氯化钠
6.(1)A (2)A
7.(1)有机物 (2)39.5%
8.(1)O2(2)分解(3)化学性质
9.(1)CO和空气混合,加热可能会发生爆炸(2)收集CO,防止污染空气
10.(1)H2;FeSO4;Cu (2)3Fe+2O2 点燃 Fe3O4 (3)Fe+H2SO4=FeSO4+H2↑
11.(1)B (2)熔点低 (3)a.Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑;b.锌、铜.
12.Ag;Cu2+、Zn2+、NO3﹣;Ag、Cu、Zn。
13.(1)Hg
(2)铝丝上附着红色固体,溶液蓝色变浅;2Al+3CuSO4=3Cu+Al2(SO4)3
(3)Cu(NO3)2、Zn(NO3)2
14.(1)Cu+2AgNO3=Cu(NO3)2+2Ag (2)Fe(NO3)2、NaNO3
15.(1)B (2)熔点低 (3)a.Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑;b.锌、铜.
《物质转化与材料利用》填空训练(7)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
