四川省德阳市第五高级中学2022-2023学年高二上学期9月开学考试化学试题(PDF版含答案)
文档属性
| 名称 | 四川省德阳市第五高级中学2022-2023学年高二上学期9月开学考试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-28 21:57:15 | ||
图片预览



文档简介
德阳五中高 2021 级 2022 年秋期入学考试
化学试卷
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 100 分,考试时间 90 分钟。
2.答卷前,考生务必将自己的姓名、考号填写在答题卡上。答卷时,考生务必将答案 涂写
在答题卷上,答在试卷上的无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16
第Ⅰ卷(选择题,共 42 分)
注意事项:
1.本题共 14 小题,每题 3分,共 42分。
2.每小题均只有一个正确答案,请用 2B 铅笔将答题卡上对应题目的正确答案标号涂黑。
一、单项选择题(共 14 题, 42 分)
1.(假期作业题)化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A.氯气作水的杀菌消毒剂 B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂 D.肥皂水作蚊虫叮咬处的清洗剂
2.(假期作业题)下列化学用语错误的是
A.乙醇的分子式:C2H6O B.羟基的结构简式:OH
C.CH4的比例模型: D.Cl 的原子结构示意图:
3.下列化合物中,既有离子键又有非极性共价键的是
A.Ba(OH)2 B.CaCl2 C.NH4Cl D.Na2O2
4.(假期作业题)某种药物主要成分 X的分子结构如图所示,关于有机物 X的说法中,错
误的是
A.X水解可生成乙醇
B.X不能跟溴水反应
C.X能发生加成反应
D.X难溶于水,易溶于有机溶剂
5.(假期作业题)W、X、Y、Z是互不同族且原子序数依次增大的短周期主族元素,其中 X、
Y为两种金属元素,W与 X、Y与 Z这两对原子的最外层电子数之和均为 9。下列说法错误
的是
A.W的最高价氧化物的水化物的酸性比 Z的强
B.X的单质在空气中燃烧,至少得到三种产物
1
C.W、Z形成的简单氢化物沸点:W>Z
D.W与 Y —形成的常见化合物中各原子最外层电子数均满足 8e 结构
6.下列说法正确的是
A. 与 为同一种物质
B.H2、D2、T2互为同分异构体
C.CH3Cl和 ClCH2CH2Cl互为同系物
D.16O2 和 18O2 互为同位素
7.(假期作业题)固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固
-
体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2 )在其间通过。该电池
的工作原理如下图所示,其中多孔电极 a、b均不参与电极反应。下列判断正确的是
A.由 O2放电的 a极为电池的负极
B.O2-移向电池的正极
C.b极对应的电极反应为
2H - -2-4e +2O2 ===2H2O
D.O2在 a极发生氧化反应
8.由实验操作和现象,可得出相应正确结论的是
实验操作 现象 结论
向 NaBr溶液中滴加过量氯水,
A 先变橙色,后变蓝色 氧化性:Cl2>Br2>I2
再加入淀粉 KI溶液
向蔗糖溶液中滴加稀硫酸,水浴
B 加热,加入新制的 Cu(OH)2悬浊 无砖红色沉淀 蔗糖未发生水解
液
加热试管中的聚氯乙烯薄膜碎 试管口润湿的蓝色石蕊
C 氯乙烯加聚是可逆反应
片 试纸变红
石蜡油加强热,将产生的气体通
D 溶液红棕色变无色 气体中含有不饱和烃
入 Br2的 CCl4溶液
2
9.某实验小组用 50 mL 0.50 mol L 1盐酸与 50 mL 0.55 mol L 1NaOH溶液在如图所示的装
置中进行中和反应。下列说法错误的是
A.烧杯间填满碎泡沫塑料的作用是减少热量散失
B.大烧杯上如不盖硬纸板,求得的中和热数值偏小
C.实验中改用 60 mL 0.50 mol L 1盐酸与 50 mL 0.55 mol L 1NaOH溶液
进行反应,与上述实验相比,所放出的热量不相等,所求中和热也不相等
D.用相同浓度和体积的氨水代替 NaOH溶液进行上述实验,测得中和热的数值会偏小
10.某温度下,在容积一定的密闭容器中进行如下反应 2X(g)+Y(s) Z(g) ΔH>0。下列叙述
正确的是( )
A.向容器中充入氩气,压强增大,反应速率不变
B.加入少量 Y,反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的容积扩大,化学反应速率增大
11.NA为阿伏伽德罗常数的值。下列说法错误的是
A.19g18OH-中,质子数、中子数和电子数分别是 9NA、10NA、10NA
B.100g质量分数 46%的乙醇溶液含有 O—H的数目是 7NA
C.11g乙醛和环氧乙烷中 H原子的数目是 NA
D.100g质量分数 12%的乙酸溶液中 H+的数目是 0.2NA
12.下列说法正确的是( )
A.甲烷燃烧热为 890.3 kJ mol-1,则甲烷燃烧的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=+890.3 kJ molˉ1
B.若 H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ molˉ1,则稀硫酸与稀 Ba(OH)2反应的
热化学方程式为 H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O (l) △H=-114.6kJ molˉ1
C.已知 2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D.500℃、30 MPa下,将 0.5 mol N2和 1.5 mol H2置于密闭的容器中充分反应生成NH3(g),
放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6 kJ·mol-1
13.已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-24.8kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47.19kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=640.4kJ·mol-1
3
则 14gCO气体还原足量 FeO固体得到 Fe单质和 CO2气体时对应的ΔH 约为
A.-218kJ·mol-1 B.-109kJ·mol-1 C.109kJ·mol-1 D.218kJ·mol-1
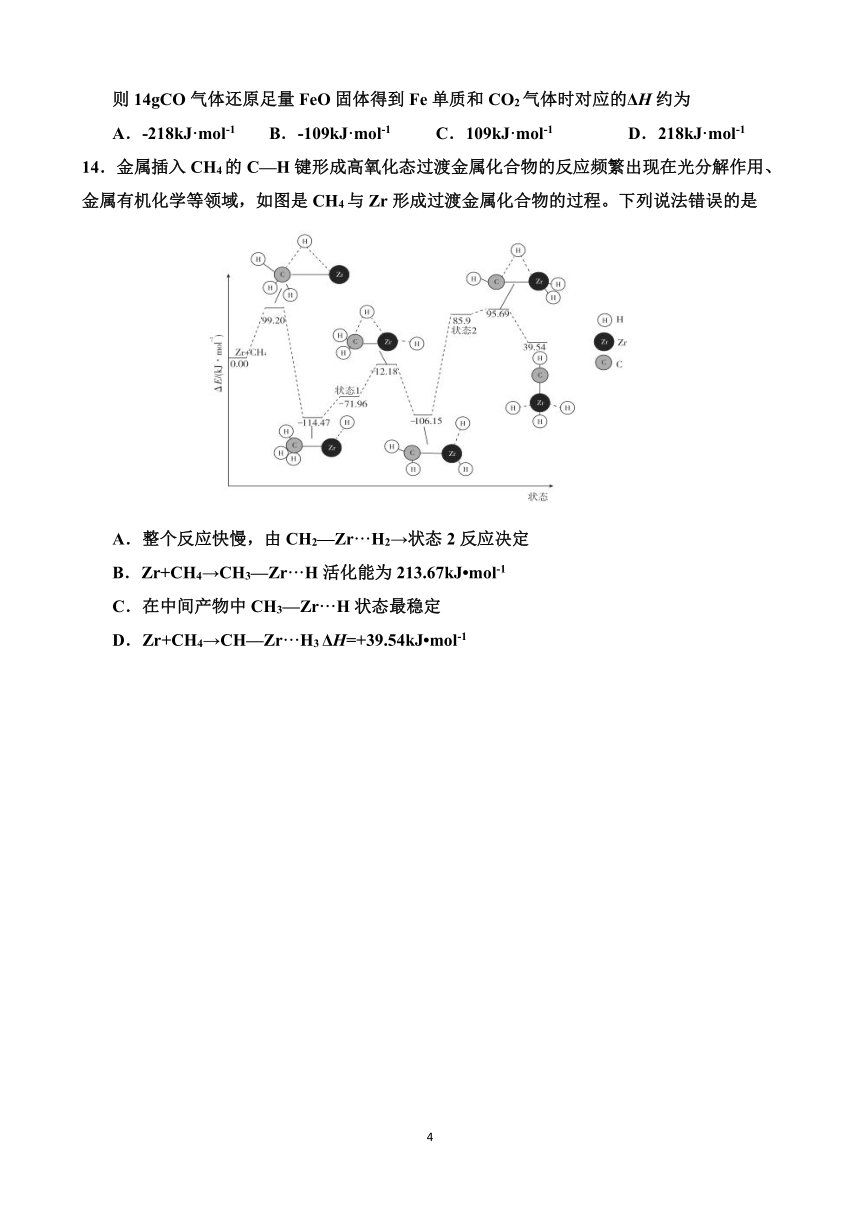
14.金属插入 CH4的 C—H键形成高氧化态过渡金属化合物的反应频繁出现在光分解作用、
金属有机化学等领域,如图是 CH4与 Zr形成过渡金属化合物的过程。下列说法错误的是
A.整个反应快慢,由 CH2—Zr···H2→状态 2反应决定
B.Zr+CH4→CH3—Zr···H活化能为 213.67kJ mol-1
C.在中间产物中 CH3—Zr···H状态最稳定
D.Zr+CH4→CH—Zr···H3ΔH=+39.54kJ mol-1
4
第 II 卷(非选择题,共 58 分)
注意事项:
主观题答案请用 0.5 毫米黑色墨迹签字笔在答题卷相应的位置作答,不得超出答题区域 作
答。
二、填空题(包括 5 个题,共 58 分)
15.(10分)下图为元素周期表的一部分,8种元素的位置如图所示,试回答下列问题:
(1)元素⑧在周期表中的位置是_____________,其最高价氧化物的水化物化学式为________。
(2)元素④⑤⑥简单离子半径从小到大的顺序为_______(用离子符号表示)。
(3)8种元素中,简单氢化物最稳定的是_______(填化学式,下同),最高价氧化物对应水化物
的酸性最强的是_______,最高价氧化物对应水化物的碱性最强的是_______。
(4)元素①和④可以按原子个数比 1:1形成一种离子化合物M,M的电子式子为___________。
M是一种良好的储氢材料,遇水后放出氢气并生成一种碱。写出M与水反应的化学方程式:
____ _____________________________________。若 NA表示阿伏伽德罗常数,则该反应每生
成标况下的氢气 11.2L,转移电子数目为_______。
16.(12分)乙烯是来自石油的重要的化工原料,乙烯的产量通常用来衡量一个国家的石油
化工发展水平。
完成下列填空:
(1)反应①产物的官能团名称是________________。
(2)反应③、⑤的反应类型分别为_________________、________________。
(3)反应②的反应方程式为________________________________________________。
5
(4)反应④得到的产物聚乙烯用来制造塑料,其单体是乙烯,而乙烯的碳原子最少的同系物也
可以通过聚合反应得高聚物,也可以用来制塑料,该有机物结构简式是________________,
其聚合反应方程式是__________________________________________________________。
(5)石油通过分馏、裂化都可以得到 C4H10,其中 属于物理变化(选填“分馏”、“裂
化”),C4H10的一氯取代产物有_______种,下列有机物二氯取代产物有三种的是_______。
A. B. (立方烷) C.
17.(12分)Ⅰ.已知断裂几种化学键要吸收的能量如下:
化学键 H-H H-I I-I
断裂 1mol 键吸收的能量/kJ 436.0 298.7 152.7
(1)1molHI(g)分解得 I2(g)、H2(g)时,_______(填“吸收”或“放出”)约_______kJ 热量。
Ⅱ.某密闭恒压容器中,某气相化学反应 2HI g I2 g H2 g 在 4 种不同条件下进行,I2(g)、
H2(g)起始浓度为 0,反应物 HI 的浓度(mol/L)随反应时间(min)的变化情况如下表:
时间
实验序号 浓度 0 10 20 30 40 50 60
温度
1 800℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800℃ 1.0 0.60 0.50 0.50 0.50 0.50 0.50
3 800℃ 1.2 0.92 0.75 0.63 0.60 0.60 0.60
4 820℃ 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空:
(2)在实验 1,反应在 10至 40分钟时间内,H2的平均反应速率为_______________。
(3)设实验 1的反应速率为 v1,实验 2的反应速率为 v2,则 v2_______ v1 (“>”“=”“<”),并推
测实验 2隐含的条件可能是_________________________,并计算实验 2,反应在 0至 20分
钟内,反应物 HI转化率为___________________________。
(4)结合上述 4种不同条件的数据,最终颜色最深的实验是:___________(填实验序号)。
6
(5)下列叙述能说明上述反应一定达到化学平衡状态的是_______________。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体颜色不随时间的变化而变化
C.单位时间内每消耗 1mol的 H2,同时生成 1mol的 I2(g)
D.混合气体的密度不随时间的变化而变化
E.混合气体的平均摩尔质量不随时间的变化而变化
F. c(H2):c(I2):c(HI)=1:1:2
Ⅲ.燃料电池是一种高效、环境友好的供电装置,如图为CH3OH燃料电池的工作原理示意图,
a、b均为惰性电极。
(6)该电池放电时 a极的电极反应为:___________________________________________。
18.(11分)碘化钾可用于有机合成、制药等,它是一种白色立方晶体或粉末,易溶于水。
实验室制备 KI的实验装置如下。
已知:I.N2H4是非电解质,沸点为 113.5°C,具有强还原性,其氧化产物为 N2。
II.装置 B是单向阀,作用是使装置 A中生成的 NH3进入装置 C,而装置 C中生成的 N2H4
不会进入装置 A。
回答下列问题:
(1)装置 A中生成 NH3的化学反应方程式为___________________________________。
(2)盛放 NaClO溶液的仪器名称是___________。
(3)实验时,装置 A处的大试管与装置 C处的三颈烧瓶均需加热,应先加热装置_________处
(填“A”或“C")。
(4)装置 C中 NaClO溶液不能加入过多,其原因是_______________________________。
7
(5)装置 E中 KOH、I2与 N2H4发生反应生成 KI,反应的离子方程式为
___________________________________________________________。
(6)反应过程中需用热源间歇性微热 D处连接管,目的是_______________________________。
(7)装置 F中稀硫酸的作用是_________________。
19.(13分) 用软锰矿(主要成分为MnO2,含少量 Fe3O4、Al2O3)和 BaS制备高纯MnCO3
的工艺流程如下:
已知:MnO2是一种两性氧化物;25℃时金属阳离子开始沉淀和完全沉淀时溶液的 pH如下
表。
物质 Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2
开始沉淀 7.6 2.7 3.2 8.3
完全沉淀 9.6* 3.7 4.9 9.8
*Fe(OH)2沉淀呈絮状,不易从溶液中过滤除去。回答下列问题:
(1)软锰矿预先粉碎的目的是_____________________________________________,MnO2
与 BaS溶液反应转化为MnO的化学方程式为_______________________________________。
(2)滤液Ⅰ可循环使用,应当将其导入到_______操作中(填操作单元的名称)。
(3)保持 BaS投料量不变,随MnO2与 BaS投料比增大,S的量达到最大值后无明显变化,
而 Ba(OH)2的量达到最大值后会减小,减小的原因是__________________________________。
(4)净化时需先加入的试剂 X为_____________(填化学式)。再使用氨水调溶液的 pH,则
pH的理论最小值为___________________。
(5)碳化过程中发生反应的离子方程式为___________________________________________。
8
德阳五中高 2021 级 2022 年秋期入学考试
化学试卷参考答案
一、选择题(1-12 每小题 2 分,13-18 每小题 3 分,共 42 分)
1 2 3 4 5 6 7
B B D A A A C
8 9 10 11 12 13 14
D C A D C B B
二、非选择题
15.(10 分,除标注外其余 1 分/空)
(1) 第四周期ⅣA 族 H2SeO4 (2) Al3+HCl O4 KOH (4) NaH+H2O=NaOH+H2 - 0.5NA (2 分)
16(12 分,除标注外其余 1 分/空)
【答案】(1)羟基 (2) 取代反应 加成反应
Cu
(3) 2CH3CH2OH+O 2 Δ 2CH3CHO+2H2O(2 分)
(4) CH CH=CH nCH CH=CH 催化剂3 2 3 2 (2 分)(5) 分馏 4 BC(2 分)
17.(12 分,除标注外其余 1 分/空)
【答案】(1) 吸收 4.35 (2) 0.005mol×L-1 ×min -1 (3) > 使用了催化剂或压缩体积(只需答一个)
50%(2 分) (4) 4 (5)BC (2 分) (6) CH3OH-6e
- +8OH- =CO2-3 +6H2O(2 分)
18.(11 分,除标注外其余 2 分/空)
Δ
【答案】(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O (2)分液漏斗 (1 分) (3)A (1 分)
(4) 过量的 ClO-会将生成的 N2H4氧化 (1 分) (5)N - -2H4+2I2+4OH =4I +N2↑+4H2O
(5) 防止 N2H4冷凝 (7)吸收多余的尾气,防止污染环境
19.(13 分,除标注外其余 2 分/空)
(1) 增大接触面积,充分反应,提高反应速率 (1 分)
MnO2+BaS+H2O=Ba(OH)2+MnO+S
(2)蒸发 (3)过量的 MnO2消耗了产生的 Ba(OH)2 (4) H2O2 4.9
(5)Mn2++ HCO-3 +NH ·H O=MnCO ↓+NH +3 2 3 4 +H2O
化学试卷
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 100 分,考试时间 90 分钟。
2.答卷前,考生务必将自己的姓名、考号填写在答题卡上。答卷时,考生务必将答案 涂写
在答题卷上,答在试卷上的无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16
第Ⅰ卷(选择题,共 42 分)
注意事项:
1.本题共 14 小题,每题 3分,共 42分。
2.每小题均只有一个正确答案,请用 2B 铅笔将答题卡上对应题目的正确答案标号涂黑。
一、单项选择题(共 14 题, 42 分)
1.(假期作业题)化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A.氯气作水的杀菌消毒剂 B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂 D.肥皂水作蚊虫叮咬处的清洗剂
2.(假期作业题)下列化学用语错误的是
A.乙醇的分子式:C2H6O B.羟基的结构简式:OH
C.CH4的比例模型: D.Cl 的原子结构示意图:
3.下列化合物中,既有离子键又有非极性共价键的是
A.Ba(OH)2 B.CaCl2 C.NH4Cl D.Na2O2
4.(假期作业题)某种药物主要成分 X的分子结构如图所示,关于有机物 X的说法中,错
误的是
A.X水解可生成乙醇
B.X不能跟溴水反应
C.X能发生加成反应
D.X难溶于水,易溶于有机溶剂
5.(假期作业题)W、X、Y、Z是互不同族且原子序数依次增大的短周期主族元素,其中 X、
Y为两种金属元素,W与 X、Y与 Z这两对原子的最外层电子数之和均为 9。下列说法错误
的是
A.W的最高价氧化物的水化物的酸性比 Z的强
B.X的单质在空气中燃烧,至少得到三种产物
1
C.W、Z形成的简单氢化物沸点:W>Z
D.W与 Y —形成的常见化合物中各原子最外层电子数均满足 8e 结构
6.下列说法正确的是
A. 与 为同一种物质
B.H2、D2、T2互为同分异构体
C.CH3Cl和 ClCH2CH2Cl互为同系物
D.16O2 和 18O2 互为同位素
7.(假期作业题)固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固
-
体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2 )在其间通过。该电池
的工作原理如下图所示,其中多孔电极 a、b均不参与电极反应。下列判断正确的是
A.由 O2放电的 a极为电池的负极
B.O2-移向电池的正极
C.b极对应的电极反应为
2H - -2-4e +2O2 ===2H2O
D.O2在 a极发生氧化反应
8.由实验操作和现象,可得出相应正确结论的是
实验操作 现象 结论
向 NaBr溶液中滴加过量氯水,
A 先变橙色,后变蓝色 氧化性:Cl2>Br2>I2
再加入淀粉 KI溶液
向蔗糖溶液中滴加稀硫酸,水浴
B 加热,加入新制的 Cu(OH)2悬浊 无砖红色沉淀 蔗糖未发生水解
液
加热试管中的聚氯乙烯薄膜碎 试管口润湿的蓝色石蕊
C 氯乙烯加聚是可逆反应
片 试纸变红
石蜡油加强热,将产生的气体通
D 溶液红棕色变无色 气体中含有不饱和烃
入 Br2的 CCl4溶液
2
9.某实验小组用 50 mL 0.50 mol L 1盐酸与 50 mL 0.55 mol L 1NaOH溶液在如图所示的装
置中进行中和反应。下列说法错误的是
A.烧杯间填满碎泡沫塑料的作用是减少热量散失
B.大烧杯上如不盖硬纸板,求得的中和热数值偏小
C.实验中改用 60 mL 0.50 mol L 1盐酸与 50 mL 0.55 mol L 1NaOH溶液
进行反应,与上述实验相比,所放出的热量不相等,所求中和热也不相等
D.用相同浓度和体积的氨水代替 NaOH溶液进行上述实验,测得中和热的数值会偏小
10.某温度下,在容积一定的密闭容器中进行如下反应 2X(g)+Y(s) Z(g) ΔH>0。下列叙述
正确的是( )
A.向容器中充入氩气,压强增大,反应速率不变
B.加入少量 Y,反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的容积扩大,化学反应速率增大
11.NA为阿伏伽德罗常数的值。下列说法错误的是
A.19g18OH-中,质子数、中子数和电子数分别是 9NA、10NA、10NA
B.100g质量分数 46%的乙醇溶液含有 O—H的数目是 7NA
C.11g乙醛和环氧乙烷中 H原子的数目是 NA
D.100g质量分数 12%的乙酸溶液中 H+的数目是 0.2NA
12.下列说法正确的是( )
A.甲烷燃烧热为 890.3 kJ mol-1,则甲烷燃烧的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=+890.3 kJ molˉ1
B.若 H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ molˉ1,则稀硫酸与稀 Ba(OH)2反应的
热化学方程式为 H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O (l) △H=-114.6kJ molˉ1
C.已知 2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D.500℃、30 MPa下,将 0.5 mol N2和 1.5 mol H2置于密闭的容器中充分反应生成NH3(g),
放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6 kJ·mol-1
13.已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-24.8kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47.19kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=640.4kJ·mol-1
3
则 14gCO气体还原足量 FeO固体得到 Fe单质和 CO2气体时对应的ΔH 约为
A.-218kJ·mol-1 B.-109kJ·mol-1 C.109kJ·mol-1 D.218kJ·mol-1
14.金属插入 CH4的 C—H键形成高氧化态过渡金属化合物的反应频繁出现在光分解作用、
金属有机化学等领域,如图是 CH4与 Zr形成过渡金属化合物的过程。下列说法错误的是
A.整个反应快慢,由 CH2—Zr···H2→状态 2反应决定
B.Zr+CH4→CH3—Zr···H活化能为 213.67kJ mol-1
C.在中间产物中 CH3—Zr···H状态最稳定
D.Zr+CH4→CH—Zr···H3ΔH=+39.54kJ mol-1
4
第 II 卷(非选择题,共 58 分)
注意事项:
主观题答案请用 0.5 毫米黑色墨迹签字笔在答题卷相应的位置作答,不得超出答题区域 作
答。
二、填空题(包括 5 个题,共 58 分)
15.(10分)下图为元素周期表的一部分,8种元素的位置如图所示,试回答下列问题:
(1)元素⑧在周期表中的位置是_____________,其最高价氧化物的水化物化学式为________。
(2)元素④⑤⑥简单离子半径从小到大的顺序为_______(用离子符号表示)。
(3)8种元素中,简单氢化物最稳定的是_______(填化学式,下同),最高价氧化物对应水化物
的酸性最强的是_______,最高价氧化物对应水化物的碱性最强的是_______。
(4)元素①和④可以按原子个数比 1:1形成一种离子化合物M,M的电子式子为___________。
M是一种良好的储氢材料,遇水后放出氢气并生成一种碱。写出M与水反应的化学方程式:
____ _____________________________________。若 NA表示阿伏伽德罗常数,则该反应每生
成标况下的氢气 11.2L,转移电子数目为_______。
16.(12分)乙烯是来自石油的重要的化工原料,乙烯的产量通常用来衡量一个国家的石油
化工发展水平。
完成下列填空:
(1)反应①产物的官能团名称是________________。
(2)反应③、⑤的反应类型分别为_________________、________________。
(3)反应②的反应方程式为________________________________________________。
5
(4)反应④得到的产物聚乙烯用来制造塑料,其单体是乙烯,而乙烯的碳原子最少的同系物也
可以通过聚合反应得高聚物,也可以用来制塑料,该有机物结构简式是________________,
其聚合反应方程式是__________________________________________________________。
(5)石油通过分馏、裂化都可以得到 C4H10,其中 属于物理变化(选填“分馏”、“裂
化”),C4H10的一氯取代产物有_______种,下列有机物二氯取代产物有三种的是_______。
A. B. (立方烷) C.
17.(12分)Ⅰ.已知断裂几种化学键要吸收的能量如下:
化学键 H-H H-I I-I
断裂 1mol 键吸收的能量/kJ 436.0 298.7 152.7
(1)1molHI(g)分解得 I2(g)、H2(g)时,_______(填“吸收”或“放出”)约_______kJ 热量。
Ⅱ.某密闭恒压容器中,某气相化学反应 2HI g I2 g H2 g 在 4 种不同条件下进行,I2(g)、
H2(g)起始浓度为 0,反应物 HI 的浓度(mol/L)随反应时间(min)的变化情况如下表:
时间
实验序号 浓度 0 10 20 30 40 50 60
温度
1 800℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800℃ 1.0 0.60 0.50 0.50 0.50 0.50 0.50
3 800℃ 1.2 0.92 0.75 0.63 0.60 0.60 0.60
4 820℃ 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空:
(2)在实验 1,反应在 10至 40分钟时间内,H2的平均反应速率为_______________。
(3)设实验 1的反应速率为 v1,实验 2的反应速率为 v2,则 v2_______ v1 (“>”“=”“<”),并推
测实验 2隐含的条件可能是_________________________,并计算实验 2,反应在 0至 20分
钟内,反应物 HI转化率为___________________________。
(4)结合上述 4种不同条件的数据,最终颜色最深的实验是:___________(填实验序号)。
6
(5)下列叙述能说明上述反应一定达到化学平衡状态的是_______________。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体颜色不随时间的变化而变化
C.单位时间内每消耗 1mol的 H2,同时生成 1mol的 I2(g)
D.混合气体的密度不随时间的变化而变化
E.混合气体的平均摩尔质量不随时间的变化而变化
F. c(H2):c(I2):c(HI)=1:1:2
Ⅲ.燃料电池是一种高效、环境友好的供电装置,如图为CH3OH燃料电池的工作原理示意图,
a、b均为惰性电极。
(6)该电池放电时 a极的电极反应为:___________________________________________。
18.(11分)碘化钾可用于有机合成、制药等,它是一种白色立方晶体或粉末,易溶于水。
实验室制备 KI的实验装置如下。
已知:I.N2H4是非电解质,沸点为 113.5°C,具有强还原性,其氧化产物为 N2。
II.装置 B是单向阀,作用是使装置 A中生成的 NH3进入装置 C,而装置 C中生成的 N2H4
不会进入装置 A。
回答下列问题:
(1)装置 A中生成 NH3的化学反应方程式为___________________________________。
(2)盛放 NaClO溶液的仪器名称是___________。
(3)实验时,装置 A处的大试管与装置 C处的三颈烧瓶均需加热,应先加热装置_________处
(填“A”或“C")。
(4)装置 C中 NaClO溶液不能加入过多,其原因是_______________________________。
7
(5)装置 E中 KOH、I2与 N2H4发生反应生成 KI,反应的离子方程式为
___________________________________________________________。
(6)反应过程中需用热源间歇性微热 D处连接管,目的是_______________________________。
(7)装置 F中稀硫酸的作用是_________________。
19.(13分) 用软锰矿(主要成分为MnO2,含少量 Fe3O4、Al2O3)和 BaS制备高纯MnCO3
的工艺流程如下:
已知:MnO2是一种两性氧化物;25℃时金属阳离子开始沉淀和完全沉淀时溶液的 pH如下
表。
物质 Fe(OH)2 Fe(OH)3 Al(OH)3 Mn(OH)2
开始沉淀 7.6 2.7 3.2 8.3
完全沉淀 9.6* 3.7 4.9 9.8
*Fe(OH)2沉淀呈絮状,不易从溶液中过滤除去。回答下列问题:
(1)软锰矿预先粉碎的目的是_____________________________________________,MnO2
与 BaS溶液反应转化为MnO的化学方程式为_______________________________________。
(2)滤液Ⅰ可循环使用,应当将其导入到_______操作中(填操作单元的名称)。
(3)保持 BaS投料量不变,随MnO2与 BaS投料比增大,S的量达到最大值后无明显变化,
而 Ba(OH)2的量达到最大值后会减小,减小的原因是__________________________________。
(4)净化时需先加入的试剂 X为_____________(填化学式)。再使用氨水调溶液的 pH,则
pH的理论最小值为___________________。
(5)碳化过程中发生反应的离子方程式为___________________________________________。
8
德阳五中高 2021 级 2022 年秋期入学考试
化学试卷参考答案
一、选择题(1-12 每小题 2 分,13-18 每小题 3 分,共 42 分)
1 2 3 4 5 6 7
B B D A A A C
8 9 10 11 12 13 14
D C A D C B B
二、非选择题
15.(10 分,除标注外其余 1 分/空)
(1) 第四周期ⅣA 族 H2SeO4 (2) Al3+
16(12 分,除标注外其余 1 分/空)
【答案】(1)羟基 (2) 取代反应 加成反应
Cu
(3) 2CH3CH2OH+O 2 Δ 2CH3CHO+2H2O(2 分)
(4) CH CH=CH nCH CH=CH 催化剂3 2 3 2 (2 分)(5) 分馏 4 BC(2 分)
17.(12 分,除标注外其余 1 分/空)
【答案】(1) 吸收 4.35 (2) 0.005mol×L-1 ×min -1 (3) > 使用了催化剂或压缩体积(只需答一个)
50%(2 分) (4) 4 (5)BC (2 分) (6) CH3OH-6e
- +8OH- =CO2-3 +6H2O(2 分)
18.(11 分,除标注外其余 2 分/空)
Δ
【答案】(1)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O (2)分液漏斗 (1 分) (3)A (1 分)
(4) 过量的 ClO-会将生成的 N2H4氧化 (1 分) (5)N - -2H4+2I2+4OH =4I +N2↑+4H2O
(5) 防止 N2H4冷凝 (7)吸收多余的尾气,防止污染环境
19.(13 分,除标注外其余 2 分/空)
(1) 增大接触面积,充分反应,提高反应速率 (1 分)
MnO2+BaS+H2O=Ba(OH)2+MnO+S
(2)蒸发 (3)过量的 MnO2消耗了产生的 Ba(OH)2 (4) H2O2 4.9
(5)Mn2++ HCO-3 +NH ·H O=MnCO ↓+NH +3 2 3 4 +H2O
同课章节目录
