鲁科版(2019)高一化学选择性必修1 2.2.2反应条件对化学平衡的影响 课件(共109张PPT)
文档属性
| 名称 | 鲁科版(2019)高一化学选择性必修1 2.2.2反应条件对化学平衡的影响 课件(共109张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 47.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 09:42:01 | ||
图片预览









文档简介
(共109张PPT)
第2节 化学反应的限度
第2课时 反应条件对化学平衡的影响
第2章 化学反应的方向、限度与速率
[素养发展目标]
1.通过实验探究,了解外界条件对化学平衡的影响,形成变化观念的学科核心素养。
2.理解勒·夏特列原理的内容并学会应用,体验科学态度与社会责任的学科核心素养。
01
知识点一
知识点一 温度、浓度对化学平衡的影响
1.化学平衡移动
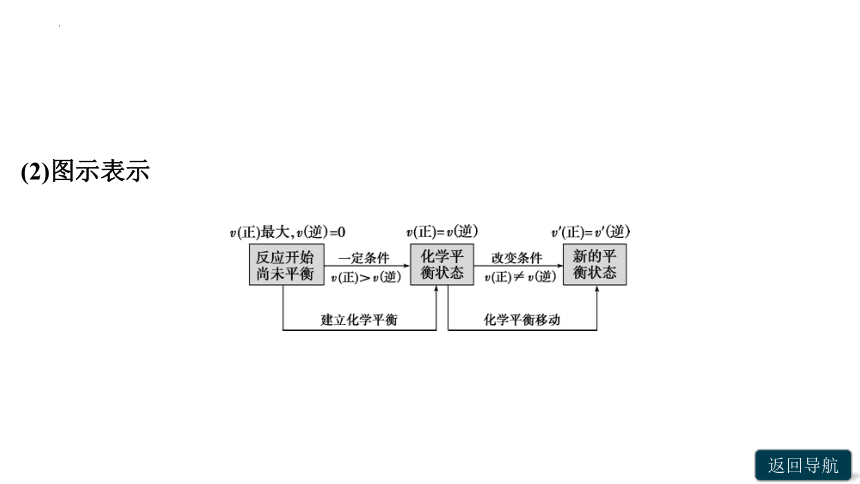
(1)内容:受温度、压强或浓度变化的影响,化学反应由一种__________变为另一种__________的过程。
平衡状态
平衡状态
(2)图示表示
2.平衡移动方向的判断
(1)根据速率判断
①若v(正)____v(逆),平衡正向移动。
②若v(正)____v(逆),平衡不移动。
③若v(正)____v(逆),平衡逆向移动。
(2)根据结果判断
对于一个已达到化学平衡状态的反应,如平衡移动的结果使反应产物浓度变大,则称平衡__________;反之,称平衡__________。
>
=
<
正向移动
逆向移动
3.实验探究:温度对化学平衡的影响
(1)实验方案
实验 原理 2NO2(g) N2O4(g) ΔH=-57.2 kJ·mol-1
红棕色 无色
实验 步骤
实验 现象 浸入热水中的容器里的混合气体颜色加深;浸入冷水中的容器里的混合气体颜色变浅
实验 结论 混合气体受热颜色加深,说明NO2浓度增大,即平衡向吸热方向移动;混合气体被冷却时颜色变浅,说明NO2浓度减小,即平衡向放热方向移动
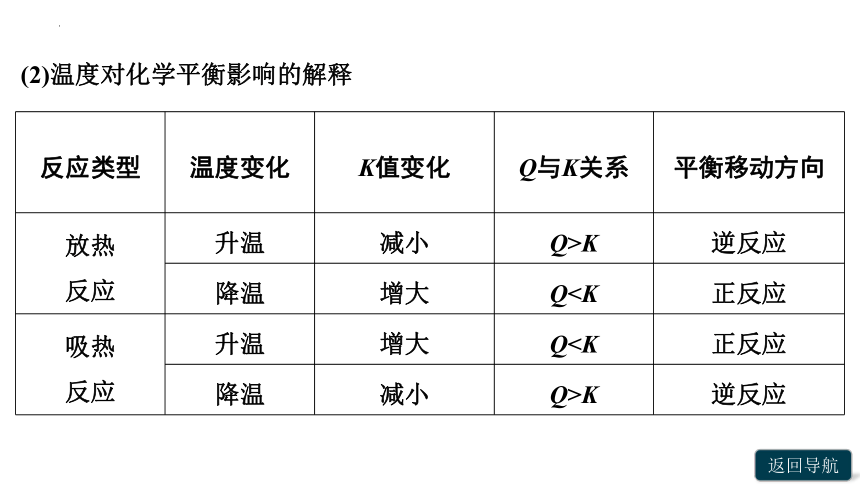
(2)温度对化学平衡影响的解释
反应类型 温度变化 K值变化 Q与K关系 平衡移动方向
放热 反应 升温 减小 Q>K 逆反应
降温 增大 Q吸热 反应 升温 增大 Q降温 减小 Q>K 逆反应
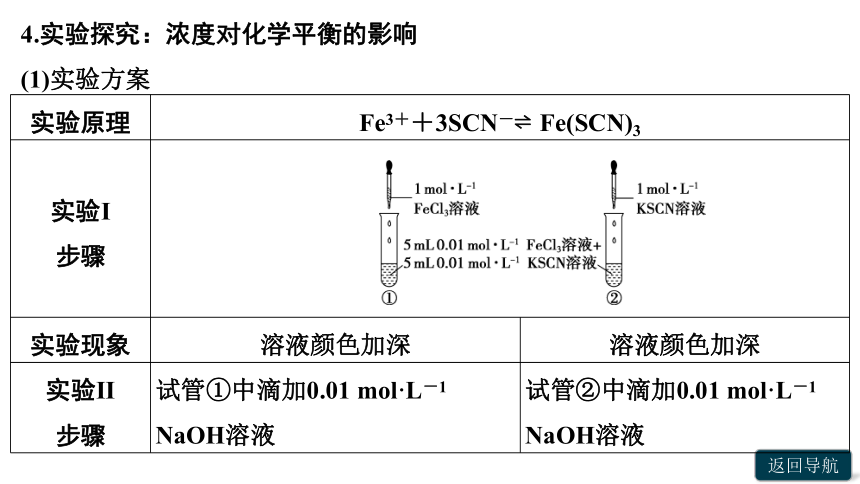
4.实验探究:浓度对化学平衡的影响
(1)实验方案
实验原理 Fe3++3SCN- Fe(SCN)3 实验Ⅰ 步骤 实验现象 溶液颜色加深 溶液颜色加深
实验Ⅱ 步骤 试管①中滴加0.01 mol·L-1 NaOH溶液 试管②中滴加0.01 mol·L-1 NaOH溶液
实验现象 溶液颜色变浅 溶液颜色变浅
实验结论 增大c(Fe3+)或c(SCN-)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动;滴加NaOH溶液,由于3OH-+Fe3+===Fe(OH)3↓,使Fe3+的浓度减小,Fe(SCN)3的浓度减小,即化学平衡向逆反应方向移动 (2)浓度对化学平衡影响的解释
浓度变化 Q值变化 Q与K关系 平衡移动方向
增大反应物浓度 减小 Q减小反应产物浓度 减小反应物浓度 增大 Q>K 逆反应
增大反应产物浓度 5.Q和K的相对大小与平衡移动的关系示意图
1.化学平衡发生移动,化学反应速率一定改变吗?化学反应速率改变,化学平衡一定移动吗?
提示:化学平衡发生移动,化学反应速率一定改变,因为正、逆反应速率不相等,是化学平衡移动的根本原因;化学反应速率改变,化学平衡不一定移动,如在催化剂作用下,正、逆反应速率改变相同的倍数,仍然相等,但平衡不移动。
2.“任意可逆反应的化学平衡,都会受温度的影响而发生移动”,你认为这种说法对吗?你是如何理解的?
提示:任何反应都具有一定的热效应,不是吸热反应就是放热反应,故温度改变,对吸热反应速率和放热反应速率的影响程度不同,正、逆反应速率不再相等,故平衡会发生移动。
3.在人体利用氧气的过程中,血红蛋白与氧气的结合过程涉及化学平衡的移动。人体中的血红蛋白分子(Hb)与氧气分子结合,形成氧合血红蛋白分子——Hb(O2),即Hb+O2 Hb(O2)。
煤气中的一氧化碳分子也能与血红蛋白分子结合,即Hb+CO Hb(CO)。一氧化碳分子与血红蛋白分子结合的能力比氧气分子强,大约是氧气分子与血红蛋白分子结合能力的200倍。
(1)当空气中一氧化碳的浓度增大时,会造成人体缺氧,严重时导致死亡。试解释原因。
提示:一氧化碳分子与血红蛋白分子结合的能力比氧气分子强,则其浓度增大时,Q(2)如果发现有人一氧化碳中毒,应马上切断一氧化碳源并将中毒者移至空气流通处,必要时应将其放入高压氧舱中施救。试解释原因。
提示:增大氧气的浓度,此时一氧化碳浓度低于平衡浓度(Q>K),一氧化碳分子结合Hb反应的化学平衡左移,Hb(CO)分解,而此时氧气的浓度大于平衡浓度(Q1.(2022·南京高二测试)在新制的氯水中存在平衡:Cl2+H2O H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.H+浓度减小,HClO浓度减小
B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大
D.H+浓度增大,HClO浓度减小
√
解析:碳酸的酸性弱于盐酸而强于次氯酸,向氯水中投入少量碳酸钙粉末后,碳酸钙与盐酸反应,而不与次氯酸反应。又由于H+浓度减小,平衡Cl2+H2O H++Cl-+HClO向正反应方向移动,故HClO浓度增大。
2.(双选)当反应COCl2(g) CO(g)+Cl2(g) ΔH>0达到平衡时,下列措施中能提高COCl2转化率的是( )
A.升高温度 B.降低温度
C.增大CO的浓度 D.减小Cl2的浓度
解析:COCl2(g) CO(g)+Cl2(g) ΔH>0,正反应为吸热反应,升高温度,平衡正向移动,COCl2转化率增大;降低温度,平衡逆向移动,COCl2转化率减小;增大反应产物(CO)的浓度,平衡逆向移动,COCl2转化率减小;减小反应产物(Cl2)的浓度,平衡正向移动,COCl2转化率增大。
√
√
3.对于达到化学平衡的反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,回答下列问题:
(1)升高温度,K________(填“增大”或“减小”),平衡向________(填“正反应方向”或“逆反应方向”)移动;降低温度,SO2的转化率________(填“增大”“减小”或“不变”)。
答案:减小 逆反应方向 增大
(2)增大c(O2),平衡向________(填“正反应方向”或“逆反应方向”,下同)移动,减小c(SO3),平衡向______移动,SO2的转化率均________(填“增大”“减小”或“不变”)。
答案:正反应方向 正反应方向 增大
02
知识点二
知识点二 压强对化学平衡的影响 勒·夏特列原理
1.压强对化学平衡的影响
对于Δvg=0的反应,改变压强,Q____K,化学平衡状态______;对于Δvg≠0的反应,增大压强,化学平衡向化学方程式中气态物质化学式前系数______的方向移动,减小压强,化学平衡向化学方程式中气态物质化学式前系数______的方向移动。
=
不变
减小
增大
对于只涉及固体或液体的反应,压强对平衡体系的影响极其微弱,可以不予考虑。
2.平衡移动原理(勒·夏特列原理)
(1)内容:如果改变平衡体系的一个条件(如温度、浓度或压强),平衡将向______这个改变的方向移动。
(2)解释:增大反应体系中反应物的浓度,平衡向____________的方向移动;增大平衡体系的压强,平衡向____________________的方向移动;升高温度,平衡向__________移动;等等。
减弱
消耗反应物
气态物质分子数减小
吸热方向
(3)注意事项:①勒·夏特列原理仅适用于已达到平衡的反应体系,不可逆过程或未达到平衡的可逆过程均不能使用该原理。此外,勒·夏特列原理对所有的动态平衡(如后面将要学到的溶解平衡、电离平衡和水解平衡等)都适用。
②勒·夏特列原理中的“减弱”不等于“消除”,更不是“扭转”,即平衡移动不能将外界影响完全消除,而只能减弱。如平衡体系的压强为p,若其他条件不变,将体系的压强增大到2p,平衡将向气态物质分子数减小的方向移动,达到新平衡时体系的压强介于p~2p。
通过NO2与N2O4相互转化时的颜色变化,探究压强对Δvg≠0的反应化学平衡的影响。
[实验原理]
2NO2(g)(红棕色) N2O4(g)(无色)
[实验操作]
用50 mL注射器吸入20 mL NO2和N2O4的混合气体,使注射器的活塞位于Ⅰ处,将细管端用橡胶塞封闭。然后把活塞拉到Ⅱ处,观察管内混合气体颜色的变化。当反复将活塞从Ⅱ处推到Ⅰ处及从Ⅰ处拉到Ⅱ处时,观察管内混合气体颜色的变化。
实验操作 体系压强增大 体系压强减小
实验现象 (1)______________________________________________________________________ (2)___________________________________________________ ___________________________
现象解释 (3)______________________________________________ ________________________ (4)______________________________________________________________________________
[实验现象]
提示:(1)混合气体的颜色先变深后逐渐变浅
(2)混合气体的颜色先变浅后逐渐变深
(3)开始由于体积变小,混合气体的浓度增大,颜色加深;之后由于压强增大,平衡向正反应方向移动,c(NO2)减小,混合气体颜色变浅
(4)开始由于体积增大,混合气体的浓度减小,颜色变浅;之后由于压强减小,平衡向逆反应方向移动,c(NO2)增大,混合气体颜色变深
(1)对于无气体参与的化学反应,由于改变压强不能改变化学反应速率,所以改变压强不能使无气体存在的化学平衡发生移动。
(2)分析压强对化学平衡的影响时,要特别注意是恒容容器还是恒压容器。
①恒温恒容时
原平衡体系体系总压强增大,但体系中各组分的浓度不变―→平衡不移动
②恒温恒压时
说明:此处无关气体指不参与反应的气体。
1.反应C2H6(g) C2H4(g)+H2(g) ΔH>0在一定条件下于密闭容器中达到平衡,下列各项措施中,不能提高乙烷的平衡转化率的是( )
A.增大容器容积 B.升高反应温度
C.分离出部分氢气 D.等容下通入惰性气体
解析:增大容器容积相当于减小压强,平衡正向移动,乙烷的平衡转化率增大;该反应为吸热反应,升高温度,平衡正向移动,乙烷的平衡转化率增大;分离出部分氢气,平衡正向移动,乙烷的平衡转化率增大;等容下通入惰性气体,原平衡体系中各物质的浓度不变,平衡不移动,乙烷的平衡转化率不变。
√
√
解析:两种气体的变化情况不一样,对于Br2(g)只是物理变化,浓度自然减半,颜色变浅;对于NO2(g)是一个平衡移动的过程:2NO2(g) N2O4(g),相当于压强减小,物理变化使之颜色变浅,浓度自然减半,但随之平衡又向生成NO2的方向移动,颜色要稍微加深一些,尽管与拉动活塞之前相比颜色要浅,但是比Br2(g)的深。
3.下列事实,不能用勒·夏特列原理解释的是( )
A.反应CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
B.合成氨的反应N2(g)+3H2(g) 2NH3(g) ΔH<0,为提高NH3的产率,理论上应采取相对较低的温度
C.溴水中存在平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D.对2HI(g) H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
√
解析:选项A的正反应为放热反应,升高温度使平衡向逆反应方向移动;选项B合成氨的反应是放热反应,理论上采取低温有利于平衡向正反应方向移动;选项C中加入AgNO3溶液后,Ag+与Br-反应生成AgBr沉淀,降低了Br-的浓度,平衡向正反应方向移动,溶液颜色变浅;选项D因反应前后气态物质分子数相等,压缩体积,压强增大,平衡不发生移动,但由于体积减小,各组分的浓度增大,故颜色变深。综上所述,只要平衡移动的结果与实际相符,都符合勒·夏特列原理。
03
知识点三
知识点三 化学平衡图像的分析与应用
1.化学平衡图像读图方法——抓“五看”
一看轴——横坐标、纵坐标代表的量。
二看线——线的斜率大小、平与陡的含义。
三看点——起点、终点、转折点、交叉点等。
四看辅助线——等温线、等压线、平衡线等。
五看量——浓度、温度等因素的改变量。
2.化学平衡图像的类型及解题原则
(1)百分含量(或转化率)-时间-温度(或压强)图像
①图像展示
②解题原则——“先拐先平数值大”
在化学平衡图像中,先出现拐点的反应则先达到平衡状态,先出现拐点的曲线表示的反应温度较高(如图Ⅰ中T2>T1)、压强较大(如图Ⅱ中p2>p1)或使用了催化剂(如图Ⅲ中a使用了催化剂)。
Ⅰ.表示T2>T1,升高温度,反应产物的百分含量降低,说明正反应是放热反应,温度升高,平衡逆向移动。
Ⅱ.表示p2>p1,增大压强,A的转化率减小,说明正反应是气态物质分子数增大的反应,增大压强,平衡逆向移动。
Ⅲ.反应产物C的百分含量不变,说明平衡不发生移动,但反应速率:a>b,故a使用了催化剂;也可能该反应是反应前后气态物质分子数不变的可逆反应,a增大了压强(压缩体积)。
(2)百分含量-压强-温度图像
①图像展示
②解题原则——“定一议二”
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量,分析方法是确定其中一个变量,讨论另外两个变量之间的关系。如图Ⅰ中确定压强为105 Pa或107 Pa,则反应产物C的百分含量随温度T的升高而逐渐减小,说明正反应是放热反应;再确定温度T不变,作横坐标轴的垂线,与压强线出现两个交点,分析反应产物C的百分含量随压强p的变化可以发现,压强增大,反应产物C的百分含量增大,说明正反应是气态物质分子数减小的反应。
1.密闭容器中进行的可逆反应aA(g)+bB(g) cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是( )
A.T1c,正反应为吸热反应
B.T1>T2,p1C.T1p2,a+bD.T1>T2,p1>p2,a+b>c,正反应为放热反应
√
解析:由(T1,p1)和(T1,p2)两条曲线可以看出:温度(T1)相同,但压强为p2时先出现“拐点”,达到平衡所需的时间短,所以p2>p1;压强较大(即压强为p2)时对应的w(B)较大,说明增大压强平衡逆向移动,则a+bT2;温度较高(即温度为T1)时对应的w(B)较小,说明升高温度平衡正向移动,故正反应为吸热反应。
2.(2022·湘潭高二检测)对于反应A(s)+2B(g) 3C(g) ΔH>0,C的百分含量φ(C)与外界条件X、Y的关系如图所示,下列结论正确的是( )
A.Y表示温度,X表示压强,且Y3>Y2>Y1
B.Y表示压强,X表示温度,且Y3>Y2>Y1
C.X表示压强,Y表示温度,且Y1>Y2>Y3
D.X表示温度,Y表示压强,且Y1>Y2>Y3
√
解析:当Y表示温度时,则Y1、Y2、Y3表示三条等温线,定住其中一条等温线(如Y1),则由于正反应是气态物质分子数增大的反应,所以随着压强的增大平衡逆向移动,φ(C)逐渐减小,符合题目所给方程式。而X表示压强时,则垂直于X轴作一条辅助线即为等压线,由于反应吸热,所以随着温度的升高,平衡正向移动,φ(C)逐渐增大,所以Y3>Y2>Y1,A正确。
对于B、C、D可以采用同样的方法分析,均错误。
3.可逆反应mA(g)+nB(g) xC(g) ΔH=Q kJ·mol-1在不同压强、温度下反应物A的转化率的变化情况如图所示。
(1)据图甲判断:p1________p2(填“>”“<”或“=”,下同);m+n________x。。
解析:由题图甲可知,p1条件下反应先达到平衡,因此p1>p2;p1时A的转化率高,即增大压强,平衡正向移动,所以m+n>x。
答案:> >
(2)据图乙判断:Q________0;若纵坐标改为A的百分含量,曲线不变,则Q________0。
解析:由题图乙可知,A的转化率随温度的升高而降低,说明温度升高时平衡逆向移动,则此反应的正反应为放热反应,即ΔH<0;若纵坐标为A的百分含量,则随温度升高,A的百分含量降低,说明温度升高时平衡正向移动,则此反应的正反应为吸热反应,即ΔH>0。
答案:< >
04
随堂练 学以致用
1.绝热环境下的可逆反应H2(g)+I2(g) 2HI(g) ΔH<0,达到平衡后,改变外界条件,下列物理量的变化能说明平衡一定发生移动的是( )
A.气体密度 B.气体平均摩尔质量
C.气体的颜色 D.气体的温度
解析:此反应中气体的平均摩尔质量是一定不会改变的;而气体密度和气体颜色均有可能是体积变化引起的;如果气体温度改变,平衡一定移动。
√
1
2
3
4
5
6
7
2.在一定条件下的溶液中,反应FeCl3+3KSCN Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡正向移动的是( )
A.加水稀释 B.加入少量FeCl3固体
C.加入少量KCl溶液 D.加入少量氢氧化钠固体
√
1
2
3
4
5
6
7
解析:加水稀释、加入少量KCl溶液,Fe3+、SCN-、Fe(SCN)3浓度都减小,平衡逆向移动,A、C不正确;
加入少量FeCl3固体,Fe3+浓度增大,平衡正向移动,B正确;
加入少量NaOH固体,Fe3+浓度减小,平衡逆向移动,D不正确。
1
2
3
4
5
6
7
3.(2022·徐州高二检测)体积一定的恒温密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.若继续充入X,平衡向正反应方向移动,Y的转化率增大
B.若继续充入Z,平衡逆向移动,Z的体积分数减小
C.若移走部分W,平衡正向移动
D.平衡后移走X,上述反应的ΔH减小
√
1
2
3
4
5
6
7
解析:B项,充入Z,平衡逆向移动,Z的体积分数增大。
C项,W为固体,改变其用量,平衡不移动。
D项,ΔH只与方程式中的各物质化学式前的系数及物质状态有关,与反应物的量无关。
1
2
3
4
5
6
7
4. 一定温度下,反应C(s)+H2O(g) CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施能使平衡向左移动的是( )
A.增加C的物质的量
B.保持容器体积不变,充入N2使体系压强增大
C.将容器的体积缩小一半
D.保持压强不变,充入N2使容器体积变大
√
1
2
3
4
5
6
7
解析:A项,C是固体,改变它的量,平衡不移动;
B项,保持容器体积不变,充入N2,由于各物质的浓度都不变,所以平衡不移动;
C项,缩小容器体积,压强增大,平衡向左移动;
D项,保持压强不变,充入N2,容器体积扩大,平衡向右移动。
1
2
3
4
5
6
7
5.(双选)在一密闭容器中,反应aA(g) bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%。下列说法正确的是( )
A.aB.平衡向逆反应方向移动了
C.平衡向正反应方向移动了
D.物质B的质量分数减小了
√
√
1
2
3
4
5
6
7
解析:假设体积增加一倍时平衡未移动,A的浓度应变为原来的50%,实际上平衡时A的浓度变为原来的60%,说明平衡向生成A的方向移动,即增大体积,减小压强,平衡向逆反应方向移动,则a>b,物质B的质量分数减小。
1
2
3
4
5
6
7
6.(2022·永安一中高二质检)某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
A.由图1可知,T1<T2,该反应的正反应为吸热反应
B.由图2可知,m+n<p
C.图3中,点3的反应速率:v正>v逆
D.图4中,若m+n=p,则a曲线一定使用了催化剂
√
1
2
3
4
5
6
7
解析:A.根据“先拐先平数值大”可知,T1<T2,升高温度,C的百分含量减小,说明升高温度,平衡逆向移动,所以该反应的正反应为放热反应,故A错误;
B.由图2可知,增大压强,C的百分含量增大,说明增大压强,平衡正向移动,所以m+n>p,故B错误;
C.图3中点3的转化率小于同温下的平衡转化率,说明点3反应正向进行,反应速率:v正>v逆,故C正确;
D.曲线a速率增大、平衡没移动,若m+n=p,曲线a可能使用了催化剂或加压,故D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
1
2
3
4
5
6
7
(2)向已加入NaOH溶液的上述溶液中再加入过量稀硫酸,则溶液呈________色,因为_________________________________________________。
1
2
3
4
5
6
7
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡________(填“向左移动”或“向右移动”),溶液颜色将_____________。
答案:向右移动 逐渐变浅,直至无色
1
2
3
4
5
6
7
05
课后测 素养评价
[基础巩固]
1.下列说法不正确的是( )
A.对于有气体参加的可逆反应,加压化学平衡不一定发生移动
B.外界条件的改变引起v正≠v逆,则平衡一定发生移动
C.平衡移动,反应物的浓度一定减小
D.外界条件发生变化,化学平衡不一定移动
解析:平衡移动分正向移动和逆向移动,所以反应物的浓度不一定减小。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2.下列对化学平衡移动的分析中,不正确的是( )
①已达到平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动 ②已达到平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定增大 ③有气体参加的反应达到平衡时,若压缩反应容器容积时,平衡一定向气态物质分子数增大的方向移动 ④有气体参加的反应达到平衡时,在恒压反应容器中充入稀有气体,平衡一定不移动
A.仅有①④ B.仅有①②③
C.仅有②③④ D.①②③④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:①已达到平衡的反应C(s)+H2O(g) CO(g)+H2(g),若增加C(s)的物质的量,则平衡不移动,不正确;②已达到平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低,不正确;③有气体参加的反应达到平衡时,压缩反应容器容积,相当于加压,平衡向气态物质分子数减小的方向移动,不正确;④有气体参加的反应达到平衡时,在恒压反应容器中充入稀有气体,相当于减小压强,平衡向气态物质分子数增大的方向移动,不正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
3.(2022·济南高二测试)对于反应A(g)+3B(g) 2C(g) ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述正确的是( )
A.平衡向吸热反应方向移动
B.平衡移动使C的浓度减小
C.平衡移动使A的转化率降低
D.化学平衡常数增大
解析:降低温度,平衡向放热反应方向移动,C的浓度增大,A的转化率升高,化学平衡常数增大。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4.将H2(g)和Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g) 2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热条件下进行上述反应,平衡时Br2(g)的转化率为b。a与 b的关系是( )
A.a>b B.a=b
C.a解析:两反应的温度不同,后者为绝热条件,相对于前者相当于升高了温度,平衡逆向移动,后者平衡时Br2(g)的转化率减小。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
5.下列事实不能用勒·夏特列原理解释的是( )
A.新制的氯水放置一段时间,溶液的pH减小
B.在配制硫酸亚铁溶液时往往要加入少量铁粉
C.反应CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,达到平衡后,升高温度,气体颜色变深
D.增大压强,有利于SO2 与O2 反应生成SO3
解析:在配制FeSO4 溶液时加入少量铁粉是为了防止Fe2+被氧化,无平衡移动,故不能用勒·夏特列原理解释。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
6.(2021·新高考辽宁卷)某温度下,在恒容密闭容器中加入一定量X,发生反应2X(s) Y(s)+Z(g),一段时间后达到平衡。下列说法错误的是( )
A.升高温度,若c平(Z)增大,则ΔH>0
B.加入一定量Z,达新平衡后m(Y)减小
C.加入等物质的量的Y和Z,达新平衡后c平(Z)增大
D.加入一定量氩气,平衡不移动
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:A.升高温度,化学平衡向吸热反应方向移动,而c平(Z)增大,说明平衡正向移动,则ΔH>0,A正确;
B.加入一定量Z,平衡逆向移动,故达新平衡后m(Y)减小,B正确;
C.加入等物质的量的Y和Z,平衡逆向移动,由于X、Y均为固体,故K=c平(Z),达新平衡后c平(Z)不变,C错误;
D.加入一定量氩气,因容器容积不变,故Z的浓度不变,正、逆反应速率不变,平衡不移动,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
7.对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5
B.反应达到平衡后,对体系一直进行加压,平衡总是逆向移动
C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动
D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡状态
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:反应达到平衡时,若两种反应物的转化率相等,则加入的反应物的物质的量之比等于化学式前的系数之比,因此起始投入的n(NH3)∶n(O2)=4∶5,A对;
反应达到平衡后,对体系一直进行加压,如果加压后水变为液体,正反应变为气态物质分子数减小的反应,则平衡正向移动,B错;
反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,容器体积变大,相当于反应体系压强减小,平衡向气态物质分子数增大的方向移动即正向移动,C错;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
当v正(NH3)∶v正(NO)=1∶1时,都是正反应方向,不能说明该化学反应已经达到平衡状态,只有当v正(NH3)∶v逆(NO)=1∶1时,才能说明反应达到平衡状态,D错。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
8.(2020·浙江7月选考)5 mL 0.1 mol·L-1 KI溶液与1 mL 0.1 mol·L-1 FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq) 2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是( )
A.加入苯,振荡,平衡正向移动
B.经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈红色,表明该化学反应存在限度
C.加入FeSO4固体,平衡逆向移动
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:碘易溶于苯,加入苯,碘进入苯中,使水溶液中碘的浓度减小,平衡正向移动,A项正确;
如果反应能进行到底,则经过苯两次萃取后溶液中不会有Fe3+,加入KSCN,溶液不会呈红色,溶液呈红色说明此反应是可逆反应,有反应限度,B项正确;
加入FeSO4固体,Fe2+浓度增大,平衡逆向移动,C项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.现有反应aA(g)+bB(g) pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小,则
(1)该反应的逆反应是________反应(填“吸热”或“放热”),且a+b________p(填“>”“<”或“=”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:达到平衡后,当升高温度时,B的转化率增大,说明温度升高平衡向正反应方向移动,则正反应为吸热反应,逆反应为放热反应;当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则化学方程式中气态反应物化学式前的系数之和大于气态反应产物化学式前的系数之和。
答案:放热 >
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同)。
解析:减压平衡向逆反应方向移动,则A的质量分数增大。
答案:增大
(3)若充入B(体积不变),则A的转化率________,B的转化率________。
解析:在反应容器中充入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,而B的转化率减小。
答案:增大 减小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:正反应吸热,则升高温度平衡向正反应方向移动,B的浓度减小,C的浓度增大,所以二者的比值将减小。
答案:减小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(5)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________(填“变浅”“变深”或“不变”,下同),而维持容器内气体的压强不变,充入氖气时,混合物的颜色________。
解析:若B是有色物质,A、C均为无色物质,则加入C(体积不变)时平衡向逆反应方向移动,B的浓度增大,混合物的颜色变深,而维持容器内气体的压强不变,充入氖气时,容器体积增大,对于反应体系来说,相当于减小压强,平衡向逆反应方向移动,但移动的量远小于体积增大的因素,则B的浓度减小,混合物的颜色变浅。
答案:变深 变浅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.(2020·新高考天津卷)用H2还原CO2可以在一定条件下合成CH3OH(不考虑副反应):CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0。
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数为____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)恒压下,CO2和H2的起始物质的量比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
①甲醇平衡产率随温度升高而降低的原因为_______________。
②P点甲醇产率高于T点的原因为_______________________________。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为______°C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:①该反应是放热反应,温度升高,平衡逆向移动,甲醇的平衡产率随温度升高而降低。②P点对应反应有分子筛膜,分子筛膜能选择性分离出H2O,有利于反应正向进行,故P点甲醇产率高于T点甲醇产率。③由题图知,当温度为210 ℃时,甲醇的产率最高,因此最佳反应温度为210 ℃。
答案:①该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小) ②分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高 ③210
1
2
3
4
5
6
7
8
9
10
11
12
13
14
[素养提升]
11~13题有一个或两个选项符合题目要求。
11.(2022·邢台高二月考)在密闭容器中进行反应:X(g)+2Y(g) 2Z(g) ΔH>0,如图能正确表示该反应有关物理量变化规律的是( )
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:A项,由题中可逆反应可知,图像中v正=v逆时反应达到平衡,继续升温时,平衡向吸热反应方向即正反应方向移动,则v正>v逆,与图像不一致,错误。
B项,升温使平衡向正反应方向移动,Z的百分含量增加,与图像不一致,错误。
C项,升温使平衡向正反应方向移动,X的转化率增大,加压使平衡向正反应方向移动,X的转化率增大,与图像一致,正确。
D项,化学平衡常数只与温度有关,不随时间和有无催化剂变化而变化,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12.已知反应2NO2 N2O4 ΔH<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体的透光率随时间的变化曲线(气体颜色越深,透光率越小)。下列说法正确的是( )
A.b点的操作是拉伸注射器
B.d点:v正C.d点与a点相比,c(NO2)减小
D.若不忽略体系温度的变化,且没有能量损失,则T(b)>T(c)
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:从b点开始,气体的透光率变小,则气体颜色变深,c(NO2)增大,故b点的操作是压缩注射器,A项错误;
c点后的拐点是拉伸注射器的过程,气体透光率增大,d点透光率变小,说明气体颜色变深,则平衡逆向移动,所以v正d点的透光率比a点的透光率大,证明d点的气体颜色没有a点的气体颜色深,因此d点与a点相比,c(NO2)减小,C项正确;
b点开始是压缩注射器的过程,压强增大,平衡正向移动,反应放热,导致T(b)1
2
3
4
5
6
7
8
9
10
11
12
13
14
13.(2022·济宁高二检测)如图所示,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。当其他条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的容积均为V L,发生如下反应并达到平衡状态:2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A.a=2
B.若Ⅱ中气体的密度随时间的变化关系如图中Ⅲ所示,则X、Y中只有一种为气体
C.若X、Y均为气体,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固体、Y为气体,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ=Ⅱ
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:设达到平衡时Y转化了x mol,则:
2X(?)+Y(?) aZ(g)
起始量/mol 2 2 0
转化量/mol 2x x ax
平衡量/mol 2-2x 2-x ax
平衡时X、Y、Z的物质的量之比为1∶3∶2,即(2-2x)∶(2-x)∶ax=1∶3∶2,解得x=0.8,a=1,A项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
由题图知,Ⅱ中气体的密度随时间的延长而增大,Ⅱ是恒容密闭容器,说明反应前后气体的质量增加,且起始时Ⅱ中气体的密度大于0,则X、Y中只有一种为气体,B项正确。
若X、Y均为气体,则该反应为气态物质分子数减小的反应,Ⅰ和Ⅱ的起始状态相同,平衡时Ⅰ中的压强比Ⅱ中的压强大,Ⅰ中平衡相当于在Ⅱ的基础上加压,所以平衡时Ⅰ中X的转化率大于Ⅱ中X的转化率,C项错误。
若X为固体、Y为气体,则该反应为气态物质分子数不变的反应,Ⅰ和Ⅱ的起始状态相同,则达到平衡时,Ⅰ和Ⅱ的状态仍然相同,所以达到平衡所需的时间也相同,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14.已知2A2(g)+B2(g) 2C3(g) ΔH=-Q1 kJ·mol-1(Q1>0)。在一个有催化剂、容积不变的密闭容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应,达到平衡时C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时,A2的转化率为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大”“减小”或“不变”)。
解析:达到平衡后,若向原恒容容器中通入少量的氩气,氩气不参与反应,反应物浓度不变,平衡不移动,A2的转化率不变。
答案:不变
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)若在原来的容器中,只加入2 mol C3,500 ℃时充分反应达到平衡后,吸收热量Q3 kJ,C3的浓度________(填“>”“=”或“<”)w mol·L-1,Q1、Q2、Q3之间满足何种关系:Q3=________。
解析:在同一容器中投入2 mol A2和1 mol B2与投入2 mol C3达到的平衡状态相同,所以反应达到平衡后,C3的浓度等于w mol·L-1;在同一容器中投入2 mol A2和1 mol B2,反应正向进行,相同条件下,投入2 mol C3相当于反应逆向进行,此时,反应的ΔH=Q1 kJ·mol-1,根据反应达到平衡后,C3的浓度相同及三段式计算可得,Q1=Q2+Q3,即Q3=Q1-Q2。
答案:= Q1-Q2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),则下列结论正确的是________。
A.反应速率:c>b>a
B.达到平衡时A2的转化率:b>a>c
C.T2>T1
D.b点对应的状态,A2和B2的起始物质的量之比为2∶1
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:增大反应体系中B2的物质的量,反应物的浓度变大,反应速率:c>b>a,A正确;
增大一种反应物的量,则另一种反应物的转化率增大,故达到平衡时A2的转化率大小为c>b>a,B错误;
正反应是放热反应,所以降低温度,平衡正向移动,C3的平衡体积分数增大,故T2<T1,C错误;
当投料比为化学式前的系数之比时,平衡时产物的体积分数最大,则b点对应的状态,A2和B2的起始物质的量之比为2∶1,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(5)若将上述容器改为恒压容器,起始时加入4 mol A2和2 mol B2,500 ℃时充分反应达到平衡后,放出热量Q4 kJ,则Q2________Q4(填“>”“<”或“=”)。
解析:恒压条件下,相当给原平衡加压,平衡正向移动,转化率变大,Q2<Q4。
答案:<
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(6)下列措施可以同时提高反应速率和B2转化率的是________。
A.选择适当的催化剂
B.增大压强
C.及时分离生成的C3
D.升高温度
解析:选择适当的催化剂,平衡不移动,B2的转化率不变,故A错误;增大压强,反应速率增大,平衡向正反应方向移动,B2的转化率增大,故B正确;及时分离生成的C3,反应速率减小,故C错误;升高温度,平衡向逆反应方向移动,B2的转化率减小,故D错误。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
第2节 化学反应的限度
第2课时 反应条件对化学平衡的影响
第2章 化学反应的方向、限度与速率
[素养发展目标]
1.通过实验探究,了解外界条件对化学平衡的影响,形成变化观念的学科核心素养。
2.理解勒·夏特列原理的内容并学会应用,体验科学态度与社会责任的学科核心素养。
01
知识点一
知识点一 温度、浓度对化学平衡的影响
1.化学平衡移动
(1)内容:受温度、压强或浓度变化的影响,化学反应由一种__________变为另一种__________的过程。
平衡状态
平衡状态
(2)图示表示
2.平衡移动方向的判断
(1)根据速率判断
①若v(正)____v(逆),平衡正向移动。
②若v(正)____v(逆),平衡不移动。
③若v(正)____v(逆),平衡逆向移动。
(2)根据结果判断
对于一个已达到化学平衡状态的反应,如平衡移动的结果使反应产物浓度变大,则称平衡__________;反之,称平衡__________。
>
=
<
正向移动
逆向移动
3.实验探究:温度对化学平衡的影响
(1)实验方案
实验 原理 2NO2(g) N2O4(g) ΔH=-57.2 kJ·mol-1
红棕色 无色
实验 步骤
实验 现象 浸入热水中的容器里的混合气体颜色加深;浸入冷水中的容器里的混合气体颜色变浅
实验 结论 混合气体受热颜色加深,说明NO2浓度增大,即平衡向吸热方向移动;混合气体被冷却时颜色变浅,说明NO2浓度减小,即平衡向放热方向移动
(2)温度对化学平衡影响的解释
反应类型 温度变化 K值变化 Q与K关系 平衡移动方向
放热 反应 升温 减小 Q>K 逆反应
降温 增大 Q
4.实验探究:浓度对化学平衡的影响
(1)实验方案
实验原理 Fe3++3SCN- Fe(SCN)3 实验Ⅰ 步骤 实验现象 溶液颜色加深 溶液颜色加深
实验Ⅱ 步骤 试管①中滴加0.01 mol·L-1 NaOH溶液 试管②中滴加0.01 mol·L-1 NaOH溶液
实验现象 溶液颜色变浅 溶液颜色变浅
实验结论 增大c(Fe3+)或c(SCN-)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动;滴加NaOH溶液,由于3OH-+Fe3+===Fe(OH)3↓,使Fe3+的浓度减小,Fe(SCN)3的浓度减小,即化学平衡向逆反应方向移动 (2)浓度对化学平衡影响的解释
浓度变化 Q值变化 Q与K关系 平衡移动方向
增大反应物浓度 减小 Q
增大反应产物浓度 5.Q和K的相对大小与平衡移动的关系示意图
1.化学平衡发生移动,化学反应速率一定改变吗?化学反应速率改变,化学平衡一定移动吗?
提示:化学平衡发生移动,化学反应速率一定改变,因为正、逆反应速率不相等,是化学平衡移动的根本原因;化学反应速率改变,化学平衡不一定移动,如在催化剂作用下,正、逆反应速率改变相同的倍数,仍然相等,但平衡不移动。
2.“任意可逆反应的化学平衡,都会受温度的影响而发生移动”,你认为这种说法对吗?你是如何理解的?
提示:任何反应都具有一定的热效应,不是吸热反应就是放热反应,故温度改变,对吸热反应速率和放热反应速率的影响程度不同,正、逆反应速率不再相等,故平衡会发生移动。
3.在人体利用氧气的过程中,血红蛋白与氧气的结合过程涉及化学平衡的移动。人体中的血红蛋白分子(Hb)与氧气分子结合,形成氧合血红蛋白分子——Hb(O2),即Hb+O2 Hb(O2)。
煤气中的一氧化碳分子也能与血红蛋白分子结合,即Hb+CO Hb(CO)。一氧化碳分子与血红蛋白分子结合的能力比氧气分子强,大约是氧气分子与血红蛋白分子结合能力的200倍。
(1)当空气中一氧化碳的浓度增大时,会造成人体缺氧,严重时导致死亡。试解释原因。
提示:一氧化碳分子与血红蛋白分子结合的能力比氧气分子强,则其浓度增大时,Q
提示:增大氧气的浓度,此时一氧化碳浓度低于平衡浓度(Q>K),一氧化碳分子结合Hb反应的化学平衡左移,Hb(CO)分解,而此时氧气的浓度大于平衡浓度(Q
A.H+浓度减小,HClO浓度减小
B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大
D.H+浓度增大,HClO浓度减小
√
解析:碳酸的酸性弱于盐酸而强于次氯酸,向氯水中投入少量碳酸钙粉末后,碳酸钙与盐酸反应,而不与次氯酸反应。又由于H+浓度减小,平衡Cl2+H2O H++Cl-+HClO向正反应方向移动,故HClO浓度增大。
2.(双选)当反应COCl2(g) CO(g)+Cl2(g) ΔH>0达到平衡时,下列措施中能提高COCl2转化率的是( )
A.升高温度 B.降低温度
C.增大CO的浓度 D.减小Cl2的浓度
解析:COCl2(g) CO(g)+Cl2(g) ΔH>0,正反应为吸热反应,升高温度,平衡正向移动,COCl2转化率增大;降低温度,平衡逆向移动,COCl2转化率减小;增大反应产物(CO)的浓度,平衡逆向移动,COCl2转化率减小;减小反应产物(Cl2)的浓度,平衡正向移动,COCl2转化率增大。
√
√
3.对于达到化学平衡的反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,回答下列问题:
(1)升高温度,K________(填“增大”或“减小”),平衡向________(填“正反应方向”或“逆反应方向”)移动;降低温度,SO2的转化率________(填“增大”“减小”或“不变”)。
答案:减小 逆反应方向 增大
(2)增大c(O2),平衡向________(填“正反应方向”或“逆反应方向”,下同)移动,减小c(SO3),平衡向______移动,SO2的转化率均________(填“增大”“减小”或“不变”)。
答案:正反应方向 正反应方向 增大
02
知识点二
知识点二 压强对化学平衡的影响 勒·夏特列原理
1.压强对化学平衡的影响
对于Δvg=0的反应,改变压强,Q____K,化学平衡状态______;对于Δvg≠0的反应,增大压强,化学平衡向化学方程式中气态物质化学式前系数______的方向移动,减小压强,化学平衡向化学方程式中气态物质化学式前系数______的方向移动。
=
不变
减小
增大
对于只涉及固体或液体的反应,压强对平衡体系的影响极其微弱,可以不予考虑。
2.平衡移动原理(勒·夏特列原理)
(1)内容:如果改变平衡体系的一个条件(如温度、浓度或压强),平衡将向______这个改变的方向移动。
(2)解释:增大反应体系中反应物的浓度,平衡向____________的方向移动;增大平衡体系的压强,平衡向____________________的方向移动;升高温度,平衡向__________移动;等等。
减弱
消耗反应物
气态物质分子数减小
吸热方向
(3)注意事项:①勒·夏特列原理仅适用于已达到平衡的反应体系,不可逆过程或未达到平衡的可逆过程均不能使用该原理。此外,勒·夏特列原理对所有的动态平衡(如后面将要学到的溶解平衡、电离平衡和水解平衡等)都适用。
②勒·夏特列原理中的“减弱”不等于“消除”,更不是“扭转”,即平衡移动不能将外界影响完全消除,而只能减弱。如平衡体系的压强为p,若其他条件不变,将体系的压强增大到2p,平衡将向气态物质分子数减小的方向移动,达到新平衡时体系的压强介于p~2p。
通过NO2与N2O4相互转化时的颜色变化,探究压强对Δvg≠0的反应化学平衡的影响。
[实验原理]
2NO2(g)(红棕色) N2O4(g)(无色)
[实验操作]
用50 mL注射器吸入20 mL NO2和N2O4的混合气体,使注射器的活塞位于Ⅰ处,将细管端用橡胶塞封闭。然后把活塞拉到Ⅱ处,观察管内混合气体颜色的变化。当反复将活塞从Ⅱ处推到Ⅰ处及从Ⅰ处拉到Ⅱ处时,观察管内混合气体颜色的变化。
实验操作 体系压强增大 体系压强减小
实验现象 (1)______________________________________________________________________ (2)___________________________________________________ ___________________________
现象解释 (3)______________________________________________ ________________________ (4)______________________________________________________________________________
[实验现象]
提示:(1)混合气体的颜色先变深后逐渐变浅
(2)混合气体的颜色先变浅后逐渐变深
(3)开始由于体积变小,混合气体的浓度增大,颜色加深;之后由于压强增大,平衡向正反应方向移动,c(NO2)减小,混合气体颜色变浅
(4)开始由于体积增大,混合气体的浓度减小,颜色变浅;之后由于压强减小,平衡向逆反应方向移动,c(NO2)增大,混合气体颜色变深
(1)对于无气体参与的化学反应,由于改变压强不能改变化学反应速率,所以改变压强不能使无气体存在的化学平衡发生移动。
(2)分析压强对化学平衡的影响时,要特别注意是恒容容器还是恒压容器。
①恒温恒容时
原平衡体系体系总压强增大,但体系中各组分的浓度不变―→平衡不移动
②恒温恒压时
说明:此处无关气体指不参与反应的气体。
1.反应C2H6(g) C2H4(g)+H2(g) ΔH>0在一定条件下于密闭容器中达到平衡,下列各项措施中,不能提高乙烷的平衡转化率的是( )
A.增大容器容积 B.升高反应温度
C.分离出部分氢气 D.等容下通入惰性气体
解析:增大容器容积相当于减小压强,平衡正向移动,乙烷的平衡转化率增大;该反应为吸热反应,升高温度,平衡正向移动,乙烷的平衡转化率增大;分离出部分氢气,平衡正向移动,乙烷的平衡转化率增大;等容下通入惰性气体,原平衡体系中各物质的浓度不变,平衡不移动,乙烷的平衡转化率不变。
√
√
解析:两种气体的变化情况不一样,对于Br2(g)只是物理变化,浓度自然减半,颜色变浅;对于NO2(g)是一个平衡移动的过程:2NO2(g) N2O4(g),相当于压强减小,物理变化使之颜色变浅,浓度自然减半,但随之平衡又向生成NO2的方向移动,颜色要稍微加深一些,尽管与拉动活塞之前相比颜色要浅,但是比Br2(g)的深。
3.下列事实,不能用勒·夏特列原理解释的是( )
A.反应CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
B.合成氨的反应N2(g)+3H2(g) 2NH3(g) ΔH<0,为提高NH3的产率,理论上应采取相对较低的温度
C.溴水中存在平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D.对2HI(g) H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
√
解析:选项A的正反应为放热反应,升高温度使平衡向逆反应方向移动;选项B合成氨的反应是放热反应,理论上采取低温有利于平衡向正反应方向移动;选项C中加入AgNO3溶液后,Ag+与Br-反应生成AgBr沉淀,降低了Br-的浓度,平衡向正反应方向移动,溶液颜色变浅;选项D因反应前后气态物质分子数相等,压缩体积,压强增大,平衡不发生移动,但由于体积减小,各组分的浓度增大,故颜色变深。综上所述,只要平衡移动的结果与实际相符,都符合勒·夏特列原理。
03
知识点三
知识点三 化学平衡图像的分析与应用
1.化学平衡图像读图方法——抓“五看”
一看轴——横坐标、纵坐标代表的量。
二看线——线的斜率大小、平与陡的含义。
三看点——起点、终点、转折点、交叉点等。
四看辅助线——等温线、等压线、平衡线等。
五看量——浓度、温度等因素的改变量。
2.化学平衡图像的类型及解题原则
(1)百分含量(或转化率)-时间-温度(或压强)图像
①图像展示
②解题原则——“先拐先平数值大”
在化学平衡图像中,先出现拐点的反应则先达到平衡状态,先出现拐点的曲线表示的反应温度较高(如图Ⅰ中T2>T1)、压强较大(如图Ⅱ中p2>p1)或使用了催化剂(如图Ⅲ中a使用了催化剂)。
Ⅰ.表示T2>T1,升高温度,反应产物的百分含量降低,说明正反应是放热反应,温度升高,平衡逆向移动。
Ⅱ.表示p2>p1,增大压强,A的转化率减小,说明正反应是气态物质分子数增大的反应,增大压强,平衡逆向移动。
Ⅲ.反应产物C的百分含量不变,说明平衡不发生移动,但反应速率:a>b,故a使用了催化剂;也可能该反应是反应前后气态物质分子数不变的可逆反应,a增大了压强(压缩体积)。
(2)百分含量-压强-温度图像
①图像展示
②解题原则——“定一议二”
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量,分析方法是确定其中一个变量,讨论另外两个变量之间的关系。如图Ⅰ中确定压强为105 Pa或107 Pa,则反应产物C的百分含量随温度T的升高而逐渐减小,说明正反应是放热反应;再确定温度T不变,作横坐标轴的垂线,与压强线出现两个交点,分析反应产物C的百分含量随压强p的变化可以发现,压强增大,反应产物C的百分含量增大,说明正反应是气态物质分子数减小的反应。
1.密闭容器中进行的可逆反应aA(g)+bB(g) cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是( )
A.T1
B.T1>T2,p1
√
解析:由(T1,p1)和(T1,p2)两条曲线可以看出:温度(T1)相同,但压强为p2时先出现“拐点”,达到平衡所需的时间短,所以p2>p1;压强较大(即压强为p2)时对应的w(B)较大,说明增大压强平衡逆向移动,则a+b
2.(2022·湘潭高二检测)对于反应A(s)+2B(g) 3C(g) ΔH>0,C的百分含量φ(C)与外界条件X、Y的关系如图所示,下列结论正确的是( )
A.Y表示温度,X表示压强,且Y3>Y2>Y1
B.Y表示压强,X表示温度,且Y3>Y2>Y1
C.X表示压强,Y表示温度,且Y1>Y2>Y3
D.X表示温度,Y表示压强,且Y1>Y2>Y3
√
解析:当Y表示温度时,则Y1、Y2、Y3表示三条等温线,定住其中一条等温线(如Y1),则由于正反应是气态物质分子数增大的反应,所以随着压强的增大平衡逆向移动,φ(C)逐渐减小,符合题目所给方程式。而X表示压强时,则垂直于X轴作一条辅助线即为等压线,由于反应吸热,所以随着温度的升高,平衡正向移动,φ(C)逐渐增大,所以Y3>Y2>Y1,A正确。
对于B、C、D可以采用同样的方法分析,均错误。
3.可逆反应mA(g)+nB(g) xC(g) ΔH=Q kJ·mol-1在不同压强、温度下反应物A的转化率的变化情况如图所示。
(1)据图甲判断:p1________p2(填“>”“<”或“=”,下同);m+n________x。。
解析:由题图甲可知,p1条件下反应先达到平衡,因此p1>p2;p1时A的转化率高,即增大压强,平衡正向移动,所以m+n>x。
答案:> >
(2)据图乙判断:Q________0;若纵坐标改为A的百分含量,曲线不变,则Q________0。
解析:由题图乙可知,A的转化率随温度的升高而降低,说明温度升高时平衡逆向移动,则此反应的正反应为放热反应,即ΔH<0;若纵坐标为A的百分含量,则随温度升高,A的百分含量降低,说明温度升高时平衡正向移动,则此反应的正反应为吸热反应,即ΔH>0。
答案:< >
04
随堂练 学以致用
1.绝热环境下的可逆反应H2(g)+I2(g) 2HI(g) ΔH<0,达到平衡后,改变外界条件,下列物理量的变化能说明平衡一定发生移动的是( )
A.气体密度 B.气体平均摩尔质量
C.气体的颜色 D.气体的温度
解析:此反应中气体的平均摩尔质量是一定不会改变的;而气体密度和气体颜色均有可能是体积变化引起的;如果气体温度改变,平衡一定移动。
√
1
2
3
4
5
6
7
2.在一定条件下的溶液中,反应FeCl3+3KSCN Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡正向移动的是( )
A.加水稀释 B.加入少量FeCl3固体
C.加入少量KCl溶液 D.加入少量氢氧化钠固体
√
1
2
3
4
5
6
7
解析:加水稀释、加入少量KCl溶液,Fe3+、SCN-、Fe(SCN)3浓度都减小,平衡逆向移动,A、C不正确;
加入少量FeCl3固体,Fe3+浓度增大,平衡正向移动,B正确;
加入少量NaOH固体,Fe3+浓度减小,平衡逆向移动,D不正确。
1
2
3
4
5
6
7
3.(2022·徐州高二检测)体积一定的恒温密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0。下列叙述正确的是( )
A.若继续充入X,平衡向正反应方向移动,Y的转化率增大
B.若继续充入Z,平衡逆向移动,Z的体积分数减小
C.若移走部分W,平衡正向移动
D.平衡后移走X,上述反应的ΔH减小
√
1
2
3
4
5
6
7
解析:B项,充入Z,平衡逆向移动,Z的体积分数增大。
C项,W为固体,改变其用量,平衡不移动。
D项,ΔH只与方程式中的各物质化学式前的系数及物质状态有关,与反应物的量无关。
1
2
3
4
5
6
7
4. 一定温度下,反应C(s)+H2O(g) CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施能使平衡向左移动的是( )
A.增加C的物质的量
B.保持容器体积不变,充入N2使体系压强增大
C.将容器的体积缩小一半
D.保持压强不变,充入N2使容器体积变大
√
1
2
3
4
5
6
7
解析:A项,C是固体,改变它的量,平衡不移动;
B项,保持容器体积不变,充入N2,由于各物质的浓度都不变,所以平衡不移动;
C项,缩小容器体积,压强增大,平衡向左移动;
D项,保持压强不变,充入N2,容器体积扩大,平衡向右移动。
1
2
3
4
5
6
7
5.(双选)在一密闭容器中,反应aA(g) bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%。下列说法正确的是( )
A.a
C.平衡向正反应方向移动了
D.物质B的质量分数减小了
√
√
1
2
3
4
5
6
7
解析:假设体积增加一倍时平衡未移动,A的浓度应变为原来的50%,实际上平衡时A的浓度变为原来的60%,说明平衡向生成A的方向移动,即增大体积,减小压强,平衡向逆反应方向移动,则a>b,物质B的质量分数减小。
1
2
3
4
5
6
7
6.(2022·永安一中高二质检)某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
A.由图1可知,T1<T2,该反应的正反应为吸热反应
B.由图2可知,m+n<p
C.图3中,点3的反应速率:v正>v逆
D.图4中,若m+n=p,则a曲线一定使用了催化剂
√
1
2
3
4
5
6
7
解析:A.根据“先拐先平数值大”可知,T1<T2,升高温度,C的百分含量减小,说明升高温度,平衡逆向移动,所以该反应的正反应为放热反应,故A错误;
B.由图2可知,增大压强,C的百分含量增大,说明增大压强,平衡正向移动,所以m+n>p,故B错误;
C.图3中点3的转化率小于同温下的平衡转化率,说明点3反应正向进行,反应速率:v正>v逆,故C正确;
D.曲线a速率增大、平衡没移动,若m+n=p,曲线a可能使用了催化剂或加压,故D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
1
2
3
4
5
6
7
(2)向已加入NaOH溶液的上述溶液中再加入过量稀硫酸,则溶液呈________色,因为_________________________________________________。
1
2
3
4
5
6
7
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡________(填“向左移动”或“向右移动”),溶液颜色将_____________。
答案:向右移动 逐渐变浅,直至无色
1
2
3
4
5
6
7
05
课后测 素养评价
[基础巩固]
1.下列说法不正确的是( )
A.对于有气体参加的可逆反应,加压化学平衡不一定发生移动
B.外界条件的改变引起v正≠v逆,则平衡一定发生移动
C.平衡移动,反应物的浓度一定减小
D.外界条件发生变化,化学平衡不一定移动
解析:平衡移动分正向移动和逆向移动,所以反应物的浓度不一定减小。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
2.下列对化学平衡移动的分析中,不正确的是( )
①已达到平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动 ②已达到平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定增大 ③有气体参加的反应达到平衡时,若压缩反应容器容积时,平衡一定向气态物质分子数增大的方向移动 ④有气体参加的反应达到平衡时,在恒压反应容器中充入稀有气体,平衡一定不移动
A.仅有①④ B.仅有①②③
C.仅有②③④ D.①②③④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:①已达到平衡的反应C(s)+H2O(g) CO(g)+H2(g),若增加C(s)的物质的量,则平衡不移动,不正确;②已达到平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低,不正确;③有气体参加的反应达到平衡时,压缩反应容器容积,相当于加压,平衡向气态物质分子数减小的方向移动,不正确;④有气体参加的反应达到平衡时,在恒压反应容器中充入稀有气体,相当于减小压强,平衡向气态物质分子数增大的方向移动,不正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
3.(2022·济南高二测试)对于反应A(g)+3B(g) 2C(g) ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述正确的是( )
A.平衡向吸热反应方向移动
B.平衡移动使C的浓度减小
C.平衡移动使A的转化率降低
D.化学平衡常数增大
解析:降低温度,平衡向放热反应方向移动,C的浓度增大,A的转化率升高,化学平衡常数增大。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
4.将H2(g)和Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g) 2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热条件下进行上述反应,平衡时Br2(g)的转化率为b。a与 b的关系是( )
A.a>b B.a=b
C.a解析:两反应的温度不同,后者为绝热条件,相对于前者相当于升高了温度,平衡逆向移动,后者平衡时Br2(g)的转化率减小。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
5.下列事实不能用勒·夏特列原理解释的是( )
A.新制的氯水放置一段时间,溶液的pH减小
B.在配制硫酸亚铁溶液时往往要加入少量铁粉
C.反应CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,达到平衡后,升高温度,气体颜色变深
D.增大压强,有利于SO2 与O2 反应生成SO3
解析:在配制FeSO4 溶液时加入少量铁粉是为了防止Fe2+被氧化,无平衡移动,故不能用勒·夏特列原理解释。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
6.(2021·新高考辽宁卷)某温度下,在恒容密闭容器中加入一定量X,发生反应2X(s) Y(s)+Z(g),一段时间后达到平衡。下列说法错误的是( )
A.升高温度,若c平(Z)增大,则ΔH>0
B.加入一定量Z,达新平衡后m(Y)减小
C.加入等物质的量的Y和Z,达新平衡后c平(Z)增大
D.加入一定量氩气,平衡不移动
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:A.升高温度,化学平衡向吸热反应方向移动,而c平(Z)增大,说明平衡正向移动,则ΔH>0,A正确;
B.加入一定量Z,平衡逆向移动,故达新平衡后m(Y)减小,B正确;
C.加入等物质的量的Y和Z,平衡逆向移动,由于X、Y均为固体,故K=c平(Z),达新平衡后c平(Z)不变,C错误;
D.加入一定量氩气,因容器容积不变,故Z的浓度不变,正、逆反应速率不变,平衡不移动,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
7.对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5
B.反应达到平衡后,对体系一直进行加压,平衡总是逆向移动
C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动
D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡状态
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:反应达到平衡时,若两种反应物的转化率相等,则加入的反应物的物质的量之比等于化学式前的系数之比,因此起始投入的n(NH3)∶n(O2)=4∶5,A对;
反应达到平衡后,对体系一直进行加压,如果加压后水变为液体,正反应变为气态物质分子数减小的反应,则平衡正向移动,B错;
反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,容器体积变大,相当于反应体系压强减小,平衡向气态物质分子数增大的方向移动即正向移动,C错;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
当v正(NH3)∶v正(NO)=1∶1时,都是正反应方向,不能说明该化学反应已经达到平衡状态,只有当v正(NH3)∶v逆(NO)=1∶1时,才能说明反应达到平衡状态,D错。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
8.(2020·浙江7月选考)5 mL 0.1 mol·L-1 KI溶液与1 mL 0.1 mol·L-1 FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq) 2Fe2+(aq)+I2(aq),达到平衡。下列说法不正确的是( )
A.加入苯,振荡,平衡正向移动
B.经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈红色,表明该化学反应存在限度
C.加入FeSO4固体,平衡逆向移动
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:碘易溶于苯,加入苯,碘进入苯中,使水溶液中碘的浓度减小,平衡正向移动,A项正确;
如果反应能进行到底,则经过苯两次萃取后溶液中不会有Fe3+,加入KSCN,溶液不会呈红色,溶液呈红色说明此反应是可逆反应,有反应限度,B项正确;
加入FeSO4固体,Fe2+浓度增大,平衡逆向移动,C项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.现有反应aA(g)+bB(g) pC(g),达到平衡后,当升高温度时,B的转化率增大;当减小压强时,混合体系中C的质量分数也减小,则
(1)该反应的逆反应是________反应(填“吸热”或“放热”),且a+b________p(填“>”“<”或“=”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:达到平衡后,当升高温度时,B的转化率增大,说明温度升高平衡向正反应方向移动,则正反应为吸热反应,逆反应为放热反应;当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则化学方程式中气态反应物化学式前的系数之和大于气态反应产物化学式前的系数之和。
答案:放热 >
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同)。
解析:减压平衡向逆反应方向移动,则A的质量分数增大。
答案:增大
(3)若充入B(体积不变),则A的转化率________,B的转化率________。
解析:在反应容器中充入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,而B的转化率减小。
答案:增大 减小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:正反应吸热,则升高温度平衡向正反应方向移动,B的浓度减小,C的浓度增大,所以二者的比值将减小。
答案:减小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(5)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________(填“变浅”“变深”或“不变”,下同),而维持容器内气体的压强不变,充入氖气时,混合物的颜色________。
解析:若B是有色物质,A、C均为无色物质,则加入C(体积不变)时平衡向逆反应方向移动,B的浓度增大,混合物的颜色变深,而维持容器内气体的压强不变,充入氖气时,容器体积增大,对于反应体系来说,相当于减小压强,平衡向逆反应方向移动,但移动的量远小于体积增大的因素,则B的浓度减小,混合物的颜色变浅。
答案:变深 变浅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.(2020·新高考天津卷)用H2还原CO2可以在一定条件下合成CH3OH(不考虑副反应):CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0。
(1)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L-1和3a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数为____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)恒压下,CO2和H2的起始物质的量比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
①甲醇平衡产率随温度升高而降低的原因为_______________。
②P点甲醇产率高于T点的原因为_______________________________。
③根据上图,在此条件下采用该分子筛膜时的最佳反应温度为______°C
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:①该反应是放热反应,温度升高,平衡逆向移动,甲醇的平衡产率随温度升高而降低。②P点对应反应有分子筛膜,分子筛膜能选择性分离出H2O,有利于反应正向进行,故P点甲醇产率高于T点甲醇产率。③由题图知,当温度为210 ℃时,甲醇的产率最高,因此最佳反应温度为210 ℃。
答案:①该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小) ②分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高 ③210
1
2
3
4
5
6
7
8
9
10
11
12
13
14
[素养提升]
11~13题有一个或两个选项符合题目要求。
11.(2022·邢台高二月考)在密闭容器中进行反应:X(g)+2Y(g) 2Z(g) ΔH>0,如图能正确表示该反应有关物理量变化规律的是( )
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:A项,由题中可逆反应可知,图像中v正=v逆时反应达到平衡,继续升温时,平衡向吸热反应方向即正反应方向移动,则v正>v逆,与图像不一致,错误。
B项,升温使平衡向正反应方向移动,Z的百分含量增加,与图像不一致,错误。
C项,升温使平衡向正反应方向移动,X的转化率增大,加压使平衡向正反应方向移动,X的转化率增大,与图像一致,正确。
D项,化学平衡常数只与温度有关,不随时间和有无催化剂变化而变化,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
12.已知反应2NO2 N2O4 ΔH<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体的透光率随时间的变化曲线(气体颜色越深,透光率越小)。下列说法正确的是( )
A.b点的操作是拉伸注射器
B.d点:v正
D.若不忽略体系温度的变化,且没有能量损失,则T(b)>T(c)
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:从b点开始,气体的透光率变小,则气体颜色变深,c(NO2)增大,故b点的操作是压缩注射器,A项错误;
c点后的拐点是拉伸注射器的过程,气体透光率增大,d点透光率变小,说明气体颜色变深,则平衡逆向移动,所以v正
b点开始是压缩注射器的过程,压强增大,平衡正向移动,反应放热,导致T(b)
2
3
4
5
6
7
8
9
10
11
12
13
14
13.(2022·济宁高二检测)如图所示,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。当其他条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的容积均为V L,发生如下反应并达到平衡状态:2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是( )
1
2
3
4
5
6
7
8
9
10
11
12
13
14
A.a=2
B.若Ⅱ中气体的密度随时间的变化关系如图中Ⅲ所示,则X、Y中只有一种为气体
C.若X、Y均为气体,则在平衡时X的转化率:Ⅰ<Ⅱ
D.若X为固体、Y为气体,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ=Ⅱ
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:设达到平衡时Y转化了x mol,则:
2X(?)+Y(?) aZ(g)
起始量/mol 2 2 0
转化量/mol 2x x ax
平衡量/mol 2-2x 2-x ax
平衡时X、Y、Z的物质的量之比为1∶3∶2,即(2-2x)∶(2-x)∶ax=1∶3∶2,解得x=0.8,a=1,A项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
由题图知,Ⅱ中气体的密度随时间的延长而增大,Ⅱ是恒容密闭容器,说明反应前后气体的质量增加,且起始时Ⅱ中气体的密度大于0,则X、Y中只有一种为气体,B项正确。
若X、Y均为气体,则该反应为气态物质分子数减小的反应,Ⅰ和Ⅱ的起始状态相同,平衡时Ⅰ中的压强比Ⅱ中的压强大,Ⅰ中平衡相当于在Ⅱ的基础上加压,所以平衡时Ⅰ中X的转化率大于Ⅱ中X的转化率,C项错误。
若X为固体、Y为气体,则该反应为气态物质分子数不变的反应,Ⅰ和Ⅱ的起始状态相同,则达到平衡时,Ⅰ和Ⅱ的状态仍然相同,所以达到平衡所需的时间也相同,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
14.已知2A2(g)+B2(g) 2C3(g) ΔH=-Q1 kJ·mol-1(Q1>0)。在一个有催化剂、容积不变的密闭容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应,达到平衡时C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时,A2的转化率为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大”“减小”或“不变”)。
解析:达到平衡后,若向原恒容容器中通入少量的氩气,氩气不参与反应,反应物浓度不变,平衡不移动,A2的转化率不变。
答案:不变
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(3)若在原来的容器中,只加入2 mol C3,500 ℃时充分反应达到平衡后,吸收热量Q3 kJ,C3的浓度________(填“>”“=”或“<”)w mol·L-1,Q1、Q2、Q3之间满足何种关系:Q3=________。
解析:在同一容器中投入2 mol A2和1 mol B2与投入2 mol C3达到的平衡状态相同,所以反应达到平衡后,C3的浓度等于w mol·L-1;在同一容器中投入2 mol A2和1 mol B2,反应正向进行,相同条件下,投入2 mol C3相当于反应逆向进行,此时,反应的ΔH=Q1 kJ·mol-1,根据反应达到平衡后,C3的浓度相同及三段式计算可得,Q1=Q2+Q3,即Q3=Q1-Q2。
答案:= Q1-Q2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),则下列结论正确的是________。
A.反应速率:c>b>a
B.达到平衡时A2的转化率:b>a>c
C.T2>T1
D.b点对应的状态,A2和B2的起始物质的量之比为2∶1
√
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析:增大反应体系中B2的物质的量,反应物的浓度变大,反应速率:c>b>a,A正确;
增大一种反应物的量,则另一种反应物的转化率增大,故达到平衡时A2的转化率大小为c>b>a,B错误;
正反应是放热反应,所以降低温度,平衡正向移动,C3的平衡体积分数增大,故T2<T1,C错误;
当投料比为化学式前的系数之比时,平衡时产物的体积分数最大,则b点对应的状态,A2和B2的起始物质的量之比为2∶1,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(5)若将上述容器改为恒压容器,起始时加入4 mol A2和2 mol B2,500 ℃时充分反应达到平衡后,放出热量Q4 kJ,则Q2________Q4(填“>”“<”或“=”)。
解析:恒压条件下,相当给原平衡加压,平衡正向移动,转化率变大,Q2<Q4。
答案:<
1
2
3
4
5
6
7
8
9
10
11
12
13
14
(6)下列措施可以同时提高反应速率和B2转化率的是________。
A.选择适当的催化剂
B.增大压强
C.及时分离生成的C3
D.升高温度
解析:选择适当的催化剂,平衡不移动,B2的转化率不变,故A错误;增大压强,反应速率增大,平衡向正反应方向移动,B2的转化率增大,故B正确;及时分离生成的C3,反应速率减小,故C错误;升高温度,平衡向逆反应方向移动,B2的转化率减小,故D错误。
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
