催化剂的重新认识(17张ppt)
图片预览


文档简介
(共17张PPT)
奉化中学 赵俊
催化剂,让我再多看你一眼!
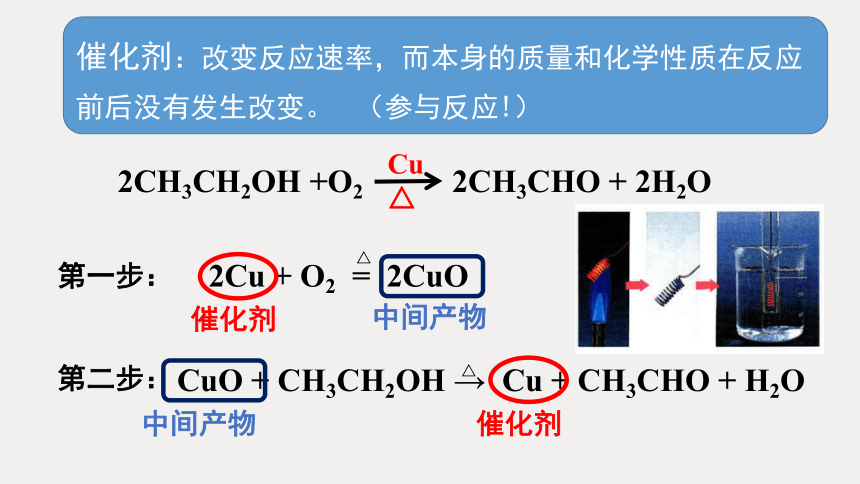
2Cu + O2 = 2CuO
△
CuO + CH3CH2OH → Cu + CH3CHO + H2O
△
Cu
△
2CH3CH2OH +O2 2CH3CHO + 2H2O
第一步:
第二步:
催化剂
中间产物
中间产物
催化剂
催化剂:改变反应速率,而本身的质量和化学性质在反应前后没有发生改变。
(参与反应!)
(17-4-31)
1. 已知:2NaClO3+H2O2+H2SO4 = 2ClO2↑+O2↑+Na2SO4+2H2O
Clˉ存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①__________________________________(用离子方程式表示),
②H2O2+Cl2 = 2Clˉ+O2+2H+。
2ClO3- + 2Cl- + 4H+ = 2ClO2 + Cl2 + 2H2O
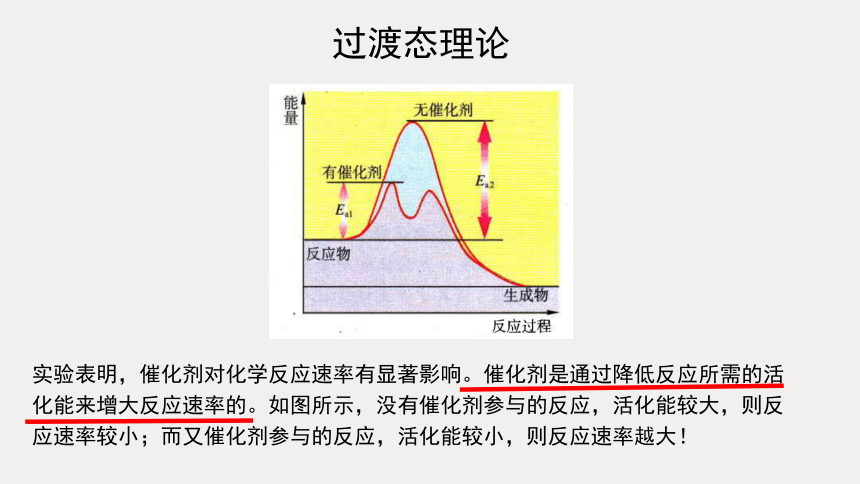
为什么催化剂参与反应就能加快反应速率?
过渡态理论
实验表明,催化剂对化学反应速率有显著影响。催化剂是通过降低反应所需的活化能来增大反应速率的。如图所示,没有催化剂参与的反应,活化能较大,则反应速率较小;而又催化剂参与的反应,活化能较小,则反应速率越大!
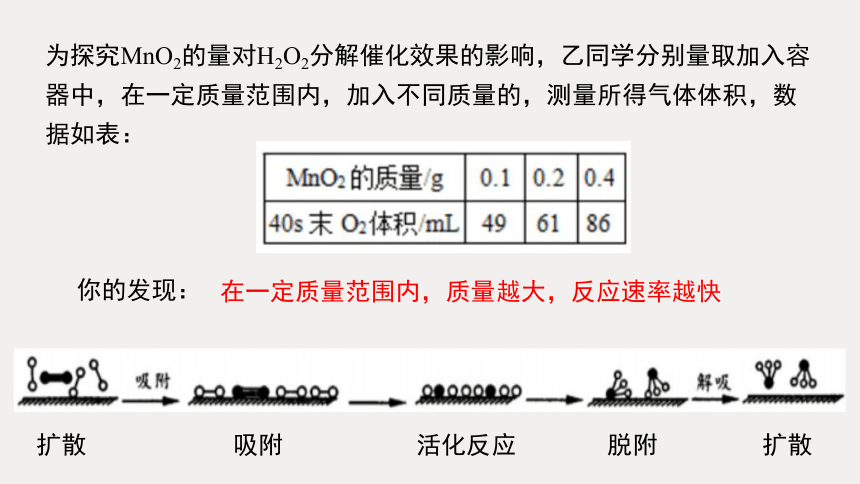
为探究MnO2的量对H2O2分解催化效果的影响,乙同学分别量取加入容器中,在一定质量范围内,加入不同质量的,测量所得气体体积,数据如表:
你的发现:
在一定质量范围内,质量越大,反应速率越快
扩散 吸附 活化反应 脱附 扩散
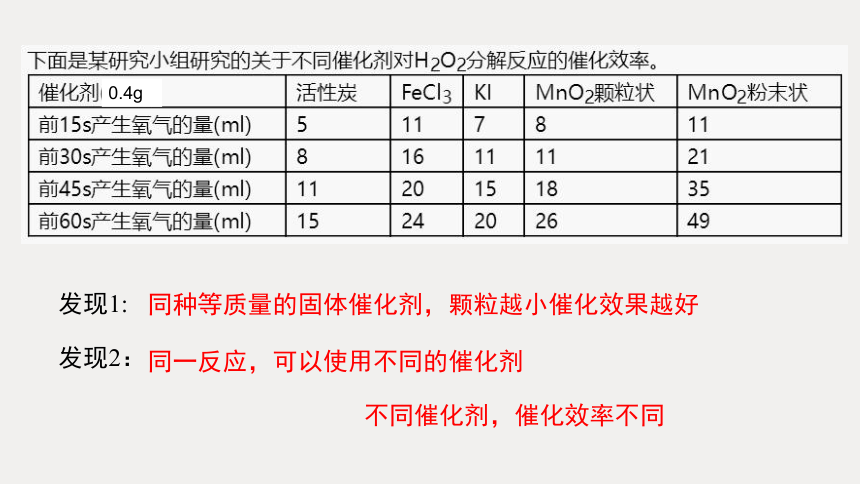
0.4g
发现1:
发现2:
同种等质量的固体催化剂,颗粒越小催化效果越好
同一反应,可以使用不同的催化剂
不同催化剂,催化效率不同
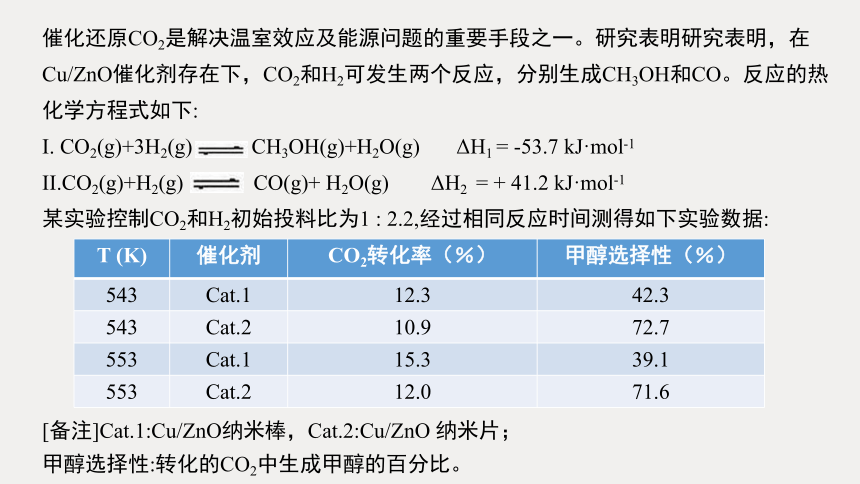
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
某实验控制CO2和H2初始投料比为1 : 2.2,经过相同反应时间测得如下实验数据:
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO 纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
T (K) 催化剂 CO2转化率(%) 甲醇选择性(%)
543 Cat.1 12.3 42.3
543 Cat.2 10.9 72.7
553 Cat.1 15.3 39.1
553 Cat.2 12.0 71.6
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
T (K) 催化剂 CO2转化率(%) 甲醇选择性(%)
543 Cat.1 12.3 42.3
543 Cat.2 10.9 72.7
553 Cat.1 15.3 39.1
553 Cat.2 12.0 71.6
问题1:543K时,Cat.1对反应I、II催化效果相同吗?如果不同,对哪个
反应催化效果更好?为什么?
问题2:543K时,Cat.2对反应I、II催化效果相同吗?如果不同,对哪个
反应催化效果更好?为什么?
问题3:工业生产中想要得到更多的目标产物CH3OH,选哪一种催化剂?
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
问题4:在右图中分别画出反应I在无催化剂、
有Cat.1和由Cat.2三种情况下
“反应过程~能量”示意图。
问题5:表中CO2 的转化率数据指的是平衡转化率还是非平衡转化率?
问题6:在543K时,其他条件相同时,使用
Cat.1和Cat.2,在图中画出反应开始
至达到化学平衡状态时CH3OH的产
率与时间关系曲线
T (K) 催化剂 CO2转化率(%) 甲醇选择性(%)
543 Cat.1 12.3 42.3
543 Cat.2 10.9 72.7
553 Cat.1 15.3 39.1
553 Cat.2 12.0 71.6
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
问题7:在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用Cat.1和Cat.2催化时的转化率与温度的、关系如图所示
(1)a、b、c、d、e点是否到达平衡状态?
(2)在图中描绘出CO2的平衡转化率随温度变化的曲线
(3)c点后CO2转化率降低的原因可能有哪些?
(4)e点转化率出现突变的原因可能是什么?
含碳物质(或其他物质)在催化剂孔中沉积,造成孔径减小,使反应物分子不能扩散进入孔中
由高温引起的催化剂结构和性能的变化。
杂质吸附在活性中心上,与活性中心作用,变成别的物质
扩散 吸附 活化反应 脱附 扩散
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
问题8:有利于提高CO2转化为CH3OH平衡转化率的措施有____________
A. 使用催化剂Cat.1 B. 使用催化剂Cat.2
C. 降低反应温度 D. 投料比不变,增加反应物的浓度
E. 增大CO2和H2的初始投料比
C D
问题9:既然催化剂不能提高CO2转化为CH3OH平衡转化率,为什么工业生产中
却要使用催化剂呢?
【试一试】1. 用水吸收NOX的相关热化学方程式如下:
反应相同时间NOx的去除率随反应温度的变化曲线
如图所示,在50~250℃范围内随着温度的升高,
NOx的去除率先迅速上升后上升缓慢的主要原因是
________________________________________;
当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是________________。
迅速上升是催化剂活性随温度升高与温度升高共同使NOx去除反应速率迅速增大;上升缓慢主要是温度升高引起的NOx去除反应速率增大
催化剂活性下降
【试一试2】
B. 催化剂M在温度高于500℃催化活性降低
√
A. c曲线的最高点一定到达平衡状态
×
C. 甲醇的选择性越高,产率就越高
×
D. 要提高CO转化为CH3OH的平衡转化率使用催化剂Q最佳
×
E. 催化剂可以降低反应的活化能和焓变
×
奉化中学 赵俊
催化剂,让我再多看你一眼!
2Cu + O2 = 2CuO
△
CuO + CH3CH2OH → Cu + CH3CHO + H2O
△
Cu
△
2CH3CH2OH +O2 2CH3CHO + 2H2O
第一步:
第二步:
催化剂
中间产物
中间产物
催化剂
催化剂:改变反应速率,而本身的质量和化学性质在反应前后没有发生改变。
(参与反应!)
(17-4-31)
1. 已知:2NaClO3+H2O2+H2SO4 = 2ClO2↑+O2↑+Na2SO4+2H2O
Clˉ存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①__________________________________(用离子方程式表示),
②H2O2+Cl2 = 2Clˉ+O2+2H+。
2ClO3- + 2Cl- + 4H+ = 2ClO2 + Cl2 + 2H2O
为什么催化剂参与反应就能加快反应速率?
过渡态理论
实验表明,催化剂对化学反应速率有显著影响。催化剂是通过降低反应所需的活化能来增大反应速率的。如图所示,没有催化剂参与的反应,活化能较大,则反应速率较小;而又催化剂参与的反应,活化能较小,则反应速率越大!
为探究MnO2的量对H2O2分解催化效果的影响,乙同学分别量取加入容器中,在一定质量范围内,加入不同质量的,测量所得气体体积,数据如表:
你的发现:
在一定质量范围内,质量越大,反应速率越快
扩散 吸附 活化反应 脱附 扩散
0.4g
发现1:
发现2:
同种等质量的固体催化剂,颗粒越小催化效果越好
同一反应,可以使用不同的催化剂
不同催化剂,催化效率不同
催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
某实验控制CO2和H2初始投料比为1 : 2.2,经过相同反应时间测得如下实验数据:
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO 纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
T (K) 催化剂 CO2转化率(%) 甲醇选择性(%)
543 Cat.1 12.3 42.3
543 Cat.2 10.9 72.7
553 Cat.1 15.3 39.1
553 Cat.2 12.0 71.6
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
T (K) 催化剂 CO2转化率(%) 甲醇选择性(%)
543 Cat.1 12.3 42.3
543 Cat.2 10.9 72.7
553 Cat.1 15.3 39.1
553 Cat.2 12.0 71.6
问题1:543K时,Cat.1对反应I、II催化效果相同吗?如果不同,对哪个
反应催化效果更好?为什么?
问题2:543K时,Cat.2对反应I、II催化效果相同吗?如果不同,对哪个
反应催化效果更好?为什么?
问题3:工业生产中想要得到更多的目标产物CH3OH,选哪一种催化剂?
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
问题4:在右图中分别画出反应I在无催化剂、
有Cat.1和由Cat.2三种情况下
“反应过程~能量”示意图。
问题5:表中CO2 的转化率数据指的是平衡转化率还是非平衡转化率?
问题6:在543K时,其他条件相同时,使用
Cat.1和Cat.2,在图中画出反应开始
至达到化学平衡状态时CH3OH的产
率与时间关系曲线
T (K) 催化剂 CO2转化率(%) 甲醇选择性(%)
543 Cat.1 12.3 42.3
543 Cat.2 10.9 72.7
553 Cat.1 15.3 39.1
553 Cat.2 12.0 71.6
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
问题7:在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用Cat.1和Cat.2催化时的转化率与温度的、关系如图所示
(1)a、b、c、d、e点是否到达平衡状态?
(2)在图中描绘出CO2的平衡转化率随温度变化的曲线
(3)c点后CO2转化率降低的原因可能有哪些?
(4)e点转化率出现突变的原因可能是什么?
含碳物质(或其他物质)在催化剂孔中沉积,造成孔径减小,使反应物分子不能扩散进入孔中
由高温引起的催化剂结构和性能的变化。
杂质吸附在活性中心上,与活性中心作用,变成别的物质
扩散 吸附 活化反应 脱附 扩散
I. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 = -53.7 kJ·mol-1
II.CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2 = + 41.2 kJ·mol-1
问题8:有利于提高CO2转化为CH3OH平衡转化率的措施有____________
A. 使用催化剂Cat.1 B. 使用催化剂Cat.2
C. 降低反应温度 D. 投料比不变,增加反应物的浓度
E. 增大CO2和H2的初始投料比
C D
问题9:既然催化剂不能提高CO2转化为CH3OH平衡转化率,为什么工业生产中
却要使用催化剂呢?
【试一试】1. 用水吸收NOX的相关热化学方程式如下:
反应相同时间NOx的去除率随反应温度的变化曲线
如图所示,在50~250℃范围内随着温度的升高,
NOx的去除率先迅速上升后上升缓慢的主要原因是
________________________________________;
当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是________________。
迅速上升是催化剂活性随温度升高与温度升高共同使NOx去除反应速率迅速增大;上升缓慢主要是温度升高引起的NOx去除反应速率增大
催化剂活性下降
【试一试2】
B. 催化剂M在温度高于500℃催化活性降低
√
A. c曲线的最高点一定到达平衡状态
×
C. 甲醇的选择性越高,产率就越高
×
D. 要提高CO转化为CH3OH的平衡转化率使用催化剂Q最佳
×
E. 催化剂可以降低反应的活化能和焓变
×
同课章节目录
