第4章认识化学变化单元测试题-2022-2023学年九年级化学沪教版(全国)上册(有答案)
文档属性
| 名称 | 第4章认识化学变化单元测试题-2022-2023学年九年级化学沪教版(全国)上册(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 129.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-29 19:33:54 | ||
图片预览

文档简介
第4章认识化学变化单元测试题
一、单选题
1.根据质量守恒定律判断,铁丝在氧气中完全燃烧,生成物的质量( )
A.大于铁丝的质量 B.小于铁丝的质量 C.等于铁丝的质量 D.不能确定
2.下列对一氧化碳性质的描述,属于化学性质的是
A.常温下为无色、无味的气体
B.极难溶于水
C.相同状况下,密度比空气略小
D.具有可燃性
3.在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌。)火法炼锌主要发生的化学反应是:,下列说法不正确的是( )
A.X的化学式是CO B.反应前后固体的质量不变
C.中碳元素的化合价为+4 D.该反应有元素的化合价发生改变
4.下列微粒或物质的名称及符号正确的是
A.2Mg2+——2个镁离子 B.3H——3个氢分子
C.氯化钾——KClO3 D.硫酸铝——AlSO4
5.“钻木取火”是古人点燃木柴的一种方法,关于这种引火方法的叙述正确的是
①钻出的木屑增大了与氧气的接触面
②钻出的木屑比原木材着火点低
③钻的目的是升高木柴的着火点
④钻的目的是升温达到木柴的着火点
A.①② B.①③ C.①④ D.②③
6.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成的是
A.H2 B.Cl2 C.NaOH D.NaNO3
7.某同学用一系列实验探究物质的燃烧,得到下列结论,其中不正确的是
A.镁条在氧气和二氧化碳中均能燃烧,说明二氧化碳分子中有氧气
B.玻璃棒不能燃烧而火柴棒可以燃烧,说明燃烧与物质本身性质有关
C.蜡烛在氧气中比在空气中燃烧更旺,说明燃烧与氧气的浓度有关
D.燃烧是一种化学反应,需考虑两方面因素:反应物(内因)和反应条件(外因)
8.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。下列判断错误的是
A.该化合物的质量为3.0g
B.该化合物一定含有碳、氢、氧三种元素
C.该化合物中碳、氢、氧的原子个数比为2:4:1
D.该化合物中碳元素的质量分数是40%
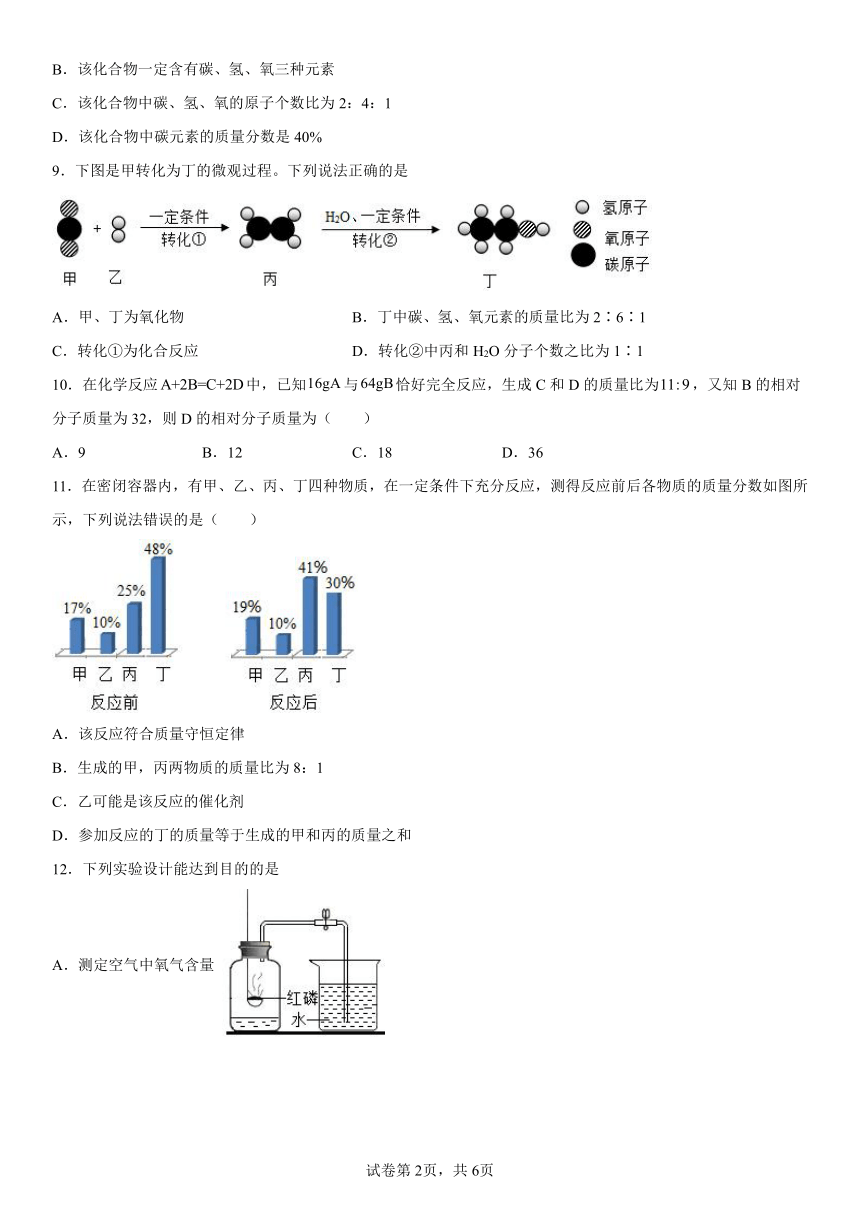
9.下图是甲转化为丁的微观过程。下列说法正确的是
A.甲、丁为氧化物 B.丁中碳、氢、氧元素的质量比为2∶6∶1
C.转化①为化合反应 D.转化②中丙和H2O分子个数之比为1∶1
10.在化学反应中,已知与恰好完全反应,生成C和D的质量比为,又知B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36
11.在密闭容器内,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是( )
A.该反应符合质量守恒定律
B.生成的甲,丙两物质的质量比为8:1
C.乙可能是该反应的催化剂
D.参加反应的丁的质量等于生成的甲和丙的质量之和
12.下列实验设计能达到目的的是
A.测定空气中氧气含量
B.细铁丝在氧气中燃烧
C.探究温度对分子运动快慢的影响
D.探究质量守恒定律
二、填空题
13.乙醇汽油就是在汽油中加入适量的乙醇。
(1)关于乙醇汽油的说法错误的是_______。
A.乙醇属于化合物 B.乙醇属于不可再生资源
C.使用乙醇汽油可减少大气污染 D.使用乙醇汽油可节省石油资源
(2)工业上利用石油中各成分的沸点不同,分离制备汽油、煤油等产品,属于_____(填“物理”或“化学”)变化。
(3)写出乙醇完全燃烧的现象________,汽油和乙醇完全燃烧后的产物相同,则汽油中一定含有____和____(填元素符号 )。
(4)汽车尾气中含有CO、NO,一种新型的催化剂能使二者发生反应,生成两种常见的无毒气体,分别________、________(填化学式)。
14.某校五楼寝室,学生熄灯就寝后,一同学违规点蜡烛看书,不小心引燃蚊帐,导致火灾。就此事件回答下列问题:
(1)从物质燃烧的条件看,蚊帐是_____。
(2)该同学慌忙打开房门,致使火势迅速扩大,其原因是_____。
(3)同寝室同学惊醒后,一边拨打“119”,一边采取了下列自救措施,其中正确的是_____(填序号).A用湿毛巾捂住口鼻迅速逃离 B跳楼逃生 C藏在桌子底下等待救援
(4)消防队员用高压水枪喷水将大火扑灭,水灭火的原理是_____。
15.质量守恒定律的发现对化学的发展作出了巨大贡献。
(1)为验证质量守恒定律,小华设计如图1所示装置进行实验。
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图1所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到______________,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是____________________________。
(2)某反应的微观示意图如图2所示。
①X的化学式是______________。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是______________________________________________________________________。
16.合理运用燃烧与灭火的化学原理对保障生命财产安全非常重要。
(1)2013年12月广州建业大厦发生严重火灾。从燃烧条件分析,大厦内存放的大量鞋、纸箱等物品充当了________________。
(2)高层建筑物通常设计了灭火用的洒水系统。从灭火原理分析,洒水的作用主要是______________。
(3)分析下表中的数据,回答问题:
物质代号 L M N P
熔点/℃ -117 3550 44 -259
沸点/℃ 78 4827 257 -253
着火点/℃ 510 370 40 580
①有人认为“物质的熔、沸点越高,着火点越高”,该结论_______________(填“合理”或“不合理”)。
②已知酒精灯火焰的温度约为500℃。利用上图装置,验证达到可燃物着火点是燃烧的条件之一,上表中可用于完成该实验的两种可燃物是_________和________(填代号)。
三、实验题
17.下列实验均用到红磷或白磷,请分析并回答相关问题。
(1)实验1中红磷要过量的目的是 ___________。
(2)实验2中红磷 ___________(填“需要”或“不需要”)过量。
(3)实验1中,为达到实验目的,红磷 ___________(填“能”或“不能”)用铁丝替代。
(4)实验3水中白磷未燃烧的原因是 ___________。
18.如图所示,将白磷和红磷分装于Y形试管的2个支管中,管口系牢小气球,将2个支管同时伸入相同深度的热水中。
(1)能燃烧的是______________(填“a”、“b”、或“c”)处,该处燃着的磷会很快熄灭,原因可能是________(填序号)。
A.温度降低
B.氧气耗尽
C.管内产生了二氧化碳气体
(2)管口的小气球可以防止__________(填化学式)进入空气,从而使该实验绿色化。
四、计算题
19.二氧化硫属于空气污染物,应处理后排放。32g硫与足量的氧气完全反应,生成二氧化硫的质量是多少
20.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的含量,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份,进行实验。
实验 1 2 3 4
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 M
(1)哪几次反应矿石有剩余 ___________。
(2)上表中M的数值是_________。
(3)试计算这种石灰石中碳酸钙的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.A
5.C
6.D
7.A
8.C
9.D
10.C
11.B
12.A
13.(1)B
(2)物理
(3) C H
(4) N2 CO2
14. (1) 可燃物 增加了氧气的量 (2) A 将可燃物的温度降低到到着火点以下
15.(1) 天平平衡 装置没有密闭,气体逸出 SO2 (2) 化学反应前后,原子质量、数目和种类不变
16.(1)可燃物;(2)降低温度至可燃物着火点以下;(3)①不合理;②M;N
17.(1)充分消耗装置内的氧气
(2)不需要
(3)不能
(4)未与空气(或氧气)接触
18. (1) a B (2) P2O5
19.64g
20.(1)第3次;(2)4.4;(3)80%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.根据质量守恒定律判断,铁丝在氧气中完全燃烧,生成物的质量( )
A.大于铁丝的质量 B.小于铁丝的质量 C.等于铁丝的质量 D.不能确定
2.下列对一氧化碳性质的描述,属于化学性质的是
A.常温下为无色、无味的气体
B.极难溶于水
C.相同状况下,密度比空气略小
D.具有可燃性
3.在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌。)火法炼锌主要发生的化学反应是:,下列说法不正确的是( )
A.X的化学式是CO B.反应前后固体的质量不变
C.中碳元素的化合价为+4 D.该反应有元素的化合价发生改变
4.下列微粒或物质的名称及符号正确的是
A.2Mg2+——2个镁离子 B.3H——3个氢分子
C.氯化钾——KClO3 D.硫酸铝——AlSO4
5.“钻木取火”是古人点燃木柴的一种方法,关于这种引火方法的叙述正确的是
①钻出的木屑增大了与氧气的接触面
②钻出的木屑比原木材着火点低
③钻的目的是升高木柴的着火点
④钻的目的是升温达到木柴的着火点
A.①② B.①③ C.①④ D.②③
6.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成的是
A.H2 B.Cl2 C.NaOH D.NaNO3
7.某同学用一系列实验探究物质的燃烧,得到下列结论,其中不正确的是
A.镁条在氧气和二氧化碳中均能燃烧,说明二氧化碳分子中有氧气
B.玻璃棒不能燃烧而火柴棒可以燃烧,说明燃烧与物质本身性质有关
C.蜡烛在氧气中比在空气中燃烧更旺,说明燃烧与氧气的浓度有关
D.燃烧是一种化学反应,需考虑两方面因素:反应物(内因)和反应条件(外因)
8.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。下列判断错误的是
A.该化合物的质量为3.0g
B.该化合物一定含有碳、氢、氧三种元素
C.该化合物中碳、氢、氧的原子个数比为2:4:1
D.该化合物中碳元素的质量分数是40%
9.下图是甲转化为丁的微观过程。下列说法正确的是
A.甲、丁为氧化物 B.丁中碳、氢、氧元素的质量比为2∶6∶1
C.转化①为化合反应 D.转化②中丙和H2O分子个数之比为1∶1
10.在化学反应中,已知与恰好完全反应,生成C和D的质量比为,又知B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36
11.在密闭容器内,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是( )
A.该反应符合质量守恒定律
B.生成的甲,丙两物质的质量比为8:1
C.乙可能是该反应的催化剂
D.参加反应的丁的质量等于生成的甲和丙的质量之和
12.下列实验设计能达到目的的是
A.测定空气中氧气含量
B.细铁丝在氧气中燃烧
C.探究温度对分子运动快慢的影响
D.探究质量守恒定律
二、填空题
13.乙醇汽油就是在汽油中加入适量的乙醇。
(1)关于乙醇汽油的说法错误的是_______。
A.乙醇属于化合物 B.乙醇属于不可再生资源
C.使用乙醇汽油可减少大气污染 D.使用乙醇汽油可节省石油资源
(2)工业上利用石油中各成分的沸点不同,分离制备汽油、煤油等产品,属于_____(填“物理”或“化学”)变化。
(3)写出乙醇完全燃烧的现象________,汽油和乙醇完全燃烧后的产物相同,则汽油中一定含有____和____(填元素符号 )。
(4)汽车尾气中含有CO、NO,一种新型的催化剂能使二者发生反应,生成两种常见的无毒气体,分别________、________(填化学式)。
14.某校五楼寝室,学生熄灯就寝后,一同学违规点蜡烛看书,不小心引燃蚊帐,导致火灾。就此事件回答下列问题:
(1)从物质燃烧的条件看,蚊帐是_____。
(2)该同学慌忙打开房门,致使火势迅速扩大,其原因是_____。
(3)同寝室同学惊醒后,一边拨打“119”,一边采取了下列自救措施,其中正确的是_____(填序号).A用湿毛巾捂住口鼻迅速逃离 B跳楼逃生 C藏在桌子底下等待救援
(4)消防队员用高压水枪喷水将大火扑灭,水灭火的原理是_____。
15.质量守恒定律的发现对化学的发展作出了巨大贡献。
(1)为验证质量守恒定律,小华设计如图1所示装置进行实验。
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图1所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到______________,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是____________________________。
(2)某反应的微观示意图如图2所示。
①X的化学式是______________。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是______________________________________________________________________。
16.合理运用燃烧与灭火的化学原理对保障生命财产安全非常重要。
(1)2013年12月广州建业大厦发生严重火灾。从燃烧条件分析,大厦内存放的大量鞋、纸箱等物品充当了________________。
(2)高层建筑物通常设计了灭火用的洒水系统。从灭火原理分析,洒水的作用主要是______________。
(3)分析下表中的数据,回答问题:
物质代号 L M N P
熔点/℃ -117 3550 44 -259
沸点/℃ 78 4827 257 -253
着火点/℃ 510 370 40 580
①有人认为“物质的熔、沸点越高,着火点越高”,该结论_______________(填“合理”或“不合理”)。
②已知酒精灯火焰的温度约为500℃。利用上图装置,验证达到可燃物着火点是燃烧的条件之一,上表中可用于完成该实验的两种可燃物是_________和________(填代号)。
三、实验题
17.下列实验均用到红磷或白磷,请分析并回答相关问题。
(1)实验1中红磷要过量的目的是 ___________。
(2)实验2中红磷 ___________(填“需要”或“不需要”)过量。
(3)实验1中,为达到实验目的,红磷 ___________(填“能”或“不能”)用铁丝替代。
(4)实验3水中白磷未燃烧的原因是 ___________。
18.如图所示,将白磷和红磷分装于Y形试管的2个支管中,管口系牢小气球,将2个支管同时伸入相同深度的热水中。
(1)能燃烧的是______________(填“a”、“b”、或“c”)处,该处燃着的磷会很快熄灭,原因可能是________(填序号)。
A.温度降低
B.氧气耗尽
C.管内产生了二氧化碳气体
(2)管口的小气球可以防止__________(填化学式)进入空气,从而使该实验绿色化。
四、计算题
19.二氧化硫属于空气污染物,应处理后排放。32g硫与足量的氧气完全反应,生成二氧化硫的质量是多少
20.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的含量,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份,进行实验。
实验 1 2 3 4
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 M
(1)哪几次反应矿石有剩余 ___________。
(2)上表中M的数值是_________。
(3)试计算这种石灰石中碳酸钙的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.A
5.C
6.D
7.A
8.C
9.D
10.C
11.B
12.A
13.(1)B
(2)物理
(3) C H
(4) N2 CO2
14. (1) 可燃物 增加了氧气的量 (2) A 将可燃物的温度降低到到着火点以下
15.(1) 天平平衡 装置没有密闭,气体逸出 SO2 (2) 化学反应前后,原子质量、数目和种类不变
16.(1)可燃物;(2)降低温度至可燃物着火点以下;(3)①不合理;②M;N
17.(1)充分消耗装置内的氧气
(2)不需要
(3)不能
(4)未与空气(或氧气)接触
18. (1) a B (2) P2O5
19.64g
20.(1)第3次;(2)4.4;(3)80%
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
