2022-2023学年人教版(2019)选择性必修1教学课件2.2 化学平衡第三课时(共32 张ppt)
文档属性
| 名称 | 2022-2023学年人教版(2019)选择性必修1教学课件2.2 化学平衡第三课时(共32 张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 19:58:46 | ||
图片预览






文档简介
(共32张PPT)
2.2 化学平衡
(第三课时)
2022-2023学年人教版(2019)选择性必修1教学课件
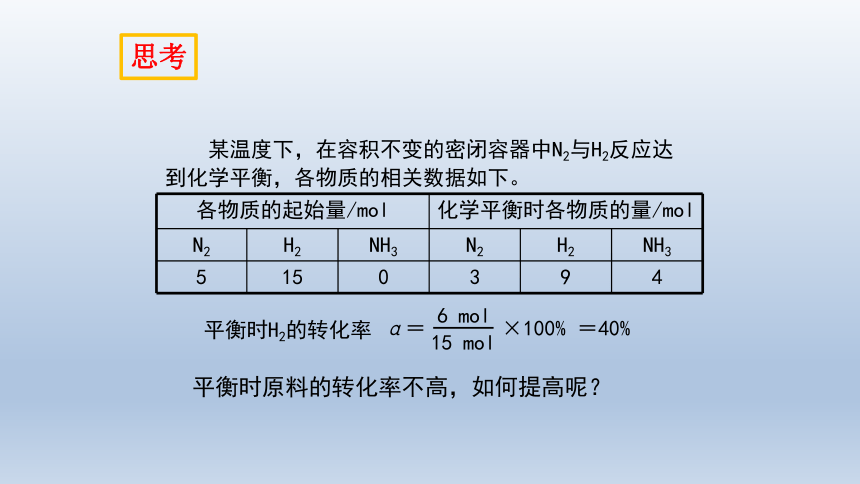
某温度下,在容积不变的密闭容器中N2与H2反应达到化学平衡,各物质的相关数据如下。
各物质的起始量/mol 化学平衡时各物质的量/mol N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
思考
α= ×100% =40%
6 mol
15 mol
平衡时H2的转化率
平衡时原料的转化率不高,如何提高呢?
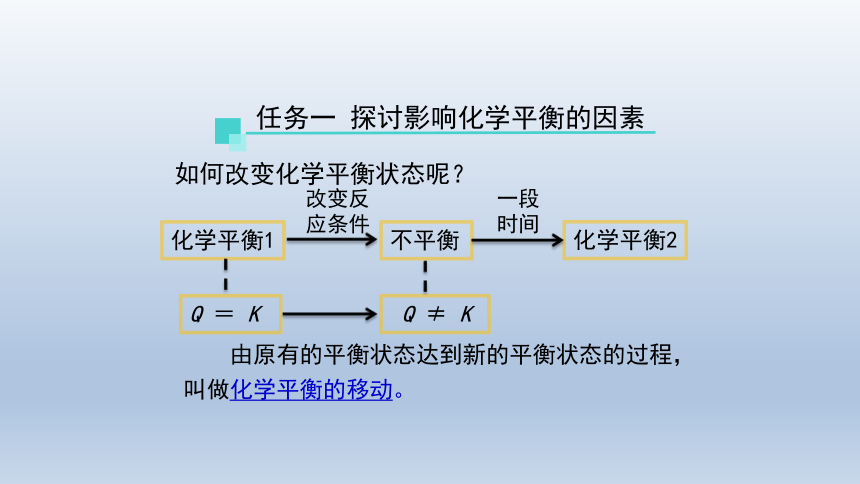
任务一 探讨影响化学平衡的因素
化学平衡1
Q = K
改变反
应条件
不平衡
Q ≠ K
一段时间
化学平衡2
如何改变化学平衡状态呢?
由原有的平衡状态达到新的平衡状态的过程,叫做化学平衡的移动。
想一想
改变哪些反应条件可使Q ≠ K,从而改变化学平衡状态?
改变浓度,使Q 发生改变
改变温度,使K 发生改变
浓度商只与浓度有关,平衡常数只与温度有关。
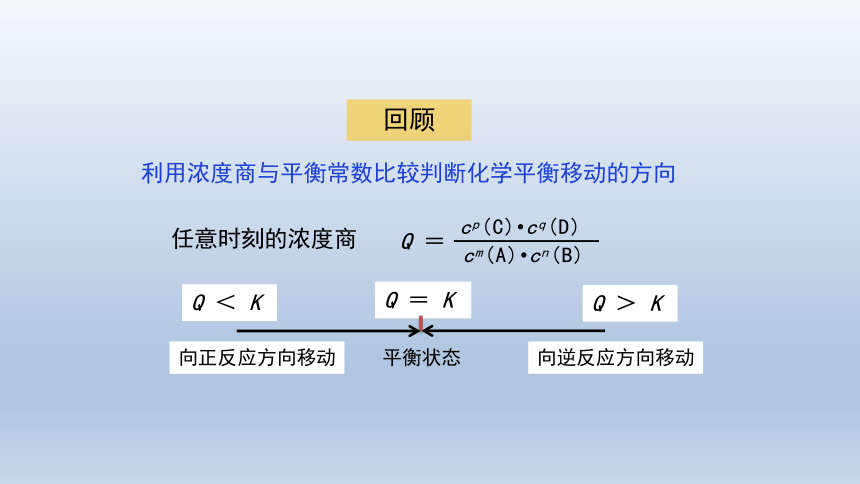
回顾
利用浓度商与平衡常数比较判断化学平衡移动的方向
向正反应方向移动
向逆反应方向移动
Q = K
任意时刻的浓度商
Q =
cp(C) cq(D)
cm(A) cn(B)
Q < K
Q > K
平衡状态
反应物浓度增大,Q 减小,使得Q < K,反应不再平衡,向正反应方向移动。
若其他条件不变,仅增加反应物的浓度,化学平衡如何移动?
任意时刻的浓度商
Q =
cp(C) cq(D)
cm(A) cn(B)
任务二 研究浓度对化学平衡的影响
m A(g) + n B(g) p C(g) + q D(g)
反应物浓度减小,Q 变大,使得Q > K,反应不再平衡,向逆反应方向移动。
理论分析
可逆反应 包含变量
便于操作 现象明显
如何选择研究体系?
变量控制
多变量问题如何进行研究?
实验验证
如何增加反应物的浓度?
如何减小反应物的浓度?
滴加饱和FeCl3溶液或
高浓度的KSCN溶液
加入铁粉降低Fe3+浓度
研究体系:
实验方案:
红色
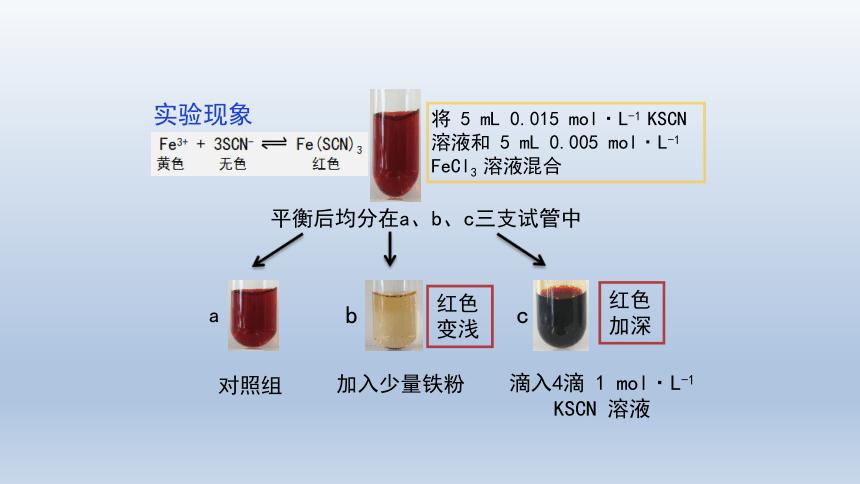
Fe3+ + 3SCN- Fe(SCN)3
无色
验证浓度对化学平衡的影响
黄色
变量控制:温度等其他因素不变,只改变一种物质的浓度。
保持溶液总体积(基本)不变,使其他粒子浓度不变
加入少量铁粉
滴入4滴 1 mol·L-1 KSCN 溶液
实验操作
将 5 mL 0.015 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
平衡后均分在a、b、c三支试管中
a
b
c
对照组
溶液总体积基本不变
加入少量铁粉
实验现象
a
c
对照组
b
红色加深
红色变浅
将 5 mL 0.015 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
滴入4滴 1 mol·L-1 KSCN 溶液
平衡后均分在a、b、c三支试管中
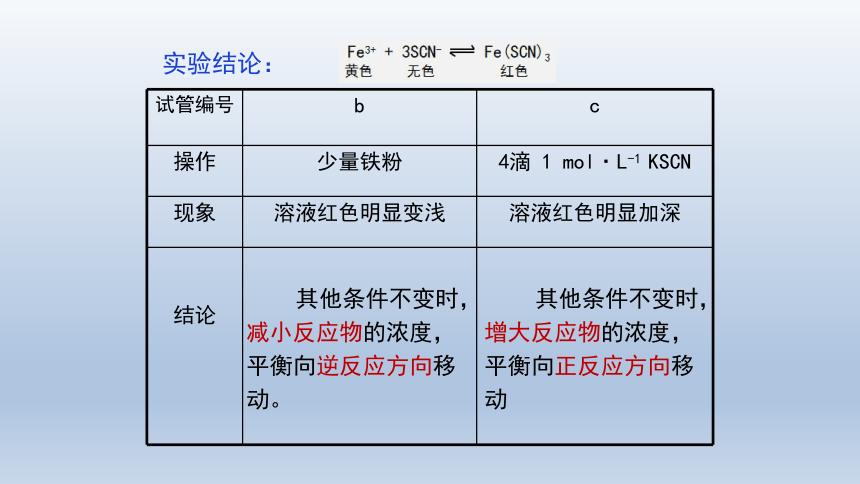
试管编号 b c
操作 少量铁粉 4滴 1 mol·L-1 KSCN
现象 溶液红色明显变浅 溶液红色明显加深
结论
实验结论:
其他条件不变时,减小反应物的浓度,平衡向逆反应方向移动。
其他条件不变时,增大反应物的浓度,平衡向正反应方向移动
其他条件不变时:
减小生成物的浓度,平衡向正反应方向移动;
增大生成物的浓度,平衡向逆反应方向移动。
大量实验也可以证明:
压强的改变,可能影响反应体系中多种物质的浓度。如果增大压强(缩小容积)以下反应各物质的浓度会如何变化?浓度商会如何变化?
2NO2(g) N2O4(g)
红棕色
无色
任务三 研究压强对化学平衡的影响
想一想
理论分析
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
压缩容积至V/2 时
b
a2
= K
2NO2(g) N2O4(g)
同温度:
Q1=
2b
(2a)2
b
2a2
Q2=
2p1
2a
2b
=
通过计算Q2 =K/2 ,
即Q2 < K 向正反应方移动
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
扩大容积至2V 时
b
a2
= K
P1
a
b
通过计算Q2 =2 K, 即Q2 > K 向逆反应方移动
1
2
1
2
1
2
1
2
b
( a)2
=
2b
a2
Q2=
1
2
2NO2(g) N2O4(g)
Q1=
同温度:
实验验证
验证压强对化学平衡的影响
向正反应方向移动
容积减小
原平衡气①
颜色变深②
颜色又变浅③
物质浓度瞬间增大
加压前
实验现象与分析
2NO2(g) N2O4(g)
红棕色
无色
加压
NO2浓度比②中的减小
容积增大
原平衡气①
颜色变浅②
颜色又变深③
实验现象与分析
减压
向逆反应方向移动
物质浓度瞬间减小
减压前
NO2浓度比②中的增大
2NO2(g) N2O4(g)
红棕色
无色
实验结论:
当该可逆反应达到平衡,其他条件不变时:
增大压强,平衡向正反应方向移动;
减小压强,平衡向逆反应方向移动。
验证压强对化学平衡的影响
2NO2(g) N2O4(g)
红棕色
无色
该反应中反应前后气体的物质的量有什么变化特点?
想一想
2NO2(g) N2O4(g)
红棕色
无色
该反应正反应方向是气体分子数减小的反应,
逆反应方向反应是气体分子数增大的反应。
其他条件不变时,增大压强(减小容器的容积)会使化学平衡向气体体积缩小的方向移动;减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
实验结论:
想一想
是否压强改变,化学平衡就一定会移动呢?
对于H2(g)+ I2(g) 2HI(g) 当其他条件不变,减小或增大容器容积来改变压强时,化学平衡如何变化呢?
想一想
对于反应前后气体物质的总体积没有变化的可逆反应,压强改变不能使化学平衡发生移动。
对于只有固体或液体参加的反应,体系压强的改变会使化学平衡移动吗?
固态或液态物质的体积受压强影响很小,可以忽略不计。当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
想一想
改变反应条件 化学平衡移动方向 移动规律
增大反应物浓度 向正反应方向
减小反应物浓度 向逆反应方向
增大压强 向气体体积缩小方向
减小压强 向气体体积增大方向
升高温度
降低温度
整理与归纳
向减少反应物浓度的方向
向增大反应物浓度的方向
向减小压强的方向
向增大压强的方向
任务四 探究温度对化学平衡的影响
实验 浸泡在热水中 浸泡在冰水中
现象 颜色加深 颜色变浅
移动方向
结论 探究温度对化学平衡的影响
2NO2(g) N2O4(g)
红棕色
无色
向逆反应方向移动
向正反应方向移动
实验现象和结论
H =-56.9 kJ/mol
其他条件不变时,
升高温度,化学平衡向吸热反应方向移动;
降低温度,化学平衡向放热反应方向移动。
加入催化剂会使化学平衡发生移动吗?
催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间。
想一想
改变反应条件 化学平衡移动方向 移动规律
增大反应物浓度 向正反应方向
减小反应物浓度 向逆反应方向
增大压强 向气体体积缩小方向
减小压强 向气体体积增大方向
升高温度
降低温度
向反应物浓度减少的方向
向反应物浓度增大的方向
向压强减小的方向
向压强增大的方向
整理与归纳
向温度降低的方向
向温度升高的方向
向吸热反应方向
向放热反应方向
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动。
这就是勒夏特列原理,也称化学平衡移动原理。
勒夏特列
勒夏特列原理
(1850—1936)
利用化学平衡移动原理,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。
思考
请同学们课下思考:合成氨中,选择哪些反应条件可
以增大氨气的含量呢?
化学平衡状态
化学平衡移动
勒夏特列原理
温度
压强
Q 与K比较
(定量分析)
(定性分析)
化学平衡的建立
定量研究:化学平衡常数
浓度
改变
小结
2.2 化学平衡
(第三课时)
2022-2023学年人教版(2019)选择性必修1教学课件
某温度下,在容积不变的密闭容器中N2与H2反应达到化学平衡,各物质的相关数据如下。
各物质的起始量/mol 化学平衡时各物质的量/mol N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
思考
α= ×100% =40%
6 mol
15 mol
平衡时H2的转化率
平衡时原料的转化率不高,如何提高呢?
任务一 探讨影响化学平衡的因素
化学平衡1
Q = K
改变反
应条件
不平衡
Q ≠ K
一段时间
化学平衡2
如何改变化学平衡状态呢?
由原有的平衡状态达到新的平衡状态的过程,叫做化学平衡的移动。
想一想
改变哪些反应条件可使Q ≠ K,从而改变化学平衡状态?
改变浓度,使Q 发生改变
改变温度,使K 发生改变
浓度商只与浓度有关,平衡常数只与温度有关。
回顾
利用浓度商与平衡常数比较判断化学平衡移动的方向
向正反应方向移动
向逆反应方向移动
Q = K
任意时刻的浓度商
Q =
cp(C) cq(D)
cm(A) cn(B)
Q < K
Q > K
平衡状态
反应物浓度增大,Q 减小,使得Q < K,反应不再平衡,向正反应方向移动。
若其他条件不变,仅增加反应物的浓度,化学平衡如何移动?
任意时刻的浓度商
Q =
cp(C) cq(D)
cm(A) cn(B)
任务二 研究浓度对化学平衡的影响
m A(g) + n B(g) p C(g) + q D(g)
反应物浓度减小,Q 变大,使得Q > K,反应不再平衡,向逆反应方向移动。
理论分析
可逆反应 包含变量
便于操作 现象明显
如何选择研究体系?
变量控制
多变量问题如何进行研究?
实验验证
如何增加反应物的浓度?
如何减小反应物的浓度?
滴加饱和FeCl3溶液或
高浓度的KSCN溶液
加入铁粉降低Fe3+浓度
研究体系:
实验方案:
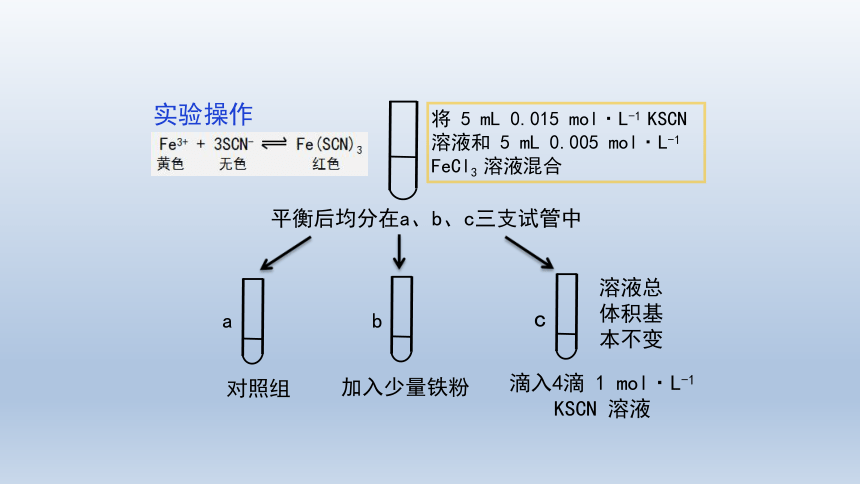
红色
Fe3+ + 3SCN- Fe(SCN)3
无色
验证浓度对化学平衡的影响
黄色
变量控制:温度等其他因素不变,只改变一种物质的浓度。
保持溶液总体积(基本)不变,使其他粒子浓度不变
加入少量铁粉
滴入4滴 1 mol·L-1 KSCN 溶液
实验操作
将 5 mL 0.015 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
平衡后均分在a、b、c三支试管中
a
b
c
对照组
溶液总体积基本不变
加入少量铁粉
实验现象
a
c
对照组
b
红色加深
红色变浅
将 5 mL 0.015 mol·L-1 KSCN 溶液和 5 mL 0.005 mol·L-1 FeCl3 溶液混合
滴入4滴 1 mol·L-1 KSCN 溶液
平衡后均分在a、b、c三支试管中
试管编号 b c
操作 少量铁粉 4滴 1 mol·L-1 KSCN
现象 溶液红色明显变浅 溶液红色明显加深
结论
实验结论:
其他条件不变时,减小反应物的浓度,平衡向逆反应方向移动。
其他条件不变时,增大反应物的浓度,平衡向正反应方向移动
其他条件不变时:
减小生成物的浓度,平衡向正反应方向移动;
增大生成物的浓度,平衡向逆反应方向移动。
大量实验也可以证明:
压强的改变,可能影响反应体系中多种物质的浓度。如果增大压强(缩小容积)以下反应各物质的浓度会如何变化?浓度商会如何变化?
2NO2(g) N2O4(g)
红棕色
无色
任务三 研究压强对化学平衡的影响
想一想
理论分析
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
压缩容积至V/2 时
b
a2
= K
2NO2(g) N2O4(g)
同温度:
Q1=
2b
(2a)2
b
2a2
Q2=
2p1
2a
2b
=
通过计算Q2 =K/2 ,
即Q2 < K 向正反应方移动
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
扩大容积至2V 时
b
a2
= K
P1
a
b
通过计算Q2 =2 K, 即Q2 > K 向逆反应方移动
1
2
1
2
1
2
1
2
b
( a)2
=
2b
a2
Q2=
1
2
2NO2(g) N2O4(g)
Q1=
同温度:
实验验证
验证压强对化学平衡的影响
向正反应方向移动
容积减小
原平衡气①
颜色变深②
颜色又变浅③
物质浓度瞬间增大
加压前
实验现象与分析
2NO2(g) N2O4(g)
红棕色
无色
加压
NO2浓度比②中的减小
容积增大
原平衡气①
颜色变浅②
颜色又变深③
实验现象与分析
减压
向逆反应方向移动
物质浓度瞬间减小
减压前
NO2浓度比②中的增大
2NO2(g) N2O4(g)
红棕色
无色
实验结论:
当该可逆反应达到平衡,其他条件不变时:
增大压强,平衡向正反应方向移动;
减小压强,平衡向逆反应方向移动。
验证压强对化学平衡的影响
2NO2(g) N2O4(g)
红棕色
无色
该反应中反应前后气体的物质的量有什么变化特点?
想一想
2NO2(g) N2O4(g)
红棕色
无色
该反应正反应方向是气体分子数减小的反应,
逆反应方向反应是气体分子数增大的反应。
其他条件不变时,增大压强(减小容器的容积)会使化学平衡向气体体积缩小的方向移动;减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
实验结论:
想一想
是否压强改变,化学平衡就一定会移动呢?
对于H2(g)+ I2(g) 2HI(g) 当其他条件不变,减小或增大容器容积来改变压强时,化学平衡如何变化呢?
想一想
对于反应前后气体物质的总体积没有变化的可逆反应,压强改变不能使化学平衡发生移动。
对于只有固体或液体参加的反应,体系压强的改变会使化学平衡移动吗?
固态或液态物质的体积受压强影响很小,可以忽略不计。当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
想一想
改变反应条件 化学平衡移动方向 移动规律
增大反应物浓度 向正反应方向
减小反应物浓度 向逆反应方向
增大压强 向气体体积缩小方向
减小压强 向气体体积增大方向
升高温度
降低温度
整理与归纳
向减少反应物浓度的方向
向增大反应物浓度的方向
向减小压强的方向
向增大压强的方向
任务四 探究温度对化学平衡的影响
实验 浸泡在热水中 浸泡在冰水中
现象 颜色加深 颜色变浅
移动方向
结论 探究温度对化学平衡的影响
2NO2(g) N2O4(g)
红棕色
无色
向逆反应方向移动
向正反应方向移动
实验现象和结论
H =-56.9 kJ/mol
其他条件不变时,
升高温度,化学平衡向吸热反应方向移动;
降低温度,化学平衡向放热反应方向移动。
加入催化剂会使化学平衡发生移动吗?
催化剂可以同等程度地改变正、逆反应速率,因此对化学平衡的移动没有影响,但可以改变反应达到平衡所需的时间。
想一想
改变反应条件 化学平衡移动方向 移动规律
增大反应物浓度 向正反应方向
减小反应物浓度 向逆反应方向
增大压强 向气体体积缩小方向
减小压强 向气体体积增大方向
升高温度
降低温度
向反应物浓度减少的方向
向反应物浓度增大的方向
向压强减小的方向
向压强增大的方向
整理与归纳
向温度降低的方向
向温度升高的方向
向吸热反应方向
向放热反应方向
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方向移动。
这就是勒夏特列原理,也称化学平衡移动原理。
勒夏特列
勒夏特列原理
(1850—1936)
利用化学平衡移动原理,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。
思考
请同学们课下思考:合成氨中,选择哪些反应条件可
以增大氨气的含量呢?
化学平衡状态
化学平衡移动
勒夏特列原理
温度
压强
Q 与K比较
(定量分析)
(定性分析)
化学平衡的建立
定量研究:化学平衡常数
浓度
改变
小结
