专题2 第二单元 溶液组成的定量研究 第二课时 化学反应的计算(共65张PPT)
文档属性
| 名称 | 专题2 第二单元 溶液组成的定量研究 第二课时 化学反应的计算(共65张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 00:00:00 | ||
图片预览











文档简介
(共65张PPT)
第二课时 化学反应的计算
【课程标准要求】
1.能熟练应用有关物质的量n与微粒数N、物质的质量m、气体体积V、溶液物质的量浓度c间的计算公式,巩固以物质的量为中心的各物理量之间的换算
方法。
2.能基于物质的量认识化学变化,从定量的角度认识化学反应。能运用物质的量及相关物理量根据化学方程式进行简单计算,体会定量研究对化学科学的重要作用,掌握计算的技巧和方法。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
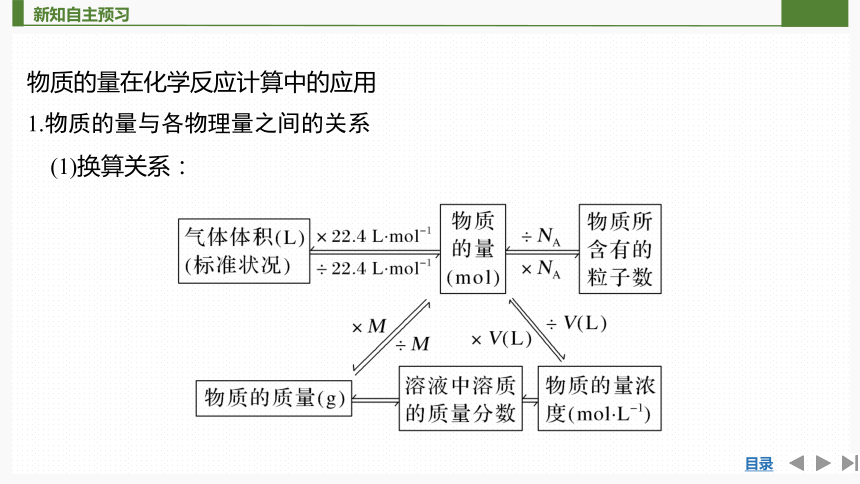
物质的量在化学反应计算中的应用
1.物质的量与各物理量之间的关系
(1)换算关系:
2.化学反应中的计量关系
化学方程式 2Na+2H2O===2NaOH+H2↑
化学计量数之比 2∶2∶2∶1
扩大NA倍之后 ______∶______∶______∶______
物质的量之比 _______∶_______∶_______∶_______
质量之比 46 g∶36 g ∶80 g∶2 g
结论 化学方程式中各物质的化学计量数之比=各物质的________之比=各物质的__________之比=参加反应的气体物质的______ (相同状况)之比。
2NA
2NA
2NA
NA
2 mol
2 mol
2 mol
1 mol
粒子数
物质的量
体积
【微自测】
判断正误,正确的打“√”,错误的打“×”。
√
×
(3)体积为22.4 L的H2的质量为2 g,物质的量为1 mol( )
(4)根据分子的物质的量和分子数可计算阿伏加德罗常数( )
(5)物质在发生化学反应时,它们的质量比等于化学方程式中化学计量数之比
( )
×
√
√
二、化学方程式计算中的常用解题技巧
一、物质的量应用于化学反应的计算
一、物质的量应用于化学反应的计算
1.物质的量应用于化学方程式计算的基本步骤
2.计算过程中的规范化注意事项
(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化:根据化学方程式计算时,要注意两个量的单位要“上下一致,左右相当”。
(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须比较每种已知量与对应化学方程式中计量数比值大小,谁大谁过量,先判断哪种物质过量,然后根据不足量的物质进行计算。
1.对于反应:2A(g)+2B(g)===3C(g)+D(g),化学计量数之比与下列各项不等的
是( )
A.分子数之比
B.物质的量之比
C.质量之比
D.气体体积之比(同温同压)
解析 计量数之比等于物质的量之比等于分子数之比等于同温同压气体体积之比。
C
2.标准状况下,2.8 g铁与足量的稀硫酸反应生成a L氢气,下列关系正确的是
( )
C
解析 根据化学方程式计算时,计量单位必须满足“上下一致,左右相当”。
3.(2021·北京石景山高一期末)把5.1 g镁铝合金的粉末放入过量的盐酸中,得到
5.6 L H2(标准状况)该合金中铝和镁的物质的量之比为( )
A.1∶1 B.2∶1
C.3∶2 D.2∶3
A
二、化学方程式计算中的常用解题技巧
1.守恒法
物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。在化学变化中的各种各样的守恒,如元素质量守恒。
2.差量法
根据化学反应前后物质的有关物理量发生的变化,找出 “理论差量”,如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物、生成物的有关量成正比。差量法就是借助这种比例关系求解的方法。
差量可以是物质的量的差,对固体、液体而言,差量可以是质量差、粒子个数差;对气体而言,差量还可以是同温、同压下的体积差。
3.关系式法
一般用于解答连续反应类型的计算。关系式是表示物质间关系的一种简化式子,能解决多步反应,计算最简捷。多步反应中建立关系式的方法:
4.将一定量的铁放入稀硫酸中,完全反应后,溶液质量增加5.4 g,计算参加反
应的铁的物质的量( )
A.5.6 g B.0.1 mol
C.5.4 g D.1 mol
B
5.将a L NH3通过灼热的装有铁触媒的硬质玻璃管发生反应2NH3(g)===N2(g)+3H2(g)后,气体体积变为b L(气体体积均在同温同压下测定),该b L 气体中NH3的体积分数是( )
C
D
1.两种或多种物质在发生化学反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于化学方程式中化学计量数之比
D.它们的物质的量之比等于化学方程式中化学计量数之比
解析 发生化学反应时各物质的物质的量之比等于化学方程式中化学计量数之比。
D
2.对于反应aA+bB===cC+dD(A、B、C、D表示物质的化学式,a、b、c、d为
化学方程式中的化学计量数),下列说法不正确的是( )
A.如果质量为m1的A与质量为m2的B恰好完全反应,则生成的C、D的质量之
和一定等于(m1+m2)
B.参加反应的A和B的原子总数一定等于生成的C和D的原子总数
C.(a+b)不一定等于(c+d)
D.A和B的元素种类不一定等于C和D的元素种类
D
解析 根据化学反应前后参加反应的元素种类、原子个数、物质的总质量不变可知A、B、C正确,D错误。
3.将足量铁粉放入100 mL 0.1 mol·L-1 CuSO4溶液中,充分反应后析出的铜的质
量为( )
A.32 g B.6.4 g
C.0.64 g D.3.2 g
解析 根据反应:Fe+CuSO4===FeSO4+Cu,n(CuSO4)=0.1 mol·L-1×0.1 L
=0.01 mol,所以m(Cu)=0.01 mol×64 g·mol-1=0.64 g。
C
4.(2021·山东肥城高一期中)0.56 g CaO正好与20 mL盐酸反应,这种盐酸的物质
的量浓度是( )
A.0.10 mol/L B.0.20 mol/L
C.0.50 mol/L D.1.00 mol/L
D
5.将0.65 g锌加到50 mL 1 mol·L-1盐酸中,计算:
(1)标准状况下生成H2的体积。
(2)若反应完成后,溶液体积仍为50 mL,则溶液中Zn2+和H+的物质的量浓度是多少?
答案 (1)224 mL
(2)0.2 mol·L-1 0.6 mol·L-1
D
解析 D项, H2、Cl2、HCl的质量之比为2∶71∶73。
2.(2021·陕西西安高一期末)利用太阳能分解制氢气,若光催化分解0.02 mol
H2O(假设完全反应),下列说法正确的是 ( )
A.生成H2的质量为0.02 g
B.生成H原子数为2.408×1023个
C.生成H2的体积为0.224 L(标准状况)
D.生成H2中含有的质子数为2.408×1022
D
D
4.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,已知2Al+2NaOH+2H2O===2NaAlO2+3H2↑,该NaOH溶液的浓度为( )
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
B
5.30 mL 2 mol·L-1 NaOH 溶液中加入20 mL 1 mol·L-1H2SO4溶液后,再滴加2~4
滴紫色石蕊溶液,加入紫色石蕊溶液后溶液应显( )
A.蓝色 B.红色
C.紫色 D.无色
A
6.2 mol·L-1盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应后生成的气体
质量之比为2∶3,则向盐酸中加入的铁粉的物质的量为( )
A.0.05 mol B.0.075 mol
C.0.15 mol D.0.2 mol
解析 n(HCl)=0.2 mol,n(H2SO4)=0.2 mol。若酸均不足,即完全反应生成H2的质量之比为1∶2;若酸均过量,即金属不足,则生成H2的质量之比为1∶1。现生成H2的质量之比为2∶3,则说明盐酸不足,硫酸过量。根据盐酸中HCl的物质的量可求出生成H2的物质的量为0.1 mol,则H2SO4反应生成
0.15 mol H2,则铁粉为0.15 mol。
C
7.n g金属溶于足量的盐酸时生成m mol H2,若该金属的化合价为+2价,则该金
属的相对原子质量为( )
A
答案 (1)4.16 g (2)67.2%
9.有6.96 g铁粉和氧化铜的混合物,进行如下实验:
根据实验所得数据,关于混合物相关说法
不正确的是( )
A.生成气体的质量为0.2 g
B.原混合物中铁的质量分数无法计算
C.实验中反应的H2SO4的质量为10.78 g
D.原混合物中铜元素的质量为0.64 g
B
解析 由题意分析可知,可燃性气体为氢气,浅绿色溶液为硫酸亚铁溶液,红色固体为金属铜。由生成0.64 g红色固体可计算出CuO的质量是0.80 g,Fe的质量是6.16 g,其中用于置换出铜的Fe的质量是0.56 g,用于和稀硫酸反应置换出氢气的Fe的质量是5.60 g。因此生成的气体的质量为0.2 g,A正确;Fe的质量是6.16 g,所以可以计算出铁的质量分数,B错误;最终的溶液是硫酸亚铁溶液,由原子守恒可知:Fe~FeSO4~H2SO4,所以反应的硫酸的质量为10.78 g,C正确;原混合物中铜元素的质量即铜单质的质量为0.64 g,D正确。
10.(2019·太原期末)将a g Fe2O3、Al2O3样品溶解在过量的100 mL 0.05 mol·L-1的盐酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,消耗NaOH溶液100 mL,则NaOH溶液的浓度为( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.05 mol·L-1 D.无法计算
解析 n(HCl)=0.05 mol·L-1×0.1 L=0.05 mol,加入NaOH溶液使Fe3+、Al3+刚好完全沉淀时,溶液中的溶质只有NaCl,根据氯原子守恒,n(NaCl)=n(HCl)=0.005 mol,则n(NaOH)=n(NaCl)=0.005 mol,所以c(NaOH)=0.005 mol÷0.1 L=0.05 mol·L-1。
C
A
解析 设原溶液中H2SO4和CuSO4的物质的量分别为x、y
12.(2021·江苏邗江高一期中)已知:硫代硫酸钠(化学式为Na2S2O3)易溶于水,具有强还原性,其相对分子质量是158。某实验室配制500 mL 0.100 mol·
L-1Na2S2O3溶液,并测定样品中CuSO4·5H2O的纯度:
(1)使用无水硫代硫酸钠进行配制,需要固体的质量是____________。配制过程中需要的玻璃仪器有玻璃棒、烧杯、胶头滴管和____________。
(2)定容时俯视刻度线,则配制得到的Na2S2O3溶液的浓度将____________(填“偏大”、“偏小”或“不变”)。定容时,如果不小心加水超过了刻度线,则处理的方法是____________。
答案 (1)7.9 g 500 mL容量瓶 (2)偏大 重新配制
解析 (1)配制硫代硫酸钠溶液的步骤有溶解、冷却、转移、洗涤、定容、摇匀、装瓶等操作。所以必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、500 mL的容量瓶。使用无水硫代硫酸钠进行配制,需要固体的质量m=nM=cVM=0.100 mol·L-1×0.5 L×158 g·mol-1=7.9 g。(2)定容时俯视刻度线,则所加溶液体积偏小,故浓度偏大。定容时,如果不小心加水超过了刻度线,则应重新配制。
Thanks!
本课时内容结束
第二课时 化学反应的计算
【课程标准要求】
1.能熟练应用有关物质的量n与微粒数N、物质的质量m、气体体积V、溶液物质的量浓度c间的计算公式,巩固以物质的量为中心的各物理量之间的换算
方法。
2.能基于物质的量认识化学变化,从定量的角度认识化学反应。能运用物质的量及相关物理量根据化学方程式进行简单计算,体会定量研究对化学科学的重要作用,掌握计算的技巧和方法。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
物质的量在化学反应计算中的应用
1.物质的量与各物理量之间的关系
(1)换算关系:
2.化学反应中的计量关系
化学方程式 2Na+2H2O===2NaOH+H2↑
化学计量数之比 2∶2∶2∶1
扩大NA倍之后 ______∶______∶______∶______
物质的量之比 _______∶_______∶_______∶_______
质量之比 46 g∶36 g ∶80 g∶2 g
结论 化学方程式中各物质的化学计量数之比=各物质的________之比=各物质的__________之比=参加反应的气体物质的______ (相同状况)之比。
2NA
2NA
2NA
NA
2 mol
2 mol
2 mol
1 mol
粒子数
物质的量
体积
【微自测】
判断正误,正确的打“√”,错误的打“×”。
√
×
(3)体积为22.4 L的H2的质量为2 g,物质的量为1 mol( )
(4)根据分子的物质的量和分子数可计算阿伏加德罗常数( )
(5)物质在发生化学反应时,它们的质量比等于化学方程式中化学计量数之比
( )
×
√
√
二、化学方程式计算中的常用解题技巧
一、物质的量应用于化学反应的计算
一、物质的量应用于化学反应的计算
1.物质的量应用于化学方程式计算的基本步骤
2.计算过程中的规范化注意事项
(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化:根据化学方程式计算时,要注意两个量的单位要“上下一致,左右相当”。
(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须比较每种已知量与对应化学方程式中计量数比值大小,谁大谁过量,先判断哪种物质过量,然后根据不足量的物质进行计算。
1.对于反应:2A(g)+2B(g)===3C(g)+D(g),化学计量数之比与下列各项不等的
是( )
A.分子数之比
B.物质的量之比
C.质量之比
D.气体体积之比(同温同压)
解析 计量数之比等于物质的量之比等于分子数之比等于同温同压气体体积之比。
C
2.标准状况下,2.8 g铁与足量的稀硫酸反应生成a L氢气,下列关系正确的是
( )
C
解析 根据化学方程式计算时,计量单位必须满足“上下一致,左右相当”。
3.(2021·北京石景山高一期末)把5.1 g镁铝合金的粉末放入过量的盐酸中,得到
5.6 L H2(标准状况)该合金中铝和镁的物质的量之比为( )
A.1∶1 B.2∶1
C.3∶2 D.2∶3
A
二、化学方程式计算中的常用解题技巧
1.守恒法
物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。在化学变化中的各种各样的守恒,如元素质量守恒。
2.差量法
根据化学反应前后物质的有关物理量发生的变化,找出 “理论差量”,如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物、生成物的有关量成正比。差量法就是借助这种比例关系求解的方法。
差量可以是物质的量的差,对固体、液体而言,差量可以是质量差、粒子个数差;对气体而言,差量还可以是同温、同压下的体积差。
3.关系式法
一般用于解答连续反应类型的计算。关系式是表示物质间关系的一种简化式子,能解决多步反应,计算最简捷。多步反应中建立关系式的方法:
4.将一定量的铁放入稀硫酸中,完全反应后,溶液质量增加5.4 g,计算参加反
应的铁的物质的量( )
A.5.6 g B.0.1 mol
C.5.4 g D.1 mol
B
5.将a L NH3通过灼热的装有铁触媒的硬质玻璃管发生反应2NH3(g)===N2(g)+3H2(g)后,气体体积变为b L(气体体积均在同温同压下测定),该b L 气体中NH3的体积分数是( )
C
D
1.两种或多种物质在发生化学反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于化学方程式中化学计量数之比
D.它们的物质的量之比等于化学方程式中化学计量数之比
解析 发生化学反应时各物质的物质的量之比等于化学方程式中化学计量数之比。
D
2.对于反应aA+bB===cC+dD(A、B、C、D表示物质的化学式,a、b、c、d为
化学方程式中的化学计量数),下列说法不正确的是( )
A.如果质量为m1的A与质量为m2的B恰好完全反应,则生成的C、D的质量之
和一定等于(m1+m2)
B.参加反应的A和B的原子总数一定等于生成的C和D的原子总数
C.(a+b)不一定等于(c+d)
D.A和B的元素种类不一定等于C和D的元素种类
D
解析 根据化学反应前后参加反应的元素种类、原子个数、物质的总质量不变可知A、B、C正确,D错误。
3.将足量铁粉放入100 mL 0.1 mol·L-1 CuSO4溶液中,充分反应后析出的铜的质
量为( )
A.32 g B.6.4 g
C.0.64 g D.3.2 g
解析 根据反应:Fe+CuSO4===FeSO4+Cu,n(CuSO4)=0.1 mol·L-1×0.1 L
=0.01 mol,所以m(Cu)=0.01 mol×64 g·mol-1=0.64 g。
C
4.(2021·山东肥城高一期中)0.56 g CaO正好与20 mL盐酸反应,这种盐酸的物质
的量浓度是( )
A.0.10 mol/L B.0.20 mol/L
C.0.50 mol/L D.1.00 mol/L
D
5.将0.65 g锌加到50 mL 1 mol·L-1盐酸中,计算:
(1)标准状况下生成H2的体积。
(2)若反应完成后,溶液体积仍为50 mL,则溶液中Zn2+和H+的物质的量浓度是多少?
答案 (1)224 mL
(2)0.2 mol·L-1 0.6 mol·L-1
D
解析 D项, H2、Cl2、HCl的质量之比为2∶71∶73。
2.(2021·陕西西安高一期末)利用太阳能分解制氢气,若光催化分解0.02 mol
H2O(假设完全反应),下列说法正确的是 ( )
A.生成H2的质量为0.02 g
B.生成H原子数为2.408×1023个
C.生成H2的体积为0.224 L(标准状况)
D.生成H2中含有的质子数为2.408×1022
D
D
4.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,已知2Al+2NaOH+2H2O===2NaAlO2+3H2↑,该NaOH溶液的浓度为( )
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
B
5.30 mL 2 mol·L-1 NaOH 溶液中加入20 mL 1 mol·L-1H2SO4溶液后,再滴加2~4
滴紫色石蕊溶液,加入紫色石蕊溶液后溶液应显( )
A.蓝色 B.红色
C.紫色 D.无色
A
6.2 mol·L-1盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应后生成的气体
质量之比为2∶3,则向盐酸中加入的铁粉的物质的量为( )
A.0.05 mol B.0.075 mol
C.0.15 mol D.0.2 mol
解析 n(HCl)=0.2 mol,n(H2SO4)=0.2 mol。若酸均不足,即完全反应生成H2的质量之比为1∶2;若酸均过量,即金属不足,则生成H2的质量之比为1∶1。现生成H2的质量之比为2∶3,则说明盐酸不足,硫酸过量。根据盐酸中HCl的物质的量可求出生成H2的物质的量为0.1 mol,则H2SO4反应生成
0.15 mol H2,则铁粉为0.15 mol。
C
7.n g金属溶于足量的盐酸时生成m mol H2,若该金属的化合价为+2价,则该金
属的相对原子质量为( )
A
答案 (1)4.16 g (2)67.2%
9.有6.96 g铁粉和氧化铜的混合物,进行如下实验:
根据实验所得数据,关于混合物相关说法
不正确的是( )
A.生成气体的质量为0.2 g
B.原混合物中铁的质量分数无法计算
C.实验中反应的H2SO4的质量为10.78 g
D.原混合物中铜元素的质量为0.64 g
B
解析 由题意分析可知,可燃性气体为氢气,浅绿色溶液为硫酸亚铁溶液,红色固体为金属铜。由生成0.64 g红色固体可计算出CuO的质量是0.80 g,Fe的质量是6.16 g,其中用于置换出铜的Fe的质量是0.56 g,用于和稀硫酸反应置换出氢气的Fe的质量是5.60 g。因此生成的气体的质量为0.2 g,A正确;Fe的质量是6.16 g,所以可以计算出铁的质量分数,B错误;最终的溶液是硫酸亚铁溶液,由原子守恒可知:Fe~FeSO4~H2SO4,所以反应的硫酸的质量为10.78 g,C正确;原混合物中铜元素的质量即铜单质的质量为0.64 g,D正确。
10.(2019·太原期末)将a g Fe2O3、Al2O3样品溶解在过量的100 mL 0.05 mol·L-1的盐酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,消耗NaOH溶液100 mL,则NaOH溶液的浓度为( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.05 mol·L-1 D.无法计算
解析 n(HCl)=0.05 mol·L-1×0.1 L=0.05 mol,加入NaOH溶液使Fe3+、Al3+刚好完全沉淀时,溶液中的溶质只有NaCl,根据氯原子守恒,n(NaCl)=n(HCl)=0.005 mol,则n(NaOH)=n(NaCl)=0.005 mol,所以c(NaOH)=0.005 mol÷0.1 L=0.05 mol·L-1。
C
A
解析 设原溶液中H2SO4和CuSO4的物质的量分别为x、y
12.(2021·江苏邗江高一期中)已知:硫代硫酸钠(化学式为Na2S2O3)易溶于水,具有强还原性,其相对分子质量是158。某实验室配制500 mL 0.100 mol·
L-1Na2S2O3溶液,并测定样品中CuSO4·5H2O的纯度:
(1)使用无水硫代硫酸钠进行配制,需要固体的质量是____________。配制过程中需要的玻璃仪器有玻璃棒、烧杯、胶头滴管和____________。
(2)定容时俯视刻度线,则配制得到的Na2S2O3溶液的浓度将____________(填“偏大”、“偏小”或“不变”)。定容时,如果不小心加水超过了刻度线,则处理的方法是____________。
答案 (1)7.9 g 500 mL容量瓶 (2)偏大 重新配制
解析 (1)配制硫代硫酸钠溶液的步骤有溶解、冷却、转移、洗涤、定容、摇匀、装瓶等操作。所以必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、500 mL的容量瓶。使用无水硫代硫酸钠进行配制,需要固体的质量m=nM=cVM=0.100 mol·L-1×0.5 L×158 g·mol-1=7.9 g。(2)定容时俯视刻度线,则所加溶液体积偏小,故浓度偏大。定容时,如果不小心加水超过了刻度线,则应重新配制。
Thanks!
本课时内容结束
