专题2 第一单元 研究物质的实验方法 第二课时 物质的检验 物质性质和变化的探究(共80张PPT)
文档属性
| 名称 | 专题2 第一单元 研究物质的实验方法 第二课时 物质的检验 物质性质和变化的探究(共80张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 20:11:30 | ||
图片预览











文档简介
(共80张PPT)
第二课时
物质的检验 物质性质和变化的探究
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
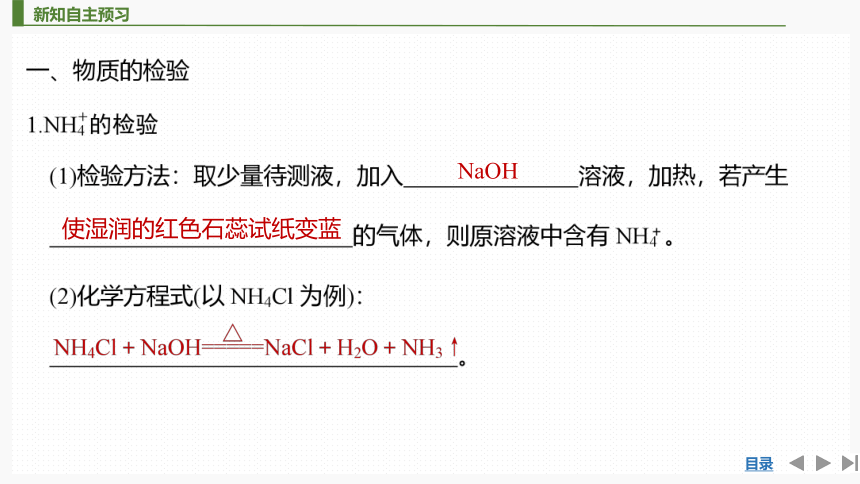
NaOH
使湿润的红色石蕊试纸变蓝
2.Cl-的检验
NH4Cl+AgNO3===AgCl↓+NH4NO3
稀硝酸酸化
白色沉淀
(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl
稀盐酸酸化
BaCl2溶液
白色沉淀
4.焰色反应
(1)概念:许多________或它们的__________在火焰上灼烧时都会使火焰呈现____________,这叫作焰色反应。
(2)实验操作
①“烧”:将铂丝(或光洁无锈的铁丝)放在酒精灯(或煤气灯)火焰灼烧至无色时为止。
②“蘸”: 用铂丝蘸取少量KCl溶液。
金属
化合物
特殊的颜色
③“烧”:在火焰上灼烧,透过____________观察火焰颜色。
④“洗”:用________洗净铂丝,并在火焰灼烧至无色时,再检验下一个试样。
(4)注意:①焰色反应体现的是元素的性质,是唯一称“反应”的物理变化。
②直接观察火焰颜色呈黄色,该物质一定含有钠元素,可能含有钾元素。
蓝色钴玻璃
稀盐酸
5.现代化学分析测试元素
(1)用____________确定物质中是否含有C、H、O、N、S、Cl、Br等元素。
(2)用____________确定物质中是否存在某些有机原子团。
(3)用________________确定物质中含有哪些金属元素等。
元素分析仪
红外光谱仪
原子吸收光谱仪
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
×
×
×
×
√
二、物质性质和变化的探究
1.实验探究二氧化碳的性质
[实验操作](1)将二氧化碳气体通入水中,向其中滴入几滴紫色石蕊试液;
(2)加热该红色液体。
[实验现象] (1)溶液变成____色(2)有______从溶液中逸出,溶液重新变成____色。
[实验结论] (1)有______物质生成(2)生成的______物质不稳定。
红
气泡
紫
酸性
酸性
2.铝与氧气加热条件下的反应
铝(与氧气)在常温下能很快被______,形成______________,具有一定的________性。所以打磨后的铝片有金属光泽。
[实验操作]
用坩埚钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动,
仔细观察
再取一小块铝箔,用砂纸仔细打磨(或在酸中处理后,用水洗净),除去表面的保护膜,再加热至熔化。
[实验现象] 两块铝箔都______,失去__________,熔化的铝________。
[结论] 化学方程式: 。
氧化
致密的氧化膜
抗腐蚀
熔化
金属光泽
不滴落
(3)铝与盐酸、NaOH溶液的反应
[实验操作]
[实验现象] 试管中____________,铝片______;点燃的木条放在试管口时发出______声。
[有关化学方程式] ________________________________、2Al+2NaOH+2H2O ===2NaAlO2+3H2↑。
有气泡产生
溶解
爆鸣
2Al+6HCl===2AlCl3+3H2↑
3.探究影响双氧水分解快慢的因素
(1)催化剂对化学反应快慢影响的探究
实验操作
实验现象
实验结论 MnO2可以使H2O2分解的速率加快
加入MnO2前有少量气泡出现,加入MnO2后产生大量气泡
(2)温度对化学反应快慢影响的探究
快
快
(3)浓度对化学反应快慢影响的探究
实验操作
实验现象 质量分数为6%的H2O2溶液产生气泡速率较快
实验结论 浓度越大,H2O2的分解速率越快
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)铝既可以与盐酸反应,又可以与氢氧化钠溶液反应( )
(2)温度越高,双氧水分解越慢( )
(3)如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有钾元素,可能有钠元素 ( )
(4)用坩埚钳夹住一小块铝箔,在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 ( )
(5)做焰色反应实验用的铂丝,每实验一种样品后都必须用稀盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用( )
√
×
√
×
√
二、常见物质的检验与探究
一、常见离子的检验
一、常见离子的检验
1.常见离子的检验
根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
2.焰色反应的注意事项
(1)不是所有的金属都可呈现焰色反应,金属单质与它的化合物的焰色反应相同。
(2)焰色反应是物理过程,是元素的特性。
(3)观察钾的焰色时,要透过蓝色钴玻璃去观察,这样可以滤去黄光,避免其中含钠杂质所造成的黄色干扰。
1.下列离子检验的方法正确的是( )
C
2.下列说法正确的是( )
A.焰色反应时火焰呈黄色,说明该物质中含有钠元素
B.某物质的焰色不显紫色,说明该物质中肯定没有钾元素
C.焰色反应不能用于物质的鉴别
D.做焰色反应的金属丝可以用铜丝、光洁无锈的铁丝
A
解析 含有金属元素钠的单质或化合物焰色反应的焰色为黄色,A项正确;含有金属元素钾的单质或化合物焰色反应的焰色为紫色(必须透过蓝色的钴玻璃观察),B项错误;焰色反应能用于物质的鉴别,比如鉴别钠盐和钾盐,C项错误;做焰色反应的金属丝可以用铂丝、光洁无锈的铁丝,但不可以用铜丝,铜灼烧火焰为绿色,会干扰所测金属元素的颜色,D项错误。
3.化学兴趣小组只准备了以下实验用品:试管、酒精灯、pH试纸、红色石蕊试纸、BaCl2溶液、Ba(NO3)2溶液、NaOH溶液、稀盐酸。计划对市郊的一个化工企业排放的废水进行检测,想检验废水中含有哪些离子。取来样品后做了以下几个实验。
(1)用pH试纸检验废水的pH,结果测得pH为3,说明废水中含有较多的____________(填离子)。
(2)取少量废水于试管中,加入浓的NaOH溶液,看到有少量蓝色沉淀,继续滴加NaOH溶液,稍加热试管,用湿润的红色石蕊试纸在试管口检验,结果试纸变蓝色。可知溶液中存在____________(填离子)。
答案 (3)否 加入的是BaCl2溶液,产生的白色沉淀也可能是AgCl,溶液中也可能含有Ag+ 先加入稀盐酸,无明显现象,再加入BaCl2溶液
(4)铂丝、蓝色钴玻璃片
二、常见物质的检验与探究
1.物质检验的方法和思路
(1)物质检验的常用方法
①物理方法:常利用物质的颜色、气味、溶解性等加以区分,如可根据颜色区分CuCl2溶液和NaCl溶液,可根据溶解性区分Na2CO3和CaCO3。
②化学方法:常用酸碱指示剂、点燃、加热、加试剂等方法,如可用紫色石蕊溶液区分盐酸、NaOH溶液和NaCl溶液。
(2)物质检验的一般思路
进行物质的检验时要做到原理正确、现象明显、方法简单、试剂用量少,应按“取样 操作 现象 结论”顺序进行描述。具体应做到:
①要“先取样,后操作”。若是固体样品,则一般先用水溶解,配成溶液后再检验。
②要“各取少量溶液分别加入几支试管中”进行检验,不得在原试剂中检验。
③要“先现象,后结论”。例如,向Na2CO3溶液中滴加盐酸,所观察到的现象为“有气泡产生”或“有无色气体放出”,不能说成“碳酸钠和盐酸反应,放出二氧化碳气体”。
2.物质的鉴定、鉴别和推断三类检验比较
不同点 相同点
鉴定 根据物质的化学性质对其组成进行全面分析,对于离子化合物而言,不仅要检出阳离子,又要检出阴离子:如鉴定某一物质是否是硫酸钾 均要根据待检物质的特征反应,选用适当的试剂和方法,准确观察反应中颜色变化、沉淀的生成或溶解、气体的生成、焰色等现象加以判定
鉴别 对两种或两种以上物质进行区别的过程 推断 通过已知实验事实,根据物质的性质进行分析、推理,确认被检验是什么物质或什么物质可能存在,什么物质一定不存在的过程 4.在未知溶液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断未知液中含有( )
C
5.有一白色固体混合物,可能含有的阴、阳离子分别是:
为了鉴定其中的离子,现进行如下实验,根据实验现象,回答下列问题:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。能排除的离子是________________,排除的依据是___________________________________。
(2)向溶液中滴加盐酸溶液有无色无味气体逸出。肯定存在的离子是__________________,
存在的依据是____________________。
(3)尚待检验的离子是________________,检验方法是_____________________。
1.下列对焰色反应实验操作注意事项的说明,正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
⑤没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全对
D
解析 观察钾的焰色时必须使用蓝色的钴玻璃滤去黄光,排除干扰;实验前必须用稀盐酸洗净铂丝,并且在酒精喷灯上灼烧至无色,防止杂质的焰色反应对实验产生干扰;火焰本身的颜色浅,便于对金属焰色的观察;铂丝、铁丝本身没有焰色,可用于蘸取试样完成实验。
2.下列检验离子的方法及现象描述,正确的是( )
D
3.实验室制取O2的一种反应:2H2O2===2H2O+O2↑,下列条件下,该反应的速
率最快的是( )
D
选项 H2O2的质量分数 温度 催化剂
A 5% 5 ℃ MnO2
B 5% 40 ℃ MnO2
C 10% 5 ℃ 无
D 10% 40 ℃ MnO2
解析 双氧水的分解速率受温度、浓度、催化剂等因素影响,浓度越大,温度越高,并使用催化剂,反应速率越快。
4.氯仿(CHCl3)可用作麻醉剂,常因保存不慎而被空气氧化产生剧毒物质COCl2(光气)和氯化氢,为防止事故发生,使用前要检验氯仿是否变质,应选用的检验试剂是( )
A.水 B.AgNO3溶液
C.NaOH溶液 D.KI溶液
解析 氯仿氧化后生成COCl2(光气)和HCl,因此,用AgNO3溶液检验HCl中Cl-的存在即可判断氯仿是否变质。
B
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的实验操作:在Ⅲ中加入____________。
(4)探究结果为____________________________________________。
你认为除实验Ⅱ所用的试剂外,还能溶解氧化铜的一种常见物质是____________。
答案 (3)Na2SO4溶液(或K2SO4溶液)
(4)氧化铜固体溶于稀硫酸是H+在起作用,而H2O、SO两种粒子都不能使CuO溶解 稀盐酸(或稀硝酸)
1.某物质在煤气火焰上灼烧,焰色反应为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物
B.该物质一定含钠元素
C.该物质中一定含有钾元素
D.该物质可能不含钠元素
解析 焰色反应为黄色是钠元素的特征颜色,不论是游离态钠,还是化合态钠,其焰色都是黄色;由于黄色可以掩盖紫色,所以该物质中可能含有钾
元素。
B
2.离子检验的常用方法有三种:
D
解析 Cl-常用AgNO3溶液和稀硝酸进行检验,即生成不溶于稀硝酸的白色沉淀,由题给信息可知,为沉淀法。
3.下列叙述中正确的是( )
A.无色试液焰色反应呈紫色(透过蓝色钴玻璃片观察),则该试液是钾盐溶液
B.每次焰色反应实验前和完毕后,均要用稀盐酸洗净铂丝
C.进行焰色反应的实验操作如图所示:
D.若没有铂丝,可直接用玻璃棒蘸取试样进行焰色反应
B
解析 A项,能说明含有K+,但不一定是钾盐,可能是KOH溶液;C项,应将铂丝放在酒精灯外焰上灼烧;D项,玻璃中含有Na+,其焰色反应呈黄色,因此不能用玻璃棒蘸取试样进行焰色反应。
B
A.加入硝酸银溶液时有白色沉淀
B.加入盐酸时有无色无味气体产生
C.加入氯化钙溶液时,有白色沉淀生成,再加稀盐酸时,白色沉淀溶解,产
生可使澄清石灰水变浑浊的无色无味气体
D.加入氢氧化钡溶液时,有白色沉淀生成,再加稀盐酸时,白色沉淀溶解,
产生可使澄清石灰水变浑浊的无色无味气体
C
6.用简便的方法鉴别硫酸铜、碳酸钠、氧化镁三种白色粉末,应选用的试剂是
( )
A.稀盐酸 B.紫色石蕊溶液
C.水 D.氢氧化钠溶液
解析 硫酸铜水溶液是蓝色的,碳酸钠溶于水无现象,氧化镁不溶于水。
C
B
8.某气体可能含有N2、HCl和CO中的一种或几种,将其依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的碱石灰,气体体积减小,但气体还有剩余。以下对该气体的组分判断正确的是( )
A.一定没有N2,CO和HCl中至少有一种
B.一定有N2、HCl和CO
C.一定有N2,CO和HCl中至少有一种
D.一定有N2和HCl,没有CO
C
解析 通入足量NaHCO3溶液和灼热CuO,气体体积都没有变化,不能得出任何结论,因HCl与NaHCO3反应、CO与CuO反应都会生成等体积的CO2;通过碱石灰,气体体积减小,则反应后的气体中必含CO2,即HCl和CO至少含一种,又体积减小并没有完全吸收,说明其中必含N2。
D
D
根据以上实验可推知四种盐的化学式分别是:
A____________,B____________,C____________,D____________。
答案 CuSO4 AgNO3 Na2CO3 BaCl2
12.有五瓶失去标签的溶液,它们分别为①Ba(NO3)2 ②KCl ③NaOH
④CuSO4 ⑤Na2SO4,如果不用其他任何试剂(包括试纸),用最简便的方法将
它们一一鉴别开来,则在下列的鉴别顺序中最合理的是( )
A.④③①⑤② B.④①⑤③②
C.①⑤③④② D.③④①⑤②
A
解析 首先通过物理方法,观察颜色,呈蓝色的溶液为CuSO4溶液;然后再用CuSO4溶液作试剂,可鉴别出NaOH溶液和Ba(NO3)2溶液;接下来再用Ba(NO3)2溶液作试剂,可鉴别出Na2SO4溶液,最后剩下的为KCl溶液,故鉴别顺序为④③①⑤②或④①③⑤②,A正确。
13.某同学做“证明鸡蛋壳的主要成分是碳酸钙”的实验时,设计了如图所示的
方案。经检查装置气密性合格后加入试剂。下列说法不正确的是 ( )
A.鸡蛋壳发生了分解反应
B.Ⅰ中产生的现象为鸡蛋壳
逐渐溶解,产生大量气泡
C.Ⅱ中的澄清石灰水变浑浊
D.Ⅲ中紫色石蕊试液变浅红色
A
解析 鸡蛋壳的主要成分是碳酸钙,加入稀盐酸后,发生如下复分解反应:CaCO3+2HCl===CaCl2+CO2↑+H2O,现象是鸡蛋壳逐渐溶解,产生大量气泡。产生的CO2气体能够使澄清石灰水变浑浊,由于H2CO3酸性很弱,能够使紫色石蕊试液变浅红。
14.某固体混合物X可能含有KCl、NH4Cl、CaCO3、Na2CO3、Na2SiO3、
CuSO4中的几种,为了确定其组成成分,某同学进行了如下实验:
根据实验现象,下列说法正确的是( )
B
A.固体混合物X中一定含有KCl,一定不含有CuSO4
B.固体混合物X中,CaCO3、Na2CO3至少含有一种
C.在无色溶液B中通入CO2气体,可能有白色沉淀生成
D.在无色溶液B中滴加NaOH溶液,未检测到使湿润的红色石蕊试纸变蓝的气
体,则该固体混合物X中不存在NH4Cl
解析 加过量硝酸银溶液产生白色沉淀E,则E为氯化银,但是混合物中不一定含有氯化钾或者氯化铵,氯离子可能来自加入的过量稀盐酸,混合物X中不一定含有氯化钾,溶液B无色,X中一定不含CuSO4,A错误;加入过量稀盐酸,产生无色气体A,则A为CO2,可以推测混合物中有碳酸钙或碳酸钠其中一种或者两种,B正确;由无色溶液B的溶质可能为氯化钙、氯化钠、氯化铵、氯化钾等,通入二氧化碳,不会有沉淀产生,C错误;若存在铵根离子,加入氢氧化钠还需要加热,才会看见红色石蕊试纸变蓝,步骤中没有加热,D错误。
15.某同学在进行“铝与氯化铜溶液反应”实验时观察到反应一段时间后,溶液
温度升高,有大量气泡逸出。经检验,生成的气体为氢气。
该同学先从理论上猜想产生上述现象的多种可能原因,再设计实验证实自己
的猜想。他取了四根洁净的铝丝分别与不同试剂反应,现象记录如下:
实验编号 ① ② ③ ④
试剂 氯化铜溶液 热水 硫酸铜 溶液 饱和氯化
钠热溶液
溶液酸碱性 酸性 中性 酸性 中性
现象 气泡较多,反应剧烈 只有在开始时有少量气泡 气泡较多,但比氯化铜溶液少 气泡比热水稍多,但比硫酸铜溶液少
(1)请分析设置实验②③④各是为了验证何种猜想。
实验②:______________________________________________________。
实验③:______________________________________________________。
实验④:______________________________________________________。
(2)从上述实验现象可知,生成氢气的主要原因是__________________。
答案 (1)水温升高后,铝能与水反应放出氢气 氯离子对铝和水(或酸)的反应起到了促进作用 铜盐溶液呈酸性,铝与溶液中的酸反应放出氢气 (2)铜盐溶液呈酸性和氯离子的促进作用
解析 实验②中铝与热水反应产生气泡,说明铝能与热水反应;实验①、③对比可以得出氯离子对铝和水(或酸)的反应起到了促进作用;实验①、④对比可以得出铜盐呈酸性,铝与溶液中的酸反应放出氢气。生成氢气的主要原因是铜盐呈酸性,H+与Al反应生成H2,Cl-促进该反应的发生,起催化作用。
Thanks!
本课时内容结束
第二课时
物质的检验 物质性质和变化的探究
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
NaOH
使湿润的红色石蕊试纸变蓝
2.Cl-的检验
NH4Cl+AgNO3===AgCl↓+NH4NO3
稀硝酸酸化
白色沉淀
(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl
稀盐酸酸化
BaCl2溶液
白色沉淀
4.焰色反应
(1)概念:许多________或它们的__________在火焰上灼烧时都会使火焰呈现____________,这叫作焰色反应。
(2)实验操作
①“烧”:将铂丝(或光洁无锈的铁丝)放在酒精灯(或煤气灯)火焰灼烧至无色时为止。
②“蘸”: 用铂丝蘸取少量KCl溶液。
金属
化合物
特殊的颜色
③“烧”:在火焰上灼烧,透过____________观察火焰颜色。
④“洗”:用________洗净铂丝,并在火焰灼烧至无色时,再检验下一个试样。
(4)注意:①焰色反应体现的是元素的性质,是唯一称“反应”的物理变化。
②直接观察火焰颜色呈黄色,该物质一定含有钠元素,可能含有钾元素。
蓝色钴玻璃
稀盐酸
5.现代化学分析测试元素
(1)用____________确定物质中是否含有C、H、O、N、S、Cl、Br等元素。
(2)用____________确定物质中是否存在某些有机原子团。
(3)用________________确定物质中含有哪些金属元素等。
元素分析仪
红外光谱仪
原子吸收光谱仪
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
×
×
×
×
√
二、物质性质和变化的探究
1.实验探究二氧化碳的性质
[实验操作](1)将二氧化碳气体通入水中,向其中滴入几滴紫色石蕊试液;
(2)加热该红色液体。
[实验现象] (1)溶液变成____色(2)有______从溶液中逸出,溶液重新变成____色。
[实验结论] (1)有______物质生成(2)生成的______物质不稳定。
红
气泡
紫
酸性
酸性
2.铝与氧气加热条件下的反应
铝(与氧气)在常温下能很快被______,形成______________,具有一定的________性。所以打磨后的铝片有金属光泽。
[实验操作]
用坩埚钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动,
仔细观察
再取一小块铝箔,用砂纸仔细打磨(或在酸中处理后,用水洗净),除去表面的保护膜,再加热至熔化。
[实验现象] 两块铝箔都______,失去__________,熔化的铝________。
[结论] 化学方程式: 。
氧化
致密的氧化膜
抗腐蚀
熔化
金属光泽
不滴落
(3)铝与盐酸、NaOH溶液的反应
[实验操作]
[实验现象] 试管中____________,铝片______;点燃的木条放在试管口时发出______声。
[有关化学方程式] ________________________________、2Al+2NaOH+2H2O ===2NaAlO2+3H2↑。
有气泡产生
溶解
爆鸣
2Al+6HCl===2AlCl3+3H2↑
3.探究影响双氧水分解快慢的因素
(1)催化剂对化学反应快慢影响的探究
实验操作
实验现象
实验结论 MnO2可以使H2O2分解的速率加快
加入MnO2前有少量气泡出现,加入MnO2后产生大量气泡
(2)温度对化学反应快慢影响的探究
快
快
(3)浓度对化学反应快慢影响的探究
实验操作
实验现象 质量分数为6%的H2O2溶液产生气泡速率较快
实验结论 浓度越大,H2O2的分解速率越快
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)铝既可以与盐酸反应,又可以与氢氧化钠溶液反应( )
(2)温度越高,双氧水分解越慢( )
(3)如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有钾元素,可能有钠元素 ( )
(4)用坩埚钳夹住一小块铝箔,在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 ( )
(5)做焰色反应实验用的铂丝,每实验一种样品后都必须用稀盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用( )
√
×
√
×
√
二、常见物质的检验与探究
一、常见离子的检验
一、常见离子的检验
1.常见离子的检验
根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
2.焰色反应的注意事项
(1)不是所有的金属都可呈现焰色反应,金属单质与它的化合物的焰色反应相同。
(2)焰色反应是物理过程,是元素的特性。
(3)观察钾的焰色时,要透过蓝色钴玻璃去观察,这样可以滤去黄光,避免其中含钠杂质所造成的黄色干扰。
1.下列离子检验的方法正确的是( )
C
2.下列说法正确的是( )
A.焰色反应时火焰呈黄色,说明该物质中含有钠元素
B.某物质的焰色不显紫色,说明该物质中肯定没有钾元素
C.焰色反应不能用于物质的鉴别
D.做焰色反应的金属丝可以用铜丝、光洁无锈的铁丝
A
解析 含有金属元素钠的单质或化合物焰色反应的焰色为黄色,A项正确;含有金属元素钾的单质或化合物焰色反应的焰色为紫色(必须透过蓝色的钴玻璃观察),B项错误;焰色反应能用于物质的鉴别,比如鉴别钠盐和钾盐,C项错误;做焰色反应的金属丝可以用铂丝、光洁无锈的铁丝,但不可以用铜丝,铜灼烧火焰为绿色,会干扰所测金属元素的颜色,D项错误。
3.化学兴趣小组只准备了以下实验用品:试管、酒精灯、pH试纸、红色石蕊试纸、BaCl2溶液、Ba(NO3)2溶液、NaOH溶液、稀盐酸。计划对市郊的一个化工企业排放的废水进行检测,想检验废水中含有哪些离子。取来样品后做了以下几个实验。
(1)用pH试纸检验废水的pH,结果测得pH为3,说明废水中含有较多的____________(填离子)。
(2)取少量废水于试管中,加入浓的NaOH溶液,看到有少量蓝色沉淀,继续滴加NaOH溶液,稍加热试管,用湿润的红色石蕊试纸在试管口检验,结果试纸变蓝色。可知溶液中存在____________(填离子)。
答案 (3)否 加入的是BaCl2溶液,产生的白色沉淀也可能是AgCl,溶液中也可能含有Ag+ 先加入稀盐酸,无明显现象,再加入BaCl2溶液
(4)铂丝、蓝色钴玻璃片
二、常见物质的检验与探究
1.物质检验的方法和思路
(1)物质检验的常用方法
①物理方法:常利用物质的颜色、气味、溶解性等加以区分,如可根据颜色区分CuCl2溶液和NaCl溶液,可根据溶解性区分Na2CO3和CaCO3。
②化学方法:常用酸碱指示剂、点燃、加热、加试剂等方法,如可用紫色石蕊溶液区分盐酸、NaOH溶液和NaCl溶液。
(2)物质检验的一般思路
进行物质的检验时要做到原理正确、现象明显、方法简单、试剂用量少,应按“取样 操作 现象 结论”顺序进行描述。具体应做到:
①要“先取样,后操作”。若是固体样品,则一般先用水溶解,配成溶液后再检验。
②要“各取少量溶液分别加入几支试管中”进行检验,不得在原试剂中检验。
③要“先现象,后结论”。例如,向Na2CO3溶液中滴加盐酸,所观察到的现象为“有气泡产生”或“有无色气体放出”,不能说成“碳酸钠和盐酸反应,放出二氧化碳气体”。
2.物质的鉴定、鉴别和推断三类检验比较
不同点 相同点
鉴定 根据物质的化学性质对其组成进行全面分析,对于离子化合物而言,不仅要检出阳离子,又要检出阴离子:如鉴定某一物质是否是硫酸钾 均要根据待检物质的特征反应,选用适当的试剂和方法,准确观察反应中颜色变化、沉淀的生成或溶解、气体的生成、焰色等现象加以判定
鉴别 对两种或两种以上物质进行区别的过程 推断 通过已知实验事实,根据物质的性质进行分析、推理,确认被检验是什么物质或什么物质可能存在,什么物质一定不存在的过程 4.在未知溶液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断未知液中含有( )
C
5.有一白色固体混合物,可能含有的阴、阳离子分别是:
为了鉴定其中的离子,现进行如下实验,根据实验现象,回答下列问题:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。能排除的离子是________________,排除的依据是___________________________________。
(2)向溶液中滴加盐酸溶液有无色无味气体逸出。肯定存在的离子是__________________,
存在的依据是____________________。
(3)尚待检验的离子是________________,检验方法是_____________________。
1.下列对焰色反应实验操作注意事项的说明,正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
⑤没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全对
D
解析 观察钾的焰色时必须使用蓝色的钴玻璃滤去黄光,排除干扰;实验前必须用稀盐酸洗净铂丝,并且在酒精喷灯上灼烧至无色,防止杂质的焰色反应对实验产生干扰;火焰本身的颜色浅,便于对金属焰色的观察;铂丝、铁丝本身没有焰色,可用于蘸取试样完成实验。
2.下列检验离子的方法及现象描述,正确的是( )
D
3.实验室制取O2的一种反应:2H2O2===2H2O+O2↑,下列条件下,该反应的速
率最快的是( )
D
选项 H2O2的质量分数 温度 催化剂
A 5% 5 ℃ MnO2
B 5% 40 ℃ MnO2
C 10% 5 ℃ 无
D 10% 40 ℃ MnO2
解析 双氧水的分解速率受温度、浓度、催化剂等因素影响,浓度越大,温度越高,并使用催化剂,反应速率越快。
4.氯仿(CHCl3)可用作麻醉剂,常因保存不慎而被空气氧化产生剧毒物质COCl2(光气)和氯化氢,为防止事故发生,使用前要检验氯仿是否变质,应选用的检验试剂是( )
A.水 B.AgNO3溶液
C.NaOH溶液 D.KI溶液
解析 氯仿氧化后生成COCl2(光气)和HCl,因此,用AgNO3溶液检验HCl中Cl-的存在即可判断氯仿是否变质。
B
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的实验操作:在Ⅲ中加入____________。
(4)探究结果为____________________________________________。
你认为除实验Ⅱ所用的试剂外,还能溶解氧化铜的一种常见物质是____________。
答案 (3)Na2SO4溶液(或K2SO4溶液)
(4)氧化铜固体溶于稀硫酸是H+在起作用,而H2O、SO两种粒子都不能使CuO溶解 稀盐酸(或稀硝酸)
1.某物质在煤气火焰上灼烧,焰色反应为黄色,下列判断正确的是( )
A.该物质一定是钠的化合物
B.该物质一定含钠元素
C.该物质中一定含有钾元素
D.该物质可能不含钠元素
解析 焰色反应为黄色是钠元素的特征颜色,不论是游离态钠,还是化合态钠,其焰色都是黄色;由于黄色可以掩盖紫色,所以该物质中可能含有钾
元素。
B
2.离子检验的常用方法有三种:
D
解析 Cl-常用AgNO3溶液和稀硝酸进行检验,即生成不溶于稀硝酸的白色沉淀,由题给信息可知,为沉淀法。
3.下列叙述中正确的是( )
A.无色试液焰色反应呈紫色(透过蓝色钴玻璃片观察),则该试液是钾盐溶液
B.每次焰色反应实验前和完毕后,均要用稀盐酸洗净铂丝
C.进行焰色反应的实验操作如图所示:
D.若没有铂丝,可直接用玻璃棒蘸取试样进行焰色反应
B
解析 A项,能说明含有K+,但不一定是钾盐,可能是KOH溶液;C项,应将铂丝放在酒精灯外焰上灼烧;D项,玻璃中含有Na+,其焰色反应呈黄色,因此不能用玻璃棒蘸取试样进行焰色反应。
B
A.加入硝酸银溶液时有白色沉淀
B.加入盐酸时有无色无味气体产生
C.加入氯化钙溶液时,有白色沉淀生成,再加稀盐酸时,白色沉淀溶解,产
生可使澄清石灰水变浑浊的无色无味气体
D.加入氢氧化钡溶液时,有白色沉淀生成,再加稀盐酸时,白色沉淀溶解,
产生可使澄清石灰水变浑浊的无色无味气体
C
6.用简便的方法鉴别硫酸铜、碳酸钠、氧化镁三种白色粉末,应选用的试剂是
( )
A.稀盐酸 B.紫色石蕊溶液
C.水 D.氢氧化钠溶液
解析 硫酸铜水溶液是蓝色的,碳酸钠溶于水无现象,氧化镁不溶于水。
C
B
8.某气体可能含有N2、HCl和CO中的一种或几种,将其依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的碱石灰,气体体积减小,但气体还有剩余。以下对该气体的组分判断正确的是( )
A.一定没有N2,CO和HCl中至少有一种
B.一定有N2、HCl和CO
C.一定有N2,CO和HCl中至少有一种
D.一定有N2和HCl,没有CO
C
解析 通入足量NaHCO3溶液和灼热CuO,气体体积都没有变化,不能得出任何结论,因HCl与NaHCO3反应、CO与CuO反应都会生成等体积的CO2;通过碱石灰,气体体积减小,则反应后的气体中必含CO2,即HCl和CO至少含一种,又体积减小并没有完全吸收,说明其中必含N2。
D
D
根据以上实验可推知四种盐的化学式分别是:
A____________,B____________,C____________,D____________。
答案 CuSO4 AgNO3 Na2CO3 BaCl2
12.有五瓶失去标签的溶液,它们分别为①Ba(NO3)2 ②KCl ③NaOH
④CuSO4 ⑤Na2SO4,如果不用其他任何试剂(包括试纸),用最简便的方法将
它们一一鉴别开来,则在下列的鉴别顺序中最合理的是( )
A.④③①⑤② B.④①⑤③②
C.①⑤③④② D.③④①⑤②
A
解析 首先通过物理方法,观察颜色,呈蓝色的溶液为CuSO4溶液;然后再用CuSO4溶液作试剂,可鉴别出NaOH溶液和Ba(NO3)2溶液;接下来再用Ba(NO3)2溶液作试剂,可鉴别出Na2SO4溶液,最后剩下的为KCl溶液,故鉴别顺序为④③①⑤②或④①③⑤②,A正确。
13.某同学做“证明鸡蛋壳的主要成分是碳酸钙”的实验时,设计了如图所示的
方案。经检查装置气密性合格后加入试剂。下列说法不正确的是 ( )
A.鸡蛋壳发生了分解反应
B.Ⅰ中产生的现象为鸡蛋壳
逐渐溶解,产生大量气泡
C.Ⅱ中的澄清石灰水变浑浊
D.Ⅲ中紫色石蕊试液变浅红色
A
解析 鸡蛋壳的主要成分是碳酸钙,加入稀盐酸后,发生如下复分解反应:CaCO3+2HCl===CaCl2+CO2↑+H2O,现象是鸡蛋壳逐渐溶解,产生大量气泡。产生的CO2气体能够使澄清石灰水变浑浊,由于H2CO3酸性很弱,能够使紫色石蕊试液变浅红。
14.某固体混合物X可能含有KCl、NH4Cl、CaCO3、Na2CO3、Na2SiO3、
CuSO4中的几种,为了确定其组成成分,某同学进行了如下实验:
根据实验现象,下列说法正确的是( )
B
A.固体混合物X中一定含有KCl,一定不含有CuSO4
B.固体混合物X中,CaCO3、Na2CO3至少含有一种
C.在无色溶液B中通入CO2气体,可能有白色沉淀生成
D.在无色溶液B中滴加NaOH溶液,未检测到使湿润的红色石蕊试纸变蓝的气
体,则该固体混合物X中不存在NH4Cl
解析 加过量硝酸银溶液产生白色沉淀E,则E为氯化银,但是混合物中不一定含有氯化钾或者氯化铵,氯离子可能来自加入的过量稀盐酸,混合物X中不一定含有氯化钾,溶液B无色,X中一定不含CuSO4,A错误;加入过量稀盐酸,产生无色气体A,则A为CO2,可以推测混合物中有碳酸钙或碳酸钠其中一种或者两种,B正确;由无色溶液B的溶质可能为氯化钙、氯化钠、氯化铵、氯化钾等,通入二氧化碳,不会有沉淀产生,C错误;若存在铵根离子,加入氢氧化钠还需要加热,才会看见红色石蕊试纸变蓝,步骤中没有加热,D错误。
15.某同学在进行“铝与氯化铜溶液反应”实验时观察到反应一段时间后,溶液
温度升高,有大量气泡逸出。经检验,生成的气体为氢气。
该同学先从理论上猜想产生上述现象的多种可能原因,再设计实验证实自己
的猜想。他取了四根洁净的铝丝分别与不同试剂反应,现象记录如下:
实验编号 ① ② ③ ④
试剂 氯化铜溶液 热水 硫酸铜 溶液 饱和氯化
钠热溶液
溶液酸碱性 酸性 中性 酸性 中性
现象 气泡较多,反应剧烈 只有在开始时有少量气泡 气泡较多,但比氯化铜溶液少 气泡比热水稍多,但比硫酸铜溶液少
(1)请分析设置实验②③④各是为了验证何种猜想。
实验②:______________________________________________________。
实验③:______________________________________________________。
实验④:______________________________________________________。
(2)从上述实验现象可知,生成氢气的主要原因是__________________。
答案 (1)水温升高后,铝能与水反应放出氢气 氯离子对铝和水(或酸)的反应起到了促进作用 铜盐溶液呈酸性,铝与溶液中的酸反应放出氢气 (2)铜盐溶液呈酸性和氯离子的促进作用
解析 实验②中铝与热水反应产生气泡,说明铝能与热水反应;实验①、③对比可以得出氯离子对铝和水(或酸)的反应起到了促进作用;实验①、④对比可以得出铜盐呈酸性,铝与溶液中的酸反应放出氢气。生成氢气的主要原因是铜盐呈酸性,H+与Al反应生成H2,Cl-促进该反应的发生,起催化作用。
Thanks!
本课时内容结束
