专题1 第二单元 物质的化学计量 第二课时 气体摩尔体积 (共71张PPT)
文档属性
| 名称 | 专题1 第二单元 物质的化学计量 第二课时 气体摩尔体积 (共71张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 20:15:33 | ||
图片预览











文档简介
(共71张PPT)
第二课时 气体摩尔体积
【课程标准要求】
1. 通过分析、推理认识气体摩尔体积的构成要素及其相互关系,了解气体摩尔体积的含义和应用。
2.在微观与宏观转换中提升对气体摩尔体积概念的理解,能运用气体摩尔体积进行简单计算。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、决定物质体积大小的因素
1.宏观物质具有不同的聚集状态。从微观粒子的角度分析,影响物质体积大小
的因素有:
大小
距离
2.相同条件下1 mol固体、液体的体积差别较大。因为相同物质的量的固体或液
体中__________相同,__________不同,其体积不同。
3.相同条件下,1 mol气体的体积近似相等,在____________约为22.4 L。因为
同温同压下气体______________相同,当气体__________相同时, 其体积
相同。
微粒数目
微粒大小
标准状况下
微粒间的距离
微粒数目
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)两种气体分子的分子数相同,体积也相同( )
(2)同温同压下,相同体积的物质,其物质的量必然相等( )
(3)当温度和压强一定时,决定气体体积大小的主要因素是分子数目的多少
( )
(4)当压强一定时,温度越高,气体分子间的距离越大;温度一定时,压强越大,气体分子间的距离越大( )
×
×
√
×
二、气体摩尔体积
1.定义:单位__________的气体所占有的______称为气体摩尔体积。符号:Vm,单位L·mol-1(或L/mol)和m3·mol-1(或m3/mol)。
2.定义式:____________。
3.影响气体摩尔体积的因素
(1)单位物质的量的气体分子数都是NA,气体摩尔体积的数值取决于气体所处的______和______。
(2)标准状况下(即___________和___________),气体摩尔体积约为_______________。
物质的量
体积
温度
压强
273 K
101 kPa
22.4 L·mol-1
4.阿伏加德罗定律:在相同的温度和压强下,任何具有____________的气体都具有相同的________。或在相同的温度和压强下,相同体积的任何气体都含有相同的________。
相同微粒数
体积
微粒数
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)常温常压下,1 mol气体的体积均为22.4 L( )
(2)标准状况下,1 mol H2和O2的混合气体的体积不一定为22.4 L( )
(3)标准状况下,1 mol任何物质的体积都约为22.4 L( )
(4)1 mol某气体的体积是22.4 L,该气体所处的状况不一定是标准状况( )
(5)某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为
22.4 L( )
×
×
×
√
×
二、阿伏加德罗定律及其推论
一、气体摩尔体积
一、气体摩尔体积
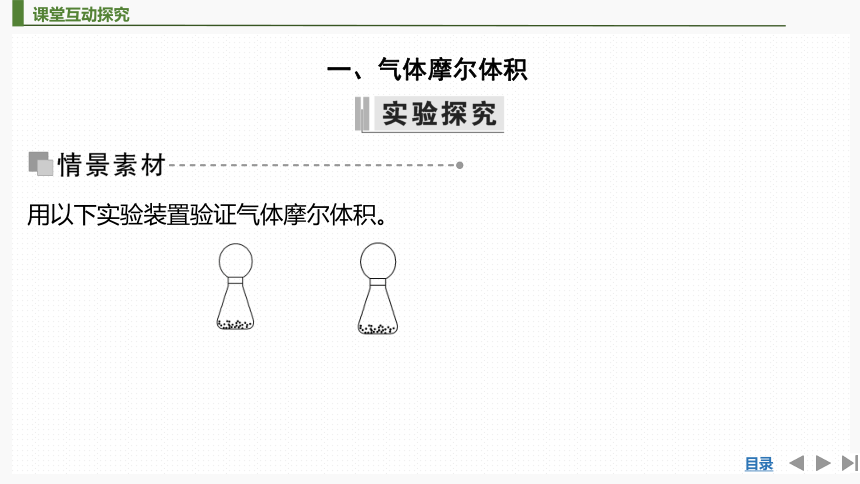
用以下实验装置验证气体摩尔体积。
【实验步骤】 (1)在托盘天平上准确称取6.5 g锌粒和10.6 g Na2CO3分别放入两个相同的气球中;(2)在两个锥形瓶中各加入稍过量的稀硫酸(已知此时反应生成的气体的物质的量相等);(3)将气球口紧紧密封固定在锥形瓶口上, 密封不漏气。(4)把气囊中的物质缓缓倒入锥形瓶中, 让它们充分反应,直至完全。
1.当充分反应完全后,可以观察到什么现象?
提示:两个气球几乎一样大。
2.你能解释上述现象的原因吗?
提示:因为两个反应生成的气体的物质的量相同,在相同条件下,占有的
体积也相同。
1.标准状况下的气体摩尔体积
(1)2个条件——①状况条件必须为标准状况。非标准状况下,1 mol气体的体积不一定是22.4 L。因此在使用气体摩尔体积时,一定要看清气体所处的状态。
②状态条件必须为气体。如水、酒精、CCl4等物质在标准状况下不是气体,摩尔体积都不是22.4 L。
(2)2个数据——“1 mol”“约22.4 L”。
2.气体摩尔体积的适用范围
(1)气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。需要注意的是混合气体中气体之间不能发生化学反应。
(2)不同状况下的气体摩尔体积受温度和压强影响,若温度和压强保持一定,那么该状况下的气体摩尔体积也保持不变。因此气体摩尔体积并不都约等于22.4 L·mol-1,22.4 L·mol-1只是气体在标准状况下的一个特例。
(3)同温同压下,任何气体的体积差别均只由气体的分子数决定。
3.气体摩尔体积的相关计算
1.下列说法正确的是( )
A.22.4 L任何气体的物质的量均为1 mol
B.0.2 mol H2和0.8 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
C.标准状况下,1 mol任何物质的体积必定是22.4 L
D.22.4 L CO2和18 g H2O所含的分子数相等
B
解析 没有指明气体是否处于标准状况,A错误;气体摩尔体积适用于单一气体,也可以是混合气体,只要符合物质的量为1 mol,且为标准状况下,体积都约为22.4 L,B正确;标准状况下,1 mol任何气体的体积都约为22.4 L,C错误;18 g H2O是1 mol H2O,但22.4 L CO2不一定是1 mol,因为其所处条件不确定,D错误。
2.下列说法正确的是( )
A.标准状况下,22.4 L任何气体都约含有6.02×1023个分子
B.含1 mol氦原子的氦气在标准状况下的体积约为11.2 L
C.常温常压下,11.2 L Cl2含有的分子数为0.5NA
D.标准状况下,11.2 L蔗糖含有的分子数为0.5NA
A
解析 标准状况下22.4 L气体的物质的量为1 mol,而分子个数N=nNA=NA个,即约为6.02×1023个,A正确;氦气分子为单原子分子,故含1 mol氦原子的氦气的物质的量为1 mol,在标况下的体积为22.4 L,B错误;常温常压下,气体摩尔体积大于22.4 L·mol-1,故11.2 L氯气的物质的量小于0.5 mol,则分子个数小于0.5NA个,C错误;标况下蔗糖为固体,故不能根据气体摩尔体积来计算其物质的量,D错误。
3.(2021·辽宁沈阳高一期中)现有一定量的气体如下:①标准状况下,6.72 L CH4、②3.01×1023个HCl分子、③13.6 g H2S、④0.2 mol NH3。下列对这四种气体的关系判断正确的有几项 ( )
a.标准状况下的体积;②>③>①>④
b.同温同压下的密度;②>③>④>①
c.质量:②>③>①>④
d.氢原子个数:①>③>④>②
A.1项 B.2项
C.3项 D.4项
D
二、阿伏加德罗定律及其推论
用打气筒给篮球打气时,气体源源不断地被打进去,而篮球的体积却未发生很大变化。
1.气体体积与什么因素有关?为什么篮球的体积未发生很大变化?
提示:影响气体体积大小的主要因素是气体分子之间的距离与气体分子数目。给篮球打气时,篮球的体积未发生很大变化是因为虽然气体分子数目增加,但是气体分子之间的距离在不断缩小。
2.1 L O2和1 L H2所含有的分子数是否相同?
提示:不一定。影响气体体积大小的主要因素是气体分子之间的距离与气体分子数目,而气体分子之间的距离受温度和压强的影响较大。温度和压强不同时,气体分子间的距离可能不相同。因此,两种气体分子数相同,体积不一定相同;两种气体体积相同,所含的分子数也不一定相同。
3.相同温度和压强下,相同体积的任何气体所含的原子数一定相同吗?
提示:不一定。相同温度和压强下,相同体积的任何气体的物质的量相同,
即所含分子数相同。分子中所含原子数可能相同,也可能不同,如N2、
CO2等。
1.阿伏加德罗定律
(1)内容:同温同压下,相同体积的任何气体都含有相同数目的粒子。
(2)涵义:
①适用范围:阿伏加德罗定律及其推论适用于气体,可以是单一气体,也可以是混合气体,对固体和液体不适用。
②定律中包含四同(同温、同压、同体积、同物质的量亦或同粒子数),“三同定一同”规律:同温、同压、同体积、同分子数中只要有任何“三同”,则必有“第四同”。
③定律中的同温同压,不一定指在标准状况下;气体摩尔体积为22.4 L·mol-1只是一种特殊情况。
2.阿伏加德罗定律的推论
4.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相
同时,这三种气体的压强(p)由大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
D
5.(2021·吉林长春二中高一期中)相同的温度和压强下,X2和Y2两种气态单质发生化合反应生成气态化合物Z,实际消耗7 L X2同时消耗21 L Y2,产生14 L Z,则Z的分子式是( )
A.XY2 B.XY3
C.X3Y D.X2Y3
B
解析 相同的温度和压强下气体的摩尔体积相同,则气体的体积比等于气体的物质的量的比。X2和Y2两种气态单质发生化合反应生成气态化合物Z,实际消耗7 L X2同时消耗21 L Y2,同时产生14 L Z,V(X2)∶V(Y2)∶V(Z)=7 L∶21 L∶14 L=1∶3∶2,则n(X2)∶n(Y2)∶n(Z)= 1∶3∶2,故反应方程式为:X2+3Y2===2Z,根据质量守恒定律,可知Z的化学式为XY3。
6.(2021·安徽池州一中高一期中)同温同压下,两容器分别充入等质量的C2H4和
C3H6气体,有关两容器内的气体,下列说法正确的是( )
A.两种气体的密度之比为1∶1
B.氢原子数之比为1∶1
C.两容器的体积之比为2∶3
D.分子数之比为2∶3
B
1. (2021·河北保定高一月考)影响1 mol气体所占体积大小的主要因素是( )
A.分子直径的大小
B.分子间距离的大小
C.分子间相互作用力的大小
D.分子数目的大小
解析 气体分子间距离较大,远大于分子的直径,所以分子大小可以忽略不计,决定气体体积的因素主要为构成物质的分子数和分子间的距离,一定质量的气体的分子数目一定,故一定温度下,影响一定质量气体体积大小的决定因素是气体分子间的平均距离, B正确。
B
2.下列有关气体摩尔体积的叙述正确的是( )
A.单位物质的量的气体所占的体积就是气体摩尔体积,为22.4 L·mol-1
B.通常状况下的气体摩尔体积约为22.4 L·mol-1
C.标准状况下的气体摩尔体积约为22.4 L·mol-1
D.相同物质的量的气体的摩尔体积相同
解析 标准状况下的气体摩尔体积约为22.4 L·mol-1,A、B错误,C正确;气体摩尔体积与气体所处的状态(温度和压强)有关,D错误。
C
3.在标准状况下,由0.5 g H2、11 g CO2和4 g O2组成的混合气体,其体积约
为( )
A.8.4 L B.11.2 L
C.14 L D.16.8 L
C
4.(2021·陕西西安一中高一期中)如图是两瓶体积相等的气体,在同温同压时瓶
内气体的关系一定正确的是( )
A.气体质量相等 B.气体密度相等
C.所含原子数相等 D.摩尔质量相等
解析 左瓶中氮气和氧气的物质的量之比为1∶1时,相当于NO。左瓶与右瓶内NO的质量、密度和摩尔质量均相等,但左瓶中氮气和氧气的物质的量之比为不一定为1∶1,故质量、密度和摩尔质量不一定相等,A、B、D错误;同温同压下,体积之比等于物质的量之比,两瓶气体的物质的量相等,都是双原子分子,物质的量相等的气体含有的原子数目相等,C正确。
C
5.(1)CO2的相对分子质量为____________,它的摩尔质量为____________。
(2)在标准状况下,0.5 mol任何气体的体积都约为____________。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是____________。
(4)0.01 mol某气体的质量为0.28 g,该气体的摩尔质量为____________,在标准状况下,该气体的体积是____________。
答案 (1)44 44 g·mol-1 (2)11.2 L (3)4 g H2 (4)28 g·mol-1 0.224 L
解析 相对分子质量和摩尔质量在数值上相等。在标准状况下1 mol任何气体所占的体积都约为22.4 L。
1.下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
B
解析 依据气体体积的影响因素可知:温度和压强一定时,气体分子间的平均距离几乎相等,因而气体体积主要由其物质的量的多少决定,故A错误,B正确;气体摩尔体积是指在一定温度、压强下,1 mol 任何气体所占的体积,22.4 L是1 mol气体在标准状况下的体积,故C错误;依据阿伏加德罗定律及其推论知:不同的气体,若体积不等,则它们所含的分子数有可能相等,故D错误。
2.(2021·湖北荆州高一期末)对于22 g CO2,下列有关说法正确的是(设NA为阿伏
加德罗常数的值)( )
A.含碳原子个数为NA
B.体积为11.2 L
C.含碳元素的质量为12 g
D.含氧原子的物质的量为1 mol
解析 1个CO2分子由1个C原子和2个O原子构成,22 g CO2的物质的量是
0.5 mol,0.5 mol CO2含碳原子个数为0.5NA,A错误;未指明气体所处的条件,无法计算CO2气体的体积,B错误;0.5 mol CO2含碳原子0.5 mol,其质量是
6 g,C错误;0.5 mol CO2含氧原子的物质的量为1 mol,D正确。
D
3.下列各组物质中,所含分子数相同的是( )
A.2 L SO2和2 L CO2
B.9 g水和标准状况下11.2 L CO2
C.标准状况下,1 mol氧气和22.4 L水
D.0.1 mol H2和2.24 L HCl气体
解析 A项,没有指明气体所处的状态,无法判断二者所含分子数是否相同;B项,9 g水的物质的量为0.5 mol,标准状况下11.2 L CO2的物质的量为
0.5 mol,故二者所含分子数相同;C项,标准状况下,水不是气体,则22.4 L水的物质的量不是1 mol,二者所含分子数不相同;D项,没有指明HCl气体所处的状态,无法判断二者所含分子数是否相同。
B
4.相同状况下,在两个密闭容器中分别充满等质量的O2、O3,下列说法正确的
是( )
A.两种气体所含分子数相等
B.两种气体所含原子数相等
C.两种气体的体积相等
D.两种气体的密度相等
解析 O2、O3都是由氧元素组成的,当两种气体的质量相等时,所含氧原子的物质的量相等,但所含分子的物质的量不相等,A项错误,B项正确;相同状态下,气体的体积之比等于其物质的量之比,故两种气体的体积不相等,密度也不相等,C、D项错误。
B
5.(2021·广东惠州一中高一期中)下面关于同温同压下的两种气体一氧化碳和氮
气的判断不正确的是( )
A.体积相等时密度不相等
B.体积相等时分子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的原子数相等
A
6.在标准状况下,224 mL某气体的质量为0.32 g,该气体的摩尔质量为( )
A.32 g·mol-1 B.64
C.64 g·mol-1 D.64 g
A
7.下列叙述中,正确的是( )
A.1 mol H2的质量只有在标准状况下才约为2 g
B.在标准状况下,某气体的体积是22.4 L,则可认为该气体的物质的量约是
1 mol
C.在20 ℃时,1 mol任何气体的体积总比 22.4 L大
D.1 mol H2和O2的混合气体,在标准状况下的体积大于22.4 L
B
解析 气体的质量只与气体的摩尔质量和气体的物质的量有关,与气体的温度、压强无关,A不正确;22.4 L·mol-1是在特定条件下的气体摩尔体积,所以在标准状况下,某气体的体积是22.4 L,则可以认为该气体的物质的量约是1 mol,B正确;由于气体摩尔体积与气体的温度、压强有关,因此仅温度一定,而压强不定,1 mol任何气体的体积都不能确定,也就是说在20 ℃时,1 mol任何气体的体积可能比22.4 L大,也可能比22.4 L小,还可能等于
22.4 L,C不正确;标准状况下,1 mol任何气体(可以是纯净气体,也可以是混合气体)的体积都约是22.4 L,D不正确。
8.(2021·四川树德中学高一期中)在下列条件下,两种气体的分子数一定相等的
是( )
A.同质量、不同密度的N2和C2H4
B.同温度、同体积的O2和N2
C.同体积、同密度的C2H4和CO2
D.同压强、同体积的O2和N2
A
9.(1)质量比为14∶15的N2和NO混合,则混合气体中氮原子和氧原子的个数比为
____________。
(2)同温同压下,质量相同的五种气体:
①CO2 ②H2 ③O2 ④CH4 ⑤SO2所占的体积由大到小的顺序是(填序号,
下同)____________。
答案 (1)3∶1 (2)②④③①⑤
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为____________,R的相对原子质量为____________。
(4)在标准状况下,有CO和CO2组成的混合气体8.96 L,质量是16 g,此混合物中CO和CO2的物质的量比是____________,C和O原子个数比是____________。
答案 (3)64 g·mol-1 32 (4)1∶3 4∶7
A
11.每年10月23日上午6∶02到下午6∶02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6∶02/10/23,外观与阿伏加德罗常数的值6.02×1023相似。设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22 g CO2与8.5 g NH3所含分子数不相等
B.17 g OH-与19 g H3O+所含电子数不等
C.NA个氧气分子与NA个氖气分子的质量比是4∶5
D.在标准状况下,20 mL NH3和60 mL O2所含分子个数比为1∶3
D
解析 22 g CO2的物质的量是n(CO2)=0.5 mol,8.5 g NH3的物质的量是n(NH3)=0.5 mol,二者的物质的量相等,可知二者所含分子数相等, A错误; 1个OH-与一个H3O+中都含有10个电子,17 g OH-与19 g H3O+的物质的量都是1 mol,则二者所含的电子数相等, B错误; NA个氧气分子与NA个氖原子的物质的量都是1 mol,而二者的质量比是32 g∶20 g=8∶5,C错误;在标准状况下,20 mL NH3和60 mL O2所含分子个数比为1∶3,D正确。
12.某密闭容器中间有一个可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入12 mol CO,右边充入O2和H2的混合气体共60 g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
A.右边O2和H2分子个数之比为2∶3
B.左边CO的体积为268.8 L
C.向右边再充入18 g H2可使隔板处于中间
D.右边混合气体对氢气的相对密度是20
C
13.设NA为阿伏加德罗常数的值,回答下列问题:
(1)0.3 mol NH3分子中所含原子数与____________个H2O分子中所含原子数相等。
(2)某气体在标准状况下的密度为1.25 g·L-1 ,则14 g该气体所含有的分子数为____________。
(3)同温同压下,同体积的H2和A气体的质量分别为1.0 g和16.0 g,则A的摩尔质量为____________。
答案 (1)0.4NA (2)0.5NA (3)32 g·mol-1
(4)56 g氮气在标准状况下的体积为____________,含有氮分子的数目为____________。
(5)4.05 g某金属氯化物MCl2中含有0.06 mol Cl-,则该氯化物的摩尔质量为____________,金属M的相对原子质量为____________。
(6)现有标准状况下CO和CO2混合气体6.72 L,其质量为11.6 g,则此混合气体中,CO和CO2的物质的量之比是____________。
答案 (4)44.8 L 2NA (5)135 g·mol-1 64 (6)1∶2
Thanks!
本课时内容结束
第二课时 气体摩尔体积
【课程标准要求】
1. 通过分析、推理认识气体摩尔体积的构成要素及其相互关系,了解气体摩尔体积的含义和应用。
2.在微观与宏观转换中提升对气体摩尔体积概念的理解,能运用气体摩尔体积进行简单计算。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、决定物质体积大小的因素
1.宏观物质具有不同的聚集状态。从微观粒子的角度分析,影响物质体积大小
的因素有:
大小
距离
2.相同条件下1 mol固体、液体的体积差别较大。因为相同物质的量的固体或液
体中__________相同,__________不同,其体积不同。
3.相同条件下,1 mol气体的体积近似相等,在____________约为22.4 L。因为
同温同压下气体______________相同,当气体__________相同时, 其体积
相同。
微粒数目
微粒大小
标准状况下
微粒间的距离
微粒数目
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)两种气体分子的分子数相同,体积也相同( )
(2)同温同压下,相同体积的物质,其物质的量必然相等( )
(3)当温度和压强一定时,决定气体体积大小的主要因素是分子数目的多少
( )
(4)当压强一定时,温度越高,气体分子间的距离越大;温度一定时,压强越大,气体分子间的距离越大( )
×
×
√
×
二、气体摩尔体积
1.定义:单位__________的气体所占有的______称为气体摩尔体积。符号:Vm,单位L·mol-1(或L/mol)和m3·mol-1(或m3/mol)。
2.定义式:____________。
3.影响气体摩尔体积的因素
(1)单位物质的量的气体分子数都是NA,气体摩尔体积的数值取决于气体所处的______和______。
(2)标准状况下(即___________和___________),气体摩尔体积约为_______________。
物质的量
体积
温度
压强
273 K
101 kPa
22.4 L·mol-1
4.阿伏加德罗定律:在相同的温度和压强下,任何具有____________的气体都具有相同的________。或在相同的温度和压强下,相同体积的任何气体都含有相同的________。
相同微粒数
体积
微粒数
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)常温常压下,1 mol气体的体积均为22.4 L( )
(2)标准状况下,1 mol H2和O2的混合气体的体积不一定为22.4 L( )
(3)标准状况下,1 mol任何物质的体积都约为22.4 L( )
(4)1 mol某气体的体积是22.4 L,该气体所处的状况不一定是标准状况( )
(5)某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为
22.4 L( )
×
×
×
√
×
二、阿伏加德罗定律及其推论
一、气体摩尔体积
一、气体摩尔体积
用以下实验装置验证气体摩尔体积。
【实验步骤】 (1)在托盘天平上准确称取6.5 g锌粒和10.6 g Na2CO3分别放入两个相同的气球中;(2)在两个锥形瓶中各加入稍过量的稀硫酸(已知此时反应生成的气体的物质的量相等);(3)将气球口紧紧密封固定在锥形瓶口上, 密封不漏气。(4)把气囊中的物质缓缓倒入锥形瓶中, 让它们充分反应,直至完全。
1.当充分反应完全后,可以观察到什么现象?
提示:两个气球几乎一样大。
2.你能解释上述现象的原因吗?
提示:因为两个反应生成的气体的物质的量相同,在相同条件下,占有的
体积也相同。
1.标准状况下的气体摩尔体积
(1)2个条件——①状况条件必须为标准状况。非标准状况下,1 mol气体的体积不一定是22.4 L。因此在使用气体摩尔体积时,一定要看清气体所处的状态。
②状态条件必须为气体。如水、酒精、CCl4等物质在标准状况下不是气体,摩尔体积都不是22.4 L。
(2)2个数据——“1 mol”“约22.4 L”。
2.气体摩尔体积的适用范围
(1)气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。需要注意的是混合气体中气体之间不能发生化学反应。
(2)不同状况下的气体摩尔体积受温度和压强影响,若温度和压强保持一定,那么该状况下的气体摩尔体积也保持不变。因此气体摩尔体积并不都约等于22.4 L·mol-1,22.4 L·mol-1只是气体在标准状况下的一个特例。
(3)同温同压下,任何气体的体积差别均只由气体的分子数决定。
3.气体摩尔体积的相关计算
1.下列说法正确的是( )
A.22.4 L任何气体的物质的量均为1 mol
B.0.2 mol H2和0.8 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
C.标准状况下,1 mol任何物质的体积必定是22.4 L
D.22.4 L CO2和18 g H2O所含的分子数相等
B
解析 没有指明气体是否处于标准状况,A错误;气体摩尔体积适用于单一气体,也可以是混合气体,只要符合物质的量为1 mol,且为标准状况下,体积都约为22.4 L,B正确;标准状况下,1 mol任何气体的体积都约为22.4 L,C错误;18 g H2O是1 mol H2O,但22.4 L CO2不一定是1 mol,因为其所处条件不确定,D错误。
2.下列说法正确的是( )
A.标准状况下,22.4 L任何气体都约含有6.02×1023个分子
B.含1 mol氦原子的氦气在标准状况下的体积约为11.2 L
C.常温常压下,11.2 L Cl2含有的分子数为0.5NA
D.标准状况下,11.2 L蔗糖含有的分子数为0.5NA
A
解析 标准状况下22.4 L气体的物质的量为1 mol,而分子个数N=nNA=NA个,即约为6.02×1023个,A正确;氦气分子为单原子分子,故含1 mol氦原子的氦气的物质的量为1 mol,在标况下的体积为22.4 L,B错误;常温常压下,气体摩尔体积大于22.4 L·mol-1,故11.2 L氯气的物质的量小于0.5 mol,则分子个数小于0.5NA个,C错误;标况下蔗糖为固体,故不能根据气体摩尔体积来计算其物质的量,D错误。
3.(2021·辽宁沈阳高一期中)现有一定量的气体如下:①标准状况下,6.72 L CH4、②3.01×1023个HCl分子、③13.6 g H2S、④0.2 mol NH3。下列对这四种气体的关系判断正确的有几项 ( )
a.标准状况下的体积;②>③>①>④
b.同温同压下的密度;②>③>④>①
c.质量:②>③>①>④
d.氢原子个数:①>③>④>②
A.1项 B.2项
C.3项 D.4项
D
二、阿伏加德罗定律及其推论
用打气筒给篮球打气时,气体源源不断地被打进去,而篮球的体积却未发生很大变化。
1.气体体积与什么因素有关?为什么篮球的体积未发生很大变化?
提示:影响气体体积大小的主要因素是气体分子之间的距离与气体分子数目。给篮球打气时,篮球的体积未发生很大变化是因为虽然气体分子数目增加,但是气体分子之间的距离在不断缩小。
2.1 L O2和1 L H2所含有的分子数是否相同?
提示:不一定。影响气体体积大小的主要因素是气体分子之间的距离与气体分子数目,而气体分子之间的距离受温度和压强的影响较大。温度和压强不同时,气体分子间的距离可能不相同。因此,两种气体分子数相同,体积不一定相同;两种气体体积相同,所含的分子数也不一定相同。
3.相同温度和压强下,相同体积的任何气体所含的原子数一定相同吗?
提示:不一定。相同温度和压强下,相同体积的任何气体的物质的量相同,
即所含分子数相同。分子中所含原子数可能相同,也可能不同,如N2、
CO2等。
1.阿伏加德罗定律
(1)内容:同温同压下,相同体积的任何气体都含有相同数目的粒子。
(2)涵义:
①适用范围:阿伏加德罗定律及其推论适用于气体,可以是单一气体,也可以是混合气体,对固体和液体不适用。
②定律中包含四同(同温、同压、同体积、同物质的量亦或同粒子数),“三同定一同”规律:同温、同压、同体积、同分子数中只要有任何“三同”,则必有“第四同”。
③定律中的同温同压,不一定指在标准状况下;气体摩尔体积为22.4 L·mol-1只是一种特殊情况。
2.阿伏加德罗定律的推论
4.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相
同时,这三种气体的压强(p)由大到小的顺序是( )
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
D
5.(2021·吉林长春二中高一期中)相同的温度和压强下,X2和Y2两种气态单质发生化合反应生成气态化合物Z,实际消耗7 L X2同时消耗21 L Y2,产生14 L Z,则Z的分子式是( )
A.XY2 B.XY3
C.X3Y D.X2Y3
B
解析 相同的温度和压强下气体的摩尔体积相同,则气体的体积比等于气体的物质的量的比。X2和Y2两种气态单质发生化合反应生成气态化合物Z,实际消耗7 L X2同时消耗21 L Y2,同时产生14 L Z,V(X2)∶V(Y2)∶V(Z)=7 L∶21 L∶14 L=1∶3∶2,则n(X2)∶n(Y2)∶n(Z)= 1∶3∶2,故反应方程式为:X2+3Y2===2Z,根据质量守恒定律,可知Z的化学式为XY3。
6.(2021·安徽池州一中高一期中)同温同压下,两容器分别充入等质量的C2H4和
C3H6气体,有关两容器内的气体,下列说法正确的是( )
A.两种气体的密度之比为1∶1
B.氢原子数之比为1∶1
C.两容器的体积之比为2∶3
D.分子数之比为2∶3
B
1. (2021·河北保定高一月考)影响1 mol气体所占体积大小的主要因素是( )
A.分子直径的大小
B.分子间距离的大小
C.分子间相互作用力的大小
D.分子数目的大小
解析 气体分子间距离较大,远大于分子的直径,所以分子大小可以忽略不计,决定气体体积的因素主要为构成物质的分子数和分子间的距离,一定质量的气体的分子数目一定,故一定温度下,影响一定质量气体体积大小的决定因素是气体分子间的平均距离, B正确。
B
2.下列有关气体摩尔体积的叙述正确的是( )
A.单位物质的量的气体所占的体积就是气体摩尔体积,为22.4 L·mol-1
B.通常状况下的气体摩尔体积约为22.4 L·mol-1
C.标准状况下的气体摩尔体积约为22.4 L·mol-1
D.相同物质的量的气体的摩尔体积相同
解析 标准状况下的气体摩尔体积约为22.4 L·mol-1,A、B错误,C正确;气体摩尔体积与气体所处的状态(温度和压强)有关,D错误。
C
3.在标准状况下,由0.5 g H2、11 g CO2和4 g O2组成的混合气体,其体积约
为( )
A.8.4 L B.11.2 L
C.14 L D.16.8 L
C
4.(2021·陕西西安一中高一期中)如图是两瓶体积相等的气体,在同温同压时瓶
内气体的关系一定正确的是( )
A.气体质量相等 B.气体密度相等
C.所含原子数相等 D.摩尔质量相等
解析 左瓶中氮气和氧气的物质的量之比为1∶1时,相当于NO。左瓶与右瓶内NO的质量、密度和摩尔质量均相等,但左瓶中氮气和氧气的物质的量之比为不一定为1∶1,故质量、密度和摩尔质量不一定相等,A、B、D错误;同温同压下,体积之比等于物质的量之比,两瓶气体的物质的量相等,都是双原子分子,物质的量相等的气体含有的原子数目相等,C正确。
C
5.(1)CO2的相对分子质量为____________,它的摩尔质量为____________。
(2)在标准状况下,0.5 mol任何气体的体积都约为____________。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是____________。
(4)0.01 mol某气体的质量为0.28 g,该气体的摩尔质量为____________,在标准状况下,该气体的体积是____________。
答案 (1)44 44 g·mol-1 (2)11.2 L (3)4 g H2 (4)28 g·mol-1 0.224 L
解析 相对分子质量和摩尔质量在数值上相等。在标准状况下1 mol任何气体所占的体积都约为22.4 L。
1.下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
B
解析 依据气体体积的影响因素可知:温度和压强一定时,气体分子间的平均距离几乎相等,因而气体体积主要由其物质的量的多少决定,故A错误,B正确;气体摩尔体积是指在一定温度、压强下,1 mol 任何气体所占的体积,22.4 L是1 mol气体在标准状况下的体积,故C错误;依据阿伏加德罗定律及其推论知:不同的气体,若体积不等,则它们所含的分子数有可能相等,故D错误。
2.(2021·湖北荆州高一期末)对于22 g CO2,下列有关说法正确的是(设NA为阿伏
加德罗常数的值)( )
A.含碳原子个数为NA
B.体积为11.2 L
C.含碳元素的质量为12 g
D.含氧原子的物质的量为1 mol
解析 1个CO2分子由1个C原子和2个O原子构成,22 g CO2的物质的量是
0.5 mol,0.5 mol CO2含碳原子个数为0.5NA,A错误;未指明气体所处的条件,无法计算CO2气体的体积,B错误;0.5 mol CO2含碳原子0.5 mol,其质量是
6 g,C错误;0.5 mol CO2含氧原子的物质的量为1 mol,D正确。
D
3.下列各组物质中,所含分子数相同的是( )
A.2 L SO2和2 L CO2
B.9 g水和标准状况下11.2 L CO2
C.标准状况下,1 mol氧气和22.4 L水
D.0.1 mol H2和2.24 L HCl气体
解析 A项,没有指明气体所处的状态,无法判断二者所含分子数是否相同;B项,9 g水的物质的量为0.5 mol,标准状况下11.2 L CO2的物质的量为
0.5 mol,故二者所含分子数相同;C项,标准状况下,水不是气体,则22.4 L水的物质的量不是1 mol,二者所含分子数不相同;D项,没有指明HCl气体所处的状态,无法判断二者所含分子数是否相同。
B
4.相同状况下,在两个密闭容器中分别充满等质量的O2、O3,下列说法正确的
是( )
A.两种气体所含分子数相等
B.两种气体所含原子数相等
C.两种气体的体积相等
D.两种气体的密度相等
解析 O2、O3都是由氧元素组成的,当两种气体的质量相等时,所含氧原子的物质的量相等,但所含分子的物质的量不相等,A项错误,B项正确;相同状态下,气体的体积之比等于其物质的量之比,故两种气体的体积不相等,密度也不相等,C、D项错误。
B
5.(2021·广东惠州一中高一期中)下面关于同温同压下的两种气体一氧化碳和氮
气的判断不正确的是( )
A.体积相等时密度不相等
B.体积相等时分子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的原子数相等
A
6.在标准状况下,224 mL某气体的质量为0.32 g,该气体的摩尔质量为( )
A.32 g·mol-1 B.64
C.64 g·mol-1 D.64 g
A
7.下列叙述中,正确的是( )
A.1 mol H2的质量只有在标准状况下才约为2 g
B.在标准状况下,某气体的体积是22.4 L,则可认为该气体的物质的量约是
1 mol
C.在20 ℃时,1 mol任何气体的体积总比 22.4 L大
D.1 mol H2和O2的混合气体,在标准状况下的体积大于22.4 L
B
解析 气体的质量只与气体的摩尔质量和气体的物质的量有关,与气体的温度、压强无关,A不正确;22.4 L·mol-1是在特定条件下的气体摩尔体积,所以在标准状况下,某气体的体积是22.4 L,则可以认为该气体的物质的量约是1 mol,B正确;由于气体摩尔体积与气体的温度、压强有关,因此仅温度一定,而压强不定,1 mol任何气体的体积都不能确定,也就是说在20 ℃时,1 mol任何气体的体积可能比22.4 L大,也可能比22.4 L小,还可能等于
22.4 L,C不正确;标准状况下,1 mol任何气体(可以是纯净气体,也可以是混合气体)的体积都约是22.4 L,D不正确。
8.(2021·四川树德中学高一期中)在下列条件下,两种气体的分子数一定相等的
是( )
A.同质量、不同密度的N2和C2H4
B.同温度、同体积的O2和N2
C.同体积、同密度的C2H4和CO2
D.同压强、同体积的O2和N2
A
9.(1)质量比为14∶15的N2和NO混合,则混合气体中氮原子和氧原子的个数比为
____________。
(2)同温同压下,质量相同的五种气体:
①CO2 ②H2 ③O2 ④CH4 ⑤SO2所占的体积由大到小的顺序是(填序号,
下同)____________。
答案 (1)3∶1 (2)②④③①⑤
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为____________,R的相对原子质量为____________。
(4)在标准状况下,有CO和CO2组成的混合气体8.96 L,质量是16 g,此混合物中CO和CO2的物质的量比是____________,C和O原子个数比是____________。
答案 (3)64 g·mol-1 32 (4)1∶3 4∶7
A
11.每年10月23日上午6∶02到下午6∶02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6∶02/10/23,外观与阿伏加德罗常数的值6.02×1023相似。设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22 g CO2与8.5 g NH3所含分子数不相等
B.17 g OH-与19 g H3O+所含电子数不等
C.NA个氧气分子与NA个氖气分子的质量比是4∶5
D.在标准状况下,20 mL NH3和60 mL O2所含分子个数比为1∶3
D
解析 22 g CO2的物质的量是n(CO2)=0.5 mol,8.5 g NH3的物质的量是n(NH3)=0.5 mol,二者的物质的量相等,可知二者所含分子数相等, A错误; 1个OH-与一个H3O+中都含有10个电子,17 g OH-与19 g H3O+的物质的量都是1 mol,则二者所含的电子数相等, B错误; NA个氧气分子与NA个氖原子的物质的量都是1 mol,而二者的质量比是32 g∶20 g=8∶5,C错误;在标准状况下,20 mL NH3和60 mL O2所含分子个数比为1∶3,D正确。
12.某密闭容器中间有一个可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入12 mol CO,右边充入O2和H2的混合气体共60 g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
A.右边O2和H2分子个数之比为2∶3
B.左边CO的体积为268.8 L
C.向右边再充入18 g H2可使隔板处于中间
D.右边混合气体对氢气的相对密度是20
C
13.设NA为阿伏加德罗常数的值,回答下列问题:
(1)0.3 mol NH3分子中所含原子数与____________个H2O分子中所含原子数相等。
(2)某气体在标准状况下的密度为1.25 g·L-1 ,则14 g该气体所含有的分子数为____________。
(3)同温同压下,同体积的H2和A气体的质量分别为1.0 g和16.0 g,则A的摩尔质量为____________。
答案 (1)0.4NA (2)0.5NA (3)32 g·mol-1
(4)56 g氮气在标准状况下的体积为____________,含有氮分子的数目为____________。
(5)4.05 g某金属氯化物MCl2中含有0.06 mol Cl-,则该氯化物的摩尔质量为____________,金属M的相对原子质量为____________。
(6)现有标准状况下CO和CO2混合气体6.72 L,其质量为11.6 g,则此混合气体中,CO和CO2的物质的量之比是____________。
答案 (4)44.8 L 2NA (5)135 g·mol-1 64 (6)1∶2
Thanks!
本课时内容结束
