专题1 第三单元 物质的分散系(共75张PPT)
文档属性
| 名称 | 专题1 第三单元 物质的分散系(共75张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 20:21:33 | ||
图片预览











文档简介
(共75张PPT)
第三单元 物质的分散系
【课程标准要求】
1.知道分散系的概念,能按分散质粒子大小对分散系进行分类。能理解胶体的性质及胶体的鉴别方法。
2.能理解电解质及电离的概念,能用化学符号描述电解质溶液的组成;会运用电离方程式表示电解质的电离过程。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、分散系及其分类
1.分散系
把由一种或几种物质(称为________)分散到另一种物质(称为________)中形成的混合物体系。例如,溶液分散系中的溶质是分散质,而溶剂就是该分散系的分散剂。
分散质
分散剂
2.分类
(1)按照分散系组成部分的状态分类
以分散质和分散剂所处的状态为标
准,共有9种组合:
(2)按照分散质粒子直径大小分类
溶液
胶体
浊液
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)在少量酒精溶于水后得到的分散系中分散质是酒精( )
(2)溶液是纯净物,浊液是混合物( )
(3)溶液、胶体、浊液的本质区别是是否有丁达尔效应( )
(4)胶体在外观上与相同分散剂的溶液没有明显区别( )
√
×
×
√
二、胶体
1.胶体的概念:
分散质粒子的直径在__________________之间的分散系叫作胶体。
2.胶体的性质
(1)丁达尔效应:当光束通过胶体时,在垂直于光线的方向可以看到一条____________,这是由于胶体粒子对光线______形成的。丁达尔效应可用来区分____________。
(2)吸附性:利用胶体的吸附性可以用来净水。如明矾能够净水是因为明矾溶于水后能形成__________胶体。
10-9 m~10-7 m
光亮的通路
散射
溶液和胶体
氢氧化铝
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)溶液、胶体和浊液的本质区别是分散质粒子的直径大小( )
(2)向氢氧化钠溶液中边滴加FeCl3饱和溶液边振荡制备Fe(OH)3胶体( )
(3)直径介于10-9 m ~10-7 m之间的粒子称为胶体( )
√
×
×
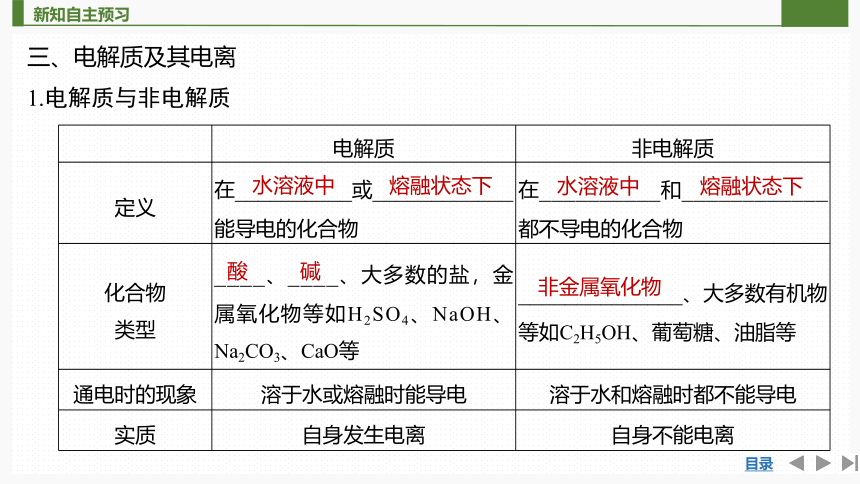
三、电解质及其电离
1.电解质与非电解质
电解质 非电解质
定义 在__________或____________能导电的化合物 在__________和____________都不导电的化合物
化合物 类型 ____、____、大多数的盐,金属氧化物等如H2SO4、NaOH、Na2CO3、CaO等 ______________、大多数有机物等如C2H5OH、葡萄糖、油脂等
通电时的现象 溶于水或熔融时能导电 溶于水和熔融时都不能导电
实质 自身发生电离 自身不能电离
水溶液中
熔融状态下
水溶液中
熔融状态下
酸
碱
非金属氧化物
2.电解质的电离
(1)电离:电解质在水溶液中或熔融状态下产生________________的过程。
(2)电离方程式:用化学符号来表示电解质电离的式子。如
H2SO4的电离: ______________________________;
NaOH的电离:______________________________;
CuSO4的电离:________________________________。
自由移动的离子
3.从电离的角度认识酸、碱、盐
(1)酸是电离时生成的阳离子全部是______的化合物。
(2)碱是电离时生成的阴离子全部是________的化合物。
(3)盐是电离时能生成____________ (或______)和酸根阴离子的化合物。
H+
OH-
金属阳离子
【微自测】
3.判断正误,正确的打“√”,错误的打“×”。
×
×
×
×
√
二、电解质及其电离
一、胶体的制备及性质
一、胶体的制备及性质
在色彩斑斓的灯光晚会上,你可以看到无数条光柱射向美丽的夜空,璀璨夺目。清晨当太阳升起时,你漫步在茂密的森林里,会看到缕缕阳光穿过林木的枝叶铺洒在地面上。
1.图中的现象在化学上有一个特定的名称,该名称是什么?这说明森林中或放
映室内的空气具有哪一类分散系具有的独特性质?
提示:丁达尔效应;胶体
2.产生上述现象的根本原因是什么?此现象在化学上有什么应用?
提示:产生该现象的原因是空气中含有的胶体粒子的大小介于10-9 m ~
10-7 m之间,能使光产生散射;此现象可以鉴别胶体和溶液。
1.溶液、胶体和浊液三种分散系的比较
1.胶体区别于其他分散系最本质的特征是( )
A.可以通过滤纸
B.胶体粒子的直径在10-9~10-7 m之间
C.胶体的胶粒带有电荷
D.胶体有丁达尔效应
解析 胶体区别于其他分散系最本质的特征是胶体粒子的直径在10-9~10-7 m之间。正是这一本质特征,才决定了胶体粒子可以通过滤纸、带有电荷和胶体有丁达尔效应等性质。
B
2.下列事实与胶体性质无关的是( )
A.向豆浆中加入硫酸钙做豆腐
B.将植物油倒入水中用力搅拌形成油水混合物
C.利用丁达尔效应可以区别溶液与胶体
D.观看电影时,从放映机到银幕有明显的光路
解析 A项,豆浆属于胶体分散系,硫酸钙属于电解质,豆浆中加入硫酸钙做豆腐是利用胶体遇电解质发生聚沉的性质,与胶体有关;B项,植物油、水的混合物属于乳浊液,不属于胶体;C项,胶体可以产生丁达尔效应,溶液不能,可以用丁达尔效应区别溶液和胶体;D项,该现象属于丁达尔效应,与胶体有关。
B
3.由多糖和多功能无机纳米颗粒组成的多糖基复合纳米材料[如图所示,(1 nm =10-9 m)]在生物医学领域具有潜在的应用价值,具有协同性能和功能。多糖基复合纳米颗粒分散到水中,下列关于该分散系的说法错误的是( )
A.该分散系属于胶体
B.多糖基复合纳米颗粒直径较大,不能透过滤纸
C.利用丁达尔效应可以区分氯化钡溶液和该分散系
D.一束光通过该分散系,可观察到光亮的通路
B
解析 由题意可知,题给多糖基复合纳米颗粒分散到水中,形成的分散系是胶体,A正确;胶粒的直径比溶液的溶质微粒大,但能透过滤纸,B错误;氯化钡溶液属于溶液,不能产生丁达尔效应。该分散系属于胶体,能够产生丁达尔效应,故利用丁达尔效应可以区分氯化钡溶液和该分散系,C正确;该分散系属于胶体,当用一束光通过该分散系,胶粒能够使光线发生散射作用而直线传播,因此可观察到光亮的通路,即能够发生丁达尔效应,D正确。
二、电解质及其电离
(1)安全用电常识要求“湿手不要摸电器,干燥绝缘要牢记。”
(2)1834年,英国M.法拉第撰文认为“离子是在电流的作用下产生的”。阿伦尼乌斯在研究高度稀释的电解质水溶液的导电性时,发现电解质分子会自动离解,他先后于1883年和1887年发表论文,内容为“酸、碱、盐在水溶液中自动地部分离解为带不同电荷的离子,而不需要借助电流的作用产生离子。”
1.如何从化学的角度解释“湿手不要摸电器,干燥绝缘要牢记”这一安全用电
要求?
提示:湿手即手上沾有NaCl或其他电解质,遇到水时形成电解质溶液,能够
导电,因此湿手直接接触电源时容易发生触电事故。
2.下列说法是否正确?说明理由。
①电解质溶液导电是因为在通电下产生了离子。②电解质只有在水中才能发生电离。
提示:①不正确。电解质溶于水会电离出自由移动的离子,通电后发生定向移动产生电流,电离的条件是溶于水或受热熔融而非在通电下才产生离子。②不正确。电解质在水溶液里或熔融状态下可以电离,二者具备其一即可。
1.电解质的判断
2.电解质与导电和导电能力的关系
(1)电解质导电条件——溶于水或熔融状态电解质本身不一定能导电,如NaCl晶体;有些电解质溶于水能导电,熔融状态不能导电,如HCl。有些电解质只在熔融状态导电,如BaSO4,其水溶液不导电是因为BaSO4难溶于水有些电解质没有熔融状态,只能在水溶液中导电如NH4Cl。像NaCl、KOH等在水溶液或熔融状态都导电。
3.电离方程式书写遵循的原则
4.酸、碱、盐导电实质
(1)酸:①固态(或液态)时只有分子,没有离子,所以不导电;②水溶液里,在水分子的作用下,电离出能自由移动的离子,所以能导电。
(2)碱和盐:①固态时,固体内虽然存在阴、阳离子,但离子不能自由移动,所以不导电;
②溶于水或熔融状态下,电离出能自由移动的离子,所以能导电。
4.现有一种固体化合物X不导电,但熔融状态或溶于水导电,下列关于X的说法
中,正确的是( )
A.X一定为电解质 B.X可能为非电解质
C.X只能是盐类 D.X只能是碱类
解析 因为该化合物在熔融状态或溶于水能导电,所以该化合物一定是电解
质,可以是盐类(如氯化钠),也可以是碱类(如氢氧化钠)等。
A
5.(2021·河北石家庄高一期中)某化学兴趣小组进行化学实验,按照图I连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.MgCl2不是电解质
B.MgCl2溶液是电解质
C.MgCl2在水溶液中电离出了可以
自由移动的离子
D.MgCl2只有在溶液中才能导电
C
解析 在MgCl2固体中含有离子,但由于不能自由移动,因此不能导电,但其溶于水或受热熔化时会电离产生自由移动的离子而能够导电,因此MgCl2是电解质,A错误; MgCl2溶液是混合物,是电解质溶液,B错误;离子化合物MgCl2在水溶液中电离出了可以自由移动的Mg2+、Cl-离子,C正确; MgCl2是离子化合物,在水溶液中或熔融状态下都能够电离产生自由移动的离子,因此不是只有在水溶液中才能够导电,D错误。
6.(2021·黑龙江绥化一中高一期中)下列电离方程式书写正确的是( )
B
7.现有以下物质:①氮气 ②液态CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体
⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaOH溶液,请回答下列问题(填序号):
(1)以上物质能导电的是____________。
(2)以上物质中属于电解质的是____________________________________。
(3)③⑧电离方程式为
③________________________________________________________,
⑧_________________________________________________________。
1.(2021·河北唐山一中高一期中)下列关于胶体说法错误的是( )
A.胶体分散质粒子直径在10-9m~10-7 m之间
B.胶体中分散质粒子对光线进行折射,产生丁达尔现象
C.胶体是较稳定、澄清、透明的分散系
D.胶体的分散质能透过滤纸
解析 胶体区别于其他分散系的本质特征是胶体粒子直径在10-9m~10-7 m之间, A正确;光线透过胶体时,胶粒对光发生散射,产生丁达尔现象, B错误;胶体是一种均一、透明、稳定的分散系,C正确;胶体的分散质能透过滤纸,不能通过半透膜,D正确。
B
2.(2021·辽宁丹东二中高一期中)“天接云涛连晓雾,星河欲转千帆舞”出
自宋·李清照《渔家傲》,以下相关说法正确的是( )
A.“晓雾”属于胶体,分散质是空气
B.“晓雾”在阳光下能观察到丁达尔效应,胶体和溶液的本质区别是丁达尔
效应
C.“云涛”的分散质粒子直径和“晓雾”的分散质粒子直径范围相同
D.氯化铁饱和溶液与“晓雾”属于同一类别的分散系
C
解析 雾有丁达尔效应,属于胶体,分散剂是空气,A错误;胶体和溶液的本质区别是分散质微粒直径不同,B错误;“云涛”“晓雾”都属于胶体,分散质微粒直径介于10-9~10-7 nm,C正确;溶液和胶体分散质微粒直径不同,是不同分散系,D错误。
3.(2021·山东省临沂一中高一期中)利用如图装置对电解质溶液导电性进行实验
探究。下列说法中正确的是( )
A.闭合开关K,电流计指针发生偏转,证明NaHSO4是电解质
B.闭合开关K,向溶液中加入少量Na2CO3固体,电流计示数明显变小
C.闭合开关K,向烧杯中加入NaCl固体,由于NaCl与NaHSO4不反应,故电流
计示数基本不变
D.选取相同浓度的Na2SO4溶液替换NaHSO4溶液,电流计的示数明显变大
A
解析 闭合开关K,电流计指针发生偏转,证明NaHSO4在水溶液中发生了电离,是电解质,A正确;闭合开关K,向溶液中加入少量Na2CO3固体,Na2CO3电离使溶液中离子浓度增大,电流计示数明显变大,B错误;闭合开关K,向烧杯中加入NaCl固体,虽然NaCl与NaHSO4不反应,但NaCl的电离使溶液中离子浓度增大,故电流计示数变大,C错误;取相同浓度的Na2SO4溶液替换NaHSO4溶液,两者电离出的离子浓度基本相同,电流计的示数基本不变,D
错误。
4.(2021·山东省东明一中高一期中)证据推理是化学常用方法,下列推理错误
的是( )
①CaCO3难溶于水,其水溶液几乎不导电,推断CaCO3不是电解质
②Cl2的水溶液能导电,推断Cl2是电解质
③铜是优良的导体,但铜不是电解质
④碳酸氢钠能电离出氢离子,但碳酸氢钠属于盐
A.①② B.①④
C.②④ D.③④
A
解析 ①CaCO3虽在水溶液中很难溶解,但溶于水的部分能完全电离,CaCO3属于电解质,故错误;②Cl2是单质,既不是电解质也不是非电解质,故错误;③铜是单质,不是电解质,故正确;④碳酸氢钠能电离出钠离子、氢离子、碳酸根离子,由金属阳离子和酸根离子组成,属于盐,故正确。
5.(2021·河南信阳高一期中)有如下物质:
①铁丝 ②NaOH溶液 ③NaHSO4固体 ④CO2 ⑤酒精 ⑥蒸馏水 ⑦CCl4 ⑧熔融的 KNO3 ⑨红褐色的氢氧化铁胶体
(1)以上物质中,属于电解质的是____________(填序号,下同),属于非电解质的是____________;
(2)已知蒸馏水有非常微弱的导电性,上述物质除⑥外,能导电的是____________;
(3)分离⑤与⑥的混合液所用的方法是____________;
(4)物质③溶于水的电离方程式为_______________________________;
(5)向⑨的溶液中逐渐滴加③的溶液,看到的现象是____________;
1.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的本质原因是( )
A.雾是一种胶体
B.光是一种胶体
C.空气中的小水滴颗粒直径约为10-9~10-7 m
D.发生丁达尔效应
解析 题干中所提及的雾,是空气中的小液滴,是一种胶体,本质特征是分散质粒子的直径在10-9~10-7 m,C正确。
C
2.下列物质中,能够导电的电解质是( )
A.铜丝 B.熔融的MgCl2
C.NaCl溶液 D.SO3
解析 铜丝是单质;NaCl溶液是混合物,SO3是非电解质。
B
3.(2021·河北石家庄一中高一月考)实验室可利用NaCl溶液和AgNO3溶液制备胶体,也可以反应生成沉淀。图中圆的大小代表分散质粒子的相对大小,下列说法正确的是( )
A.Ⅰ为悬浊液中的分散质粒子
B.制备Ⅰ对应的分散系的离子方程式为Ag++Cl-===AgCl(胶体)
C.利用过滤操作可得到为Ⅰ中的分散质粒子
D.两分散系的本质区别是是否有丁达尔效应
B
解析 胶体分散质粒子直径在10-9~10-7 m之间,浊液分散质粒子直径大于10-7 m。根据题意可知,图中圆的大小代表分散质粒子的相对大小,即Ⅰ为胶体中的分散质粒子,Ⅱ为浊液中的分散质粒子,A错误; Ⅰ对应的分散系为氯化银胶体,制备I对应的分散系的离子方程式为Ag++Cl-===AgCl(胶体),B正确;Ⅰ对应的分散系为氯化银胶体,胶体可以通过滤纸,故不能通过过滤得到Ⅰ中的分散质粒子,C错误;两分散系的本质区别是分散质粒子直径的大小不同,D错误。
4.按溶液、浊液、胶体的顺序排列正确的是( )
A.苏打水、牛奶、豆浆
B.碘酒、泥水、血液
C.白糖水、食盐水、茶水
D.Ca(OH)2悬浊液、澄清石灰水、石灰浆
解析 苏打水是碳酸氢钠的水溶液,牛奶、豆浆都是胶体,故A错误;碘酒是碘的酒精溶液,泥水是浊液,血液为胶体,故B正确;白糖水是蔗糖水溶液,食盐水是氯化钠的水溶液,茶水是溶液,故C错误;Ca(OH)2悬浊液为浊液,澄清石灰水为溶液,石灰浆为浊液,故D错误。
B
5.(2021·北京大兴高一期末)依据下列实验事实,所得结论正确的是( )
D
选项 实验 结论
A 铜丝能导电 铜是电解质
B 干燥的NaCl固体不导电 NaCl固体中不含阴、阳离子
C NaCl溶于水能导电 NaCl在通电条件
下发生电离
D 熔融的NaCl能导电 NaCl是电解质
解析 铜丝能导电,但铜为单质,不是电解质,A错误;干燥的NaCl固体不导电,是由于钠离子和氯离子不能自由移动,B错误;NaCl溶于水能导电,是由于NaCl在水分子作用下发生电离,C错误。
6.(2021·河北保定高一月考)下列电离方程式书写正确的是( )
C
7.下列应用或事实与胶体的性质没有关系的是( )
A.用明矾净化饮用水
B.用石膏或盐卤点制豆腐
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.放电影时,放映室射到银幕上的光柱
解析 明矾溶于水后电离出的Al3+与水作用,生成的Al(OH)3胶体具有吸附性,可以吸附水中的小颗粒,A项与胶体性质有关;石膏或盐卤点制豆腐是利用蛋白质胶体遇到电解质发生聚沉,B项与胶体性质有关;FeCl3溶液中滴加NaOH溶液出现红褐色沉淀的过程中没有胶体生成,C项与胶体性质无关;放电影时,放映室射到银幕上的光柱为丁达尔效应,D项与胶体性质有关。
C
8.下列物质中:A.NaCl晶体;B.CH3CH2OH(酒精);C.H2SO4溶液;D.单质铜;
E.HNO3溶液;F.熔融氯化钾;G.SO2气体;H.液态氯化氢
(1)能够直接导电的是____________;
(2)虽溶于水能导电,但不是电解质的是____________;
(3)溶于水也不能导电的是____________;
(4)虽直接能导电,但不是电解质的是____________;
(5)虽不能直接导电,但也是电解质的是____________。
答案 (1)C、D、E、F (2)G (3)B
(4)C、D、E (5)A、H
C
A.实验室制备氢氧化铁胶体需要加热至红褐色即可
B.化学小组实验过程中产生的气体为CO2
C.FeCl3溶液与Fe(OH)3胶体的本质区别是丁达尔效应
D.用过量Na2CO3粉末代替CaCO3粉末,Fe(OH)3胶体会发生聚沉
解析 制取氢氧化铁胶体时,滴加饱和氯化铁溶液于沸水后继续加热至出现红褐色即停止加热,A正确;制备Fe(OH)3胶体时产生HCl与CaCO3反应产生气体CO2,B正确;FeCl3溶液与Fe(OH)3胶体的本质区别是胶粒直径大小不同,C错误;加入过量Na2CO3即向胶体中加入电解质,Fe(OH)3胶体会发生聚沉,D正确。
10.下表是常见的几种酸、碱、盐在水溶液中电离出离子的情况,根据表
中信息分析正确的是( )
B
A.在水溶液中电离出H+的物质一定是酸
B.在水溶液中电离出金属阳离子和酸根阴离子的物质一定是盐
C.盐溶液电离出的阳离子一定是金属阳离子
D.碱溶液电离出的离子一定是金属阳离子和OH-
11.(2021·辽宁丹东市二中高一期中)用下图所示装置进行a的导电性实验,灯泡
不能发光的是( )
①NaCl溶液 ②液态氯化氢 ③蔗糖溶液
④氨水 ⑤乙醇溶液 ⑥食醋 ⑦浓硫酸
⑧盐酸 ⑨Ba(OH)2溶液
A.②③④⑥ B.②③⑤⑦
C.①⑤⑦ D.③⑤⑥⑦
解析 水溶液中或熔融状态下,有可自由移动的离子则能导电。根据此要求,能导电的有①NaCl溶液、④氨水、⑥食醋、⑧盐酸、⑨Ba(OH)2溶液。
B
12.在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入A溶液时,溶液的导电性的变化趋势如图(Ⅱ)所示。
(1)滴加溶液A至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,溶液A中含有的溶质可能是________(填序号)。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
②
(2)关于图(Ⅱ)下列说法中错误的是________(填字母)。
A.反应前一段导电能力不断减弱,说明生成的BaSO4是非电解质
B.图(Ⅱ)中最低点导电能力约为零说明溶液中几乎没有自由移动的离子
C.图(Ⅱ)中最低点导电能力约为零时,Ba(OH)2溶液与稀硫酸恰好完全中和
D.Ba(OH)2、H2SO4和BaSO4都是电解质
A
(3)请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式: _____________________。
②NaHSO4属于________(填“酸”“碱”或“盐”)。
③将NaHSO4溶液中逐滴加入Ba(OH)2溶液中能否出现如图(Ⅱ)的导电性曲线________。
A.能 B.否
答案 (3)①NaHSO4===Na++H++SO
②盐 ③B
Thanks!
本单元内容结束
第三单元 物质的分散系
【课程标准要求】
1.知道分散系的概念,能按分散质粒子大小对分散系进行分类。能理解胶体的性质及胶体的鉴别方法。
2.能理解电解质及电离的概念,能用化学符号描述电解质溶液的组成;会运用电离方程式表示电解质的电离过程。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、分散系及其分类
1.分散系
把由一种或几种物质(称为________)分散到另一种物质(称为________)中形成的混合物体系。例如,溶液分散系中的溶质是分散质,而溶剂就是该分散系的分散剂。
分散质
分散剂
2.分类
(1)按照分散系组成部分的状态分类
以分散质和分散剂所处的状态为标
准,共有9种组合:
(2)按照分散质粒子直径大小分类
溶液
胶体
浊液
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)在少量酒精溶于水后得到的分散系中分散质是酒精( )
(2)溶液是纯净物,浊液是混合物( )
(3)溶液、胶体、浊液的本质区别是是否有丁达尔效应( )
(4)胶体在外观上与相同分散剂的溶液没有明显区别( )
√
×
×
√
二、胶体
1.胶体的概念:
分散质粒子的直径在__________________之间的分散系叫作胶体。
2.胶体的性质
(1)丁达尔效应:当光束通过胶体时,在垂直于光线的方向可以看到一条____________,这是由于胶体粒子对光线______形成的。丁达尔效应可用来区分____________。
(2)吸附性:利用胶体的吸附性可以用来净水。如明矾能够净水是因为明矾溶于水后能形成__________胶体。
10-9 m~10-7 m
光亮的通路
散射
溶液和胶体
氢氧化铝
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)溶液、胶体和浊液的本质区别是分散质粒子的直径大小( )
(2)向氢氧化钠溶液中边滴加FeCl3饱和溶液边振荡制备Fe(OH)3胶体( )
(3)直径介于10-9 m ~10-7 m之间的粒子称为胶体( )
√
×
×
三、电解质及其电离
1.电解质与非电解质
电解质 非电解质
定义 在__________或____________能导电的化合物 在__________和____________都不导电的化合物
化合物 类型 ____、____、大多数的盐,金属氧化物等如H2SO4、NaOH、Na2CO3、CaO等 ______________、大多数有机物等如C2H5OH、葡萄糖、油脂等
通电时的现象 溶于水或熔融时能导电 溶于水和熔融时都不能导电
实质 自身发生电离 自身不能电离
水溶液中
熔融状态下
水溶液中
熔融状态下
酸
碱
非金属氧化物
2.电解质的电离
(1)电离:电解质在水溶液中或熔融状态下产生________________的过程。
(2)电离方程式:用化学符号来表示电解质电离的式子。如
H2SO4的电离: ______________________________;
NaOH的电离:______________________________;
CuSO4的电离:________________________________。
自由移动的离子
3.从电离的角度认识酸、碱、盐
(1)酸是电离时生成的阳离子全部是______的化合物。
(2)碱是电离时生成的阴离子全部是________的化合物。
(3)盐是电离时能生成____________ (或______)和酸根阴离子的化合物。
H+
OH-
金属阳离子
【微自测】
3.判断正误,正确的打“√”,错误的打“×”。
×
×
×
×
√
二、电解质及其电离
一、胶体的制备及性质
一、胶体的制备及性质
在色彩斑斓的灯光晚会上,你可以看到无数条光柱射向美丽的夜空,璀璨夺目。清晨当太阳升起时,你漫步在茂密的森林里,会看到缕缕阳光穿过林木的枝叶铺洒在地面上。
1.图中的现象在化学上有一个特定的名称,该名称是什么?这说明森林中或放
映室内的空气具有哪一类分散系具有的独特性质?
提示:丁达尔效应;胶体
2.产生上述现象的根本原因是什么?此现象在化学上有什么应用?
提示:产生该现象的原因是空气中含有的胶体粒子的大小介于10-9 m ~
10-7 m之间,能使光产生散射;此现象可以鉴别胶体和溶液。
1.溶液、胶体和浊液三种分散系的比较
1.胶体区别于其他分散系最本质的特征是( )
A.可以通过滤纸
B.胶体粒子的直径在10-9~10-7 m之间
C.胶体的胶粒带有电荷
D.胶体有丁达尔效应
解析 胶体区别于其他分散系最本质的特征是胶体粒子的直径在10-9~10-7 m之间。正是这一本质特征,才决定了胶体粒子可以通过滤纸、带有电荷和胶体有丁达尔效应等性质。
B
2.下列事实与胶体性质无关的是( )
A.向豆浆中加入硫酸钙做豆腐
B.将植物油倒入水中用力搅拌形成油水混合物
C.利用丁达尔效应可以区别溶液与胶体
D.观看电影时,从放映机到银幕有明显的光路
解析 A项,豆浆属于胶体分散系,硫酸钙属于电解质,豆浆中加入硫酸钙做豆腐是利用胶体遇电解质发生聚沉的性质,与胶体有关;B项,植物油、水的混合物属于乳浊液,不属于胶体;C项,胶体可以产生丁达尔效应,溶液不能,可以用丁达尔效应区别溶液和胶体;D项,该现象属于丁达尔效应,与胶体有关。
B
3.由多糖和多功能无机纳米颗粒组成的多糖基复合纳米材料[如图所示,(1 nm =10-9 m)]在生物医学领域具有潜在的应用价值,具有协同性能和功能。多糖基复合纳米颗粒分散到水中,下列关于该分散系的说法错误的是( )
A.该分散系属于胶体
B.多糖基复合纳米颗粒直径较大,不能透过滤纸
C.利用丁达尔效应可以区分氯化钡溶液和该分散系
D.一束光通过该分散系,可观察到光亮的通路
B
解析 由题意可知,题给多糖基复合纳米颗粒分散到水中,形成的分散系是胶体,A正确;胶粒的直径比溶液的溶质微粒大,但能透过滤纸,B错误;氯化钡溶液属于溶液,不能产生丁达尔效应。该分散系属于胶体,能够产生丁达尔效应,故利用丁达尔效应可以区分氯化钡溶液和该分散系,C正确;该分散系属于胶体,当用一束光通过该分散系,胶粒能够使光线发生散射作用而直线传播,因此可观察到光亮的通路,即能够发生丁达尔效应,D正确。
二、电解质及其电离
(1)安全用电常识要求“湿手不要摸电器,干燥绝缘要牢记。”
(2)1834年,英国M.法拉第撰文认为“离子是在电流的作用下产生的”。阿伦尼乌斯在研究高度稀释的电解质水溶液的导电性时,发现电解质分子会自动离解,他先后于1883年和1887年发表论文,内容为“酸、碱、盐在水溶液中自动地部分离解为带不同电荷的离子,而不需要借助电流的作用产生离子。”
1.如何从化学的角度解释“湿手不要摸电器,干燥绝缘要牢记”这一安全用电
要求?
提示:湿手即手上沾有NaCl或其他电解质,遇到水时形成电解质溶液,能够
导电,因此湿手直接接触电源时容易发生触电事故。
2.下列说法是否正确?说明理由。
①电解质溶液导电是因为在通电下产生了离子。②电解质只有在水中才能发生电离。
提示:①不正确。电解质溶于水会电离出自由移动的离子,通电后发生定向移动产生电流,电离的条件是溶于水或受热熔融而非在通电下才产生离子。②不正确。电解质在水溶液里或熔融状态下可以电离,二者具备其一即可。
1.电解质的判断
2.电解质与导电和导电能力的关系
(1)电解质导电条件——溶于水或熔融状态电解质本身不一定能导电,如NaCl晶体;有些电解质溶于水能导电,熔融状态不能导电,如HCl。有些电解质只在熔融状态导电,如BaSO4,其水溶液不导电是因为BaSO4难溶于水有些电解质没有熔融状态,只能在水溶液中导电如NH4Cl。像NaCl、KOH等在水溶液或熔融状态都导电。
3.电离方程式书写遵循的原则
4.酸、碱、盐导电实质
(1)酸:①固态(或液态)时只有分子,没有离子,所以不导电;②水溶液里,在水分子的作用下,电离出能自由移动的离子,所以能导电。
(2)碱和盐:①固态时,固体内虽然存在阴、阳离子,但离子不能自由移动,所以不导电;
②溶于水或熔融状态下,电离出能自由移动的离子,所以能导电。
4.现有一种固体化合物X不导电,但熔融状态或溶于水导电,下列关于X的说法
中,正确的是( )
A.X一定为电解质 B.X可能为非电解质
C.X只能是盐类 D.X只能是碱类
解析 因为该化合物在熔融状态或溶于水能导电,所以该化合物一定是电解
质,可以是盐类(如氯化钠),也可以是碱类(如氢氧化钠)等。
A
5.(2021·河北石家庄高一期中)某化学兴趣小组进行化学实验,按照图I连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.MgCl2不是电解质
B.MgCl2溶液是电解质
C.MgCl2在水溶液中电离出了可以
自由移动的离子
D.MgCl2只有在溶液中才能导电
C
解析 在MgCl2固体中含有离子,但由于不能自由移动,因此不能导电,但其溶于水或受热熔化时会电离产生自由移动的离子而能够导电,因此MgCl2是电解质,A错误; MgCl2溶液是混合物,是电解质溶液,B错误;离子化合物MgCl2在水溶液中电离出了可以自由移动的Mg2+、Cl-离子,C正确; MgCl2是离子化合物,在水溶液中或熔融状态下都能够电离产生自由移动的离子,因此不是只有在水溶液中才能够导电,D错误。
6.(2021·黑龙江绥化一中高一期中)下列电离方程式书写正确的是( )
B
7.现有以下物质:①氮气 ②液态CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体
⑥蔗糖 ⑦酒精 ⑧熔化的KNO3 ⑨NaOH溶液,请回答下列问题(填序号):
(1)以上物质能导电的是____________。
(2)以上物质中属于电解质的是____________________________________。
(3)③⑧电离方程式为
③________________________________________________________,
⑧_________________________________________________________。
1.(2021·河北唐山一中高一期中)下列关于胶体说法错误的是( )
A.胶体分散质粒子直径在10-9m~10-7 m之间
B.胶体中分散质粒子对光线进行折射,产生丁达尔现象
C.胶体是较稳定、澄清、透明的分散系
D.胶体的分散质能透过滤纸
解析 胶体区别于其他分散系的本质特征是胶体粒子直径在10-9m~10-7 m之间, A正确;光线透过胶体时,胶粒对光发生散射,产生丁达尔现象, B错误;胶体是一种均一、透明、稳定的分散系,C正确;胶体的分散质能透过滤纸,不能通过半透膜,D正确。
B
2.(2021·辽宁丹东二中高一期中)“天接云涛连晓雾,星河欲转千帆舞”出
自宋·李清照《渔家傲》,以下相关说法正确的是( )
A.“晓雾”属于胶体,分散质是空气
B.“晓雾”在阳光下能观察到丁达尔效应,胶体和溶液的本质区别是丁达尔
效应
C.“云涛”的分散质粒子直径和“晓雾”的分散质粒子直径范围相同
D.氯化铁饱和溶液与“晓雾”属于同一类别的分散系
C
解析 雾有丁达尔效应,属于胶体,分散剂是空气,A错误;胶体和溶液的本质区别是分散质微粒直径不同,B错误;“云涛”“晓雾”都属于胶体,分散质微粒直径介于10-9~10-7 nm,C正确;溶液和胶体分散质微粒直径不同,是不同分散系,D错误。
3.(2021·山东省临沂一中高一期中)利用如图装置对电解质溶液导电性进行实验
探究。下列说法中正确的是( )
A.闭合开关K,电流计指针发生偏转,证明NaHSO4是电解质
B.闭合开关K,向溶液中加入少量Na2CO3固体,电流计示数明显变小
C.闭合开关K,向烧杯中加入NaCl固体,由于NaCl与NaHSO4不反应,故电流
计示数基本不变
D.选取相同浓度的Na2SO4溶液替换NaHSO4溶液,电流计的示数明显变大
A
解析 闭合开关K,电流计指针发生偏转,证明NaHSO4在水溶液中发生了电离,是电解质,A正确;闭合开关K,向溶液中加入少量Na2CO3固体,Na2CO3电离使溶液中离子浓度增大,电流计示数明显变大,B错误;闭合开关K,向烧杯中加入NaCl固体,虽然NaCl与NaHSO4不反应,但NaCl的电离使溶液中离子浓度增大,故电流计示数变大,C错误;取相同浓度的Na2SO4溶液替换NaHSO4溶液,两者电离出的离子浓度基本相同,电流计的示数基本不变,D
错误。
4.(2021·山东省东明一中高一期中)证据推理是化学常用方法,下列推理错误
的是( )
①CaCO3难溶于水,其水溶液几乎不导电,推断CaCO3不是电解质
②Cl2的水溶液能导电,推断Cl2是电解质
③铜是优良的导体,但铜不是电解质
④碳酸氢钠能电离出氢离子,但碳酸氢钠属于盐
A.①② B.①④
C.②④ D.③④
A
解析 ①CaCO3虽在水溶液中很难溶解,但溶于水的部分能完全电离,CaCO3属于电解质,故错误;②Cl2是单质,既不是电解质也不是非电解质,故错误;③铜是单质,不是电解质,故正确;④碳酸氢钠能电离出钠离子、氢离子、碳酸根离子,由金属阳离子和酸根离子组成,属于盐,故正确。
5.(2021·河南信阳高一期中)有如下物质:
①铁丝 ②NaOH溶液 ③NaHSO4固体 ④CO2 ⑤酒精 ⑥蒸馏水 ⑦CCl4 ⑧熔融的 KNO3 ⑨红褐色的氢氧化铁胶体
(1)以上物质中,属于电解质的是____________(填序号,下同),属于非电解质的是____________;
(2)已知蒸馏水有非常微弱的导电性,上述物质除⑥外,能导电的是____________;
(3)分离⑤与⑥的混合液所用的方法是____________;
(4)物质③溶于水的电离方程式为_______________________________;
(5)向⑨的溶液中逐渐滴加③的溶液,看到的现象是____________;
1.朱自清先生在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的本质原因是( )
A.雾是一种胶体
B.光是一种胶体
C.空气中的小水滴颗粒直径约为10-9~10-7 m
D.发生丁达尔效应
解析 题干中所提及的雾,是空气中的小液滴,是一种胶体,本质特征是分散质粒子的直径在10-9~10-7 m,C正确。
C
2.下列物质中,能够导电的电解质是( )
A.铜丝 B.熔融的MgCl2
C.NaCl溶液 D.SO3
解析 铜丝是单质;NaCl溶液是混合物,SO3是非电解质。
B
3.(2021·河北石家庄一中高一月考)实验室可利用NaCl溶液和AgNO3溶液制备胶体,也可以反应生成沉淀。图中圆的大小代表分散质粒子的相对大小,下列说法正确的是( )
A.Ⅰ为悬浊液中的分散质粒子
B.制备Ⅰ对应的分散系的离子方程式为Ag++Cl-===AgCl(胶体)
C.利用过滤操作可得到为Ⅰ中的分散质粒子
D.两分散系的本质区别是是否有丁达尔效应
B
解析 胶体分散质粒子直径在10-9~10-7 m之间,浊液分散质粒子直径大于10-7 m。根据题意可知,图中圆的大小代表分散质粒子的相对大小,即Ⅰ为胶体中的分散质粒子,Ⅱ为浊液中的分散质粒子,A错误; Ⅰ对应的分散系为氯化银胶体,制备I对应的分散系的离子方程式为Ag++Cl-===AgCl(胶体),B正确;Ⅰ对应的分散系为氯化银胶体,胶体可以通过滤纸,故不能通过过滤得到Ⅰ中的分散质粒子,C错误;两分散系的本质区别是分散质粒子直径的大小不同,D错误。
4.按溶液、浊液、胶体的顺序排列正确的是( )
A.苏打水、牛奶、豆浆
B.碘酒、泥水、血液
C.白糖水、食盐水、茶水
D.Ca(OH)2悬浊液、澄清石灰水、石灰浆
解析 苏打水是碳酸氢钠的水溶液,牛奶、豆浆都是胶体,故A错误;碘酒是碘的酒精溶液,泥水是浊液,血液为胶体,故B正确;白糖水是蔗糖水溶液,食盐水是氯化钠的水溶液,茶水是溶液,故C错误;Ca(OH)2悬浊液为浊液,澄清石灰水为溶液,石灰浆为浊液,故D错误。
B
5.(2021·北京大兴高一期末)依据下列实验事实,所得结论正确的是( )
D
选项 实验 结论
A 铜丝能导电 铜是电解质
B 干燥的NaCl固体不导电 NaCl固体中不含阴、阳离子
C NaCl溶于水能导电 NaCl在通电条件
下发生电离
D 熔融的NaCl能导电 NaCl是电解质
解析 铜丝能导电,但铜为单质,不是电解质,A错误;干燥的NaCl固体不导电,是由于钠离子和氯离子不能自由移动,B错误;NaCl溶于水能导电,是由于NaCl在水分子作用下发生电离,C错误。
6.(2021·河北保定高一月考)下列电离方程式书写正确的是( )
C
7.下列应用或事实与胶体的性质没有关系的是( )
A.用明矾净化饮用水
B.用石膏或盐卤点制豆腐
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.放电影时,放映室射到银幕上的光柱
解析 明矾溶于水后电离出的Al3+与水作用,生成的Al(OH)3胶体具有吸附性,可以吸附水中的小颗粒,A项与胶体性质有关;石膏或盐卤点制豆腐是利用蛋白质胶体遇到电解质发生聚沉,B项与胶体性质有关;FeCl3溶液中滴加NaOH溶液出现红褐色沉淀的过程中没有胶体生成,C项与胶体性质无关;放电影时,放映室射到银幕上的光柱为丁达尔效应,D项与胶体性质有关。
C
8.下列物质中:A.NaCl晶体;B.CH3CH2OH(酒精);C.H2SO4溶液;D.单质铜;
E.HNO3溶液;F.熔融氯化钾;G.SO2气体;H.液态氯化氢
(1)能够直接导电的是____________;
(2)虽溶于水能导电,但不是电解质的是____________;
(3)溶于水也不能导电的是____________;
(4)虽直接能导电,但不是电解质的是____________;
(5)虽不能直接导电,但也是电解质的是____________。
答案 (1)C、D、E、F (2)G (3)B
(4)C、D、E (5)A、H
C
A.实验室制备氢氧化铁胶体需要加热至红褐色即可
B.化学小组实验过程中产生的气体为CO2
C.FeCl3溶液与Fe(OH)3胶体的本质区别是丁达尔效应
D.用过量Na2CO3粉末代替CaCO3粉末,Fe(OH)3胶体会发生聚沉
解析 制取氢氧化铁胶体时,滴加饱和氯化铁溶液于沸水后继续加热至出现红褐色即停止加热,A正确;制备Fe(OH)3胶体时产生HCl与CaCO3反应产生气体CO2,B正确;FeCl3溶液与Fe(OH)3胶体的本质区别是胶粒直径大小不同,C错误;加入过量Na2CO3即向胶体中加入电解质,Fe(OH)3胶体会发生聚沉,D正确。
10.下表是常见的几种酸、碱、盐在水溶液中电离出离子的情况,根据表
中信息分析正确的是( )
B
A.在水溶液中电离出H+的物质一定是酸
B.在水溶液中电离出金属阳离子和酸根阴离子的物质一定是盐
C.盐溶液电离出的阳离子一定是金属阳离子
D.碱溶液电离出的离子一定是金属阳离子和OH-
11.(2021·辽宁丹东市二中高一期中)用下图所示装置进行a的导电性实验,灯泡
不能发光的是( )
①NaCl溶液 ②液态氯化氢 ③蔗糖溶液
④氨水 ⑤乙醇溶液 ⑥食醋 ⑦浓硫酸
⑧盐酸 ⑨Ba(OH)2溶液
A.②③④⑥ B.②③⑤⑦
C.①⑤⑦ D.③⑤⑥⑦
解析 水溶液中或熔融状态下,有可自由移动的离子则能导电。根据此要求,能导电的有①NaCl溶液、④氨水、⑥食醋、⑧盐酸、⑨Ba(OH)2溶液。
B
12.在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入A溶液时,溶液的导电性的变化趋势如图(Ⅱ)所示。
(1)滴加溶液A至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,溶液A中含有的溶质可能是________(填序号)。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
②
(2)关于图(Ⅱ)下列说法中错误的是________(填字母)。
A.反应前一段导电能力不断减弱,说明生成的BaSO4是非电解质
B.图(Ⅱ)中最低点导电能力约为零说明溶液中几乎没有自由移动的离子
C.图(Ⅱ)中最低点导电能力约为零时,Ba(OH)2溶液与稀硫酸恰好完全中和
D.Ba(OH)2、H2SO4和BaSO4都是电解质
A
(3)请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式: _____________________。
②NaHSO4属于________(填“酸”“碱”或“盐”)。
③将NaHSO4溶液中逐滴加入Ba(OH)2溶液中能否出现如图(Ⅱ)的导电性曲线________。
A.能 B.否
答案 (3)①NaHSO4===Na++H++SO
②盐 ③B
Thanks!
本单元内容结束
