专题1 第一单元 物质及其反应的分类(共84张PPT)
文档属性
| 名称 | 专题1 第一单元 物质及其反应的分类(共84张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 20:24:13 | ||
图片预览











文档简介
(共84张PPT)
第一单元
物质及其反应的分类
专题1 物质的分类及计量
【课程标准要求】
1.能从不同层次认识物质的多样性,能依据不同标准对物质进行分类。
2.能举例说明四种基本化学反应类型的分类。
3.能够根据化合价变化判断氧化还原反应和非氧化还原反应。
4.能认识物质是变化的,知道化学变化需要一定的条件,并遵循一定规律。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、物质的分类
1.物质的分类方法
(1)根据物质存在的状态:将物质分为固态物质、液态物质和______物质。
(2)根据物质的________:将物质分为导体、半导体和绝缘体。
(3)根据物质在水中的溶解性:将物质分为可溶性物质、微溶性物质、________物质。
气态
导电性
难溶性
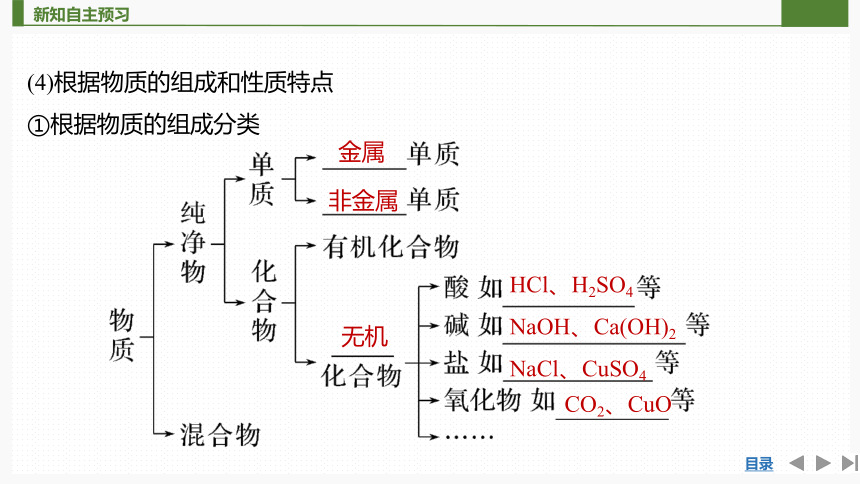
(4)根据物质的组成和性质特点
①根据物质的组成分类
HCl、H2SO4
NaOH、Ca(OH)2
NaCl、CuSO4
金属
非金属
无机
CO2、CuO
②根据氧化物的性质分类
a.酸性氧化物:能与碱反应生成盐和水的氧化物;如CO2、SO2 等, CO2与澄清石灰水反应的化学方程式为____________________________________。
b.碱性氧化物:能与酸反应生成盐和水的氧化物;如CaO、Na2O等,CaO与稀盐酸反应的化学方程式为________________________________。
CO2+Ca(OH)2===CaCO3↓+H2O
CaO+2HCl===CaCl2+H2O
③根据酸的组成分类
④根据碱的溶解性分类
2.物质分类的意义
同一类物质在组成和性质方面往往具有一定的相似性。对物质进行合理的分类,有助于我们按物质的类别进一步研究物质的组成、结构和性质。
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)Fe2O3与HNO3均属于氧化物( )
(2)CO2和CO都属于酸性氧化物( )
(3)只含有一种元素的物质一定属于纯净物( )
(4)CaCO3既属于难溶性物质,又属于盐( )
×
×
×
√
二、物质的转化
不同类别的物质在一定条件下可以相互转化。物质之间的转化需要一定的条件。以钙为例,钙及其化合物之间的转化关系如下:
1.写出相关反应方程式:
①____________________________
②CaO+H2O===Ca(OH)2
③CaO+CO2===CaCO3
④____________________________________
⑤Ca(OH)2+2HCl===CaCl2+2H2O
⑥__________________________________________。
2Ca+O2===2CaO
Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+2HCl===CaCl2+CO2↑+H2O
2.上述反应中,属于化合反应的是________ (填序号,下同),属于复分解反应的是______。
①②③
⑤⑥
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)化学变化过程中,物质和元素都会发生改变( )
(2)金属单质可与氧气反应生成碱性氧化物( )
(3)制取某种碱,可以采取盐与另一种碱发生反应的方法( )
(4)所有的金属氧化物与水反应都能生成相应碱( )
×
√
√
×
三、化学反应的分类
1.根据反应物、生成物的类别和种数,把化学反应分成四种基本反应类型
分解
置换
复分解
2.根据化学反应中元素的_________是否发生变化,将化学反应分为氧化还原
反应和非氧化还原反应。
①有元素________________的反应称为氧化还原反应;如,Fe+
CuSO4===Cu+FeSO4 。
②元素化合价不发生变化的反应,称为非氧化还原反应;如,CuSO4+
2NaOH===Na2SO4+Cu(OH)2↓。
化合价
化合价发生变化
【微自测】
3.判断正误,正确的打“√”,错误的打“×”。
×
√
√
√
×
二、物质的转化与反应类型
一、物质的分类
一、物质的分类
在某食品的包装内,有上面写着“生石灰干燥剂,请勿食用” 的小纸袋,内装白色颗粒状固体,裸露在空气中过一段时间后纸袋内的白色颗粒黏在一起,成为块状固体。
1.你能写出上述文字中涉及到的物质的化学式吗?其所属物质各是什么类别?
2.上述物质中的氧化物根据其性质分类应属于哪一类氧化物?该氧化物固体是
常见的干燥剂,请用化学方程式表示其做干燥剂的原理。
提示:CaO、Ca(OH)2和CaCO3;它们分别属于氧化物、碱和盐。
提示:碱性氧化物 CaO+H2O===Ca(OH)2。
1.从不同角度对物质分类(又称交叉分类法)
被分类的对象应用多种不同的单一分类法进行分类,如对Na2CO3进行分类:
2.根据化合物的组成和性质分类(又称树状分类法)
3.根据氧化物的组成和性质分类(树状分类法)
1.(2021·江苏邗江高一期中)重铬酸钾(K2Cr2O7)是一种重要的着色剂、强氧化剂。
它属于( )
A.酸 B.碱
C.盐 D.氧化物
解析 重铬酸钾(K2Cr2O7)含有三种元素,由钾离子和重铬酸根离子组成,属于盐。
C
2.(2021·福建福州一中高一期中)按照物质的分类方法,硝酸应属于( )
①酸、②氢化物、③氧化物、④含氧酸、⑤难挥发性酸、⑥一元酸、⑦化合物、⑧混合物。
A.①②③④⑥⑦⑧ B.①④⑥⑦
C.①⑨ D.①④⑤⑥⑦
B
解析 硝酸的化学式为HNO3。①硝酸是常见的强酸,属于酸;②氢化物是指由氢元素和另外一种元素构成的化合物,硝酸含有三种元素,不属于氢化物;③氧化物是指由氧元素和另外一种元素构成的化合物,硝酸含有三种元素,不属于氧化物;④硝酸分子中含有H、O、N三种元素,硝酸属于含氧酸;⑤硝酸是易挥发性酸;⑥一个硝酸分子在溶液中完全电离生成一个氢离子,属于一元酸;⑦硝酸分子中含有H、O、N三种元素,硝酸属于化合物;⑧硝酸分子的化学式为HNO3,说明硝酸为纯净物。
3.(2021·江苏宿迁青华中学高一期中)歌曲《青花瓷》,唱道“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3 (碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应的说法正确的是( )
A.该反应中CO2是酸性氧化物
B.该反应中氧元素和碳元素化合价发生变化
C.该反应不属于氧化还原反应
D.该反应中Cu2(OH)2CO3是碱
A
解析 CO2能与碱反应生成盐和水,2NaOH+CO2===Na2CO3+H2O,故该反应中CO2是酸性氧化物,A正确;由反应可知,该反应中氧元素和铜元素化合价发生变化,碳元素的化合价未改变,B错误;该反应前后有元素的化合价发生了改变,故该反应属于氧化还原反应,C错误;该反应中Cu2(OH)2CO3是盐,碱式盐,D错误。
二、物质的转化与反应类型
1.单质、酸、碱、盐、氧化物之间的转化关系
2.化学反应的分类
判断一个反应是否为氧化还原反应的依据是看该反应中各元素的化合价有没有发生变化。
3.氧化还原反应与四种基本反应类型的关系
即有单质参加的化合反应或有单质生成的分解反应一定是氧化还原反应;置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应。
4.(2021·江苏淮安高一期中)下列反应一定属于氧化还原的是( )
A.复分解反应 B.置换反应
C.化合反应 D.分解反应
B
5.(2021·江苏沭阳高一期中)KOH是我国古代纺织业常用作漂洗的洗涤剂。古代
制取KOH的流程如下:
上述流程中没有涉及的化学反应类型是( )
A.化合反应 B.分解反应
C.氧化还原反应 D.复分解反应
C
6.如图中,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下通过置换反应可以转化为乙。下面四组选项中,符合图示要求的是( )
C
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B BaCl2 K2CO3 HCl KOH
C O2 CO CuO C
D Fe CuCl2 Zn HCl
1.下列物质的分类不正确的是( )
A.SO2(氧化物) B.碘酒(单质)
C.HNO3(含氧酸) D.氯水(混合物)
解析 SO2是由氧元素和硫元素组成的化合物属于氧化物,A正确;碘酒是酒精和碘单质的混合物,B错误;HNO3属于含氧酸,C正确;氯水是Cl2溶于水形成的混合物,D正确。
B
2.(2021·黑龙江漠河高中高一月考)下列叙述中正确的是( )
A.由同种元素组成的物质一定是单质
B.非金属氧化物不一定是酸性氧化物
C.金属氧化物一定是碱性氧化物
D.CO、NO、CO2均属于不成盐氧化物
解析 由同种元素组成的物质不一定属于纯净物,如O2、O3组成的混合物,A错误;非金属氧化物可以是不成盐氧化物,如CO、NO、H2O等,B正确;金属氧化物可以是酸性氧化物如Mn2O7,C错误; CO2与NaOH反应生成碳酸钠,属于成盐(或酸性)氧化物,D错误。
B
3.(2021·江苏上冈高中高一期中)下列反应不属于四种基本反应类型,但属于氧
化还原反应的是( )
B
4.2022年2月第24届冬奥会在中国北京——河北张家口联合举行。小美在奥运五连环中填入了如图所示的5种物质,相连环的物质间所发生的反应中,没有涉及的基本反应类型和属于氧化还原反应的个数有( )
A.复分解反应、1个
B.分解反应、2个
C.化合反应、3个
D.置换反应、2个
B
5.(2021·陕西榆林十二中高一)某同学在实验探究中发现了一些物质之间发生化
学反应的颜色变化,如图所示。
(1)编号①反应的指示剂是____________;编号②反应的金属单质是____________。
(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是____________反应。
(3)请你写出符合编号③反应的化学方程式_______________________________。
(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是____________。
答案 (1)石蕊试剂 Fe (2)置换反应 (3)6HCl+Fe2O3===3H2O+2FeCl3
(4)产生白色沉淀
解析 (1)石蕊试剂遇酸变为红色;Fe2+的溶液为浅绿色,故金属单质为Fe。
(2)反应②为Fe+2HCl===FeCl2+H2↑,为置换反应。(3)Fe3+的溶液为黄色,故氧化物为Fe2O3,故化学方程式为6HCl+Fe2O3===3H2O+2FeCl3。(4)编号④为稀盐酸和AgNO3生成氯化银白色沉淀和水,故现象为产生白色沉淀。
1.(2021·江苏阜宁高一期中)2021年诺贝尔化学奖授予了两位化学家Benjamin List和David W·C·MacMillan,以表彰他们在脯氨酸方面的研究成果。脯氨酸(C5H9NO2)结构式见下图,它属于( )
A.单质 B.氧化物
C.混合物 D.有机物
解析 脯氨酸(C5H9NO2)是含碳、氢、氧、氮的化合物,属于有机物。
D
2.某学生发现实验室中的一瓶无色气体,他想知道是何种气体。经实验测定此瓶气体中只含有C、O两种元素。通常情况下这瓶气体不可能是( )
A.一种化合物 B.单质和化合物的混合物
C.两种化合物 D.两种单质
解析 只含有C、O两种元素的气体,既可能是纯净物(只含有CO或只含有CO2),也可能是混合物(即同时含有CO与CO2,CO与O2,CO、CO2和O2或CO2与O2的混合物)。常温下碳单质不可能是气体,D错误。
D
3.分类是学习和研究化学的一种常用的科学方法,下列分类合理的是( )
A.根据酸分子中所含氢原子的个数,将酸分为一元酸、二元酸等
B.根据物质在水中的溶解性,将物质分为可溶性物质、微溶性物质和难溶性物质
C.根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化
物等
D.根据化合物中是否含有碳元素,将化合物分为无机化合物和有机化合物
B
解析 根据酸分子能电离出氢离子的个数,将酸分为一元酸、二元酸等,A项分类不合理;根据氧化物能否与酸或碱反应生成盐和水,将氧化物分为碱性氧化物、酸性氧化物等,C项分类不合理;有机化合物中一定含有碳元素,但含有碳元素的化合物不一定是有机化合物,如Na2CO3,D项分类不合理。
4.(2021·江苏省响水中学高一期中)化学变化多姿多彩,美丽如花。如图所示,甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是( )
A.C B.Fe2O3
C.CO D.盐酸
解析 甲、乙、丙均能与X发生化学反应,从四种物质的两两反应关系可知,只有Fe2O3能与其他三种物质分别反应,则X是Fe2O3。
B
C
6.(2021·江苏常熟高一开学考试)分类是化学学习和研究的常用手段。下列分类
依据和结论都正确的是( )
A.含有氧元素的化合物,一定是氧化物
B.烧碱、纯碱、火碱都属于碱
C.酸性氧化物一定是非金属氧化物
D.CuSO4·5H2O、冰水、液氨都属于纯净物
D
解析 含有氧元素的化合物不一定都是氧化物,如Na2CO3是盐,A错误;纯碱是碳酸钠,属于盐,B错误;酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,但也是酸性氧化物,C错误; CuSO4·5H2O、冰水、液氨都属于纯净物,D正确。
7.(2021·山东省实验中学高一期中)下列物质的分类合理的是( )
A.酸性氧化物:SO2、SO3、CO2、CO
B.碱:烧碱、苏打、苛性钾、消石灰
C.混合物:食盐水、豆浆、冰水混合物、氢氧化铁胶体
D.有机物:乙醇、醋酸、葡萄糖、四氯化碳
解析 CO既不能和酸反应又不能和碱反应,CO不是酸性氧化物,A错误;苏打是碳酸钠,碳酸钠属于盐,B错误;冰水混合物中只含水分子,属于纯净物,C错误;乙醇、醋酸、葡萄糖、四氯化碳都是含有碳元素的化合物,都属于有机物,D正确。
D
8.下列各组物质之间可以按下图所示关系直接转化的是( )
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
解析 选项A中,Fe2O3―→FeSO4不能一步实现;选项B中,H2CO3―→CO不能一步实现;选项C中,NaCl―→Na2CO3不能一步实现。
D
9.下列各选项中,不能通过一步反应实现如图所示转化关系的是( )
A.X为铜、Y为氧化铜、Z为硫酸铜
B.X为二氧化碳、Y为碳酸钠、Z为碳酸钙
C.X为碳酸钙、Y为氧化钙、Z为氢氧化钙
D.X为氢氧化钠、Y为氯化钠、Z为碳酸钠
D
解析 铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜,硫酸铜溶液与铁反应生成铜,故A不符合题意;二氧化碳与氢氧化钠反应生成碳酸钠,碳酸钠与氯化钙反应生成碳酸钙,碳酸钙与盐酸反应生成二氧化碳,故B不符合题意;碳酸钙高温分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,故C不符合题意;氢氧化钠与盐酸反应生成氯化钠,氯化钠不能通过一步反应转化生成碳酸钠,故D符合题意。
10.某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ
实验
现象 没有明显变化, 溶液仍为无色 有沉淀生成, 溶液为蓝色 有无色气
泡产生
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中的化学方程式为2HCl+Zn===ZnCl2+H2↑
D.Ⅲ中发生的反应是氧化还原反应
解析 Ⅰ中氢氧化钠与硫酸反应生成硫酸钠和水,A错误;Ⅱ中氯化钡与硫酸铜反应生成白色沉淀为BaSO4,B正确;Ⅲ中锌与盐酸反应生成氯化锌和氢气,反应的化学方程式为2HCl+Zn===ZnCl2+H2↑,C正确;Ⅲ中锌元素、氢元素化合价发生变化,属于氧化还原反应,D正确。
A
11.(2021·四川雅安中学高一)Ⅰ.常温下,氯酸钾的溶解度较小,在工业上可通过
如图转化制得。
(1)已知反应Ⅰ中,通电时发生的反应方程式为NaCl+3X===NaClO3+3H2↑,则X的化学式为____________。
(2)现有KClO3固体中混有少量NaCl,除杂的方法是溶解,____________,过滤,洗涤,最后干燥。
答案 (1)H2O (2)蒸发浓缩、冷却结晶
解析 (1)结合反应NaCl+3X===NaClO3+3H2↑,根据元素守恒,可知X的化学式为H2O。(2)常温下,氯酸钾的溶解度较小,KClO3固体中混有少量NaCl,除杂的方法是溶解,蒸发浓缩,冷却结晶,过滤,洗涤,最后干燥得到KClO3固体。
请写出上述方案中有关反应的化学方程式,并指明反应类型:
(3)__________________;___________________________________。
(4) __________________;___________________________________。
(5) __________________;___________________________________。
剂高温条件下,被⑧氧气(O2)氧化得到⑨一氧化氮(NO),NO经一系列变化制得⑩硝酸(HNO3),HNO3与NH3反应可得到另一种常见氮肥。
答案 (1)④;⑥⑨;⑩;⑦
解析 (1)①氨水是氨气的水溶液,属于混合物,故属于混合物的是④;②二氧化碳、一氧化氮都是两种元素组成,其中一种元素是氧元素,二氧化碳、一氧化氮是氧化物,属于氧化物的是⑥⑨;③HNO3电离出的阳离子全是氢离子,HNO3是酸,属于酸的是⑩;④CO(NH2)2是含有碳元素的化合物,是有机物,故属于有机物的是⑦。
答案 (2)单质或非金属单质或气体 不是
13.顺式Pt(NH3)2Cl2(相对分子质量为300)是临床广泛使用的抗肿瘤药物。
下列有关说法中正确的是( )
A.由4种元素组成
B.该物质由PtCl2和NH3组成,属于混合物
C.NH3属于碱
D.Pt的化合价为+4价
A
解析 顺式Pt(NH3)2Cl2是化合物,是纯净物,故B不正确;NH3属于氢化物,不属于碱,故C不正确;Pt(NH3)2Cl2中有Pt、N、H、Cl四种元素,故A正确;Pt(NH3)2Cl2分子中整个“NH3”为0价,Cl为-1价,根据化合物中各元素正、负化合价代数和为0可知,Pt为+2价,故D不正确。
C
解析 CuO不能与水反应生成Cu(OH)2,A错误;MgCl2不能与Na2SO4发生反应,B错误;碳在氧气中燃烧生成CO2,CO2与水反应生成H2CO3,H2CO3与氢氧化钙反应生成CaCO3沉淀,C正确;硫在氧气中燃烧生成SO2,SO2与水反应生成H2SO3,H2SO3与NaOH反应生成Na2SO3, D不正确。
15. (1)下面是某同学对有关物质进行分类的列表:
碱 酸 盐 碱性 氧化物 酸性
氧化物
第一组 Na2CO3 H2SO4 NaHCO3 CaO CO2
第二组 NaOH HCl NaCl Na2O CO
第三组 NaOH CH3COOH CaF2 Na2O2 SO2
已知:2Na2O2 +4HCl=== 4NaCl +O2↑+2H2O每组分类均有错误,其错误的物质分别是____________、____________、____________(填化学式)。
(2)已知:H3PO2+NaOH(过量)===NaH2PO2+H2O。据此回答下列问题:H3PO2中磷元素的化合价是____________。该反应属于四种基本反应类型中的____________反应(选填“化合”、“分解”、“置换”或“复分解”)。该反应____________(选填“属于”或“不属于”)氧化还原反应。
答案 (1)Na2CO3 CO Na2O2
(2)+1(价) 复分解 不属于
解析 (1)第一组中的碳酸钠是盐,不是碱;第二组中的CO与碱不反应,不是酸性氧化物;第三组中的Na2O2是氧化物但不是碱性氧化物,因为与酸反应生成氧气。(2)①H3PO2中H为+1价,O为-2价,由化合价代数和为0可知P元素化合价为+1价;反应H3PO2+NaOH(过量)===NaH2PO2+H2O由两种化合物相互交换成分生成另外两种新的化合物,属于四种基本反应类型中的复分解反应;该反应中各元素化合价均不变,不属于氧化还原反应。
(3)一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表所示:
①该变化的基本反应类型是____________反应。
②物质Q在反应中起的作用是____________________。
物质 M N Q P
反应前质量/g 50 1 3 12
反应后质量/g x 26 3 30
答案 (3)①分解 ②催化剂
解析 (3)①N和P的质量增加,这说明二者是生成物,所以M是反应物,则该反应是M的分解反应;②根据表中数据可知反应前后Q的质量不变,因此Q是催化剂,起催化作用。
Thanks!
本单元内容结束
第一单元
物质及其反应的分类
专题1 物质的分类及计量
【课程标准要求】
1.能从不同层次认识物质的多样性,能依据不同标准对物质进行分类。
2.能举例说明四种基本化学反应类型的分类。
3.能够根据化合价变化判断氧化还原反应和非氧化还原反应。
4.能认识物质是变化的,知道化学变化需要一定的条件,并遵循一定规律。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、物质的分类
1.物质的分类方法
(1)根据物质存在的状态:将物质分为固态物质、液态物质和______物质。
(2)根据物质的________:将物质分为导体、半导体和绝缘体。
(3)根据物质在水中的溶解性:将物质分为可溶性物质、微溶性物质、________物质。
气态
导电性
难溶性
(4)根据物质的组成和性质特点
①根据物质的组成分类
HCl、H2SO4
NaOH、Ca(OH)2
NaCl、CuSO4
金属
非金属
无机
CO2、CuO
②根据氧化物的性质分类
a.酸性氧化物:能与碱反应生成盐和水的氧化物;如CO2、SO2 等, CO2与澄清石灰水反应的化学方程式为____________________________________。
b.碱性氧化物:能与酸反应生成盐和水的氧化物;如CaO、Na2O等,CaO与稀盐酸反应的化学方程式为________________________________。
CO2+Ca(OH)2===CaCO3↓+H2O
CaO+2HCl===CaCl2+H2O
③根据酸的组成分类
④根据碱的溶解性分类
2.物质分类的意义
同一类物质在组成和性质方面往往具有一定的相似性。对物质进行合理的分类,有助于我们按物质的类别进一步研究物质的组成、结构和性质。
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)Fe2O3与HNO3均属于氧化物( )
(2)CO2和CO都属于酸性氧化物( )
(3)只含有一种元素的物质一定属于纯净物( )
(4)CaCO3既属于难溶性物质,又属于盐( )
×
×
×
√
二、物质的转化
不同类别的物质在一定条件下可以相互转化。物质之间的转化需要一定的条件。以钙为例,钙及其化合物之间的转化关系如下:
1.写出相关反应方程式:
①____________________________
②CaO+H2O===Ca(OH)2
③CaO+CO2===CaCO3
④____________________________________
⑤Ca(OH)2+2HCl===CaCl2+2H2O
⑥__________________________________________。
2Ca+O2===2CaO
Ca(OH)2+CO2===CaCO3↓+H2O
CaCO3+2HCl===CaCl2+CO2↑+H2O
2.上述反应中,属于化合反应的是________ (填序号,下同),属于复分解反应的是______。
①②③
⑤⑥
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)化学变化过程中,物质和元素都会发生改变( )
(2)金属单质可与氧气反应生成碱性氧化物( )
(3)制取某种碱,可以采取盐与另一种碱发生反应的方法( )
(4)所有的金属氧化物与水反应都能生成相应碱( )
×
√
√
×
三、化学反应的分类
1.根据反应物、生成物的类别和种数,把化学反应分成四种基本反应类型
分解
置换
复分解
2.根据化学反应中元素的_________是否发生变化,将化学反应分为氧化还原
反应和非氧化还原反应。
①有元素________________的反应称为氧化还原反应;如,Fe+
CuSO4===Cu+FeSO4 。
②元素化合价不发生变化的反应,称为非氧化还原反应;如,CuSO4+
2NaOH===Na2SO4+Cu(OH)2↓。
化合价
化合价发生变化
【微自测】
3.判断正误,正确的打“√”,错误的打“×”。
×
√
√
√
×
二、物质的转化与反应类型
一、物质的分类
一、物质的分类
在某食品的包装内,有上面写着“生石灰干燥剂,请勿食用” 的小纸袋,内装白色颗粒状固体,裸露在空气中过一段时间后纸袋内的白色颗粒黏在一起,成为块状固体。
1.你能写出上述文字中涉及到的物质的化学式吗?其所属物质各是什么类别?
2.上述物质中的氧化物根据其性质分类应属于哪一类氧化物?该氧化物固体是
常见的干燥剂,请用化学方程式表示其做干燥剂的原理。
提示:CaO、Ca(OH)2和CaCO3;它们分别属于氧化物、碱和盐。
提示:碱性氧化物 CaO+H2O===Ca(OH)2。
1.从不同角度对物质分类(又称交叉分类法)
被分类的对象应用多种不同的单一分类法进行分类,如对Na2CO3进行分类:
2.根据化合物的组成和性质分类(又称树状分类法)
3.根据氧化物的组成和性质分类(树状分类法)
1.(2021·江苏邗江高一期中)重铬酸钾(K2Cr2O7)是一种重要的着色剂、强氧化剂。
它属于( )
A.酸 B.碱
C.盐 D.氧化物
解析 重铬酸钾(K2Cr2O7)含有三种元素,由钾离子和重铬酸根离子组成,属于盐。
C
2.(2021·福建福州一中高一期中)按照物质的分类方法,硝酸应属于( )
①酸、②氢化物、③氧化物、④含氧酸、⑤难挥发性酸、⑥一元酸、⑦化合物、⑧混合物。
A.①②③④⑥⑦⑧ B.①④⑥⑦
C.①⑨ D.①④⑤⑥⑦
B
解析 硝酸的化学式为HNO3。①硝酸是常见的强酸,属于酸;②氢化物是指由氢元素和另外一种元素构成的化合物,硝酸含有三种元素,不属于氢化物;③氧化物是指由氧元素和另外一种元素构成的化合物,硝酸含有三种元素,不属于氧化物;④硝酸分子中含有H、O、N三种元素,硝酸属于含氧酸;⑤硝酸是易挥发性酸;⑥一个硝酸分子在溶液中完全电离生成一个氢离子,属于一元酸;⑦硝酸分子中含有H、O、N三种元素,硝酸属于化合物;⑧硝酸分子的化学式为HNO3,说明硝酸为纯净物。
3.(2021·江苏宿迁青华中学高一期中)歌曲《青花瓷》,唱道“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3 (碱式碳酸铜)。铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O===Cu2(OH)2CO3。下列有关该反应的说法正确的是( )
A.该反应中CO2是酸性氧化物
B.该反应中氧元素和碳元素化合价发生变化
C.该反应不属于氧化还原反应
D.该反应中Cu2(OH)2CO3是碱
A
解析 CO2能与碱反应生成盐和水,2NaOH+CO2===Na2CO3+H2O,故该反应中CO2是酸性氧化物,A正确;由反应可知,该反应中氧元素和铜元素化合价发生变化,碳元素的化合价未改变,B错误;该反应前后有元素的化合价发生了改变,故该反应属于氧化还原反应,C错误;该反应中Cu2(OH)2CO3是盐,碱式盐,D错误。
二、物质的转化与反应类型
1.单质、酸、碱、盐、氧化物之间的转化关系
2.化学反应的分类
判断一个反应是否为氧化还原反应的依据是看该反应中各元素的化合价有没有发生变化。
3.氧化还原反应与四种基本反应类型的关系
即有单质参加的化合反应或有单质生成的分解反应一定是氧化还原反应;置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应。
4.(2021·江苏淮安高一期中)下列反应一定属于氧化还原的是( )
A.复分解反应 B.置换反应
C.化合反应 D.分解反应
B
5.(2021·江苏沭阳高一期中)KOH是我国古代纺织业常用作漂洗的洗涤剂。古代
制取KOH的流程如下:
上述流程中没有涉及的化学反应类型是( )
A.化合反应 B.分解反应
C.氧化还原反应 D.复分解反应
C
6.如图中,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下通过置换反应可以转化为乙。下面四组选项中,符合图示要求的是( )
C
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B BaCl2 K2CO3 HCl KOH
C O2 CO CuO C
D Fe CuCl2 Zn HCl
1.下列物质的分类不正确的是( )
A.SO2(氧化物) B.碘酒(单质)
C.HNO3(含氧酸) D.氯水(混合物)
解析 SO2是由氧元素和硫元素组成的化合物属于氧化物,A正确;碘酒是酒精和碘单质的混合物,B错误;HNO3属于含氧酸,C正确;氯水是Cl2溶于水形成的混合物,D正确。
B
2.(2021·黑龙江漠河高中高一月考)下列叙述中正确的是( )
A.由同种元素组成的物质一定是单质
B.非金属氧化物不一定是酸性氧化物
C.金属氧化物一定是碱性氧化物
D.CO、NO、CO2均属于不成盐氧化物
解析 由同种元素组成的物质不一定属于纯净物,如O2、O3组成的混合物,A错误;非金属氧化物可以是不成盐氧化物,如CO、NO、H2O等,B正确;金属氧化物可以是酸性氧化物如Mn2O7,C错误; CO2与NaOH反应生成碳酸钠,属于成盐(或酸性)氧化物,D错误。
B
3.(2021·江苏上冈高中高一期中)下列反应不属于四种基本反应类型,但属于氧
化还原反应的是( )
B
4.2022年2月第24届冬奥会在中国北京——河北张家口联合举行。小美在奥运五连环中填入了如图所示的5种物质,相连环的物质间所发生的反应中,没有涉及的基本反应类型和属于氧化还原反应的个数有( )
A.复分解反应、1个
B.分解反应、2个
C.化合反应、3个
D.置换反应、2个
B
5.(2021·陕西榆林十二中高一)某同学在实验探究中发现了一些物质之间发生化
学反应的颜色变化,如图所示。
(1)编号①反应的指示剂是____________;编号②反应的金属单质是____________。
(2)根据如图可以总结出稀盐酸的化学性质,其中编号②反应的基本反应类型是____________反应。
(3)请你写出符合编号③反应的化学方程式_______________________________。
(4)假设编号④反应的盐是AgNO3,则编号④对应方框中的现象是____________。
答案 (1)石蕊试剂 Fe (2)置换反应 (3)6HCl+Fe2O3===3H2O+2FeCl3
(4)产生白色沉淀
解析 (1)石蕊试剂遇酸变为红色;Fe2+的溶液为浅绿色,故金属单质为Fe。
(2)反应②为Fe+2HCl===FeCl2+H2↑,为置换反应。(3)Fe3+的溶液为黄色,故氧化物为Fe2O3,故化学方程式为6HCl+Fe2O3===3H2O+2FeCl3。(4)编号④为稀盐酸和AgNO3生成氯化银白色沉淀和水,故现象为产生白色沉淀。
1.(2021·江苏阜宁高一期中)2021年诺贝尔化学奖授予了两位化学家Benjamin List和David W·C·MacMillan,以表彰他们在脯氨酸方面的研究成果。脯氨酸(C5H9NO2)结构式见下图,它属于( )
A.单质 B.氧化物
C.混合物 D.有机物
解析 脯氨酸(C5H9NO2)是含碳、氢、氧、氮的化合物,属于有机物。
D
2.某学生发现实验室中的一瓶无色气体,他想知道是何种气体。经实验测定此瓶气体中只含有C、O两种元素。通常情况下这瓶气体不可能是( )
A.一种化合物 B.单质和化合物的混合物
C.两种化合物 D.两种单质
解析 只含有C、O两种元素的气体,既可能是纯净物(只含有CO或只含有CO2),也可能是混合物(即同时含有CO与CO2,CO与O2,CO、CO2和O2或CO2与O2的混合物)。常温下碳单质不可能是气体,D错误。
D
3.分类是学习和研究化学的一种常用的科学方法,下列分类合理的是( )
A.根据酸分子中所含氢原子的个数,将酸分为一元酸、二元酸等
B.根据物质在水中的溶解性,将物质分为可溶性物质、微溶性物质和难溶性物质
C.根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化
物等
D.根据化合物中是否含有碳元素,将化合物分为无机化合物和有机化合物
B
解析 根据酸分子能电离出氢离子的个数,将酸分为一元酸、二元酸等,A项分类不合理;根据氧化物能否与酸或碱反应生成盐和水,将氧化物分为碱性氧化物、酸性氧化物等,C项分类不合理;有机化合物中一定含有碳元素,但含有碳元素的化合物不一定是有机化合物,如Na2CO3,D项分类不合理。
4.(2021·江苏省响水中学高一期中)化学变化多姿多彩,美丽如花。如图所示,甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是( )
A.C B.Fe2O3
C.CO D.盐酸
解析 甲、乙、丙均能与X发生化学反应,从四种物质的两两反应关系可知,只有Fe2O3能与其他三种物质分别反应,则X是Fe2O3。
B
C
6.(2021·江苏常熟高一开学考试)分类是化学学习和研究的常用手段。下列分类
依据和结论都正确的是( )
A.含有氧元素的化合物,一定是氧化物
B.烧碱、纯碱、火碱都属于碱
C.酸性氧化物一定是非金属氧化物
D.CuSO4·5H2O、冰水、液氨都属于纯净物
D
解析 含有氧元素的化合物不一定都是氧化物,如Na2CO3是盐,A错误;纯碱是碳酸钠,属于盐,B错误;酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,但也是酸性氧化物,C错误; CuSO4·5H2O、冰水、液氨都属于纯净物,D正确。
7.(2021·山东省实验中学高一期中)下列物质的分类合理的是( )
A.酸性氧化物:SO2、SO3、CO2、CO
B.碱:烧碱、苏打、苛性钾、消石灰
C.混合物:食盐水、豆浆、冰水混合物、氢氧化铁胶体
D.有机物:乙醇、醋酸、葡萄糖、四氯化碳
解析 CO既不能和酸反应又不能和碱反应,CO不是酸性氧化物,A错误;苏打是碳酸钠,碳酸钠属于盐,B错误;冰水混合物中只含水分子,属于纯净物,C错误;乙醇、醋酸、葡萄糖、四氯化碳都是含有碳元素的化合物,都属于有机物,D正确。
D
8.下列各组物质之间可以按下图所示关系直接转化的是( )
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
解析 选项A中,Fe2O3―→FeSO4不能一步实现;选项B中,H2CO3―→CO不能一步实现;选项C中,NaCl―→Na2CO3不能一步实现。
D
9.下列各选项中,不能通过一步反应实现如图所示转化关系的是( )
A.X为铜、Y为氧化铜、Z为硫酸铜
B.X为二氧化碳、Y为碳酸钠、Z为碳酸钙
C.X为碳酸钙、Y为氧化钙、Z为氢氧化钙
D.X为氢氧化钠、Y为氯化钠、Z为碳酸钠
D
解析 铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜,硫酸铜溶液与铁反应生成铜,故A不符合题意;二氧化碳与氢氧化钠反应生成碳酸钠,碳酸钠与氯化钙反应生成碳酸钙,碳酸钙与盐酸反应生成二氧化碳,故B不符合题意;碳酸钙高温分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,故C不符合题意;氢氧化钠与盐酸反应生成氯化钠,氯化钠不能通过一步反应转化生成碳酸钠,故D符合题意。
10.某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ
实验
现象 没有明显变化, 溶液仍为无色 有沉淀生成, 溶液为蓝色 有无色气
泡产生
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中的化学方程式为2HCl+Zn===ZnCl2+H2↑
D.Ⅲ中发生的反应是氧化还原反应
解析 Ⅰ中氢氧化钠与硫酸反应生成硫酸钠和水,A错误;Ⅱ中氯化钡与硫酸铜反应生成白色沉淀为BaSO4,B正确;Ⅲ中锌与盐酸反应生成氯化锌和氢气,反应的化学方程式为2HCl+Zn===ZnCl2+H2↑,C正确;Ⅲ中锌元素、氢元素化合价发生变化,属于氧化还原反应,D正确。
A
11.(2021·四川雅安中学高一)Ⅰ.常温下,氯酸钾的溶解度较小,在工业上可通过
如图转化制得。
(1)已知反应Ⅰ中,通电时发生的反应方程式为NaCl+3X===NaClO3+3H2↑,则X的化学式为____________。
(2)现有KClO3固体中混有少量NaCl,除杂的方法是溶解,____________,过滤,洗涤,最后干燥。
答案 (1)H2O (2)蒸发浓缩、冷却结晶
解析 (1)结合反应NaCl+3X===NaClO3+3H2↑,根据元素守恒,可知X的化学式为H2O。(2)常温下,氯酸钾的溶解度较小,KClO3固体中混有少量NaCl,除杂的方法是溶解,蒸发浓缩,冷却结晶,过滤,洗涤,最后干燥得到KClO3固体。
请写出上述方案中有关反应的化学方程式,并指明反应类型:
(3)__________________;___________________________________。
(4) __________________;___________________________________。
(5) __________________;___________________________________。
剂高温条件下,被⑧氧气(O2)氧化得到⑨一氧化氮(NO),NO经一系列变化制得⑩硝酸(HNO3),HNO3与NH3反应可得到另一种常见氮肥。
答案 (1)④;⑥⑨;⑩;⑦
解析 (1)①氨水是氨气的水溶液,属于混合物,故属于混合物的是④;②二氧化碳、一氧化氮都是两种元素组成,其中一种元素是氧元素,二氧化碳、一氧化氮是氧化物,属于氧化物的是⑥⑨;③HNO3电离出的阳离子全是氢离子,HNO3是酸,属于酸的是⑩;④CO(NH2)2是含有碳元素的化合物,是有机物,故属于有机物的是⑦。
答案 (2)单质或非金属单质或气体 不是
13.顺式Pt(NH3)2Cl2(相对分子质量为300)是临床广泛使用的抗肿瘤药物。
下列有关说法中正确的是( )
A.由4种元素组成
B.该物质由PtCl2和NH3组成,属于混合物
C.NH3属于碱
D.Pt的化合价为+4价
A
解析 顺式Pt(NH3)2Cl2是化合物,是纯净物,故B不正确;NH3属于氢化物,不属于碱,故C不正确;Pt(NH3)2Cl2中有Pt、N、H、Cl四种元素,故A正确;Pt(NH3)2Cl2分子中整个“NH3”为0价,Cl为-1价,根据化合物中各元素正、负化合价代数和为0可知,Pt为+2价,故D不正确。
C
解析 CuO不能与水反应生成Cu(OH)2,A错误;MgCl2不能与Na2SO4发生反应,B错误;碳在氧气中燃烧生成CO2,CO2与水反应生成H2CO3,H2CO3与氢氧化钙反应生成CaCO3沉淀,C正确;硫在氧气中燃烧生成SO2,SO2与水反应生成H2SO3,H2SO3与NaOH反应生成Na2SO3, D不正确。
15. (1)下面是某同学对有关物质进行分类的列表:
碱 酸 盐 碱性 氧化物 酸性
氧化物
第一组 Na2CO3 H2SO4 NaHCO3 CaO CO2
第二组 NaOH HCl NaCl Na2O CO
第三组 NaOH CH3COOH CaF2 Na2O2 SO2
已知:2Na2O2 +4HCl=== 4NaCl +O2↑+2H2O每组分类均有错误,其错误的物质分别是____________、____________、____________(填化学式)。
(2)已知:H3PO2+NaOH(过量)===NaH2PO2+H2O。据此回答下列问题:H3PO2中磷元素的化合价是____________。该反应属于四种基本反应类型中的____________反应(选填“化合”、“分解”、“置换”或“复分解”)。该反应____________(选填“属于”或“不属于”)氧化还原反应。
答案 (1)Na2CO3 CO Na2O2
(2)+1(价) 复分解 不属于
解析 (1)第一组中的碳酸钠是盐,不是碱;第二组中的CO与碱不反应,不是酸性氧化物;第三组中的Na2O2是氧化物但不是碱性氧化物,因为与酸反应生成氧气。(2)①H3PO2中H为+1价,O为-2价,由化合价代数和为0可知P元素化合价为+1价;反应H3PO2+NaOH(过量)===NaH2PO2+H2O由两种化合物相互交换成分生成另外两种新的化合物,属于四种基本反应类型中的复分解反应;该反应中各元素化合价均不变,不属于氧化还原反应。
(3)一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表所示:
①该变化的基本反应类型是____________反应。
②物质Q在反应中起的作用是____________________。
物质 M N Q P
反应前质量/g 50 1 3 12
反应后质量/g x 26 3 30
答案 (3)①分解 ②催化剂
解析 (3)①N和P的质量增加,这说明二者是生成物,所以M是反应物,则该反应是M的分解反应;②根据表中数据可知反应前后Q的质量不变,因此Q是催化剂,起催化作用。
Thanks!
本单元内容结束
