专题3 第二单元 金属钠及钠的化合物 第三课时 离子反应(共95张PPT)
文档属性
| 名称 | 专题3 第二单元 金属钠及钠的化合物 第三课时 离子反应(共95张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 00:00:00 | ||
图片预览







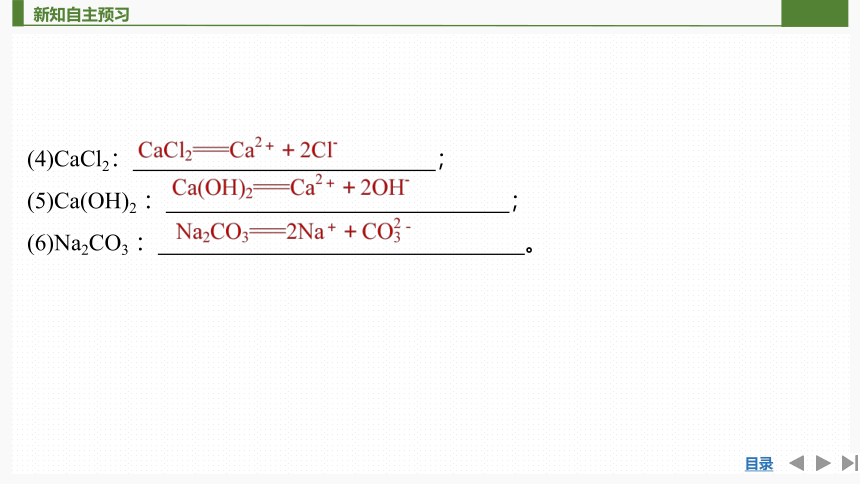



文档简介
(共95张PPT)
第三课时 离子反应
【课程标准要求】
1.理解强电解质和弱电解质的概念,能用电离方程式表示电解质的电离。
2.了解离子反应和离子方程式的含义,掌握离子方程式的书写步骤和方法,能根据离子反应发生的条件分析判断离子反应能否发生。能运用化学变化规律分析生产、生活中的实际问题。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、强电解质与弱电解质
1.相同物质的量浓度不同溶液导电性实验
0.1 mol·L-1盐酸和0.1 mol·L-1氢氧化钠溶液的导电能力明显______0.1 mol·L-1醋酸溶液和0.1 mol·L-1氨水。这是因为HCl 和NaOH在水溶液中能__________,而CH3COOH 和NH3·H2O在水溶液中只能发生__________。
强于
完全电离
部分电离
2.强电解质
(1)概念:在水溶液中能够__________的电解质。
(2)常见物质:①______:如H2SO4、HCl、HNO3、HClO4等。
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
③绝大多数盐:如NaCl、BaSO4、KNO3、CaCO3等。
完全电离
强酸
3.弱电解质
(1)概念:在水溶液中______________的电解质。
(2)常见物质:
①______:如H2CO3、CH3COOH、HClO等。
②弱碱:如NH3·H2O、Cu(OH)2等。
③少数盐:醋酸铅等。
④水。
不能完全电离
弱酸
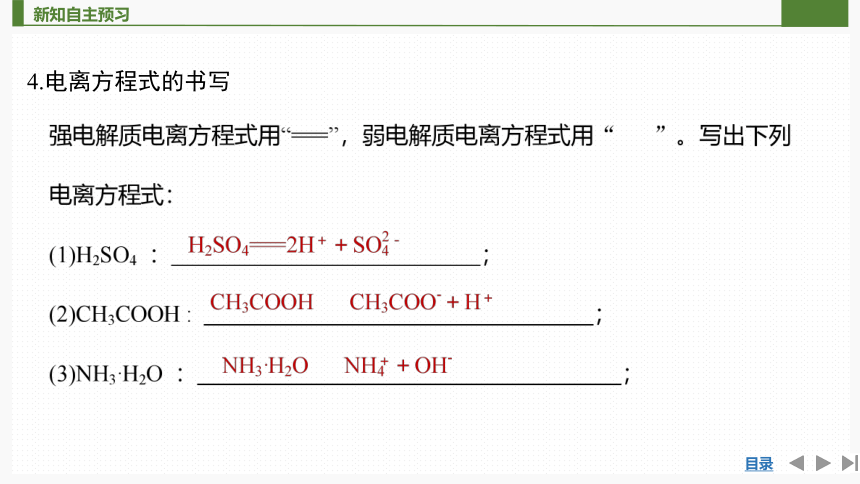
4.电离方程式的书写
(4)CaCl2: ;
(5)Ca(OH)2 : ;
(6)Na2CO3 : 。
5.电解质溶液的导电性和导电能力
(1)溶液的导电性:电解质溶液是通过自由移动离子的定向移动而导电的。
(2)溶液的导电能力
电解质的强弱与溶液的导电能力及电解质的溶解度都没有必然联系,只与电离程度有关。强电解质溶液的导电能力不一定强。
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)强电解质在水溶液中能完全电离( )
(2)弱电解质导电能力一定弱( )
(3)液氯不导电,氯水导电是因为氯气与水反应生成电解质而导电,故氯气是非电解质( )
(4)水溶液能导电的化合物一定是电解质( )
√
×
×
×
二、离子反应及离子方程式
1.离子反应
(1)定义:有离子________的反应。电解质在水溶液中的反应本质上是________反应。
(2)发生条件:在溶液中进行的相互交换离子的复分解反应发生的条件:溶液中______数目由多变少。当离子结合生成______物质、________物质(如弱酸、弱碱、水等)或易挥发物质(如CO2、H2S等)时,可发生离子反应。
参加
离子
离子
难溶
难电离
2.离子方程式
用______________的离子符号表示化学反应的式子。
3.书写步骤(以碳酸钠与盐酸的反应为例)
实际参加反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
质量(原子)
4.离子方程式的意义
化学方程式只能表示____________的化学反应,离子方程式可以表示________化学反应,如NaOH+HCl===NaCl+H2O表示氢氧化钠溶液和盐酸反应,而H++OH-===H2O可以表示强酸溶液与强碱溶液作用生成______________的中和反应。
某一个特定
同一类
可溶性盐和水
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
×
×
√
×
×
二、离子大量共存的判断
一、离子方程式的书写和正误判断
一、离子方程式的书写和正误判断
波尔多液是法国植物学家米拉德无意中发现的。1878年,名为“霉叶病”的植物病害狂虐波尔多城,许多葡萄园很快变得枝叶凋零。米拉德发现公路旁的葡萄树郁郁葱葱,经打听,才知是园主为防馋嘴的过路人偷吃而洒的“毒药”,由熟石灰与硫酸铜溶液混合配制而成。于是米拉德经过不断努力,成功制成了波尔多液。
硫酸铜溶液是蓝色溶液,向硫酸铜溶液中加入BaCl2溶液,有白色沉淀生成。
1.硫酸铜和BaCl2在溶液中电离出的离子分别是哪些?Cu2+和Cl-有没有参加反应?
2.生成的白色沉淀是什么?硫酸铜与BaCl2反应的实质是什么?写出该反应的离
子方程式?
1.离子方程式书写及判断的核心
(1)两易:易溶、易电离——同时满足“两易”的强电解质才能拆成离子形式。
(2)两等:离子方程式左右两侧同种元素原子数目相等(原子守恒),离子方程式左右两侧电荷总数相等(电荷守恒)。
(3)两查:检查是否漏写必要的反应条件,化学计量数是否有公约数,若有必须约去。
2.书写离子方程式的几点技巧与注意事项
3.“六看”判断离子方程式的正误
C
2.(2021·河南信阳高一期中)能用离子方程式H++OH-===H2O表示的反应是( )
A.稀硫酸和氢氧化钾
B.稀硫酸和氢氧化钡溶液
C.醋酸和氢氧化钠溶液
D.稀硝酸和氨水
A
3.下列反应的离子方程式书写正确的是( )
B
二、离子大量共存的判断
离子在同一溶液中大量共存,就是指离子之间不发生任何反应;若离子间能发生反应,则不能大量共存。
1.因发生复分解反应不共存
2.因发生氧化还原反应不共存
3.注意事项——“隐含条件”不能共存的常见离子
(1)“无色透明”溶液不存在有色离子,如:
(2)酸性溶液中不能大量存在与H+反应的离子。 “酸性”溶液的不同描述:a.酸性溶液;b.pH<7的溶液;c.使石蕊溶液变红色的溶液。
(3)碱性溶液中不能大量存在与OH-反应的离子。 “碱性”溶液的不同描述:a.碱性溶液;b.pH>7的溶液;c.使石蕊溶液变蓝的溶液;d.使酚酞溶液变红的溶液。
4.(2021·河北石家庄二十八中高一期中)下列各组中的离子,能在溶液中大量共
存的是( )
B
5.在下列各溶液中,离子一定能大量共存的是( )
D
6.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,
请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是____________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是____________,有关的离子方程式为_________________________________________________________。
答案 (1)Cu2+、Fe3+ (2)Ag+
解析 (1)无色透明溶液中不可能含有Cu2+、Fe3+等有色离子。
(2)加稀盐酸有不溶于稀硝酸的白色沉淀生成,则肯定存在Ag+,离子方程式为Ag++Cl-===AgCl↓。
微专题5 离子推断题解题思路
1.离子推断的“四原则”
(2)互斥原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在(注意题目中的隐含条件,如酸性、碱性、指示剂的颜色变化、与铝反应产生H2、水的电离促进或抑制等)。
(3)电中性原则:溶液呈电中性,溶液中有阳离子,必有阴离子,且溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等(这一原则可帮助我们确定一些隐含的离子)。
(4)进出原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
2.注意定量型离子推断中的电荷守恒
离子定量推断试题常根据离子的物质的量(或浓度)定量推断最后一种离子的存在:如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
C
[解题指导] 本题考查离子的推断,熟悉各离子的性质和离子间的反应是解题的关键。首先根据离子的特征反应确定一定存在的离子,根据离子性质排除掉一定不能大量共存的离子;其次根据存在离子的定量关系,结合电荷守恒原理推断隐含的离子,这是最易忽视的一步。
1.重金属离子具有毒性,如Cu2+、Ba2+。实验室中有甲、乙两种含重金属离子的废液,甲废液经化验呈碱性,所含阳离子主要是Ba2+。如将甲、乙两废液按一定比例混合,毒性明显降低,则乙废液中可能含有的离子是( )
A
C
D
(1)试分析原溶液中一定含有的离子是____________,一定不含有的阴离子是________,可能含有的离子是___________________________________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)____________,说明理由_______________________________________。
(3)写出①中反应的离子方程式______________________________________。
1.下列电离方程式中,正确的是( )
D
2.(2021·北京东城高一期中)下列化学方程式中,不能用离子方程式H++OH-===
H2O表示的是( )
A.Cu(OH)2+H2SO4=== CuSO4+2H2O
B.Ba(OH)2+2HNO3=== Ba(NO3)2+2H2O
C.NaOH+HCl=== NaCl+H2O
D.2KOH+H2SO4=== K2SO4+2H2O
A
解析 A项, Cu(OH)2是难溶物质,离子反应中不能拆写,则不能用离子方程式 H++OH- ===H2O表示; B项, Ba(OH)2、HNO3、Ba(NO3)2均为可溶性物质,在离子反应中均可拆写为离子形式,可用离子方程式 H++OH- ===H2O表示; C项, NaOH、HCl、NaCl均为可溶性物质,可用离子方程式 H++OH- ===H2O表示; D项, KOH、H2SO4、K2SO4均为可溶性物质,可用离子方程式 H++OH-===H2O表示。
3.下列离子方程式正确的是( )
A
4.在强酸性溶液中,能大量共存的无色透明离子组是( )
B
5.某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有________(填字母)。
a.天平 B.烧杯
c.漏斗 D.玻璃棒
(2)OA段反应的离子方程式为_______________________________________。
(3)AB段反应的离子方程式为_______________________________________。
答案 (1)bd (2)H++OH-===H2O (3)Mg2++2OH-===Mg(OH)2↓
解析 (1)溶解MgCl2固体所用的玻璃仪器有烧杯和玻璃棒。 (2)OA段没有沉淀生成,说明反应为盐酸和氢氧化钠反应。 (3)AB段反应为氯化镁和氢氧化钠反应生成氢氧化镁沉淀。
1.下列关于强、弱电解质的叙述中,错误的是( )
A.强电解质在溶液中完全电离,不存在溶质分子
B.在溶液里导电能力强的电解质是强电解质,导电能力弱的电解质是弱电
解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.纯的强电解质在液态时,有的导电,有的不导电
B
解析 A项,强电解质在水溶液中完全电离,不存在溶质分子,正确;B项,电解质的强弱与其水溶液的导电能力无关,而取决于其在水溶液中能否完全电离,错误;C项,弱电解质溶液的导电能力与离子的浓度和离子所带的电荷数有关,而离子浓度与温度及电解质的浓度都有关系,正确;D项,熔融态的NaCl、K2SO4可以导电,而纯净的HCl液态时不能导电,正确。
2.下列物质既能导电又是强电解质的是( )
A.氯化钠溶液 B.氢氧化钠晶体
C.熔融的氢氧化钠 D.液态氯化氢
解析 题给选项所涉及的NaCl、NaOH、HCl均属于强电解质,氯化钠溶液为电解质溶液,属于混合物,不属于电解质,A项错误;氢氧化钠晶体没有发生电离,不存在自由移动的离子,不能导电,B项错误;熔融的氢氧化钠属于纯净物,且已发生电离,能导电,C项正确;液态氯化氢中不存在离子,不能导电,D项错误。
C
3.依据离子反应发生的条件分析,下列离子反应不能发生的是( )
A.AgNO3+HCl===AgCl↓+HNO3
B.NaOH+KCl===NaCl+KOH
C.Na2CO3+2HCl===2NaCl+H2O+CO2↑
D.Fe+CuCl2===Cu+FeCl2
解析 A、C项,反应符合复分解反应的条件,能发生离子反应; B项,NaOH与KCl不符合复分解反应的条件,二者不能发生离子反应;Fe与CuCl2反应属于置换反应,离子方程式为Fe+Cu2+===Cu+Fe2+。
B
4.(2021·广东中山一中高一月考)下列离子方程式中,正确的是( )
D
5.(2021·福建龙岩高一期中)下列各物质间反应的离子方程式相同的是( )
①NaOH溶液与稀H2SO4溶液 ②BaCl2溶液与Na2SO4溶液 ③Ba(OH)2溶液与K2SO4溶液 ④Ba(OH)2溶液与H2SO4溶液
A.①② B.③④
C.①④ D.②③
D
6.某混合溶液中所含离子的浓度如表所示,则M可能为( )
D
7.下列体系中,离子能大量共存的是( )
B
A
9.下列离子方程式正确的是( )
C
10.(1)写出下列反应的离子方程式。
①用小苏打片治疗胃酸过多: ____________________________________。
②如果病人胃酸过多同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3]:______________________________________________________。
③硫酸氢钠溶液中滴加过量的氢氧化钡溶液:____________。
11.将下列离子方程式改写成化学方程式,正确的是( )
C
解析 A项,离子方程式中的生成物只有Mg(OH)2沉淀,而改写后的化学方程式中却出现了Mg(OH)2、BaSO4两种沉淀,错误;B项,离子方程式表示的是Fe与含Cu2+的溶液反应,生成可溶于水的含Fe2+的化合物,而化学方程式不符合客观事实,Fe不能与Cu(OH)2发生置换反应,错误;D项,离子方程式表示CO2与可溶性的强碱溶液反应生成可溶于水的碳酸盐,而化学方程式中的碳酸盐却是难溶于水的CaCO3,错误。
12.关于离子方程式Cu2++2OH-===Cu(OH)2↓的说法不正确的是( )
A.可表示所有铜盐和强碱的反应
B.可表示某一个具体的反应,也可以表示一类反应
C.离子方程式中的OH-只能代表可溶性强碱
D.该反应可看到Cu(OH)2蓝色沉淀
解析 题中离子方程式不能表示CuSO4和Ba(OH)2的反应,A错误;离子方程式中OH-只能代表强碱,C正确。
A
13.下列各选项中的反应Ⅰ与反应Ⅱ不能用同一离子方程式表示的是( )
A.①② B.②③ C.③④ D.②④
B
反应Ⅰ 反应Ⅱ
① 向AgNO3溶液中滴加稀盐酸 AgNO3溶液与食盐水混合
② 少量CO2通入NaOH溶液中 少量CO2通入澄清石灰水中
③ 向烧碱溶液中滴加稀盐酸 向NaHSO4溶液中滴加KOH溶液
④ 向Ba(OH)2溶液中滴加稀硫酸 向Ba(OH)2溶液中滴加少量NaHSO4溶液
C
(1)根据上述实验推断:原溶液中肯定有____________,肯定没有____________,不能肯定存在____________。
(2)写出操作③中发生反应的离子方程式:______________________________。
Thanks!
本课时内容结束
第三课时 离子反应
【课程标准要求】
1.理解强电解质和弱电解质的概念,能用电离方程式表示电解质的电离。
2.了解离子反应和离子方程式的含义,掌握离子方程式的书写步骤和方法,能根据离子反应发生的条件分析判断离子反应能否发生。能运用化学变化规律分析生产、生活中的实际问题。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、强电解质与弱电解质
1.相同物质的量浓度不同溶液导电性实验
0.1 mol·L-1盐酸和0.1 mol·L-1氢氧化钠溶液的导电能力明显______0.1 mol·L-1醋酸溶液和0.1 mol·L-1氨水。这是因为HCl 和NaOH在水溶液中能__________,而CH3COOH 和NH3·H2O在水溶液中只能发生__________。
强于
完全电离
部分电离
2.强电解质
(1)概念:在水溶液中能够__________的电解质。
(2)常见物质:①______:如H2SO4、HCl、HNO3、HClO4等。
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
③绝大多数盐:如NaCl、BaSO4、KNO3、CaCO3等。
完全电离
强酸
3.弱电解质
(1)概念:在水溶液中______________的电解质。
(2)常见物质:
①______:如H2CO3、CH3COOH、HClO等。
②弱碱:如NH3·H2O、Cu(OH)2等。
③少数盐:醋酸铅等。
④水。
不能完全电离
弱酸
4.电离方程式的书写
(4)CaCl2: ;
(5)Ca(OH)2 : ;
(6)Na2CO3 : 。
5.电解质溶液的导电性和导电能力
(1)溶液的导电性:电解质溶液是通过自由移动离子的定向移动而导电的。
(2)溶液的导电能力
电解质的强弱与溶液的导电能力及电解质的溶解度都没有必然联系,只与电离程度有关。强电解质溶液的导电能力不一定强。
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)强电解质在水溶液中能完全电离( )
(2)弱电解质导电能力一定弱( )
(3)液氯不导电,氯水导电是因为氯气与水反应生成电解质而导电,故氯气是非电解质( )
(4)水溶液能导电的化合物一定是电解质( )
√
×
×
×
二、离子反应及离子方程式
1.离子反应
(1)定义:有离子________的反应。电解质在水溶液中的反应本质上是________反应。
(2)发生条件:在溶液中进行的相互交换离子的复分解反应发生的条件:溶液中______数目由多变少。当离子结合生成______物质、________物质(如弱酸、弱碱、水等)或易挥发物质(如CO2、H2S等)时,可发生离子反应。
参加
离子
离子
难溶
难电离
2.离子方程式
用______________的离子符号表示化学反应的式子。
3.书写步骤(以碳酸钠与盐酸的反应为例)
实际参加反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
质量(原子)
4.离子方程式的意义
化学方程式只能表示____________的化学反应,离子方程式可以表示________化学反应,如NaOH+HCl===NaCl+H2O表示氢氧化钠溶液和盐酸反应,而H++OH-===H2O可以表示强酸溶液与强碱溶液作用生成______________的中和反应。
某一个特定
同一类
可溶性盐和水
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
×
×
√
×
×
二、离子大量共存的判断
一、离子方程式的书写和正误判断
一、离子方程式的书写和正误判断
波尔多液是法国植物学家米拉德无意中发现的。1878年,名为“霉叶病”的植物病害狂虐波尔多城,许多葡萄园很快变得枝叶凋零。米拉德发现公路旁的葡萄树郁郁葱葱,经打听,才知是园主为防馋嘴的过路人偷吃而洒的“毒药”,由熟石灰与硫酸铜溶液混合配制而成。于是米拉德经过不断努力,成功制成了波尔多液。
硫酸铜溶液是蓝色溶液,向硫酸铜溶液中加入BaCl2溶液,有白色沉淀生成。
1.硫酸铜和BaCl2在溶液中电离出的离子分别是哪些?Cu2+和Cl-有没有参加反应?
2.生成的白色沉淀是什么?硫酸铜与BaCl2反应的实质是什么?写出该反应的离
子方程式?
1.离子方程式书写及判断的核心
(1)两易:易溶、易电离——同时满足“两易”的强电解质才能拆成离子形式。
(2)两等:离子方程式左右两侧同种元素原子数目相等(原子守恒),离子方程式左右两侧电荷总数相等(电荷守恒)。
(3)两查:检查是否漏写必要的反应条件,化学计量数是否有公约数,若有必须约去。
2.书写离子方程式的几点技巧与注意事项
3.“六看”判断离子方程式的正误
C
2.(2021·河南信阳高一期中)能用离子方程式H++OH-===H2O表示的反应是( )
A.稀硫酸和氢氧化钾
B.稀硫酸和氢氧化钡溶液
C.醋酸和氢氧化钠溶液
D.稀硝酸和氨水
A
3.下列反应的离子方程式书写正确的是( )
B
二、离子大量共存的判断
离子在同一溶液中大量共存,就是指离子之间不发生任何反应;若离子间能发生反应,则不能大量共存。
1.因发生复分解反应不共存
2.因发生氧化还原反应不共存
3.注意事项——“隐含条件”不能共存的常见离子
(1)“无色透明”溶液不存在有色离子,如:
(2)酸性溶液中不能大量存在与H+反应的离子。 “酸性”溶液的不同描述:a.酸性溶液;b.pH<7的溶液;c.使石蕊溶液变红色的溶液。
(3)碱性溶液中不能大量存在与OH-反应的离子。 “碱性”溶液的不同描述:a.碱性溶液;b.pH>7的溶液;c.使石蕊溶液变蓝的溶液;d.使酚酞溶液变红的溶液。
4.(2021·河北石家庄二十八中高一期中)下列各组中的离子,能在溶液中大量共
存的是( )
B
5.在下列各溶液中,离子一定能大量共存的是( )
D
6.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,
请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是____________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是____________,有关的离子方程式为_________________________________________________________。
答案 (1)Cu2+、Fe3+ (2)Ag+
解析 (1)无色透明溶液中不可能含有Cu2+、Fe3+等有色离子。
(2)加稀盐酸有不溶于稀硝酸的白色沉淀生成,则肯定存在Ag+,离子方程式为Ag++Cl-===AgCl↓。
微专题5 离子推断题解题思路
1.离子推断的“四原则”
(2)互斥原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在(注意题目中的隐含条件,如酸性、碱性、指示剂的颜色变化、与铝反应产生H2、水的电离促进或抑制等)。
(3)电中性原则:溶液呈电中性,溶液中有阳离子,必有阴离子,且溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等(这一原则可帮助我们确定一些隐含的离子)。
(4)进出原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
2.注意定量型离子推断中的电荷守恒
离子定量推断试题常根据离子的物质的量(或浓度)定量推断最后一种离子的存在:如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
C
[解题指导] 本题考查离子的推断,熟悉各离子的性质和离子间的反应是解题的关键。首先根据离子的特征反应确定一定存在的离子,根据离子性质排除掉一定不能大量共存的离子;其次根据存在离子的定量关系,结合电荷守恒原理推断隐含的离子,这是最易忽视的一步。
1.重金属离子具有毒性,如Cu2+、Ba2+。实验室中有甲、乙两种含重金属离子的废液,甲废液经化验呈碱性,所含阳离子主要是Ba2+。如将甲、乙两废液按一定比例混合,毒性明显降低,则乙废液中可能含有的离子是( )
A
C
D
(1)试分析原溶液中一定含有的离子是____________,一定不含有的阴离子是________,可能含有的离子是___________________________________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)____________,说明理由_______________________________________。
(3)写出①中反应的离子方程式______________________________________。
1.下列电离方程式中,正确的是( )
D
2.(2021·北京东城高一期中)下列化学方程式中,不能用离子方程式H++OH-===
H2O表示的是( )
A.Cu(OH)2+H2SO4=== CuSO4+2H2O
B.Ba(OH)2+2HNO3=== Ba(NO3)2+2H2O
C.NaOH+HCl=== NaCl+H2O
D.2KOH+H2SO4=== K2SO4+2H2O
A
解析 A项, Cu(OH)2是难溶物质,离子反应中不能拆写,则不能用离子方程式 H++OH- ===H2O表示; B项, Ba(OH)2、HNO3、Ba(NO3)2均为可溶性物质,在离子反应中均可拆写为离子形式,可用离子方程式 H++OH- ===H2O表示; C项, NaOH、HCl、NaCl均为可溶性物质,可用离子方程式 H++OH- ===H2O表示; D项, KOH、H2SO4、K2SO4均为可溶性物质,可用离子方程式 H++OH-===H2O表示。
3.下列离子方程式正确的是( )
A
4.在强酸性溶液中,能大量共存的无色透明离子组是( )
B
5.某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有________(填字母)。
a.天平 B.烧杯
c.漏斗 D.玻璃棒
(2)OA段反应的离子方程式为_______________________________________。
(3)AB段反应的离子方程式为_______________________________________。
答案 (1)bd (2)H++OH-===H2O (3)Mg2++2OH-===Mg(OH)2↓
解析 (1)溶解MgCl2固体所用的玻璃仪器有烧杯和玻璃棒。 (2)OA段没有沉淀生成,说明反应为盐酸和氢氧化钠反应。 (3)AB段反应为氯化镁和氢氧化钠反应生成氢氧化镁沉淀。
1.下列关于强、弱电解质的叙述中,错误的是( )
A.强电解质在溶液中完全电离,不存在溶质分子
B.在溶液里导电能力强的电解质是强电解质,导电能力弱的电解质是弱电
解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.纯的强电解质在液态时,有的导电,有的不导电
B
解析 A项,强电解质在水溶液中完全电离,不存在溶质分子,正确;B项,电解质的强弱与其水溶液的导电能力无关,而取决于其在水溶液中能否完全电离,错误;C项,弱电解质溶液的导电能力与离子的浓度和离子所带的电荷数有关,而离子浓度与温度及电解质的浓度都有关系,正确;D项,熔融态的NaCl、K2SO4可以导电,而纯净的HCl液态时不能导电,正确。
2.下列物质既能导电又是强电解质的是( )
A.氯化钠溶液 B.氢氧化钠晶体
C.熔融的氢氧化钠 D.液态氯化氢
解析 题给选项所涉及的NaCl、NaOH、HCl均属于强电解质,氯化钠溶液为电解质溶液,属于混合物,不属于电解质,A项错误;氢氧化钠晶体没有发生电离,不存在自由移动的离子,不能导电,B项错误;熔融的氢氧化钠属于纯净物,且已发生电离,能导电,C项正确;液态氯化氢中不存在离子,不能导电,D项错误。
C
3.依据离子反应发生的条件分析,下列离子反应不能发生的是( )
A.AgNO3+HCl===AgCl↓+HNO3
B.NaOH+KCl===NaCl+KOH
C.Na2CO3+2HCl===2NaCl+H2O+CO2↑
D.Fe+CuCl2===Cu+FeCl2
解析 A、C项,反应符合复分解反应的条件,能发生离子反应; B项,NaOH与KCl不符合复分解反应的条件,二者不能发生离子反应;Fe与CuCl2反应属于置换反应,离子方程式为Fe+Cu2+===Cu+Fe2+。
B
4.(2021·广东中山一中高一月考)下列离子方程式中,正确的是( )
D
5.(2021·福建龙岩高一期中)下列各物质间反应的离子方程式相同的是( )
①NaOH溶液与稀H2SO4溶液 ②BaCl2溶液与Na2SO4溶液 ③Ba(OH)2溶液与K2SO4溶液 ④Ba(OH)2溶液与H2SO4溶液
A.①② B.③④
C.①④ D.②③
D
6.某混合溶液中所含离子的浓度如表所示,则M可能为( )
D
7.下列体系中,离子能大量共存的是( )
B
A
9.下列离子方程式正确的是( )
C
10.(1)写出下列反应的离子方程式。
①用小苏打片治疗胃酸过多: ____________________________________。
②如果病人胃酸过多同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3]:______________________________________________________。
③硫酸氢钠溶液中滴加过量的氢氧化钡溶液:____________。
11.将下列离子方程式改写成化学方程式,正确的是( )
C
解析 A项,离子方程式中的生成物只有Mg(OH)2沉淀,而改写后的化学方程式中却出现了Mg(OH)2、BaSO4两种沉淀,错误;B项,离子方程式表示的是Fe与含Cu2+的溶液反应,生成可溶于水的含Fe2+的化合物,而化学方程式不符合客观事实,Fe不能与Cu(OH)2发生置换反应,错误;D项,离子方程式表示CO2与可溶性的强碱溶液反应生成可溶于水的碳酸盐,而化学方程式中的碳酸盐却是难溶于水的CaCO3,错误。
12.关于离子方程式Cu2++2OH-===Cu(OH)2↓的说法不正确的是( )
A.可表示所有铜盐和强碱的反应
B.可表示某一个具体的反应,也可以表示一类反应
C.离子方程式中的OH-只能代表可溶性强碱
D.该反应可看到Cu(OH)2蓝色沉淀
解析 题中离子方程式不能表示CuSO4和Ba(OH)2的反应,A错误;离子方程式中OH-只能代表强碱,C正确。
A
13.下列各选项中的反应Ⅰ与反应Ⅱ不能用同一离子方程式表示的是( )
A.①② B.②③ C.③④ D.②④
B
反应Ⅰ 反应Ⅱ
① 向AgNO3溶液中滴加稀盐酸 AgNO3溶液与食盐水混合
② 少量CO2通入NaOH溶液中 少量CO2通入澄清石灰水中
③ 向烧碱溶液中滴加稀盐酸 向NaHSO4溶液中滴加KOH溶液
④ 向Ba(OH)2溶液中滴加稀硫酸 向Ba(OH)2溶液中滴加少量NaHSO4溶液
C
(1)根据上述实验推断:原溶液中肯定有____________,肯定没有____________,不能肯定存在____________。
(2)写出操作③中发生反应的离子方程式:______________________________。
Thanks!
本课时内容结束
