专题3 第一单元 氯气及氯的化合物 第三课时 氧化还原反应(共122张PPT)
文档属性
| 名称 | 专题3 第一单元 氯气及氯的化合物 第三课时 氧化还原反应(共122张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 20:40:02 | ||
图片预览









文档简介
(共122张PPT)
第三课时 氧化还原反应
【课程标准要求】
1.能运用发展的、相互联系的、对立统一的观点理解化学变化。能从化合价变化和电子转移的角度认识氧化还原反应。
2.能够正确表示氧化还原反应电子转移的方向和数目。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、氧化还原反应基本概念
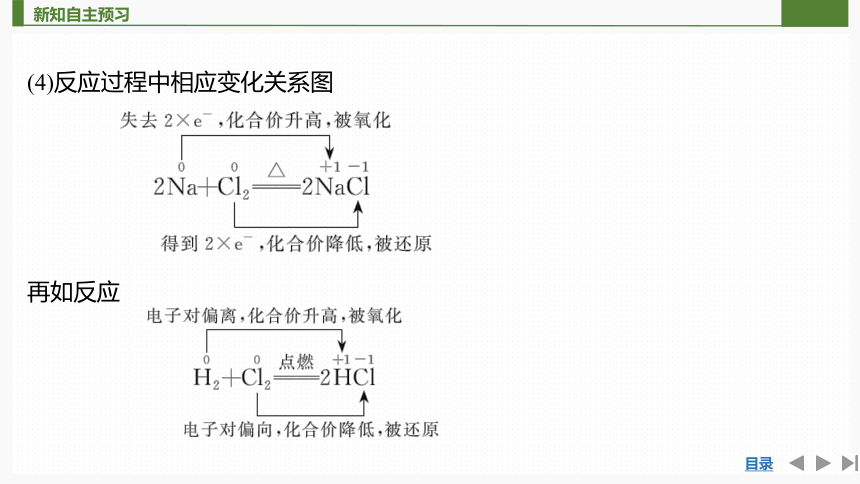
1.2Na+Cl2===2NaCl的反应过程分析
(1)钠原子______最外层上的1个电子,成为具有稳定结构的Na+,其化合价由____价升高为______价。
(2)氯原子最外层______1个电子,成为具有稳定结构的Cl-,其化合价由____价降低为______价。
(3)在这个反应中,氯原子和钠原子之间发生了电子的______,分别形成阴离子和阳离子,使元素的________发生了变化。
失去
0
+1
得到
0
-1
得失
化合价
(4)反应过程中相应变化关系图
再如反应
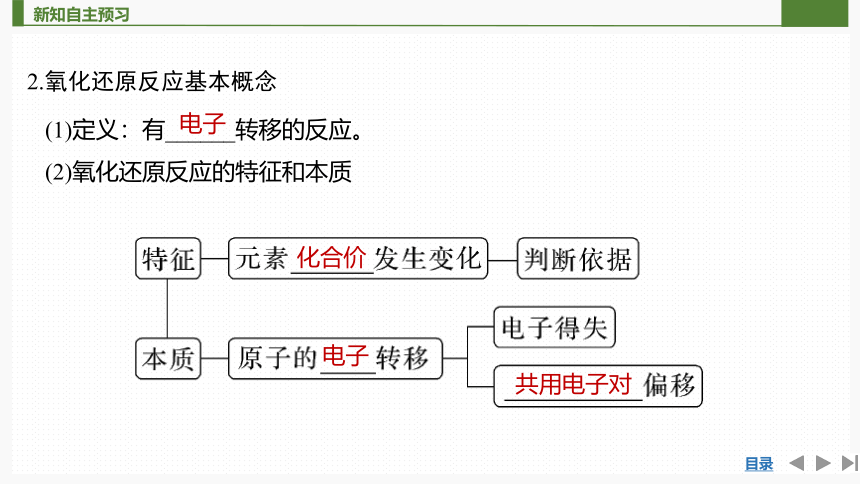
2.氧化还原反应基本概念
(1)定义:有______转移的反应。
(2)氧化还原反应的特征和本质
电子
化合价
电子
共用电子对
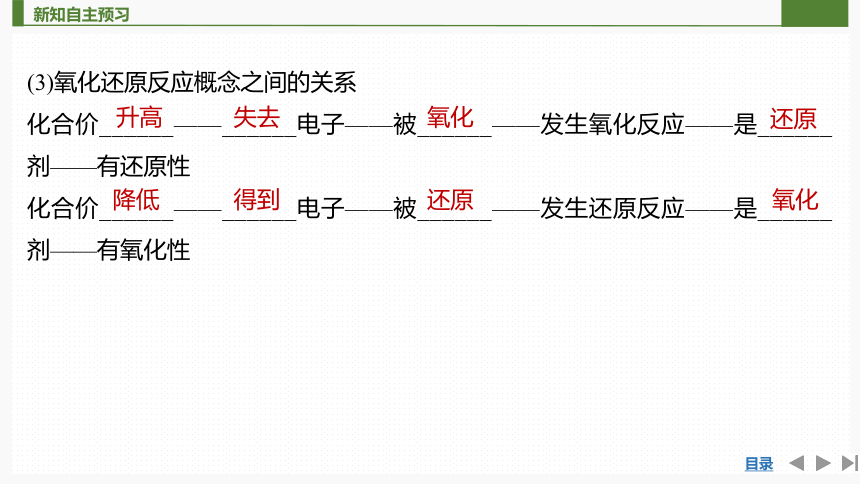
(3)氧化还原反应概念之间的关系
化合价______——______电子——被______——发生氧化反应——是______剂——有还原性
化合价______——______电子——被______——发生还原反应——是______剂——有氧化性
升高
失去
氧化
还原
降低
得到
还原
氧化
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)有化合价变化的反应不一定是氧化还原反应( )
(2)在HNO3、N2O4、NaNO2、NO、N2和NH4Cl中氮元素的化合价分别为+5、+4、+3、+2、0和-3价( )
(3)在氧化还原反应中可能只有元素的化合价的升高,而无化合价的降低( )
(4)CO2+2NaOH===Na2CO3+H2O 属于氧化还原反应( )
(5)有单质参加或生成的反应不一定是氧化还原反应。( )
×
√
×
×
√
二、氧化还原反应的表示方法——双线桥法
1.用带箭头的线由________指向________,且对准同种元素。
2.要标明“得”“失”电子,且得失电子总数______。
3.箭头不代表电子转移的方向,而是指某元素从反应物到产物时______的变化。
例如:
反应物
生成物
相等
价态
该表示法能体现出氧化还原反应的实质及过程,同时清楚地表示出了得失电子的情况,上述反应中CuO中Cu元素得电子为“2×2e-”,前一个“2”表示有2个Cu2+得电子,后一个“2e-”,表示一个Cu2+得2个电子,共得4个电子。
【微自测】
2.判断下列用双线桥法表示电子的转移情况,正确的打“√”,错误的打“×”。
×
×
√
√
三、氧化剂、还原剂
1.氧化剂和还原剂
(1)氧化剂:在反应中__________________________的物质,氧化剂发生______反应。
(2)还原剂:在反应中__________________________的物质,还原剂发生______反应。
得到电子(或电子对偏向)
还原
失去电子(或电子对偏离)
氧化
(3)常见的氧化剂和还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、KMnO4、MnO2等
还原剂 活泼的金属单质 Al、Zn、Fe等
某些非金属单质 C、H2等
某些非金属氧化物 CO等
2.氧化性和还原性
(1)氧化性:氧化剂发生______反应,表现出______性。
(2)还原性:还原剂发生______反应,表现出______性。
还原
氧化
氧化
还原
【微自测】
3.判断正误,正确的打“√”,错误的打“×”。
(1)一种元素被氧化,一定有另一种元素被还原( )
(2)氧化还原反应中的反应物,不是氧化剂就是还原剂( )
(3)氧化还原反应过程中得电子的物质是还原剂,失电子的原子被还原( )
(4)氧化还原反应时还原剂先失去电子,氧化剂后得到电子( )
(5)还原性就是物质失去电子的性质。( )
×
×
×
×
√
二、氧化性和还原性强弱的比较
一、氧化还原反应基本概念
三、氧化还原反应规律与应用
一、氧化还原反应基本概念
1.在上述反应过程中Fe2+发生哪种类型的反应?
提示:因为Fe2+转化为Fe3+,化合价升高,Fe2+发生氧化反应。
3.一个化学反应中,氧化反应或还原反应能单独存在吗?
提示:不能。因为在化学反应中,发生氧化反应,必然会发生还原反应,即氧化反应和还原反应是在一个反应中同时发生的,不可能单独存在。
1.氧化还原反应的特征和本质
2.氧化还原反应概念间的关系
3.氧化还原反应与四个基本反应类型的关系
(1)置换反应一定属于氧化还原反应。
(2)复分解反应一定不属于氧化还原反应。
(3)有单质参与的化合反应和有单质生成的分解反应均属于氧化还原反应。
C
解析 根据置换反应的定义可知,题给反应属于置换反应,反应前后元素的化合价发生变化,也属于氧化还原反应。
2.下列氧化还原反应中,水作为还原剂的是( )
D
解析 反应中水作还原剂,说明该反应中有电子转移,为氧化还原反应,且水中元素失电子,化合价升高,据此分析解答。A项反应中水中的氢由+1价变为0价,水作氧化剂,A项错误;B项反应中,水中元素化合价没有变化,所以水既不是氧化剂又不是还原剂,B项错误;C项反应中,水中元素化合价没有变化,所以水既不是氧化剂又不是还原剂,C项错误;D项反应中,水中的氧元素化合价由-2价升高到0价,失电子作还原剂,D项正确。
3.已知:2KMnO4+16HCl(浓)===2KCl+5Cl2↑+2MnCl2+8H2O,下列说法正
确的是( )
A.HCl发生了还原反应
B.氧化剂与还原剂的物质的量比为1∶8
C.当标准状况下,产生22.4 L氯气,转移电子数为2NA
D.氧化性: Cl2>KMnO4
C
解析 部分氯化氢发生氧化反应生成氯气, A错误;氯化氢只有10 mol被氧化,氧化剂与还原剂的物质的量之比为2∶10=1∶5, B错误;生成了1 mol氯气,转移电子数为2NA,C正确;氧化剂的氧化性大于氧化产物的氧化性,故氧化性:高锰酸钾大于氯气, D项错误。
二、氧化性和还原性强弱的比较
酒精、含氯消毒剂(如“84”消毒液)均可有效灭活病毒。“84”消毒液是一种高效消毒液(见下图)
1.“84”消毒液的主要成分是NaClO,其中氯元素的化合价是多少?用“84”消毒液
灭杀新冠病毒,利用的是NaClO的什么性质?
提示:NaClO中氯元素的化合价是+1价,“84”消毒液能灭杀病毒是利用了
NaClO的强氧化性。
2.“84”消毒液与洁厕灵混用时发生如下反应:
NaClO+2HCl===NaCl+Cl2↑+H2O,用双线桥法标出电子转移的方向和数目,并指出反应中的氧化剂和还原剂。根据上述反应能否确定NaClO、Cl2的氧化性强弱?
3.通过对上述反应的分析,判断氧化剂与物质的氧化性。还原剂与物质的还原
性之间有何关系?
提示:二者是一致的,即氧化剂具有氧化性,还原剂具有还原性。
1.氧化性和还原性
(1)氧化性即氧化剂表现出得电子的性质。还原性即还原剂表现出失电子的性质。
(2)氧化性和还原性的强弱
物质氧化性、还原性的强弱与得失电子的数目无关,而是取决于它们得失电子的难易程度。物质的氧化性强即得电子能力强,物质的还原性强即失电子能力强。
2.氧化性和还原性强弱的比较方法
(1)根据氧化还原反应方程式比较
则氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2)根据元素的活动性顺序比较
4.从硫元素的价态上判断,下列物质中的硫元素不能表现氧化性的是( )
A.Na2S B.S
C.SO2 D.H2SO4
解析 处于最低价态的元素,不能再得电子,故不能表现氧化性。Na2S中硫
元素处于最低价态,不能表现氧化性。
A
5.已知2NaA+B2===2NaB+A2
2NaA+C2===2NaC+A2
2NaB+C2===2NaC+B2
2NaC+D2===2NaD+C2
则氧化性由强到弱的顺序是( )
A.A2>B2>C2>D2 B.B2>A2>C2>D2
C.C2>B2>A2>D2 D.D2>C2>B2>A2
D
解析 利用在同一个氧化还原反应中“氧化剂的氧化性>氧化产物”的规律可分析如下:由2NaA+B2===2NaB+A2得出氧化性B2>A2,由2NaA+C2===2NaC+A2得出氧化性C2>A2,由2NaB+C2===2NaC+B2得出氧化性C2>B2,由2NaC+D2===2NaD+C2得出氧化性D2>C2,故氧化性D2>C2>B2>A2。
三、氧化还原反应规律与应用
1.守恒规律
(1)内容
2.强弱规律
(1)内容
还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。
(2)应用:比较物质间氧化性或还原性的强弱
如:2KBr+Cl2===2KCl+Br2
氧化性:Cl2>Br2,还原性:KBr>KCl。
3.先后规律
4.价态规律
(1)内容
①高低规律
元素最高价态:只有氧化性。
元素中间价态:既有氧化性又有还原性。
元素最低价态:只有还原性。
②归中规律
同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”,可总结为:价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。
③歧化规律
同种元素的中间价态生成高价和低价,即中间价―→高价+低价。
(2)应用:可判断氧化还原反应能否发生及反应产物。
6.(2020·江西南昌市高一开学考试)Na2SO3与K2Cr2O7按照3∶1恰好完全反应。已
知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5
B
x
7.对于反应3Cl2+6NaOH(热)===5NaCl+NaClO3+3H2O,下列叙述正确的是
( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子与被还原的氯原子的物质的量之比为5∶1
C.Cl2既是氧化剂又是还原剂
D.氧化剂的得电子数与还原剂的失电子数之比为5∶1
C
B
微专题3 探究物质的氧化性或还原性 (以H2O2为例)
过氧化氢,俗称双氧水,纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比例混溶,是一种强氧化剂。H2O2水溶液为无色透明液体,质量分数为3%的H2O2水溶液适用于伤口消毒、环境消毒和食品消毒。H2O2在通常情况下会缓慢分解成水和氧气,但分解速率极其慢,加快其反应速率的方法是加入催化剂二氧化锰等或用短波射线照射。H2O2在不同情况下分别体现氧化性和还原性。过氧化氢是常用的绿色氧化剂。
[实验目的]
过氧化氢(H2O2)中氧元素的化合价为-1价,处于氧元素的中间价态。设计实验证明过氧化氢既具有氧化性又具有还原性。
[实验用品]
H2O2溶液、酸性KMnO4溶液(紫红色)、KI溶液、淀粉溶液、MnO2粉末、试管、胶头滴管。
[实验原理]
①酸性KMnO4与H2O2反应的化学方程式:
2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4(无色)+5O2↑+8H2O
②H2O2溶液与KI溶液反应的化学方程式:
2KI+H2O2+H2SO4===K2SO4+I2+2H2O[碘(I2)遇淀粉变蓝色]
[实验设计]
实验①:向试管中加入约1 mL酸性KMnO4溶液,逐滴加入H2O2溶液有大量无色气泡冒出,溶液紫红色褪去。
实验②:向试管中加入约1 mL的KI溶液,再滴入2~3滴淀粉溶液,逐滴加入H2O2溶液,溶液由无色变成蓝色。
实验③:向试管中加入约5 mL的H2O2溶液再加入少量MnO2粉末,立即把带火星的木条伸入试管口。有大量无色气泡产生,带火星的木条复燃
1.实验①中产生气泡的成分是什么?在此反应中H2O2体现了什么性质?
提示:气泡的成分是O2;H2O2在反应中氧元素的化合价由-1价升高到0价,
故H2O2体现了还原性。
2.实验②中溶液变成蓝色的原因是什么?在此反应中H2O2体现了什么性质?
提示:反应中I-被H2O2氧化成I2,I2使淀粉溶液呈蓝色。H2O2在反应中氧元素
的化合价由-1价降低到-2价,故H2O2体现了氧化性。
3.实验③中木条复燃的原因是什么?H2O2在此反应中体现了什么性质?
提示:H2O2在MnO2的催化作用下分解产生O2,O2使木条复燃,在反应中
H2O2氧元素的化合价既升高又降低,故H2O2既体现了氧化性,又体现了还
原性。
4.为什么称双氧水是绿色氧化剂?
提示:H2O2作氧化剂,其还原产物是H2O,不会向溶液中引入杂质离子,且
H2O对环境无毒无害,故被称为绿色氧化剂。
研究物质氧化性或还原性的方法
(1)根据物质中所含元素化合价升高或降低的可能性,预测物质可能具有还原性或氧化性。若所含某元素的化合价有升高的趋势,说明该物质可能具有还原性;反之,若所含某元素的化合价有降低的趋势,说明该物质可能具有氧化性。
(2)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应验证预测。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验来验证预测。
[典例] (2022·江苏无锡高一期末)某小组设计了如下图所示的实验装置来探究
过氧化钠的强氧化性。
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接装置A、B、C。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待装置D中导管口产生连续气泡后,将导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,停止滴加浓盐酸,再通一段时间N2,直至装置中气体变为无色。
(1)装置D中收集的无色气体X能使带火星的木条复燃,据此推断该气体X是____________。
答案 (1)O2(或氧气)
解析 (1)装置D中收集的无色气体X能使带火星的木条复燃,据此推断该气体X是氧气。
(2)装置B中湿润的淀粉碘化钾试纸变蓝。
甲同学根据A中气体的颜色推测试纸变蓝时发生反应的化学方程式为__________________________________________________________________;
乙同学认为使试纸变蓝的原因也可能是________(填序号)。
a.挥发的HCl气体使试纸变蓝
b.在此实验过程中生成的X气体也能将I-氧化为I2
c.通入的N2使试纸变蓝
答案 (2)Cl2+2KI===I2+2KCl
b
解析 (2)淀粉碘化钾试纸变蓝是由于氧化剂将I-氧化得到I2,I2使湿润的淀粉试纸变蓝色。A中气体呈黄绿色判断是Cl2,推测试纸变蓝时发生反应的化学方程式为:Cl2+2KI===I2+2KI;圆底烧瓶中得到的强氧化性气体除了Cl2还有O2,HCl气体和N2均不能氧化I-,故可以认为使试纸变蓝的原因也可能是在此实验过程中生成的X气体,选b。
(3)C中NaOH溶液的作用是______________________________________。
(4)Na2O2与干燥的HCl能发生化学反应生成Cl2、NaCl和H2O,该反应的化学方程式为_____________________________________________________________,
当反应生成标准状况下2.24 L Cl2时,转移的电子数为____________ mol。
答案 (3)吸收挥发的HCl气体和生成的氯气
(4)Na2O2+4HCl===2NaCl+Cl2↑+2H2O 0.2
解析 (3)进入C装置的气体有Cl2、O2、HCl和N2,NaOH溶液能与Cl2和HCl反应,C中NaOH溶液的作用是吸收挥发的HCl气体和生成的Cl2。
(4)Na2O2与干燥的HCl能发生氧化还原反应生成Cl2、NaCl和H2O,该反应的化学方程式为Na2O2+4HCl===2NaCl+Cl2↑+2H2O;该反应Na2O2+4HCl===2NaCl+Cl2↑+2H2O ~2e-,当反应生成标准状况下2.24 L Cl2物质的量为0.1 mol时,转移的电子数为0.2 mol。
【解题关键】 明确从圆底烧瓶出来的混合气体含有氯气、氧气、氮气、氯化氢和水是正确解题的关键。
1.针对以下A~D四个涉及H2O2的反应填空:
(1)H2O2仅体现氧化性的反应是____________(填字母,下同),H2O2仅体现还原性的反应是____________,H2O2既体现氧化性又体现还原性的反应是____________,H2O2既不作氧化剂又不作还原剂的反应是____________。
(2)指出D反应中的氧化剂是 ____________,被氧化的元素是____________。
答案 (1)D B C A
(2)H2O2 Cr
解析 Na2O2和H2O2中氧元素的化合价是-1。A中H2O2不是氧化剂,也不是还原剂;B中H2O2中氧元素的化合价升高,H2O2仅表现还原性;C中H2O2中氧元素的化合价既有升高也有降低,H2O2既表现氧化性,又表现还原性;D中H2O2中氧元素的化合价降低,H2O2只表现氧化性。
2.H2O2有杀菌消毒作用,医疗上常利用它来清洗伤口。
(1)采矿废液中的氰化物(如KCN)一般用H2O2进行无毒化处理,化学方程式为KCN+H2O2+H2O===KHCO3+NH3↑(KCN中N为-3价),该反应中被氧化的元素是____________(填元素名称),体现了H2O2的____________性。
(2)H2O2被称为“绿色氧化剂”的原因是____________。
答案 (1)碳元素 氧化
(2)H2O2作氧化剂,其还原产物是H2O,无污染
解析 (1)反应中碳元素化合价从+2价升高到+4价,碳元素被氧化。(2)H2O2作氧化剂时,其还原产物是H2O,无污染,因此H2O2被称为“绿色氧化剂”。
3.一反应体系有反应物和生成物共7种物质:O2、KMnO4、MnSO4、H2SO4、
H2O、H2O2、K2SO4。已知该反应中H2O2只发生如下过程:H2O2→O2,试回
答下列问题:
(1)该反应中的氧化剂是__________________________________________。
(2)该反应中,发生还原反应的过程是__________________________________。
(3)该反应中,氧化产物与还原产物的物质的量之比是____________。
答案 (1)KMnO4 (2)KMnO4→MnSO4
(3)5∶2
1.(2021·山东临沂兰山高一期中)近年来,我国大力弘扬中华优秀传统文化,体
现了中华民族“文化自信”。下列说法不正确的是( )
A.“春蚕到死丝方尽,蜡炬成灰泪始干”,诗中涉及氧化还原反应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“粉身碎骨浑不怕,要留清白在人间”,该过程中只发生分解反应
D.《荷塘月色》中“薄薄的青雾浮起在荷塘里”中的“青雾”属于胶体
C
解析 诗中涉及到燃烧反应,燃烧为氧化还原反应,A正确;铁置换硫酸铜中的铜,该过程发生了置换反应,B正确;碳酸钙分解为氧化钙,氧化钙与水反应生成氢氧化钙,后者是化合反应,C错误;“青雾”属于胶体为气溶胶,D正确。
2.下列说法正确的是( )
A.氧化还原反应的本质是元素化合价的升降
B.氧化还原反应一定有氧元素参加
C.有单质参与的反应一定是氧化还原反应
D.发生氧化反应的物质也可能同时发生还原反应
D
解析 氧化还原反应的本质是电子转移,A错误;氧化还原反应不一定有氧元素参加,B错误;有单质参与的反应不一定是氧化还原反应,如同素异形体之间的转化,C错误;发生氧化反应的物质也可能同时发生还原反应,如氯气与氢氧化钠溶液的反应,氯气既发生氧化反应又发生还原反应,D正确。
3.下列对氧化还原反应分析正确的是( )
C
解析 A项,得、失电子数为2e-;B项,Fe失2e-,H+得2e-;D项,H2失电子,被氧化。
C
5.(1)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
其中你认为不可能实现的是____________(填序号)。
②
解析 (1)氧化还原反应中元素化合价有升必有降。①中,NO、HNO3中氮的化合价分别为+2价、+5价,生成N2O3(氮的化合价为+3价)的过程中氮元素的化合价有升有降,此反应可能实现;②中,NH3、NO中氮的化合价分别为-3价、+2价,生成HNO2(氮的化合价为+3价)的过程中氮元素的化合价都是升高,此反应不可能实现;③中,N2O4(氮的化合价为+4价)生成HNO3(氮的化合价为+5价)、HNO2(氮的化合价为+3价)的过程中氮元素的化合价有升有降,此反应可能实现。
(2)下列三个氧化还原反应中,氧化性最强的物质是____________。
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除Cl2单质外,还可应用上述反应中的____________作氧化剂。
答案 (2)KMnO4 FeCl3
1.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中
不属于氧化还原反应的是( )
A.炒菜用过的铁锅,放置一段时间常出现红棕色斑迹
B.用煤气灶燃烧沼气[主要成分为甲烷(CH4)]为炒菜提供热量
C.牛奶久置变质腐败
D.用醋酸除去水垢[主要成分是CaCO3、Mg(OH)2]
D
解析 Fe被氧化生成铁锈,发生氧化还原反应,A项错误;CH4燃烧生成二氧化碳和水,C、O元素的化合价发生变化,属于氧化还原反应,B项错误;牛奶久置变质腐败,是被空气中的氧气氧化,有元素的化合价发生变化,属于氧化还原反应,C项错误;用醋酸除去水垢,属于复分解反应,不属于氧化还原反应,D项正确。
2.单宁是葡萄酒中所含有的两种酚类化合物其中的一种物质,单宁有独特的抗
氧化性,能有效抵御生物氧化作用,它还有清除活性氧的功能。
下列对于单宁在保护葡萄酒过程中的有关说法正确的是( )
A.单宁作还原剂
B.单宁作氧化剂
C.单宁被还原
D.单宁中某元素化合价降低
解析 单宁有独特的抗氧化性,能有效抵御生物氧化作用,故单宁具有还原性,能作还原剂。
A
3.下列变化属于氧化反应的是( )
B
4.吸进人体的氧有2%转化为氧化性极强的活性氧(O3),这些活性氧加速人体衰老,被称为“生命杀手”,科学家试用Na2SeO3消除人体内的活性氧,则Na2SeO3的作用是( )
B
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.以上均不是
解析 人体内的“活性氧”中氧元素的化合价为零价,Na2SeO3消除“活性氧”,即Na2SeO3中元素化合价升高,被氧化,则Na2SeO3的作用是作还原剂。
5.(2021·山东泰安高一期中)下列叙述中正确的是( )
A.含最高价元素的化合物,一定具有强氧化性
B.氧化剂在同一反应中既可以是反应物,也可以是生成物
C.失电子越多,还原性越强,得电子越多,氧化性越强
D.化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被
还原
D
解析 二氧化碳为碳的最高价氧化物,但其氧化性较弱,A错误;氧化剂一定是反应物,B错误;失(得)电子越容易,还原性(氧化性)越强,与失去(得到)电子数目多少无关,C错误;化学反应中,某元素由化合态变为游离态,此元素化合价可能升高也可能降低,即此元素可能被氧化,也可能被还原,D正确。
6.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,
反应温度可高达2 700 ℃,对于该反应,下列说法正确的是( )
A.该反应属于置换反应
B.N2H4是氧化剂,被氧化
C.N2O4是还原剂,发生氧化反应
D.N2既是氧化产物又是还原产物
D
解析 题给反应的反应物中无单质,不属于置换反应;题给反应实际上是不同价态的氮元素之间发生的反应,N2H4是还原剂,被氧化,发生氧化反应,N2O4是氧化剂,被还原,发生还原反应,N2既是氧化产物又是还原产物。
7.下列变化中只有通过还原反应才能实现的是 ( )
解析 发生还原反应时,元素的化合价降低。B中锰元素化合价由+2价升高为+7价,C中氯元素的化合价由-1价升高为0价,D中元素的化合价无变化。
A
B
解析 NaN3中N化合价升高,是还原剂,KNO3中N化合价降低,是氧化剂,则氧化剂与还原剂的物质的量之比为1∶5,故A错误;反应中只有N的化合价变化,则N2既是氧化产物也是还原产物,故B正确;NaN3中N化合价升高,是还原剂,故C错误;KNO3中N化合价降低,被还原,发生还原反应,故D错误。
9.O2F2可以发生反应:H2S+4O2F2===SF6+2HF+4O2。下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成1分子HF,则转移8个电子
D.还原剂与氧化剂的微粒个数之比为1∶4
D
解析 O元素由+1价降低到0价,化合价降低,获得电子,被还原,所以氧气是还原产物,故A错误;在反应中,O2F2中的O元素化合价降低,获得电子,所以该物质是氧化剂,而硫化氢中的S元素的化合价是-2价,反应后升高到+6价,所以H2S是还原剂,故B错误;S元素化合价由-2价升高到+6价,O元素由+1价降低到0价,转移8个电子,若生成1分子HF,则转移4个电子,故C错误;由方程式可知,还原剂(H2S)和氧化剂(O2F2)的微粒个数的比是1∶4,故D正确。
10.(2021·黑龙江绥化一中高一期中)《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的“发烛”就是原始的火柴。已知K2Cr2O7用于工业中制造火柴头。K2Cr2O7+HCl(浓)→KCl+CrCl3+Cl2↑+H2O(未配平)
(1)(填元素名称)____________元素被氧化 (填化学式,下同),____________是氧化剂,____________发生氧化反应。
答案 (1)氯 K2Cr2O7 HCl
解析 (1)已知反应中,氯元素化合价升高发生氧化反应,氯元素被氧化,K2Cr2O7中Cr元素化合价降低,K2Cr2O7是氧化剂,HCl中氯元素化合价升高, HCl发生氧化反应。
(2)参加反应的HCl,表现了____________和____________。(填“还原性”“氧化性”或“酸性”)
(3)该反应中每生成6个Cl2转移电子个数为____________个。
(4)配平上述反应,并用双线桥法表示出该反应中电子转移的方向和数目____________。
D
解析 在反应中,NaNO2中N元素由+3价降低为0价,发生还原反应, NH4Cl中N元素由-3价升高为0价,发生氧化反应,根据化合价升高和降低的总数相等,可知生成1 mol N2时转移3 mol e-,NH4Cl中N被氧化,被氧化和被还原的元素均为N。
12.(2021·河北张家口高一月考)ClO2作为一种广谱型的消毒剂,将逐渐取代Cl2成为自来水的消毒剂。可用NaClO3和H2O2溶液在酸性条件下制备,反应的化学方程式为2NaClO3+H2O2+H2SO4===2ClO2↑+Na2SO4+2H2O+O2↑,下列说法不正确的是( )
A.1 mol NaClO3参加反应,转移1 mol电子
B.NaClO3在反应中被氧化
C.H2O2的还原性强于ClO2
D.该反应的氧化产物是O2
B
解析 Cl元素化合价由反应前NaClO3中的+5价变为反应后ClO2中的+4价,化合价降低,得到电子,则1 mol NaClO3参加反应,转移1 mol电子,A正确;NaClO3中Cl元素化合价降低,得到电子,被还原为ClO2,NaClO3作氧化剂,B错误;根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,在该反应中,NaClO3作氧化剂,得到电子被还原为ClO2,H2O2作还原剂,失去电子被氧化为O2,所以H2O2的还原性强于ClO2,C正确;该反应中,H2O2作还原剂,氧化产物为O2,D正确。
13.NaClO2可用作造纸的漂白剂,它可由反应H2O2+2ClO2+2NaOH===2NaClO2
+2H2O+O2制得,下列关于该反应的说法正确的是( )
A.H2O2是氧化剂,H2O2中的氧元素被还原
B.ClO2中氧元素化合价升高,被氧化
C.ClO2中的氯元素被氧化
D.ClO2是氧化剂,H2O2是还原剂
D
解析 A项,在反应中,H2O2中氧元素的化合价从-1价升高到0价,H2O2作还原剂,错误;B项,ClO2中氧元素的化合价没有变化,错误;C项,ClO2中的氯元素化合价从+4价降低到+3价,氯元素被还原,错误。
14.天然气中含有硫化氢(H2S),H2S燃烧时会产生有毒气体SO2,如何高效脱去天然气中的硫化氢(以下简称脱硫)是化学工作者始终关注的问题,某脱硫新工艺原理如下图所示,回答有关问题。
(1)过程ii反应的化学方程式可表示为aFeSO4+O2+2H2SO4===bFe2(SO4)3+2H2O。则a=____________,发生还原反应的物质是____________,氧化产物是____________,该反应____________(填“是”或“不是”)四种基本反应类型中的一种。
答案 (1)4 O2 Fe2(SO4)3 不是
解析 (1)根据原子守恒可知:a=2b,a+2=3b,解得b=2、a=4。反应中铁元素的化合价升高、氧元素的化合价降低,故O2发生还原反应,Fe2(SO4)3是氧化产物,该反应中三种反应物生成两种产物,与四种基本反应类型中的任何一种均不相符。
(2)写出过程i中H2S发生反应的化学方程式并用双线桥表示出电子转移方向与数目:_____________________________________________________,
该反应中发生还原反应的物质是_________________________________。
答案
解析 (2)由图知,过程i中明确给出的反应物是Fe2(SO4)3、H2S,生成物有FeSO4、S,可先写出H2S+Fe2(SO4)3―→2FeSO4+S↓,然后根据质量守恒可知生成物中还有H2SO4。
15.(2021·黑龙江绥化一中高一期中)已知HNO2是一种弱酸,向NaNO2中加入强酸可生成HNO2。HNO2不稳定,易分解成NO和NO2气体。HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。NaNO2晶体外观和食盐相似,又有咸味,因而容易误食引起中毒。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可以服用维生素C解毒,维生素C在解毒的过程中表现出____________ (填“氧化”或“还原”)性。
答案 (1)还原
解析 (1)根据题意,维生素C在解毒的过程中表现出还原性。
(2)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为____________________________________。
(3)已知NaNO2能发生反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。鉴别NaNO2和NaCl,可选用的物质有:①KI-淀粉试纸;②水;③淀粉;④白酒;⑤食醋,你认为必须选用的物质有____________(填序号)。
(4)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中能使NaNO2转化为不引起二次污染的N2的是____________(填字母)。
A.NaCl B.NH4Cl
C.HNO3 D.浓H2SO4
(5)请配平以下化学方程式Al+NaNO3+NaOH——NaAlO2+N2↑+H2O
答案 (4)B
(5)10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O
Thanks!
本课时内容结束
第三课时 氧化还原反应
【课程标准要求】
1.能运用发展的、相互联系的、对立统一的观点理解化学变化。能从化合价变化和电子转移的角度认识氧化还原反应。
2.能够正确表示氧化还原反应电子转移的方向和数目。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、氧化还原反应基本概念
1.2Na+Cl2===2NaCl的反应过程分析
(1)钠原子______最外层上的1个电子,成为具有稳定结构的Na+,其化合价由____价升高为______价。
(2)氯原子最外层______1个电子,成为具有稳定结构的Cl-,其化合价由____价降低为______价。
(3)在这个反应中,氯原子和钠原子之间发生了电子的______,分别形成阴离子和阳离子,使元素的________发生了变化。
失去
0
+1
得到
0
-1
得失
化合价
(4)反应过程中相应变化关系图
再如反应
2.氧化还原反应基本概念
(1)定义:有______转移的反应。
(2)氧化还原反应的特征和本质
电子
化合价
电子
共用电子对
(3)氧化还原反应概念之间的关系
化合价______——______电子——被______——发生氧化反应——是______剂——有还原性
化合价______——______电子——被______——发生还原反应——是______剂——有氧化性
升高
失去
氧化
还原
降低
得到
还原
氧化
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)有化合价变化的反应不一定是氧化还原反应( )
(2)在HNO3、N2O4、NaNO2、NO、N2和NH4Cl中氮元素的化合价分别为+5、+4、+3、+2、0和-3价( )
(3)在氧化还原反应中可能只有元素的化合价的升高,而无化合价的降低( )
(4)CO2+2NaOH===Na2CO3+H2O 属于氧化还原反应( )
(5)有单质参加或生成的反应不一定是氧化还原反应。( )
×
√
×
×
√
二、氧化还原反应的表示方法——双线桥法
1.用带箭头的线由________指向________,且对准同种元素。
2.要标明“得”“失”电子,且得失电子总数______。
3.箭头不代表电子转移的方向,而是指某元素从反应物到产物时______的变化。
例如:
反应物
生成物
相等
价态
该表示法能体现出氧化还原反应的实质及过程,同时清楚地表示出了得失电子的情况,上述反应中CuO中Cu元素得电子为“2×2e-”,前一个“2”表示有2个Cu2+得电子,后一个“2e-”,表示一个Cu2+得2个电子,共得4个电子。
【微自测】
2.判断下列用双线桥法表示电子的转移情况,正确的打“√”,错误的打“×”。
×
×
√
√
三、氧化剂、还原剂
1.氧化剂和还原剂
(1)氧化剂:在反应中__________________________的物质,氧化剂发生______反应。
(2)还原剂:在反应中__________________________的物质,还原剂发生______反应。
得到电子(或电子对偏向)
还原
失去电子(或电子对偏离)
氧化
(3)常见的氧化剂和还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、KMnO4、MnO2等
还原剂 活泼的金属单质 Al、Zn、Fe等
某些非金属单质 C、H2等
某些非金属氧化物 CO等
2.氧化性和还原性
(1)氧化性:氧化剂发生______反应,表现出______性。
(2)还原性:还原剂发生______反应,表现出______性。
还原
氧化
氧化
还原
【微自测】
3.判断正误,正确的打“√”,错误的打“×”。
(1)一种元素被氧化,一定有另一种元素被还原( )
(2)氧化还原反应中的反应物,不是氧化剂就是还原剂( )
(3)氧化还原反应过程中得电子的物质是还原剂,失电子的原子被还原( )
(4)氧化还原反应时还原剂先失去电子,氧化剂后得到电子( )
(5)还原性就是物质失去电子的性质。( )
×
×
×
×
√
二、氧化性和还原性强弱的比较
一、氧化还原反应基本概念
三、氧化还原反应规律与应用
一、氧化还原反应基本概念
1.在上述反应过程中Fe2+发生哪种类型的反应?
提示:因为Fe2+转化为Fe3+,化合价升高,Fe2+发生氧化反应。
3.一个化学反应中,氧化反应或还原反应能单独存在吗?
提示:不能。因为在化学反应中,发生氧化反应,必然会发生还原反应,即氧化反应和还原反应是在一个反应中同时发生的,不可能单独存在。
1.氧化还原反应的特征和本质
2.氧化还原反应概念间的关系
3.氧化还原反应与四个基本反应类型的关系
(1)置换反应一定属于氧化还原反应。
(2)复分解反应一定不属于氧化还原反应。
(3)有单质参与的化合反应和有单质生成的分解反应均属于氧化还原反应。
C
解析 根据置换反应的定义可知,题给反应属于置换反应,反应前后元素的化合价发生变化,也属于氧化还原反应。
2.下列氧化还原反应中,水作为还原剂的是( )
D
解析 反应中水作还原剂,说明该反应中有电子转移,为氧化还原反应,且水中元素失电子,化合价升高,据此分析解答。A项反应中水中的氢由+1价变为0价,水作氧化剂,A项错误;B项反应中,水中元素化合价没有变化,所以水既不是氧化剂又不是还原剂,B项错误;C项反应中,水中元素化合价没有变化,所以水既不是氧化剂又不是还原剂,C项错误;D项反应中,水中的氧元素化合价由-2价升高到0价,失电子作还原剂,D项正确。
3.已知:2KMnO4+16HCl(浓)===2KCl+5Cl2↑+2MnCl2+8H2O,下列说法正
确的是( )
A.HCl发生了还原反应
B.氧化剂与还原剂的物质的量比为1∶8
C.当标准状况下,产生22.4 L氯气,转移电子数为2NA
D.氧化性: Cl2>KMnO4
C
解析 部分氯化氢发生氧化反应生成氯气, A错误;氯化氢只有10 mol被氧化,氧化剂与还原剂的物质的量之比为2∶10=1∶5, B错误;生成了1 mol氯气,转移电子数为2NA,C正确;氧化剂的氧化性大于氧化产物的氧化性,故氧化性:高锰酸钾大于氯气, D项错误。
二、氧化性和还原性强弱的比较
酒精、含氯消毒剂(如“84”消毒液)均可有效灭活病毒。“84”消毒液是一种高效消毒液(见下图)
1.“84”消毒液的主要成分是NaClO,其中氯元素的化合价是多少?用“84”消毒液
灭杀新冠病毒,利用的是NaClO的什么性质?
提示:NaClO中氯元素的化合价是+1价,“84”消毒液能灭杀病毒是利用了
NaClO的强氧化性。
2.“84”消毒液与洁厕灵混用时发生如下反应:
NaClO+2HCl===NaCl+Cl2↑+H2O,用双线桥法标出电子转移的方向和数目,并指出反应中的氧化剂和还原剂。根据上述反应能否确定NaClO、Cl2的氧化性强弱?
3.通过对上述反应的分析,判断氧化剂与物质的氧化性。还原剂与物质的还原
性之间有何关系?
提示:二者是一致的,即氧化剂具有氧化性,还原剂具有还原性。
1.氧化性和还原性
(1)氧化性即氧化剂表现出得电子的性质。还原性即还原剂表现出失电子的性质。
(2)氧化性和还原性的强弱
物质氧化性、还原性的强弱与得失电子的数目无关,而是取决于它们得失电子的难易程度。物质的氧化性强即得电子能力强,物质的还原性强即失电子能力强。
2.氧化性和还原性强弱的比较方法
(1)根据氧化还原反应方程式比较
则氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2)根据元素的活动性顺序比较
4.从硫元素的价态上判断,下列物质中的硫元素不能表现氧化性的是( )
A.Na2S B.S
C.SO2 D.H2SO4
解析 处于最低价态的元素,不能再得电子,故不能表现氧化性。Na2S中硫
元素处于最低价态,不能表现氧化性。
A
5.已知2NaA+B2===2NaB+A2
2NaA+C2===2NaC+A2
2NaB+C2===2NaC+B2
2NaC+D2===2NaD+C2
则氧化性由强到弱的顺序是( )
A.A2>B2>C2>D2 B.B2>A2>C2>D2
C.C2>B2>A2>D2 D.D2>C2>B2>A2
D
解析 利用在同一个氧化还原反应中“氧化剂的氧化性>氧化产物”的规律可分析如下:由2NaA+B2===2NaB+A2得出氧化性B2>A2,由2NaA+C2===2NaC+A2得出氧化性C2>A2,由2NaB+C2===2NaC+B2得出氧化性C2>B2,由2NaC+D2===2NaD+C2得出氧化性D2>C2,故氧化性D2>C2>B2>A2。
三、氧化还原反应规律与应用
1.守恒规律
(1)内容
2.强弱规律
(1)内容
还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。
(2)应用:比较物质间氧化性或还原性的强弱
如:2KBr+Cl2===2KCl+Br2
氧化性:Cl2>Br2,还原性:KBr>KCl。
3.先后规律
4.价态规律
(1)内容
①高低规律
元素最高价态:只有氧化性。
元素中间价态:既有氧化性又有还原性。
元素最低价态:只有还原性。
②归中规律
同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”,可总结为:价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。
③歧化规律
同种元素的中间价态生成高价和低价,即中间价―→高价+低价。
(2)应用:可判断氧化还原反应能否发生及反应产物。
6.(2020·江西南昌市高一开学考试)Na2SO3与K2Cr2O7按照3∶1恰好完全反应。已
知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5
B
x
7.对于反应3Cl2+6NaOH(热)===5NaCl+NaClO3+3H2O,下列叙述正确的是
( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子与被还原的氯原子的物质的量之比为5∶1
C.Cl2既是氧化剂又是还原剂
D.氧化剂的得电子数与还原剂的失电子数之比为5∶1
C
B
微专题3 探究物质的氧化性或还原性 (以H2O2为例)
过氧化氢,俗称双氧水,纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比例混溶,是一种强氧化剂。H2O2水溶液为无色透明液体,质量分数为3%的H2O2水溶液适用于伤口消毒、环境消毒和食品消毒。H2O2在通常情况下会缓慢分解成水和氧气,但分解速率极其慢,加快其反应速率的方法是加入催化剂二氧化锰等或用短波射线照射。H2O2在不同情况下分别体现氧化性和还原性。过氧化氢是常用的绿色氧化剂。
[实验目的]
过氧化氢(H2O2)中氧元素的化合价为-1价,处于氧元素的中间价态。设计实验证明过氧化氢既具有氧化性又具有还原性。
[实验用品]
H2O2溶液、酸性KMnO4溶液(紫红色)、KI溶液、淀粉溶液、MnO2粉末、试管、胶头滴管。
[实验原理]
①酸性KMnO4与H2O2反应的化学方程式:
2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4(无色)+5O2↑+8H2O
②H2O2溶液与KI溶液反应的化学方程式:
2KI+H2O2+H2SO4===K2SO4+I2+2H2O[碘(I2)遇淀粉变蓝色]
[实验设计]
实验①:向试管中加入约1 mL酸性KMnO4溶液,逐滴加入H2O2溶液有大量无色气泡冒出,溶液紫红色褪去。
实验②:向试管中加入约1 mL的KI溶液,再滴入2~3滴淀粉溶液,逐滴加入H2O2溶液,溶液由无色变成蓝色。
实验③:向试管中加入约5 mL的H2O2溶液再加入少量MnO2粉末,立即把带火星的木条伸入试管口。有大量无色气泡产生,带火星的木条复燃
1.实验①中产生气泡的成分是什么?在此反应中H2O2体现了什么性质?
提示:气泡的成分是O2;H2O2在反应中氧元素的化合价由-1价升高到0价,
故H2O2体现了还原性。
2.实验②中溶液变成蓝色的原因是什么?在此反应中H2O2体现了什么性质?
提示:反应中I-被H2O2氧化成I2,I2使淀粉溶液呈蓝色。H2O2在反应中氧元素
的化合价由-1价降低到-2价,故H2O2体现了氧化性。
3.实验③中木条复燃的原因是什么?H2O2在此反应中体现了什么性质?
提示:H2O2在MnO2的催化作用下分解产生O2,O2使木条复燃,在反应中
H2O2氧元素的化合价既升高又降低,故H2O2既体现了氧化性,又体现了还
原性。
4.为什么称双氧水是绿色氧化剂?
提示:H2O2作氧化剂,其还原产物是H2O,不会向溶液中引入杂质离子,且
H2O对环境无毒无害,故被称为绿色氧化剂。
研究物质氧化性或还原性的方法
(1)根据物质中所含元素化合价升高或降低的可能性,预测物质可能具有还原性或氧化性。若所含某元素的化合价有升高的趋势,说明该物质可能具有还原性;反之,若所含某元素的化合价有降低的趋势,说明该物质可能具有氧化性。
(2)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应验证预测。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验来验证预测。
[典例] (2022·江苏无锡高一期末)某小组设计了如下图所示的实验装置来探究
过氧化钠的强氧化性。
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接装置A、B、C。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待装置D中导管口产生连续气泡后,将导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,停止滴加浓盐酸,再通一段时间N2,直至装置中气体变为无色。
(1)装置D中收集的无色气体X能使带火星的木条复燃,据此推断该气体X是____________。
答案 (1)O2(或氧气)
解析 (1)装置D中收集的无色气体X能使带火星的木条复燃,据此推断该气体X是氧气。
(2)装置B中湿润的淀粉碘化钾试纸变蓝。
甲同学根据A中气体的颜色推测试纸变蓝时发生反应的化学方程式为__________________________________________________________________;
乙同学认为使试纸变蓝的原因也可能是________(填序号)。
a.挥发的HCl气体使试纸变蓝
b.在此实验过程中生成的X气体也能将I-氧化为I2
c.通入的N2使试纸变蓝
答案 (2)Cl2+2KI===I2+2KCl
b
解析 (2)淀粉碘化钾试纸变蓝是由于氧化剂将I-氧化得到I2,I2使湿润的淀粉试纸变蓝色。A中气体呈黄绿色判断是Cl2,推测试纸变蓝时发生反应的化学方程式为:Cl2+2KI===I2+2KI;圆底烧瓶中得到的强氧化性气体除了Cl2还有O2,HCl气体和N2均不能氧化I-,故可以认为使试纸变蓝的原因也可能是在此实验过程中生成的X气体,选b。
(3)C中NaOH溶液的作用是______________________________________。
(4)Na2O2与干燥的HCl能发生化学反应生成Cl2、NaCl和H2O,该反应的化学方程式为_____________________________________________________________,
当反应生成标准状况下2.24 L Cl2时,转移的电子数为____________ mol。
答案 (3)吸收挥发的HCl气体和生成的氯气
(4)Na2O2+4HCl===2NaCl+Cl2↑+2H2O 0.2
解析 (3)进入C装置的气体有Cl2、O2、HCl和N2,NaOH溶液能与Cl2和HCl反应,C中NaOH溶液的作用是吸收挥发的HCl气体和生成的Cl2。
(4)Na2O2与干燥的HCl能发生氧化还原反应生成Cl2、NaCl和H2O,该反应的化学方程式为Na2O2+4HCl===2NaCl+Cl2↑+2H2O;该反应Na2O2+4HCl===2NaCl+Cl2↑+2H2O ~2e-,当反应生成标准状况下2.24 L Cl2物质的量为0.1 mol时,转移的电子数为0.2 mol。
【解题关键】 明确从圆底烧瓶出来的混合气体含有氯气、氧气、氮气、氯化氢和水是正确解题的关键。
1.针对以下A~D四个涉及H2O2的反应填空:
(1)H2O2仅体现氧化性的反应是____________(填字母,下同),H2O2仅体现还原性的反应是____________,H2O2既体现氧化性又体现还原性的反应是____________,H2O2既不作氧化剂又不作还原剂的反应是____________。
(2)指出D反应中的氧化剂是 ____________,被氧化的元素是____________。
答案 (1)D B C A
(2)H2O2 Cr
解析 Na2O2和H2O2中氧元素的化合价是-1。A中H2O2不是氧化剂,也不是还原剂;B中H2O2中氧元素的化合价升高,H2O2仅表现还原性;C中H2O2中氧元素的化合价既有升高也有降低,H2O2既表现氧化性,又表现还原性;D中H2O2中氧元素的化合价降低,H2O2只表现氧化性。
2.H2O2有杀菌消毒作用,医疗上常利用它来清洗伤口。
(1)采矿废液中的氰化物(如KCN)一般用H2O2进行无毒化处理,化学方程式为KCN+H2O2+H2O===KHCO3+NH3↑(KCN中N为-3价),该反应中被氧化的元素是____________(填元素名称),体现了H2O2的____________性。
(2)H2O2被称为“绿色氧化剂”的原因是____________。
答案 (1)碳元素 氧化
(2)H2O2作氧化剂,其还原产物是H2O,无污染
解析 (1)反应中碳元素化合价从+2价升高到+4价,碳元素被氧化。(2)H2O2作氧化剂时,其还原产物是H2O,无污染,因此H2O2被称为“绿色氧化剂”。
3.一反应体系有反应物和生成物共7种物质:O2、KMnO4、MnSO4、H2SO4、
H2O、H2O2、K2SO4。已知该反应中H2O2只发生如下过程:H2O2→O2,试回
答下列问题:
(1)该反应中的氧化剂是__________________________________________。
(2)该反应中,发生还原反应的过程是__________________________________。
(3)该反应中,氧化产物与还原产物的物质的量之比是____________。
答案 (1)KMnO4 (2)KMnO4→MnSO4
(3)5∶2
1.(2021·山东临沂兰山高一期中)近年来,我国大力弘扬中华优秀传统文化,体
现了中华民族“文化自信”。下列说法不正确的是( )
A.“春蚕到死丝方尽,蜡炬成灰泪始干”,诗中涉及氧化还原反应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“粉身碎骨浑不怕,要留清白在人间”,该过程中只发生分解反应
D.《荷塘月色》中“薄薄的青雾浮起在荷塘里”中的“青雾”属于胶体
C
解析 诗中涉及到燃烧反应,燃烧为氧化还原反应,A正确;铁置换硫酸铜中的铜,该过程发生了置换反应,B正确;碳酸钙分解为氧化钙,氧化钙与水反应生成氢氧化钙,后者是化合反应,C错误;“青雾”属于胶体为气溶胶,D正确。
2.下列说法正确的是( )
A.氧化还原反应的本质是元素化合价的升降
B.氧化还原反应一定有氧元素参加
C.有单质参与的反应一定是氧化还原反应
D.发生氧化反应的物质也可能同时发生还原反应
D
解析 氧化还原反应的本质是电子转移,A错误;氧化还原反应不一定有氧元素参加,B错误;有单质参与的反应不一定是氧化还原反应,如同素异形体之间的转化,C错误;发生氧化反应的物质也可能同时发生还原反应,如氯气与氢氧化钠溶液的反应,氯气既发生氧化反应又发生还原反应,D正确。
3.下列对氧化还原反应分析正确的是( )
C
解析 A项,得、失电子数为2e-;B项,Fe失2e-,H+得2e-;D项,H2失电子,被氧化。
C
5.(1)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
其中你认为不可能实现的是____________(填序号)。
②
解析 (1)氧化还原反应中元素化合价有升必有降。①中,NO、HNO3中氮的化合价分别为+2价、+5价,生成N2O3(氮的化合价为+3价)的过程中氮元素的化合价有升有降,此反应可能实现;②中,NH3、NO中氮的化合价分别为-3价、+2价,生成HNO2(氮的化合价为+3价)的过程中氮元素的化合价都是升高,此反应不可能实现;③中,N2O4(氮的化合价为+4价)生成HNO3(氮的化合价为+5价)、HNO2(氮的化合价为+3价)的过程中氮元素的化合价有升有降,此反应可能实现。
(2)下列三个氧化还原反应中,氧化性最强的物质是____________。
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除Cl2单质外,还可应用上述反应中的____________作氧化剂。
答案 (2)KMnO4 FeCl3
1.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中
不属于氧化还原反应的是( )
A.炒菜用过的铁锅,放置一段时间常出现红棕色斑迹
B.用煤气灶燃烧沼气[主要成分为甲烷(CH4)]为炒菜提供热量
C.牛奶久置变质腐败
D.用醋酸除去水垢[主要成分是CaCO3、Mg(OH)2]
D
解析 Fe被氧化生成铁锈,发生氧化还原反应,A项错误;CH4燃烧生成二氧化碳和水,C、O元素的化合价发生变化,属于氧化还原反应,B项错误;牛奶久置变质腐败,是被空气中的氧气氧化,有元素的化合价发生变化,属于氧化还原反应,C项错误;用醋酸除去水垢,属于复分解反应,不属于氧化还原反应,D项正确。
2.单宁是葡萄酒中所含有的两种酚类化合物其中的一种物质,单宁有独特的抗
氧化性,能有效抵御生物氧化作用,它还有清除活性氧的功能。
下列对于单宁在保护葡萄酒过程中的有关说法正确的是( )
A.单宁作还原剂
B.单宁作氧化剂
C.单宁被还原
D.单宁中某元素化合价降低
解析 单宁有独特的抗氧化性,能有效抵御生物氧化作用,故单宁具有还原性,能作还原剂。
A
3.下列变化属于氧化反应的是( )
B
4.吸进人体的氧有2%转化为氧化性极强的活性氧(O3),这些活性氧加速人体衰老,被称为“生命杀手”,科学家试用Na2SeO3消除人体内的活性氧,则Na2SeO3的作用是( )
B
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.以上均不是
解析 人体内的“活性氧”中氧元素的化合价为零价,Na2SeO3消除“活性氧”,即Na2SeO3中元素化合价升高,被氧化,则Na2SeO3的作用是作还原剂。
5.(2021·山东泰安高一期中)下列叙述中正确的是( )
A.含最高价元素的化合物,一定具有强氧化性
B.氧化剂在同一反应中既可以是反应物,也可以是生成物
C.失电子越多,还原性越强,得电子越多,氧化性越强
D.化学反应中,某元素由化合态变为游离态,此元素可能被氧化,也可能被
还原
D
解析 二氧化碳为碳的最高价氧化物,但其氧化性较弱,A错误;氧化剂一定是反应物,B错误;失(得)电子越容易,还原性(氧化性)越强,与失去(得到)电子数目多少无关,C错误;化学反应中,某元素由化合态变为游离态,此元素化合价可能升高也可能降低,即此元素可能被氧化,也可能被还原,D正确。
6.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4===3N2+4H2O,
反应温度可高达2 700 ℃,对于该反应,下列说法正确的是( )
A.该反应属于置换反应
B.N2H4是氧化剂,被氧化
C.N2O4是还原剂,发生氧化反应
D.N2既是氧化产物又是还原产物
D
解析 题给反应的反应物中无单质,不属于置换反应;题给反应实际上是不同价态的氮元素之间发生的反应,N2H4是还原剂,被氧化,发生氧化反应,N2O4是氧化剂,被还原,发生还原反应,N2既是氧化产物又是还原产物。
7.下列变化中只有通过还原反应才能实现的是 ( )
解析 发生还原反应时,元素的化合价降低。B中锰元素化合价由+2价升高为+7价,C中氯元素的化合价由-1价升高为0价,D中元素的化合价无变化。
A
B
解析 NaN3中N化合价升高,是还原剂,KNO3中N化合价降低,是氧化剂,则氧化剂与还原剂的物质的量之比为1∶5,故A错误;反应中只有N的化合价变化,则N2既是氧化产物也是还原产物,故B正确;NaN3中N化合价升高,是还原剂,故C错误;KNO3中N化合价降低,被还原,发生还原反应,故D错误。
9.O2F2可以发生反应:H2S+4O2F2===SF6+2HF+4O2。下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成1分子HF,则转移8个电子
D.还原剂与氧化剂的微粒个数之比为1∶4
D
解析 O元素由+1价降低到0价,化合价降低,获得电子,被还原,所以氧气是还原产物,故A错误;在反应中,O2F2中的O元素化合价降低,获得电子,所以该物质是氧化剂,而硫化氢中的S元素的化合价是-2价,反应后升高到+6价,所以H2S是还原剂,故B错误;S元素化合价由-2价升高到+6价,O元素由+1价降低到0价,转移8个电子,若生成1分子HF,则转移4个电子,故C错误;由方程式可知,还原剂(H2S)和氧化剂(O2F2)的微粒个数的比是1∶4,故D正确。
10.(2021·黑龙江绥化一中高一期中)《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的“发烛”就是原始的火柴。已知K2Cr2O7用于工业中制造火柴头。K2Cr2O7+HCl(浓)→KCl+CrCl3+Cl2↑+H2O(未配平)
(1)(填元素名称)____________元素被氧化 (填化学式,下同),____________是氧化剂,____________发生氧化反应。
答案 (1)氯 K2Cr2O7 HCl
解析 (1)已知反应中,氯元素化合价升高发生氧化反应,氯元素被氧化,K2Cr2O7中Cr元素化合价降低,K2Cr2O7是氧化剂,HCl中氯元素化合价升高, HCl发生氧化反应。
(2)参加反应的HCl,表现了____________和____________。(填“还原性”“氧化性”或“酸性”)
(3)该反应中每生成6个Cl2转移电子个数为____________个。
(4)配平上述反应,并用双线桥法表示出该反应中电子转移的方向和数目____________。
D
解析 在反应中,NaNO2中N元素由+3价降低为0价,发生还原反应, NH4Cl中N元素由-3价升高为0价,发生氧化反应,根据化合价升高和降低的总数相等,可知生成1 mol N2时转移3 mol e-,NH4Cl中N被氧化,被氧化和被还原的元素均为N。
12.(2021·河北张家口高一月考)ClO2作为一种广谱型的消毒剂,将逐渐取代Cl2成为自来水的消毒剂。可用NaClO3和H2O2溶液在酸性条件下制备,反应的化学方程式为2NaClO3+H2O2+H2SO4===2ClO2↑+Na2SO4+2H2O+O2↑,下列说法不正确的是( )
A.1 mol NaClO3参加反应,转移1 mol电子
B.NaClO3在反应中被氧化
C.H2O2的还原性强于ClO2
D.该反应的氧化产物是O2
B
解析 Cl元素化合价由反应前NaClO3中的+5价变为反应后ClO2中的+4价,化合价降低,得到电子,则1 mol NaClO3参加反应,转移1 mol电子,A正确;NaClO3中Cl元素化合价降低,得到电子,被还原为ClO2,NaClO3作氧化剂,B错误;根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,在该反应中,NaClO3作氧化剂,得到电子被还原为ClO2,H2O2作还原剂,失去电子被氧化为O2,所以H2O2的还原性强于ClO2,C正确;该反应中,H2O2作还原剂,氧化产物为O2,D正确。
13.NaClO2可用作造纸的漂白剂,它可由反应H2O2+2ClO2+2NaOH===2NaClO2
+2H2O+O2制得,下列关于该反应的说法正确的是( )
A.H2O2是氧化剂,H2O2中的氧元素被还原
B.ClO2中氧元素化合价升高,被氧化
C.ClO2中的氯元素被氧化
D.ClO2是氧化剂,H2O2是还原剂
D
解析 A项,在反应中,H2O2中氧元素的化合价从-1价升高到0价,H2O2作还原剂,错误;B项,ClO2中氧元素的化合价没有变化,错误;C项,ClO2中的氯元素化合价从+4价降低到+3价,氯元素被还原,错误。
14.天然气中含有硫化氢(H2S),H2S燃烧时会产生有毒气体SO2,如何高效脱去天然气中的硫化氢(以下简称脱硫)是化学工作者始终关注的问题,某脱硫新工艺原理如下图所示,回答有关问题。
(1)过程ii反应的化学方程式可表示为aFeSO4+O2+2H2SO4===bFe2(SO4)3+2H2O。则a=____________,发生还原反应的物质是____________,氧化产物是____________,该反应____________(填“是”或“不是”)四种基本反应类型中的一种。
答案 (1)4 O2 Fe2(SO4)3 不是
解析 (1)根据原子守恒可知:a=2b,a+2=3b,解得b=2、a=4。反应中铁元素的化合价升高、氧元素的化合价降低,故O2发生还原反应,Fe2(SO4)3是氧化产物,该反应中三种反应物生成两种产物,与四种基本反应类型中的任何一种均不相符。
(2)写出过程i中H2S发生反应的化学方程式并用双线桥表示出电子转移方向与数目:_____________________________________________________,
该反应中发生还原反应的物质是_________________________________。
答案
解析 (2)由图知,过程i中明确给出的反应物是Fe2(SO4)3、H2S,生成物有FeSO4、S,可先写出H2S+Fe2(SO4)3―→2FeSO4+S↓,然后根据质量守恒可知生成物中还有H2SO4。
15.(2021·黑龙江绥化一中高一期中)已知HNO2是一种弱酸,向NaNO2中加入强酸可生成HNO2。HNO2不稳定,易分解成NO和NO2气体。HNO2是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。NaNO2晶体外观和食盐相似,又有咸味,因而容易误食引起中毒。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可以服用维生素C解毒,维生素C在解毒的过程中表现出____________ (填“氧化”或“还原”)性。
答案 (1)还原
解析 (1)根据题意,维生素C在解毒的过程中表现出还原性。
(2)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为____________________________________。
(3)已知NaNO2能发生反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。鉴别NaNO2和NaCl,可选用的物质有:①KI-淀粉试纸;②水;③淀粉;④白酒;⑤食醋,你认为必须选用的物质有____________(填序号)。
(4)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中能使NaNO2转化为不引起二次污染的N2的是____________(填字母)。
A.NaCl B.NH4Cl
C.HNO3 D.浓H2SO4
(5)请配平以下化学方程式Al+NaNO3+NaOH——NaAlO2+N2↑+H2O
答案 (4)B
(5)10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O
Thanks!
本课时内容结束
