专题4 第二单元 硫及其化合物的相互转化(共87张PPT)
文档属性
| 名称 | 专题4 第二单元 硫及其化合物的相互转化(共87张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 00:00:00 | ||
图片预览










文档简介
(共87张PPT)
第二单元
硫及其化合物的相互转化
【课程标准要求】
1.从物质类别和元素化合价的角度,利用不同类型化学反应知识,研究不同价态含硫物质的转化,能设计物质转化的方案。
2.能从氧化还原反应的视角研究物质的转化,认识同一元素不同化合物之间转化的一般规律。
3.学会氧化还原反应的配平原则和基本方法,建立配平氧化还原反应方程式的思维模型。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
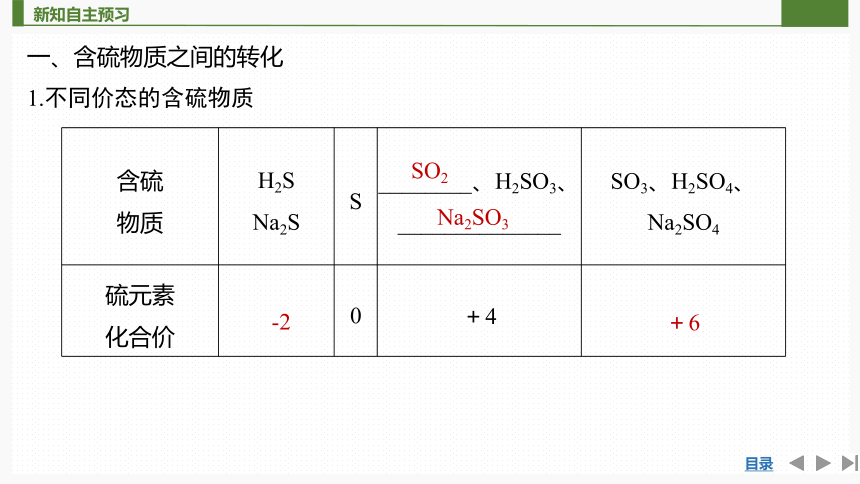
一、含硫物质之间的转化
1.不同价态的含硫物质
含硫 物质 H2S Na2S S ________、H2SO3、______________ SO3、H2SO4、
Na2SO4
硫元素 化合价 0 +4
SO2
Na2SO3
-2
+6
2.通过氧化还原反应实现含不同价态硫元素的物质间的转化。
黑色
Hg+S===HgS
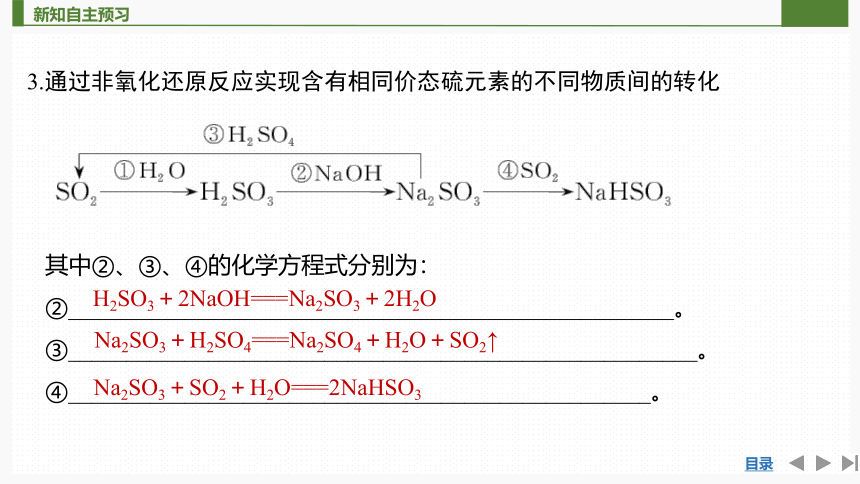
3.通过非氧化还原反应实现含有相同价态硫元素的不同物质间的转化
其中②、③、④的化学方程式分别为:
②____________________________________________________。
③______________________________________________________。
④__________________________________________________。
H2SO3+2NaOH===Na2SO3+2H2O
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
Na2SO3+SO2+H2O===2NaHSO3
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)含硫化合物间的转化,既可以通过氧化还原反应实现,也可以通过非氧化还原反应实现( )
(2)S能氧化Fe,使Fe生成+3价铁的化合物( )
(3)向H2S溶液中通入空气,溶液变浑浊,是因为发生了氧化还原反应( )
(4)浓硫酸具有强氧化性,SO2具有还原性,所以浓硫酸不能干燥SO2( )
(5)因为Cu(或Fe)与Cl2反应生成高价态的氯化物,而Cu(或Fe)与S反应生成低价态的硫化物,所以氧化性:Cl2>S( )
√
×
√
×
√
二、氧化还原反应方程式配平的步骤
1.氧化还原反应方程式配平的依据
____________总数相等,电子转移守恒。
2.氧化还原反应方程式配平的基本步骤
(1)标变价:写出反应物、生成物的化学式。在化学方程式中标出化合价发生
变化的元素的化合价。
化合价升降
(2)列得失:根据化合价的变化标出电子转移的方向和数目。
(3)求总数:使__________的总数相等。
得失电子
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)氧化还原反应中元素化合价升高的数值和元素化合价降低的数值相等( )
(2)氧化还原反应中氧化剂失电子总数等于还原剂得电子总数( )
(3)配平的氧化还原反应方程式中各种元素原子数守恒( )
×
×
√
二、氧化还原反应方程式的配平与计算
一、含硫物质之间的相互转化
一、含硫物质之间的相互转化
1.硫及其化合物的转化关系
2.含硫化合物的价态变化规律
3.相邻价态的微粒不发生氧化还原反应
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
4.含硫物质的连续氧化
1.下列变化,需要加入还原剂才能实现的是( )
解析 还原剂失去电子被氧化,即选项中所含元素化合价降低的过程需要加入还原剂。
A
2.下列化合物中,不能由组成该化合物的两种元素的单质直接化合而成的是( )
A.Cu2S B.SO3
C.FeS D.H2S
解析 由于S的氧化性相对O2和Cl2较弱,只能将变价金属氧化成较低价态,故S与Cu、Fe化合,分别生成Cu2S、FeS,S与O2直接化合只能生成SO2,S与H2化合生成H2S。
B
3.硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,乙溶液变成丙。在丙里加入Na2S生成气体丁,把丁通入乙得到沉淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是( )
A.SO3、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、SO2、SO3
C.SO3、H2SO4、H2SO3、H2S、S
D.SO2、H2SO3、H2SO4、H2S、S
D
二、氧化还原反应方程式的配平与计算
1.氧化还原反应方程式的配平
(1)配平三原则
(2)配平五步骤
2.氧化还原反应中的电子守恒法计算
(1)电子得失守恒
反应中氧化剂得到的电子总数与还原剂失去的电子总数相等,即得失电子守恒。
(2)计算思维流程
①找物质:分析反应前后化合价变化的元素,确定氧化剂、还原剂及相应的还原产物、氧化产物。
②定得失:确定一个原子(或离子)的得失电子数(注意化学式中原子的个数)。
③列等式:根据已知化学计量数及得失电子守恒列出等式,变价原子个数(氧化剂)×化合价变化值(高价-低价)=变价原子个数(还原剂)×化合价变化值(高价-低价)。
对于多步连续进行的氧化还原反应,若中间各步反应过程中无损耗,可直接根据得失电子守恒建立起始反应物和最终生成物的关系,快速列式求解。
4.把图b的碎纸片补充到图a中,可得到一个完整的离子方程式。下列有关该离
子方程式的说法正确的是( )
A.配平后的化学计量数依次为3、1、2、6、3
B.若有1个S原子被氧化,则生成2个S2-
C.氧化剂与还原剂的原子数目之比为1∶2
D.3个S原子参加反应有8个电子发生转移
B
A
6.配平下列氧化还原反应方程式。
答案 ①4 1 1 1 2
②2 10 8 1 2 5 8
答案 ①3 6 2 1 3 ②3 6 5 1 3
答案 ①2 5 6H+ 2 5 8
②2 1 2 2 1 4H+
微专题6 新情景氧化还原反应离子方程式的书写
1.新情景氧化还原反应方程式配平的基本原则
(1)得失电子守恒。氧化还原反应中,氧化剂得电子总数等于还原剂失电子
总数。表现为化合价有升必有降,升降总值相等。
(2)质量守恒定律。反应前后原子的种类和数目不变。
(3)电荷守恒。离子反应方程式两侧阴、阳离子所带电荷数相等。
2.新情景氧化还原反应型离子方程式的书写流程
(1)确定参加反应的粒子(离子):根据题中情景信息,通过氧化还原反应中元素价态的变化,找出发生氧化还原反应的微粒。
(2)正确预测产物:依据氧化还原反应价态规律确定氧化产物和还原产物。
(3)配平变价微粒:根据信息提示或确定给出的生成物信息判断并写出“氧化剂+还原剂―→还原产物+氧化产物”的离子方程式主干形式,根据化合价升高总数等于降低的总数确定相应的化学计量数。
(4)确定缺项物质:根据溶液酸碱性及电荷守恒确定缺项物质是 H2O、OH-还是 H+。
(5)整体元素配平:根据原子守恒并通过观察法确定所有物质的化学计量数。
(6)“三查”检验验证离子方程式正误:检查物质拆分是否正确,电荷、质量是否守恒。
[典例] KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应,生成Mn2+和CO2,写
出该反应的离子方程式______________________________________________。
解析 第1步:依题意,锰元素的化合价降低,故KMnO4是氧化剂,Mn2+是还原产物;碳元素的化合价升高,故Na2C2O4(碳元素化合价为+3价)是还原剂,CO2是氧化产物。
[解题指导] 离子方程式配平时添补缺项的方法
根据写出的离子方程式,观察缺少的项,缺少的一般是H+、OH-或H2O,需要根据溶液环境判断。
补项 缺项
条件 缺H或 多O 少O或 多H 禁sf止
酸性条件下 补H+ 补H2O 出现OH-
碱性条件下 补H2O 补OH- 出现H+
C
C
D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶
体能吸附水中的悬浮杂质
1.下列变化需要加入还原剂才能实现的是( )
A.MnO2―→Mn2+ B.CO―→CO2
C.Cu―→Cu2+ D.Cl2―→Cl-
解析 A项,MnO2中Mn元素化合价降低,MnO2为氧化剂,需加入还原剂才能实现,符合题意;B中CO和C中Cu在反应中化合价升高,作为还原剂,加入氧化剂才能实现,不符合题意;D中Cl2转变为Cl-可加入氢氧化钠,不一定要加入还原剂,不符合题意。
A
2.下列生成SO2的反应中,反应物中的含硫物质被氧化的是( )
A.Cu与浓H2SO4共热
B.红热的木炭与浓H2SO4反应
C.Na2SO3与浓H2SO4反应
D.S在空气中燃烧
解析 只有D项硫元素的化合价升高,被氧化。
D
3.根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上常将NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得ClO2,则反应后Na2SO3转化为( )
A.Na2SO4 B.SO2
C.S D.Na2S
解析 NaClO3中Cl为+5价,ClO2中Cl为+4价,Cl元素的化合价降低,则一定有元素的化合价升高。Na2SO3中S为+4价,S可升高至+6价,则产物为Na2SO4。
A
4.对于反应O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是( )
A.O2和H2O是还原产物
B.该反应能说明O2的氧化性大于I2
C.氧化产物和还原产物的物质的量之比为1∶1
D.配平后的化学方程式为2O3+2I-+4H+===I2+2O2+H2O
解析 此反应中氧化剂是O3,还原剂是I-,氧化产物是I2,还原产物是H2O;由题意可知氧化性O3>I2,不能说明氧化性O2>I2;D中电荷不守恒,应为O3+2I-+2H+===I2+O2+H2O。
C
5.亚硫酸钠中有+4价的硫,它既有氧化性又有还原性。现有试剂:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液、氨水。
(1)要证明亚硫酸钠具有还原性,应选用的试剂有____________,看到的现象是________________________,反应的离子方程式是____________。
(2)要证明亚硫酸钠具有氧化性,应选用的试剂有____________,看到的现象是______________________________________________,反应的离子方程式是__________________。
B
解析 (1)要证明Na2SO3具有还原性,应选择有氧化性的试剂,所给试剂中只有溴水合适,反应过程中溴水褪色。(2)要证明亚硫酸钠具有氧化性,应选择有还原性的试剂,所给试剂中完成实验需选用稀硫酸、硫化钠溶液,反应过程中有单质硫生成,溶液变浑浊。
1.下列物质中的硫元素,既有氧化性又有还原性的是( )
A.H2S B.SO2
C.SO3 D.H2SO4
解析 SO2中S的化合价为+4价,处于中间价态,既有氧化性又有还原性。
B
2.下列转化不能一步实现的是( )
A.S→H2S B.S→SO3
C.H2SO4→SO2 D.Na2SO3→SO2
解析 S能一步生成SO2,不能直接生成SO3,故选B。
B
3.常温下,单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温
度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的
是( )
A.S8转化为S6、S4、S2属于物理变化
B.不论哪种硫分子,完全燃烧时都生成SO2
C.S2、S4、S6、S8物理性质相同
D.把硫单质在空气中加热到750 ℃即得S2
解析 硫单质之间的转化为化学变化,完全燃烧的产物为SO2,硫单质在空
气中加热会燃烧生成SO2,不可能转化成S2。
B
解析 在该反应中,一部分S化合价降低生成了Na2S,表现氧化性,一部分S化合价升高生成了Na2SO3,表现还原性。
D
D
C
C
8.如图是硫元素价态与含硫元素物质类别的二维坐标图,其中b、c、d、e分子
中只含有一个S原子,下列说法错误的是( )
A.物质j和物质e反应生成物质a
B.物质b既有氧化性又有还原性
C.物质d的浓溶液具有脱水性
D.物质f可以与物质q发生氧化还原反应
D
9.单质X与浓硫酸共热,反应中X与H2SO4的物质的量之比为1∶2,则X元素在
生成物中的化合价可能为( )
①+1 ②+2 ③+3 ④+4
A.②④ B.③④
C.①③ D.②③
A
10.能实现下列物质间直接转化的元素是( )
解析 镁、铜和铁对应的氧化物分别为氧化镁、氧化铜、氧化铁,均不能直接和水反应。
B
11.在学习了硫的转化后,某学生绘制了如图转化关系。
(1)写出指定物质的化学式:A________,B________,D________。
(2)写出“H2SO4→C”的化学方程式: __________________(写一个即可)。
(3)写出A与SO2相互转化的化学方程式:______________________。
(4)写出一个由SO2直接生成H2SO4的化学方程式:______________________。
12.某小组同学设计实验实现几种价态硫元素的转化。
Ⅰ:从以下试剂中选择合适的试剂实现S(+6)→S(+4)的转化。
试剂清单:①浓H2SO4 ②稀H2SO4
③酸性KMnO4溶液 ④Na2SO3溶液
⑤Cu ⑥品红
(1)写出实现转化的化学方程式_____________________________________。
(2)设计实验,证明实现了该转化(写出操作和现象)_ _____________________。
D
C
15.利用元素的化合价推测物质的性质是化学研究的重要手段。下图是硫元素
的常见化合价与部分物质类别的对应关系:
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的氧化物为____________(填化学式)。
(2)将X与Y混合可生成淡黄色固体,该反应的化学方程式为_________________________。
答案 (1)SO2
(2)2H2S+SO2===3S↓+2H2O
(3)Z的浓溶液与碳在一定条件下可以发生反应,体现了Z的____________性。
(4)写出硫与浓硫酸在加热条件下反应的化学方程式:____________________
__________________________________________。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方法理论上可行的是____________(填字母)。
a.Na2SO3+S b.Na2S+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)治理含CO、SO2的烟道气,以Fe2O3作催化剂,将CO、SO2在380 ℃时转化为S和一种无毒气体,写出该治理烟道气反应的化学方程式:_______________________________________________________________。
解析 根据图示:X为H2S, Y为SO2,Z为H2SO4。
(5)Na2S2O3中硫元素为+2价,由化合价升降变化规律可知,一种物质中硫元素化合价高于+2,另一种物质中硫元素化合价低于+2,选a。
Thanks!
本单元内容结束
第二单元
硫及其化合物的相互转化
【课程标准要求】
1.从物质类别和元素化合价的角度,利用不同类型化学反应知识,研究不同价态含硫物质的转化,能设计物质转化的方案。
2.能从氧化还原反应的视角研究物质的转化,认识同一元素不同化合物之间转化的一般规律。
3.学会氧化还原反应的配平原则和基本方法,建立配平氧化还原反应方程式的思维模型。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、含硫物质之间的转化
1.不同价态的含硫物质
含硫 物质 H2S Na2S S ________、H2SO3、______________ SO3、H2SO4、
Na2SO4
硫元素 化合价 0 +4
SO2
Na2SO3
-2
+6
2.通过氧化还原反应实现含不同价态硫元素的物质间的转化。
黑色
Hg+S===HgS
3.通过非氧化还原反应实现含有相同价态硫元素的不同物质间的转化
其中②、③、④的化学方程式分别为:
②____________________________________________________。
③______________________________________________________。
④__________________________________________________。
H2SO3+2NaOH===Na2SO3+2H2O
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
Na2SO3+SO2+H2O===2NaHSO3
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)含硫化合物间的转化,既可以通过氧化还原反应实现,也可以通过非氧化还原反应实现( )
(2)S能氧化Fe,使Fe生成+3价铁的化合物( )
(3)向H2S溶液中通入空气,溶液变浑浊,是因为发生了氧化还原反应( )
(4)浓硫酸具有强氧化性,SO2具有还原性,所以浓硫酸不能干燥SO2( )
(5)因为Cu(或Fe)与Cl2反应生成高价态的氯化物,而Cu(或Fe)与S反应生成低价态的硫化物,所以氧化性:Cl2>S( )
√
×
√
×
√
二、氧化还原反应方程式配平的步骤
1.氧化还原反应方程式配平的依据
____________总数相等,电子转移守恒。
2.氧化还原反应方程式配平的基本步骤
(1)标变价:写出反应物、生成物的化学式。在化学方程式中标出化合价发生
变化的元素的化合价。
化合价升降
(2)列得失:根据化合价的变化标出电子转移的方向和数目。
(3)求总数:使__________的总数相等。
得失电子
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)氧化还原反应中元素化合价升高的数值和元素化合价降低的数值相等( )
(2)氧化还原反应中氧化剂失电子总数等于还原剂得电子总数( )
(3)配平的氧化还原反应方程式中各种元素原子数守恒( )
×
×
√
二、氧化还原反应方程式的配平与计算
一、含硫物质之间的相互转化
一、含硫物质之间的相互转化
1.硫及其化合物的转化关系
2.含硫化合物的价态变化规律
3.相邻价态的微粒不发生氧化还原反应
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
4.含硫物质的连续氧化
1.下列变化,需要加入还原剂才能实现的是( )
解析 还原剂失去电子被氧化,即选项中所含元素化合价降低的过程需要加入还原剂。
A
2.下列化合物中,不能由组成该化合物的两种元素的单质直接化合而成的是( )
A.Cu2S B.SO3
C.FeS D.H2S
解析 由于S的氧化性相对O2和Cl2较弱,只能将变价金属氧化成较低价态,故S与Cu、Fe化合,分别生成Cu2S、FeS,S与O2直接化合只能生成SO2,S与H2化合生成H2S。
B
3.硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,乙溶液变成丙。在丙里加入Na2S生成气体丁,把丁通入乙得到沉淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是( )
A.SO3、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、SO2、SO3
C.SO3、H2SO4、H2SO3、H2S、S
D.SO2、H2SO3、H2SO4、H2S、S
D
二、氧化还原反应方程式的配平与计算
1.氧化还原反应方程式的配平
(1)配平三原则
(2)配平五步骤
2.氧化还原反应中的电子守恒法计算
(1)电子得失守恒
反应中氧化剂得到的电子总数与还原剂失去的电子总数相等,即得失电子守恒。
(2)计算思维流程
①找物质:分析反应前后化合价变化的元素,确定氧化剂、还原剂及相应的还原产物、氧化产物。
②定得失:确定一个原子(或离子)的得失电子数(注意化学式中原子的个数)。
③列等式:根据已知化学计量数及得失电子守恒列出等式,变价原子个数(氧化剂)×化合价变化值(高价-低价)=变价原子个数(还原剂)×化合价变化值(高价-低价)。
对于多步连续进行的氧化还原反应,若中间各步反应过程中无损耗,可直接根据得失电子守恒建立起始反应物和最终生成物的关系,快速列式求解。
4.把图b的碎纸片补充到图a中,可得到一个完整的离子方程式。下列有关该离
子方程式的说法正确的是( )
A.配平后的化学计量数依次为3、1、2、6、3
B.若有1个S原子被氧化,则生成2个S2-
C.氧化剂与还原剂的原子数目之比为1∶2
D.3个S原子参加反应有8个电子发生转移
B
A
6.配平下列氧化还原反应方程式。
答案 ①4 1 1 1 2
②2 10 8 1 2 5 8
答案 ①3 6 2 1 3 ②3 6 5 1 3
答案 ①2 5 6H+ 2 5 8
②2 1 2 2 1 4H+
微专题6 新情景氧化还原反应离子方程式的书写
1.新情景氧化还原反应方程式配平的基本原则
(1)得失电子守恒。氧化还原反应中,氧化剂得电子总数等于还原剂失电子
总数。表现为化合价有升必有降,升降总值相等。
(2)质量守恒定律。反应前后原子的种类和数目不变。
(3)电荷守恒。离子反应方程式两侧阴、阳离子所带电荷数相等。
2.新情景氧化还原反应型离子方程式的书写流程
(1)确定参加反应的粒子(离子):根据题中情景信息,通过氧化还原反应中元素价态的变化,找出发生氧化还原反应的微粒。
(2)正确预测产物:依据氧化还原反应价态规律确定氧化产物和还原产物。
(3)配平变价微粒:根据信息提示或确定给出的生成物信息判断并写出“氧化剂+还原剂―→还原产物+氧化产物”的离子方程式主干形式,根据化合价升高总数等于降低的总数确定相应的化学计量数。
(4)确定缺项物质:根据溶液酸碱性及电荷守恒确定缺项物质是 H2O、OH-还是 H+。
(5)整体元素配平:根据原子守恒并通过观察法确定所有物质的化学计量数。
(6)“三查”检验验证离子方程式正误:检查物质拆分是否正确,电荷、质量是否守恒。
[典例] KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应,生成Mn2+和CO2,写
出该反应的离子方程式______________________________________________。
解析 第1步:依题意,锰元素的化合价降低,故KMnO4是氧化剂,Mn2+是还原产物;碳元素的化合价升高,故Na2C2O4(碳元素化合价为+3价)是还原剂,CO2是氧化产物。
[解题指导] 离子方程式配平时添补缺项的方法
根据写出的离子方程式,观察缺少的项,缺少的一般是H+、OH-或H2O,需要根据溶液环境判断。
补项 缺项
条件 缺H或 多O 少O或 多H 禁sf止
酸性条件下 补H+ 补H2O 出现OH-
碱性条件下 补H2O 补OH- 出现H+
C
C
D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶
体能吸附水中的悬浮杂质
1.下列变化需要加入还原剂才能实现的是( )
A.MnO2―→Mn2+ B.CO―→CO2
C.Cu―→Cu2+ D.Cl2―→Cl-
解析 A项,MnO2中Mn元素化合价降低,MnO2为氧化剂,需加入还原剂才能实现,符合题意;B中CO和C中Cu在反应中化合价升高,作为还原剂,加入氧化剂才能实现,不符合题意;D中Cl2转变为Cl-可加入氢氧化钠,不一定要加入还原剂,不符合题意。
A
2.下列生成SO2的反应中,反应物中的含硫物质被氧化的是( )
A.Cu与浓H2SO4共热
B.红热的木炭与浓H2SO4反应
C.Na2SO3与浓H2SO4反应
D.S在空气中燃烧
解析 只有D项硫元素的化合价升高,被氧化。
D
3.根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上常将NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得ClO2,则反应后Na2SO3转化为( )
A.Na2SO4 B.SO2
C.S D.Na2S
解析 NaClO3中Cl为+5价,ClO2中Cl为+4价,Cl元素的化合价降低,则一定有元素的化合价升高。Na2SO3中S为+4价,S可升高至+6价,则产物为Na2SO4。
A
4.对于反应O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是( )
A.O2和H2O是还原产物
B.该反应能说明O2的氧化性大于I2
C.氧化产物和还原产物的物质的量之比为1∶1
D.配平后的化学方程式为2O3+2I-+4H+===I2+2O2+H2O
解析 此反应中氧化剂是O3,还原剂是I-,氧化产物是I2,还原产物是H2O;由题意可知氧化性O3>I2,不能说明氧化性O2>I2;D中电荷不守恒,应为O3+2I-+2H+===I2+O2+H2O。
C
5.亚硫酸钠中有+4价的硫,它既有氧化性又有还原性。现有试剂:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液、氨水。
(1)要证明亚硫酸钠具有还原性,应选用的试剂有____________,看到的现象是________________________,反应的离子方程式是____________。
(2)要证明亚硫酸钠具有氧化性,应选用的试剂有____________,看到的现象是______________________________________________,反应的离子方程式是__________________。
B
解析 (1)要证明Na2SO3具有还原性,应选择有氧化性的试剂,所给试剂中只有溴水合适,反应过程中溴水褪色。(2)要证明亚硫酸钠具有氧化性,应选择有还原性的试剂,所给试剂中完成实验需选用稀硫酸、硫化钠溶液,反应过程中有单质硫生成,溶液变浑浊。
1.下列物质中的硫元素,既有氧化性又有还原性的是( )
A.H2S B.SO2
C.SO3 D.H2SO4
解析 SO2中S的化合价为+4价,处于中间价态,既有氧化性又有还原性。
B
2.下列转化不能一步实现的是( )
A.S→H2S B.S→SO3
C.H2SO4→SO2 D.Na2SO3→SO2
解析 S能一步生成SO2,不能直接生成SO3,故选B。
B
3.常温下,单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温
度达到750 ℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中正确的
是( )
A.S8转化为S6、S4、S2属于物理变化
B.不论哪种硫分子,完全燃烧时都生成SO2
C.S2、S4、S6、S8物理性质相同
D.把硫单质在空气中加热到750 ℃即得S2
解析 硫单质之间的转化为化学变化,完全燃烧的产物为SO2,硫单质在空
气中加热会燃烧生成SO2,不可能转化成S2。
B
解析 在该反应中,一部分S化合价降低生成了Na2S,表现氧化性,一部分S化合价升高生成了Na2SO3,表现还原性。
D
D
C
C
8.如图是硫元素价态与含硫元素物质类别的二维坐标图,其中b、c、d、e分子
中只含有一个S原子,下列说法错误的是( )
A.物质j和物质e反应生成物质a
B.物质b既有氧化性又有还原性
C.物质d的浓溶液具有脱水性
D.物质f可以与物质q发生氧化还原反应
D
9.单质X与浓硫酸共热,反应中X与H2SO4的物质的量之比为1∶2,则X元素在
生成物中的化合价可能为( )
①+1 ②+2 ③+3 ④+4
A.②④ B.③④
C.①③ D.②③
A
10.能实现下列物质间直接转化的元素是( )
解析 镁、铜和铁对应的氧化物分别为氧化镁、氧化铜、氧化铁,均不能直接和水反应。
B
11.在学习了硫的转化后,某学生绘制了如图转化关系。
(1)写出指定物质的化学式:A________,B________,D________。
(2)写出“H2SO4→C”的化学方程式: __________________(写一个即可)。
(3)写出A与SO2相互转化的化学方程式:______________________。
(4)写出一个由SO2直接生成H2SO4的化学方程式:______________________。
12.某小组同学设计实验实现几种价态硫元素的转化。
Ⅰ:从以下试剂中选择合适的试剂实现S(+6)→S(+4)的转化。
试剂清单:①浓H2SO4 ②稀H2SO4
③酸性KMnO4溶液 ④Na2SO3溶液
⑤Cu ⑥品红
(1)写出实现转化的化学方程式_____________________________________。
(2)设计实验,证明实现了该转化(写出操作和现象)_ _____________________。
D
C
15.利用元素的化合价推测物质的性质是化学研究的重要手段。下图是硫元素
的常见化合价与部分物质类别的对应关系:
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的氧化物为____________(填化学式)。
(2)将X与Y混合可生成淡黄色固体,该反应的化学方程式为_________________________。
答案 (1)SO2
(2)2H2S+SO2===3S↓+2H2O
(3)Z的浓溶液与碳在一定条件下可以发生反应,体现了Z的____________性。
(4)写出硫与浓硫酸在加热条件下反应的化学方程式:____________________
__________________________________________。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方法理论上可行的是____________(填字母)。
a.Na2SO3+S b.Na2S+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)治理含CO、SO2的烟道气,以Fe2O3作催化剂,将CO、SO2在380 ℃时转化为S和一种无毒气体,写出该治理烟道气反应的化学方程式:_______________________________________________________________。
解析 根据图示:X为H2S, Y为SO2,Z为H2SO4。
(5)Na2S2O3中硫元素为+2价,由化合价升降变化规律可知,一种物质中硫元素化合价高于+2,另一种物质中硫元素化合价低于+2,选a。
Thanks!
本单元内容结束
