专题4 第一单元 含硫化合物的性质 第二课时 硫酸的工业制备 浓硫酸的性质(共81张PPT)
文档属性
| 名称 | 专题4 第一单元 含硫化合物的性质 第二课时 硫酸的工业制备 浓硫酸的性质(共81张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 20:50:41 | ||
图片预览











文档简介
(共81张PPT)
第二课时
硫酸的工业制备 浓硫酸的性质
【课程标准要求】
1.知道接触法制硫酸的化学原理。
2.记住浓H2SO4吸水性、脱水性的区别及应用。
3.能理解浓H2SO4具有强氧化性的原因。
4.认识化学工业与人类生活、社会发展的关系,能辨证地分析化学品的影响。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
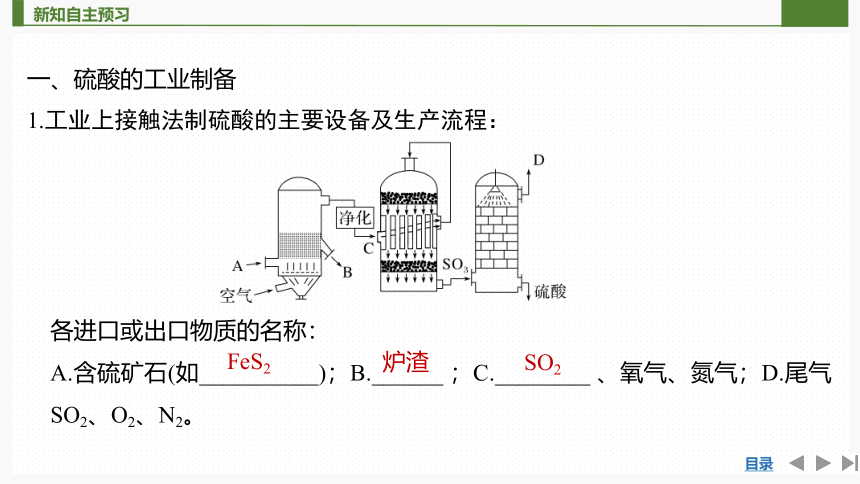
一、硫酸的工业制备
1.工业上接触法制硫酸的主要设备及生产流程:
各进口或出口物质的名称:
A.含硫矿石(如__________);B.______ ;C.________ 、氧气、氮气;D.尾气
SO2、O2、N2。
FeS2
炉渣
SO2
2.接触法制硫酸“三个阶段”:
FeS2
沸腾炉
O2
接触室
98.3%浓硫酸
吸收塔
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)在接触法制硫酸中,矿石粉碎的目的是为了增大反应物的接触面积,使反应更充分( )
(2)在吸收塔内,是用浓硫酸吸收SO3而不是用水,目的是为了防止形成酸雾,腐蚀设备( )
(3)SO2氧化为SO3时需要使用催化剂,可以使SO2全部转化为SO3( )
(4)从沸腾炉出来的SO2气体直接进入接触室,无需除杂( )
√
√
×
×
二、硫酸的性质和用途
1.稀H2SO4的化学性质
具有酸的通性(完成下列离子方程式)
(1)使紫色石蕊试液变____。
(2)与活泼金属反应(如Zn):____________________________________。
(3)与碱性氧化物反应(如CuO):______________________________________。
(4)与碱反应(如NaOH):__________________________。
(5)与某些盐反应(如BaCl2): 。
红
Zn+2H+===Zn2++H2↑
CuO+2H+===Cu2++H2O
OH-+H+===H2O
2.浓硫酸的物理性质
实验室常用的浓H2SO4质量分数为98.3%,为无色油状液体,密度大
(1.84 g· cm-3),沸点高,难挥发,易溶于水,溶于水时放出大量的热,所以稀释浓H2SO4时,应将浓H2SO4沿器壁慢慢注入水中并不断搅拌。
3.浓硫酸的特性
(1)吸水性
浓硫酸可吸收空气或其他气体中的________、混在固体中的湿存水、结晶水合物中的结晶水。常用作干燥剂,如常用盛有浓硫酸的洗气瓶干燥某些气体(如H2、Cl2、SO2等)。
(2)脱水性
浓硫酸能按水的______比,夺取某些有机物中的________元素形成________。蔗糖和浓硫酸的实验说明浓硫酸具有______性。
水蒸气
组成
氢、氧
水分子
脱水
(3)强氧化性
①与金属铜的反应
反应的化学方程式为: 。在该反应中,氧化剂为____________,还原剂为______,氧化剂与还原剂的物质的量之比为________。浓硫酸在反应中既体现出__________又体现出______。
②与非金属的反应
浓硫酸不仅能与金属反应,还能与部分非金属单质如碳等反应,方程式为:
,浓硫酸在反应中只体现出__________。
③在常温下,________等金属在浓硫酸中可发生______,即金属的表面上会生成一层致密的____________,从而阻止酸与内层金属的进一步反应。
H2SO4
Cu
1∶1
强氧化性
酸性
强氧化性
铁、铝
钝化
氧化物薄膜
4.硫酸的用途
(1)浓硫酸在生产、生活和科学研究中有着广泛的应用。化肥、医药、农药的生产,金属矿石的处理,金属材料的表面清洗等都要用到硫酸。
(2)制备________等。
硫酸盐
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)常温下,浓硫酸能使某些活泼金属“钝化”,钝化是物理变化( )
(2)硫酸铜晶体滴加浓硫酸后变白色,说明浓硫酸有脱水性( )
(3)浓硫酸具有吸水性,所以浓硫酸可以干燥H2、CO、NH3、H2S、HI、HBr等气体( )
(4)将浓硫酸滴到湿的蔗糖表面,固体变黑膨胀并有刺激性气味气体生成,说明浓硫酸有脱水性、吸水性和强氧化性( )
×
×
×
√
二、浓硫酸的性质
一、硫酸的工业制备
一、硫酸的工业制备
1.接触法制硫酸生产流程及主要设备
在吸收塔中,用98.3%的浓硫酸吸收SO3的目的是因为SO3与水反应产生大量酸雾,形成酸雾既不利于SO3的吸收,同时又腐蚀设备用98.3%的浓H2SO4吸收SO3,形成发烟硫酸,再用水稀释,效果更好。
2.工业制硫酸中提高硫酸产率的措施
(1)适当增加反应物浓度。燃烧硫铁矿时通入过量的廉价空气使之充分燃烧。
(2)增大接触面积。在沸腾炉中,将矿石从上部投入,空气从下面充入,粉碎硫铁矿,吸收塔中填充瓷环,采取逆流方式吸收SO3都是为了增大接触面积(增大反应速率)。
(3)使用催化剂。接触室中用V2O5作催化剂,加快反应速率。
(4)循环利用反应物。吸收塔上部导出的气体再次通入接触室,进行第二次氧化、再吸收。
3.工业制硫酸中的“三废”处理
(1)废气:尾气中主要含有N2、O2、SO2,直接排放会污染大气。常见的处理方法有碱液吸收法等。
用氨水吸收:SO2+2NH3·H2O===(NH4)2SO3+H2O、SO2+NH3·H2O===NH4HSO3。
当吸收液中NH4HSO3达一定浓度后,再与浓硫酸反应放出SO2气体,生成硫酸铵:2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑。(NH4)2SO4作肥料,SO2重新通入接触室被氧化,循环利用。
(2)废液:呈酸性,用石灰乳处理污水。
(3)废渣:含Fe2O3,可用作炼铁原料,或用作制水泥、制砖的原料等。
1.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还
装入了大量瓷环。下列有关说法不正确的是( )
A.从①处通入SO3,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
C
解析 从吸收塔上部导出的气体有N2、未参与反应的O2和少量SO2,直接排入大气会污染环境,所以应用吸收剂吸收或循环使用,故C错误。
2.在工业生产硫酸的过程中,为了有利于SO2的转化,且能够充分利用热能,采用了中间有热交换器的接触室,如图所示。按此密闭体系中气体的流向,在A处流出的气体为( )
A.SO2 B.SO3、O2
C.SO2、O2 D.SO3、SO2
C
解析 干燥的SO2与O2发生化学反应的有利条件是催化剂和约450 ℃的温度。在通常状况下SO2与O2不发生反应,即使在加热的条件下也基本上不发生反应。从热交换器(或接触室)左侧进入的是SO2与O2的混合气体,在热交换器内只是被加热升高温度,没有与催化剂接触,基本上没有SO3生成。从热交换器内出来的热SO2与O2的混合气体,进入接触室内的催化剂区域后,发生可逆反应,生成SO3。
二、浓硫酸的性质
[实验1]
实验装置
实验现象 蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭,品红溶液褪色。
[实验2]
某实验小组试用下图所列各装置设计一个实验,来验证[实验1]的各种产物。
1.②中所加固体药品是什么?可验证的产物是什么?确定②在整套装置中位置
的理由是什么?
提示:因为②是验证水蒸气的装置,所以其中固体药品必是可与水结合,而且有可观察到明显现象变化的物质,中学中熟悉的是白色无水硫酸铜遇水变蓝,或变色硅胶遇水由蓝色变为粉红色。确定②位置的理由是①③都是水
溶液。
2.实验时可观察到①中A瓶的溶液褪色,C瓶的溶液不褪色。A、B、C三瓶溶液
的作用分别是什么?
提示:A瓶中品红溶液褪色,可证明产物中有SO2,C瓶溶液不褪色说明进入C瓶的气体中已没有SO2,从而推断出B瓶溶液的作用是氧化吸收从A瓶出来的气体中的SO2,因而C瓶溶液的作用是确认气流中SO2已被B瓶溶液全部
吸收。
3.③中所盛溶液是什么?可验证哪一种产物?
提示:由于从①中C瓶出来的气流中已确认没有SO2,因此③中所盛溶液必定是澄清石灰水,用来验证气流中的CO2。
1.浓硫酸吸水性和脱水性的区别
(1)吸水性:浓硫酸能吸收物质中游离的水,如气体、液体中的水分子,以及固体中的结晶水等。如浓硫酸吸收CuSO4·5H2O晶体中的结晶水。
(2)脱水性:物质中本来没有水分子,浓硫酸可将有机物中的H、O原子按2∶1比例以“H2O”的形式脱去,如可以使蔗糖、纤维素、纸张等脱水炭化。
(3)脱水性与吸水性的根本区别在于物质本身是否存在水分子。
2.浓硫酸强氧化性的体现
(3)与还原性物质反应
浓硫酸具有强氧化性,能将还原性物质(如H2S、HI)氧化,如:H2S+H2SO4(浓)===S↓+SO2↑+2H2O。
3.下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.蓝色胆矾晶体滴加浓硫酸时变为白色固体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸与铜片共热的反应中,浓硫酸只表现强氧化性
B
解析 浓硫酸具有脱水性,使蔗糖中氢、氧元素以水的形式脱出,而使蔗糖炭化变黑,与吸水性无关,A错误;浓硫酸具有吸水性,能吸收胆矾晶体中的结晶水,可以使蓝色的胆矾晶体失水变为白色晶体,B正确;浓硫酸是一种酸,能和氨气反应,故不能干燥氨气,C错误;浓硫酸与铜片共热的反应中,浓硫酸既表现出强氧化性,又表现出酸性,D错误。
4.(2021·江苏苏州高一期末)下列制取 SO2、验
证其漂白性、收集 SO2,并制备
CuSO4·5H2O晶体的装置和原理能达到实验
目的的是( )
A.图1:制取SO2
B.图2:验证SO2漂白性
C.图3:收集SO2
D.图4:蒸干溶液制备CuSO4·5H2O晶体
B
解析 常温下,铜与浓硫酸不反应,加热条件下才能反应产生SO2气体, A错误;SO2能够与品红化合成无色物质,溶液褪色,图中导气管“长进短出”,可以实现目的,B正确;SO2易溶于水,部分能够与水反应,不能用排水法收集,可以用排饱和亚硫酸氢钠溶液或用向上排空气法收集,C错误;硫酸铜的溶解度随着温度的降低而降低,从硫酸铜溶液中获取硫酸铜晶体,可以采用蒸发浓缩、冷却结晶、过滤、洗涤等操作得到,蒸干溶液CuSO4·5H2O分解得不到硫酸铜晶体, D错误。故选B。
5.浓硫酸在实现下列物质的转化过程中,既表现出氧化性,又表现出酸性的是( )
①Cu―→CuSO4 ②C―→CO2 ③FeO―→Fe2(SO4)3 ④Fe2O3―→Fe2(SO4)3
A.①③ B.②④
C.①④ D.②③
解析 ①正确,浓硫酸表现出强氧化性,将Cu氧化为Cu2+,自身还原为SO2,同时生成了盐(CuSO4),体现了浓硫酸的酸性;②只体现了浓硫酸的强氧化性;③既体现了浓硫酸的强氧化性,将Fe2+氧化为Fe3+,同时又生成了盐[Fe2(SO4)3],体现了浓硫酸的酸性;④只体现了浓硫酸的酸性。
A
1.实验室有两瓶硫酸,分别是浓硫酸和稀硫酸,但由于同学的粗心将标签弄混
了。请你帮助该同学选择既简单又可靠的区分方法 ( )
A.与铜片反应
B.与石蕊溶液反应
C.用玻璃棒各蘸少许涂在纸上
D.加入锌片看是否有气体生成
解析 Cu与稀硫酸不反应,与浓硫酸反应需要加热, A不符合题意;与石蕊溶液反应,溶液都变红色,现象不明显,B不符合题意;用玻璃棒各蘸少许涂在纸上,变黑的为浓硫酸,可鉴别,既简单又安全,C符合题意;加入锌片都生成气体,分别为SO2、H2, D不符合题意。
C
2.在硫酸的工业制法中,下列生产操作和主要原因均正确的是( )
A.硫铁矿燃烧前要粉碎,因为大块硫铁矿不能燃烧
B.从沸腾炉出来的气体需净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3,SO2能全部转化为SO3
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
解析 硫铁矿燃烧前要粉碎,目的是增大接触面积,使矿石燃烧更充分,A错误;从沸腾炉中出来的气体含有杂质,会造成催化剂中毒,使催化剂失去催化作用,B错误;SO2氧化成SO3的反应是可逆反应,SO2不能全部转化为SO3,C错误;D正确。
D
3.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还
原的H2SO4的物质的量( )
A.小于0.45 mol
B.等于0.45 mol
C.在0.45 mol和0.90 mol之间
D.大于0.90 mol
A
4.(2022·江苏徐州高一期末)SO3可溶于浓硫酸生成H2SO4·SO3,继续与水反应转
化为H2SO4,下列有关硫酸的说法正确的是( )
A.浓硫酸具有吸水性,可用于干燥SO3
B.浓硫酸与铁不反应,可用铁罐储运浓硫酸
C.常温下,可用浓硫酸与Cu反应制备SO2
D.将1 mol H2SO4·SO3全部转化为H2SO4需消耗1 mol H2O
D
解析 浓硫酸具有很强的吸水性,但能与SO3反应生成H2SO4·SO3,不可用于干燥SO3, A错误;常温下金属Fe与浓硫酸发生钝化反应,会在金属表面形成致密的氧化膜,阻止反应进一步发生,可用铁罐来进行贮存、运输冷的浓硫酸, B错误;常温下,铜和浓硫酸不反应,加热条件下可用浓硫酸与Cu反应制备SO2, C错误;将1 mol H2SO4·SO3全部转化为H2SO4需消耗1 mol H2O得到2 mol H2SO4, D正确。
5.某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置已略去)。
(1)试管①中反应的化学方程式是____________________________________;
用“可抽动铜丝”代替“直接投入铜片”的优点是________________________。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是_________________________;
若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有____________性。
(3)试管③中的试剂为NaOH溶液,其作用是____________,反应的离子方程式是__________________________________________________________。
1.以下设备名称中不属于接触法制硫酸的是( )
A.沸腾炉 B.氧化炉
C.吸收塔 D.接触室
解析 接触法制硫酸的三设备是沸腾炉、吸收塔、接触室。
B
2.在如下图所示的实验中,实验开始一段时间后,对观察到的现象叙述错误的
是( )
A.苹果块会干瘪 B.胆矾晶体表面“有白斑”
C.小试管内有晶体析出 D.pH试纸变红
D
解析 浓硫酸具有较强的吸水性、脱水性和强氧化性,因此将苹果块、胆矾晶体和饱和硝酸钾溶液在题中图示装置中放置一段时间后,浓硫酸会吸收它们中的水分,使苹果块萎缩,胆矾晶体变为白色的无水硫酸铜,饱和硝酸钾溶液中析出晶体。D项pH试纸在浓硫酸中先变红后变黑,因浓硫酸具有极强的氧化性和脱水性,能使pH试纸炭化变黑。
3.下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁、铝不反应,所以铁制、铝制容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取SO2时,浓硫酸表现出强氧化性
解析 钝化不是不反应,A错误;蔗糖炭化浓硫酸表现出脱水性,B错误;浓硫酸和亚硫酸钠反应制备SO2时体现其酸性,D错误。
C
4.(2021·江苏镇江高一期末)用如图所示实验装置制取SO2并验证其某些化学性质。
下列说法不正确的是( )
A.甲中试管内的反应,浓H2SO4体现强
氧化性和酸性
B.乙中溶液先变红后褪色
C.丙和戊中溶液都褪色,原理不相同
D.丁中出现浑浊,说明SO2具有氧化性
B
解析 铜片和浓硫酸反应生成硫酸铜、SO2和水,体现了浓硫酸的强氧化性和酸性,A正确;SO2的水溶液显酸性,则乙通入SO2后,溶液变红,但SO2不能使变红的溶液褪色,B错误;丙溶液褪色,是SO2的漂白性导致的,戊中溶液褪色是SO2的还原性导致的,原理不相同,C正确;丁中出现浑浊,是通入的SO2和硫化钠反应生成不溶于水的硫导致的,体现了SO2的氧化性,D正确。
5.(2021·江苏常州高一期中)在下列反应中,H2SO4既表现出酸性又表现出氧化性
的是( )
A
解析 A项生成硫酸铜体现酸性,生成二氧化硫体现氧化性,A正确;B项S元素化合价降低,只体现氧化性,C元素化合价升高,体现还原性,B错误;C项S元素化合价降低,只体现氧化性,Br元素化合价升高,体现还原性,C错误;D项S元素化合价不变,只体现酸性,D错误。
6.(2021·江苏高一期末)对下列事实的解释错误的是( )
A.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性
B.浓H2SO4和浓HCl混合可制得氯化氢,说明浓H2SO4是一种难挥发的酸
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓H2SO4不反应
D.反应CuSO4+H2S===CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶
于硫酸
解析 常温下铝在浓硫酸中发生钝化,所以常温下,浓硫酸可以用铝罐贮存,但钝化是化学变化。
C
7.硫元素常见化合价及其物质类别关系
如图,下列说法错误的是( )
A.X是H2S
B.Y既有氧化性又有还原性
C.将X与Y混合,不能生成硫
D.工业上制Z的主要原料是硫铁矿
C
解析 -2价硫的氢化物,为硫化氢, X是H2S, A正确;处于中间价态的元素具有氧化性和还原性,+4价的硫处于中间价态,所以Y既有氧化性又有还原性,B正确;将X(硫化氢)、Y(二氧化硫)两者混合,发生反应能生成硫, C错误;工业上制硫酸用煅烧硫铁矿来造气产生SO2,则工业上制Z的主要原料是硫铁矿, D正确。
8.(2022·江苏苏州高一期末)利用如下实验研究浓硫酸的性质。
实验1:取2 g蔗糖放入大试管中,加2~3滴水, 再加入3 mL浓硫酸,搅拌,蔗糖变黑,同时将产生的气体通入酸性KMnO4溶液中,观察到KMnO4溶液褪色。
实验2:将一小片铜放入试管中再加入3 mL浓硫酸,加热,将产生的气体通入品红溶液中,观察到品红溶液褪色。将反应后的混合物溶于水,得到蓝色溶液。
下列说法正确的是( )
C
A.“实验1” 只可以说明浓硫酸具有吸水性和强氧化性
B.“实验1”中产生的气体直接通入澄清石灰水可检验是否含CO2
C.“ 实验2”可以说明浓硫酸具有强氧化性和酸性
D.“实验1”和“实验2”的现象都说明SO2具有漂白性
解析 “实验1” 中蔗糖变黑且有使酸性高锰酸钾溶液褪色的气体生成,可以说明浓硫酸具有吸水性、强氧化性和脱水性,A错误; “实验1”中产生的气体含有CO2和SO2,需要先除去SO2再通入澄清石灰水检验是否含CO2,B错误; “ 实验2”中铜片和浓硫酸反应生成SO2可以说明浓硫酸具有强氧化性,生成蓝色的铜盐说明有酸性,C正确; “实验1”的现象说明SO2有还原性,“实验2”的现象说明SO2具有漂白性,D错误。
9.已知X为一种常见酸的浓溶液,能使蔗糖粉末
变黑。A与X反应的转化关系如图所示,
其中反应条件及部分产物均已略去,则下列
有关说法正确的是( )
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
D
10.(2021·江苏江阴高一期末)硫酸厂的钢铁硫酸储罐在拆除前需进行安全检测。某次检测到罐体内残留H2SO4浓度为4.5 mol·L-1,H2、CO、SO2和H2S的体积分数分别为4.2%,0.019%,0.000 8%和0.005%。下列有关推测合理的是( )
A.钢铁储罐可以用来储存稀H2SO4
B.CO可能是C或有机物被浓硫酸氧化的产物
C.H2可能是浓硫酸与Fe反应的产物
D.SO2和H2S可能是稀H2SO4被还原的产物
B
解析 钢铁储罐的主要成分为Fe,Fe与稀H2SO4发生反应,即Fe+H2SO4===FeSO4+H2↑,则钢铁储罐不能用来储存稀H2SO4,A错误; C或有机物与浓硫酸发生氧化还原反应,浓H2SO4呈现强氧化性,C或有机物中C失电子被氧化,化合价升高,发生氧化反应,生成CO是氧化产物,B正确;浓H2SO4有强氧化性,Fe在冷的浓H2SO4中产生钝化现象,在加热条件下Fe与浓H2SO4发生氧化还原反应,均不产生H2,C错误;稀H2SO4中S元素没有强氧化性,不能得电子,所以SO2和H2S不是稀H2SO4被还原的产物,故D
错误。
11.工业上制硫酸的设备分为三大部分:沸腾炉、接触室、吸收塔。下面的装置是仿照工业上制备硫酸工艺的流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
请回答下列问题:
(1)写出沸腾炉内煅烧硫铁矿的反应方程式______________________________。
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的______________、______________。
(3)从乙装置中出来的气体有____________________________________。
(4)丙装置的作用为________________,丁中的现象为________________。
(5)本实验设计还存在的较明显缺陷是__________________________________。
答案 (2)接触室 吸收塔 (3)SO2、O2、SO3 (4)吸收SO3 有酸雾产生
(5)缺少尾气吸收装置
解析 乙装置相当于接触室,将SO2催化氧化为SO3,由于该反应是一个可逆反应,故从乙装置中出来的气体含有SO2、O2、SO3;丙装置相当于吸收塔,用浓硫酸吸收SO3;丁装置是用水吸收SO3,SO3溶于水会放出大量的热,使水汽化为水蒸气,从而形成酸雾;本实验中缺少尾气吸收装置。
12.在化学课上,围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是____________(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是____________(填化学式),反应的化学方程式为______________________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有____________(填字母)。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
答案 (3)BCD
解析 (3)根据实验现象及(1)(2)的分析知,在蔗糖与浓硫酸的反应中,浓硫酸具有脱水性、强氧化性和吸水性。
生产中用浓硫酸代替水吸收SO3,制得发烟硫酸(H2SO4·xSO3),将发烟硫酸稀释后可制得密度为1.84 g· cm-3、质量分数为98%的浓硫酸。下列有关工业制硫酸的说法正确的是( )
A.98%的浓硫酸的物质的量浓度为18.4 mol·L-1
B.反应①中FeS2既是氧化剂又是还原剂
C.该条件下反应②中生成的SO3不能转化为SO2
D.将50 g发烟硫酸与50 g H2O混合,可得到100 g质量分数等于50%的硫酸
溶液
A
14.浓硫酸分别和三种钠盐反应,下列分析正确的是( )
A.对比①和②可以说明还原性Br->Cl-
B.①和③相比可说明氧化性Br2>SO2
C.②中试管口白雾是HCl遇水蒸气所致,
能说明酸性H2SO4>HCl
D.③中浓H2SO4被还原成SO2
A
解析 反应①出现红棕色气体,说明产生Br2(g),Br-被氧化,反应②管口出现白雾,白雾是HCl的小液滴,Cl-没有被氧化,说明Br-的还原性强于Cl-,A项正确;反应③产生的气体为SO2,反应③发生Na2SO3+H2SO4===Na2SO4+SO2↑+H2O,不属于氧化还原反应,不能说明Br2的氧化性强于SO2, B错误、D错误;利用浓硫酸高沸点,HCl易挥发,反应②是利用高沸点酸制取低沸点酸,不能说明酸性H2SO4>HCl,C错误。
15.某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是____________(填化学式),写出此过程所发生的2个化学反应方程式: __________________________;_____________________________。
(2)一定质量的Zn与87.5 mL 16.0 mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78 g,产生SO2体积(标准状况下)= ____________ L。
解析 (1)浓硫酸随反应进行浓度变小后,稀硫酸和锌反应生成氢气,所以气体杂质含有氢气;锌和浓硫酸反应生成硫酸锌、二氧化硫和水,故对应的化学方程式为Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,锌和稀硫酸反应生成硫酸锌和氢气,故对应的化学方程式为Zn+H2SO4===ZnSO4+H2↑。
(2)一定质量的Zn与87.5 mL 16.0 mol/L的H2SO4的浓溶液充分反应,反应后称量剩余锌发现质量减少了78.0 g,则参加反应Zn的物质的量为1.2 mol,H2SO4的物质的量为0.087 5 L×16 mol/L=1.4 mol;由于硫酸没有剩余,设与浓硫酸反应的Zn为x mol,与稀硫酸反应的Zn为y mol,则在Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O中参加反应的H2SO4为2x mol、生成的SO2为x mol,在Zn+H2SO4===ZnSO4+H2↑中参加反应的H2SO4为y mol,生成的H2为y mol;由题意可知:x+y=1.2、2x+y=1.4,解得x=0.2,y=1.0;故产生SO2体积(标准状况下)=0.2 mol×22.4 L·mol-1=4.48 L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
①酸性KMnO4溶液的作用是__________________________________;
B中添加的试剂是____________。
②装置C中所装药品为____________,可证实气体X中混有较多量某杂质气体的实验现象是__________________________________________。
答案 (3)①除去SO2气体 浓硫酸
②CuO C中黑色粉末变为红色,D中的白色固体变为蓝色
解析 (3)证明气体中含有氢气,酸性高锰酸钾溶液的作用是吸收生成的SO2气体,则B装置中加浓硫酸吸收气体中混有的水分,装置C将残留的气体通过灼热的氧化铜反应,目的是验证该气体具有还原性,装置D中无水硫酸铜检验水,若变蓝色则C装置中反应生成水,根据元素守恒且该气体具有还原性,则X气体为H2;①由以上分析得,酸性KMnO4溶液的作用是除去SO2气体;B中添加的试剂是浓硫酸;②由以上分析得,装置C中所装药品为CuO;可证实气体X中混有较多量某杂质气体的实验现象是C中黑色粉末变为红色,D中的白色固体变为蓝色。
Thanks!
本课时内容结束
第二课时
硫酸的工业制备 浓硫酸的性质
【课程标准要求】
1.知道接触法制硫酸的化学原理。
2.记住浓H2SO4吸水性、脱水性的区别及应用。
3.能理解浓H2SO4具有强氧化性的原因。
4.认识化学工业与人类生活、社会发展的关系,能辨证地分析化学品的影响。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、硫酸的工业制备
1.工业上接触法制硫酸的主要设备及生产流程:
各进口或出口物质的名称:
A.含硫矿石(如__________);B.______ ;C.________ 、氧气、氮气;D.尾气
SO2、O2、N2。
FeS2
炉渣
SO2
2.接触法制硫酸“三个阶段”:
FeS2
沸腾炉
O2
接触室
98.3%浓硫酸
吸收塔
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)在接触法制硫酸中,矿石粉碎的目的是为了增大反应物的接触面积,使反应更充分( )
(2)在吸收塔内,是用浓硫酸吸收SO3而不是用水,目的是为了防止形成酸雾,腐蚀设备( )
(3)SO2氧化为SO3时需要使用催化剂,可以使SO2全部转化为SO3( )
(4)从沸腾炉出来的SO2气体直接进入接触室,无需除杂( )
√
√
×
×
二、硫酸的性质和用途
1.稀H2SO4的化学性质
具有酸的通性(完成下列离子方程式)
(1)使紫色石蕊试液变____。
(2)与活泼金属反应(如Zn):____________________________________。
(3)与碱性氧化物反应(如CuO):______________________________________。
(4)与碱反应(如NaOH):__________________________。
(5)与某些盐反应(如BaCl2): 。
红
Zn+2H+===Zn2++H2↑
CuO+2H+===Cu2++H2O
OH-+H+===H2O
2.浓硫酸的物理性质
实验室常用的浓H2SO4质量分数为98.3%,为无色油状液体,密度大
(1.84 g· cm-3),沸点高,难挥发,易溶于水,溶于水时放出大量的热,所以稀释浓H2SO4时,应将浓H2SO4沿器壁慢慢注入水中并不断搅拌。
3.浓硫酸的特性
(1)吸水性
浓硫酸可吸收空气或其他气体中的________、混在固体中的湿存水、结晶水合物中的结晶水。常用作干燥剂,如常用盛有浓硫酸的洗气瓶干燥某些气体(如H2、Cl2、SO2等)。
(2)脱水性
浓硫酸能按水的______比,夺取某些有机物中的________元素形成________。蔗糖和浓硫酸的实验说明浓硫酸具有______性。
水蒸气
组成
氢、氧
水分子
脱水
(3)强氧化性
①与金属铜的反应
反应的化学方程式为: 。在该反应中,氧化剂为____________,还原剂为______,氧化剂与还原剂的物质的量之比为________。浓硫酸在反应中既体现出__________又体现出______。
②与非金属的反应
浓硫酸不仅能与金属反应,还能与部分非金属单质如碳等反应,方程式为:
,浓硫酸在反应中只体现出__________。
③在常温下,________等金属在浓硫酸中可发生______,即金属的表面上会生成一层致密的____________,从而阻止酸与内层金属的进一步反应。
H2SO4
Cu
1∶1
强氧化性
酸性
强氧化性
铁、铝
钝化
氧化物薄膜
4.硫酸的用途
(1)浓硫酸在生产、生活和科学研究中有着广泛的应用。化肥、医药、农药的生产,金属矿石的处理,金属材料的表面清洗等都要用到硫酸。
(2)制备________等。
硫酸盐
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)常温下,浓硫酸能使某些活泼金属“钝化”,钝化是物理变化( )
(2)硫酸铜晶体滴加浓硫酸后变白色,说明浓硫酸有脱水性( )
(3)浓硫酸具有吸水性,所以浓硫酸可以干燥H2、CO、NH3、H2S、HI、HBr等气体( )
(4)将浓硫酸滴到湿的蔗糖表面,固体变黑膨胀并有刺激性气味气体生成,说明浓硫酸有脱水性、吸水性和强氧化性( )
×
×
×
√
二、浓硫酸的性质
一、硫酸的工业制备
一、硫酸的工业制备
1.接触法制硫酸生产流程及主要设备
在吸收塔中,用98.3%的浓硫酸吸收SO3的目的是因为SO3与水反应产生大量酸雾,形成酸雾既不利于SO3的吸收,同时又腐蚀设备用98.3%的浓H2SO4吸收SO3,形成发烟硫酸,再用水稀释,效果更好。
2.工业制硫酸中提高硫酸产率的措施
(1)适当增加反应物浓度。燃烧硫铁矿时通入过量的廉价空气使之充分燃烧。
(2)增大接触面积。在沸腾炉中,将矿石从上部投入,空气从下面充入,粉碎硫铁矿,吸收塔中填充瓷环,采取逆流方式吸收SO3都是为了增大接触面积(增大反应速率)。
(3)使用催化剂。接触室中用V2O5作催化剂,加快反应速率。
(4)循环利用反应物。吸收塔上部导出的气体再次通入接触室,进行第二次氧化、再吸收。
3.工业制硫酸中的“三废”处理
(1)废气:尾气中主要含有N2、O2、SO2,直接排放会污染大气。常见的处理方法有碱液吸收法等。
用氨水吸收:SO2+2NH3·H2O===(NH4)2SO3+H2O、SO2+NH3·H2O===NH4HSO3。
当吸收液中NH4HSO3达一定浓度后,再与浓硫酸反应放出SO2气体,生成硫酸铵:2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑。(NH4)2SO4作肥料,SO2重新通入接触室被氧化,循环利用。
(2)废液:呈酸性,用石灰乳处理污水。
(3)废渣:含Fe2O3,可用作炼铁原料,或用作制水泥、制砖的原料等。
1.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还
装入了大量瓷环。下列有关说法不正确的是( )
A.从①处通入SO3,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
C
解析 从吸收塔上部导出的气体有N2、未参与反应的O2和少量SO2,直接排入大气会污染环境,所以应用吸收剂吸收或循环使用,故C错误。
2.在工业生产硫酸的过程中,为了有利于SO2的转化,且能够充分利用热能,采用了中间有热交换器的接触室,如图所示。按此密闭体系中气体的流向,在A处流出的气体为( )
A.SO2 B.SO3、O2
C.SO2、O2 D.SO3、SO2
C
解析 干燥的SO2与O2发生化学反应的有利条件是催化剂和约450 ℃的温度。在通常状况下SO2与O2不发生反应,即使在加热的条件下也基本上不发生反应。从热交换器(或接触室)左侧进入的是SO2与O2的混合气体,在热交换器内只是被加热升高温度,没有与催化剂接触,基本上没有SO3生成。从热交换器内出来的热SO2与O2的混合气体,进入接触室内的催化剂区域后,发生可逆反应,生成SO3。
二、浓硫酸的性质
[实验1]
实验装置
实验现象 蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭,品红溶液褪色。
[实验2]
某实验小组试用下图所列各装置设计一个实验,来验证[实验1]的各种产物。
1.②中所加固体药品是什么?可验证的产物是什么?确定②在整套装置中位置
的理由是什么?
提示:因为②是验证水蒸气的装置,所以其中固体药品必是可与水结合,而且有可观察到明显现象变化的物质,中学中熟悉的是白色无水硫酸铜遇水变蓝,或变色硅胶遇水由蓝色变为粉红色。确定②位置的理由是①③都是水
溶液。
2.实验时可观察到①中A瓶的溶液褪色,C瓶的溶液不褪色。A、B、C三瓶溶液
的作用分别是什么?
提示:A瓶中品红溶液褪色,可证明产物中有SO2,C瓶溶液不褪色说明进入C瓶的气体中已没有SO2,从而推断出B瓶溶液的作用是氧化吸收从A瓶出来的气体中的SO2,因而C瓶溶液的作用是确认气流中SO2已被B瓶溶液全部
吸收。
3.③中所盛溶液是什么?可验证哪一种产物?
提示:由于从①中C瓶出来的气流中已确认没有SO2,因此③中所盛溶液必定是澄清石灰水,用来验证气流中的CO2。
1.浓硫酸吸水性和脱水性的区别
(1)吸水性:浓硫酸能吸收物质中游离的水,如气体、液体中的水分子,以及固体中的结晶水等。如浓硫酸吸收CuSO4·5H2O晶体中的结晶水。
(2)脱水性:物质中本来没有水分子,浓硫酸可将有机物中的H、O原子按2∶1比例以“H2O”的形式脱去,如可以使蔗糖、纤维素、纸张等脱水炭化。
(3)脱水性与吸水性的根本区别在于物质本身是否存在水分子。
2.浓硫酸强氧化性的体现
(3)与还原性物质反应
浓硫酸具有强氧化性,能将还原性物质(如H2S、HI)氧化,如:H2S+H2SO4(浓)===S↓+SO2↑+2H2O。
3.下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.蓝色胆矾晶体滴加浓硫酸时变为白色固体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸与铜片共热的反应中,浓硫酸只表现强氧化性
B
解析 浓硫酸具有脱水性,使蔗糖中氢、氧元素以水的形式脱出,而使蔗糖炭化变黑,与吸水性无关,A错误;浓硫酸具有吸水性,能吸收胆矾晶体中的结晶水,可以使蓝色的胆矾晶体失水变为白色晶体,B正确;浓硫酸是一种酸,能和氨气反应,故不能干燥氨气,C错误;浓硫酸与铜片共热的反应中,浓硫酸既表现出强氧化性,又表现出酸性,D错误。
4.(2021·江苏苏州高一期末)下列制取 SO2、验
证其漂白性、收集 SO2,并制备
CuSO4·5H2O晶体的装置和原理能达到实验
目的的是( )
A.图1:制取SO2
B.图2:验证SO2漂白性
C.图3:收集SO2
D.图4:蒸干溶液制备CuSO4·5H2O晶体
B
解析 常温下,铜与浓硫酸不反应,加热条件下才能反应产生SO2气体, A错误;SO2能够与品红化合成无色物质,溶液褪色,图中导气管“长进短出”,可以实现目的,B正确;SO2易溶于水,部分能够与水反应,不能用排水法收集,可以用排饱和亚硫酸氢钠溶液或用向上排空气法收集,C错误;硫酸铜的溶解度随着温度的降低而降低,从硫酸铜溶液中获取硫酸铜晶体,可以采用蒸发浓缩、冷却结晶、过滤、洗涤等操作得到,蒸干溶液CuSO4·5H2O分解得不到硫酸铜晶体, D错误。故选B。
5.浓硫酸在实现下列物质的转化过程中,既表现出氧化性,又表现出酸性的是( )
①Cu―→CuSO4 ②C―→CO2 ③FeO―→Fe2(SO4)3 ④Fe2O3―→Fe2(SO4)3
A.①③ B.②④
C.①④ D.②③
解析 ①正确,浓硫酸表现出强氧化性,将Cu氧化为Cu2+,自身还原为SO2,同时生成了盐(CuSO4),体现了浓硫酸的酸性;②只体现了浓硫酸的强氧化性;③既体现了浓硫酸的强氧化性,将Fe2+氧化为Fe3+,同时又生成了盐[Fe2(SO4)3],体现了浓硫酸的酸性;④只体现了浓硫酸的酸性。
A
1.实验室有两瓶硫酸,分别是浓硫酸和稀硫酸,但由于同学的粗心将标签弄混
了。请你帮助该同学选择既简单又可靠的区分方法 ( )
A.与铜片反应
B.与石蕊溶液反应
C.用玻璃棒各蘸少许涂在纸上
D.加入锌片看是否有气体生成
解析 Cu与稀硫酸不反应,与浓硫酸反应需要加热, A不符合题意;与石蕊溶液反应,溶液都变红色,现象不明显,B不符合题意;用玻璃棒各蘸少许涂在纸上,变黑的为浓硫酸,可鉴别,既简单又安全,C符合题意;加入锌片都生成气体,分别为SO2、H2, D不符合题意。
C
2.在硫酸的工业制法中,下列生产操作和主要原因均正确的是( )
A.硫铁矿燃烧前要粉碎,因为大块硫铁矿不能燃烧
B.从沸腾炉出来的气体需净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3,SO2能全部转化为SO3
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
解析 硫铁矿燃烧前要粉碎,目的是增大接触面积,使矿石燃烧更充分,A错误;从沸腾炉中出来的气体含有杂质,会造成催化剂中毒,使催化剂失去催化作用,B错误;SO2氧化成SO3的反应是可逆反应,SO2不能全部转化为SO3,C错误;D正确。
D
3.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还
原的H2SO4的物质的量( )
A.小于0.45 mol
B.等于0.45 mol
C.在0.45 mol和0.90 mol之间
D.大于0.90 mol
A
4.(2022·江苏徐州高一期末)SO3可溶于浓硫酸生成H2SO4·SO3,继续与水反应转
化为H2SO4,下列有关硫酸的说法正确的是( )
A.浓硫酸具有吸水性,可用于干燥SO3
B.浓硫酸与铁不反应,可用铁罐储运浓硫酸
C.常温下,可用浓硫酸与Cu反应制备SO2
D.将1 mol H2SO4·SO3全部转化为H2SO4需消耗1 mol H2O
D
解析 浓硫酸具有很强的吸水性,但能与SO3反应生成H2SO4·SO3,不可用于干燥SO3, A错误;常温下金属Fe与浓硫酸发生钝化反应,会在金属表面形成致密的氧化膜,阻止反应进一步发生,可用铁罐来进行贮存、运输冷的浓硫酸, B错误;常温下,铜和浓硫酸不反应,加热条件下可用浓硫酸与Cu反应制备SO2, C错误;将1 mol H2SO4·SO3全部转化为H2SO4需消耗1 mol H2O得到2 mol H2SO4, D正确。
5.某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置已略去)。
(1)试管①中反应的化学方程式是____________________________________;
用“可抽动铜丝”代替“直接投入铜片”的优点是________________________。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是_________________________;
若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有____________性。
(3)试管③中的试剂为NaOH溶液,其作用是____________,反应的离子方程式是__________________________________________________________。
1.以下设备名称中不属于接触法制硫酸的是( )
A.沸腾炉 B.氧化炉
C.吸收塔 D.接触室
解析 接触法制硫酸的三设备是沸腾炉、吸收塔、接触室。
B
2.在如下图所示的实验中,实验开始一段时间后,对观察到的现象叙述错误的
是( )
A.苹果块会干瘪 B.胆矾晶体表面“有白斑”
C.小试管内有晶体析出 D.pH试纸变红
D
解析 浓硫酸具有较强的吸水性、脱水性和强氧化性,因此将苹果块、胆矾晶体和饱和硝酸钾溶液在题中图示装置中放置一段时间后,浓硫酸会吸收它们中的水分,使苹果块萎缩,胆矾晶体变为白色的无水硫酸铜,饱和硝酸钾溶液中析出晶体。D项pH试纸在浓硫酸中先变红后变黑,因浓硫酸具有极强的氧化性和脱水性,能使pH试纸炭化变黑。
3.下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁、铝不反应,所以铁制、铝制容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取SO2时,浓硫酸表现出强氧化性
解析 钝化不是不反应,A错误;蔗糖炭化浓硫酸表现出脱水性,B错误;浓硫酸和亚硫酸钠反应制备SO2时体现其酸性,D错误。
C
4.(2021·江苏镇江高一期末)用如图所示实验装置制取SO2并验证其某些化学性质。
下列说法不正确的是( )
A.甲中试管内的反应,浓H2SO4体现强
氧化性和酸性
B.乙中溶液先变红后褪色
C.丙和戊中溶液都褪色,原理不相同
D.丁中出现浑浊,说明SO2具有氧化性
B
解析 铜片和浓硫酸反应生成硫酸铜、SO2和水,体现了浓硫酸的强氧化性和酸性,A正确;SO2的水溶液显酸性,则乙通入SO2后,溶液变红,但SO2不能使变红的溶液褪色,B错误;丙溶液褪色,是SO2的漂白性导致的,戊中溶液褪色是SO2的还原性导致的,原理不相同,C正确;丁中出现浑浊,是通入的SO2和硫化钠反应生成不溶于水的硫导致的,体现了SO2的氧化性,D正确。
5.(2021·江苏常州高一期中)在下列反应中,H2SO4既表现出酸性又表现出氧化性
的是( )
A
解析 A项生成硫酸铜体现酸性,生成二氧化硫体现氧化性,A正确;B项S元素化合价降低,只体现氧化性,C元素化合价升高,体现还原性,B错误;C项S元素化合价降低,只体现氧化性,Br元素化合价升高,体现还原性,C错误;D项S元素化合价不变,只体现酸性,D错误。
6.(2021·江苏高一期末)对下列事实的解释错误的是( )
A.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性
B.浓H2SO4和浓HCl混合可制得氯化氢,说明浓H2SO4是一种难挥发的酸
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓H2SO4不反应
D.反应CuSO4+H2S===CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶
于硫酸
解析 常温下铝在浓硫酸中发生钝化,所以常温下,浓硫酸可以用铝罐贮存,但钝化是化学变化。
C
7.硫元素常见化合价及其物质类别关系
如图,下列说法错误的是( )
A.X是H2S
B.Y既有氧化性又有还原性
C.将X与Y混合,不能生成硫
D.工业上制Z的主要原料是硫铁矿
C
解析 -2价硫的氢化物,为硫化氢, X是H2S, A正确;处于中间价态的元素具有氧化性和还原性,+4价的硫处于中间价态,所以Y既有氧化性又有还原性,B正确;将X(硫化氢)、Y(二氧化硫)两者混合,发生反应能生成硫, C错误;工业上制硫酸用煅烧硫铁矿来造气产生SO2,则工业上制Z的主要原料是硫铁矿, D正确。
8.(2022·江苏苏州高一期末)利用如下实验研究浓硫酸的性质。
实验1:取2 g蔗糖放入大试管中,加2~3滴水, 再加入3 mL浓硫酸,搅拌,蔗糖变黑,同时将产生的气体通入酸性KMnO4溶液中,观察到KMnO4溶液褪色。
实验2:将一小片铜放入试管中再加入3 mL浓硫酸,加热,将产生的气体通入品红溶液中,观察到品红溶液褪色。将反应后的混合物溶于水,得到蓝色溶液。
下列说法正确的是( )
C
A.“实验1” 只可以说明浓硫酸具有吸水性和强氧化性
B.“实验1”中产生的气体直接通入澄清石灰水可检验是否含CO2
C.“ 实验2”可以说明浓硫酸具有强氧化性和酸性
D.“实验1”和“实验2”的现象都说明SO2具有漂白性
解析 “实验1” 中蔗糖变黑且有使酸性高锰酸钾溶液褪色的气体生成,可以说明浓硫酸具有吸水性、强氧化性和脱水性,A错误; “实验1”中产生的气体含有CO2和SO2,需要先除去SO2再通入澄清石灰水检验是否含CO2,B错误; “ 实验2”中铜片和浓硫酸反应生成SO2可以说明浓硫酸具有强氧化性,生成蓝色的铜盐说明有酸性,C正确; “实验1”的现象说明SO2有还原性,“实验2”的现象说明SO2具有漂白性,D错误。
9.已知X为一种常见酸的浓溶液,能使蔗糖粉末
变黑。A与X反应的转化关系如图所示,
其中反应条件及部分产物均已略去,则下列
有关说法正确的是( )
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
D
10.(2021·江苏江阴高一期末)硫酸厂的钢铁硫酸储罐在拆除前需进行安全检测。某次检测到罐体内残留H2SO4浓度为4.5 mol·L-1,H2、CO、SO2和H2S的体积分数分别为4.2%,0.019%,0.000 8%和0.005%。下列有关推测合理的是( )
A.钢铁储罐可以用来储存稀H2SO4
B.CO可能是C或有机物被浓硫酸氧化的产物
C.H2可能是浓硫酸与Fe反应的产物
D.SO2和H2S可能是稀H2SO4被还原的产物
B
解析 钢铁储罐的主要成分为Fe,Fe与稀H2SO4发生反应,即Fe+H2SO4===FeSO4+H2↑,则钢铁储罐不能用来储存稀H2SO4,A错误; C或有机物与浓硫酸发生氧化还原反应,浓H2SO4呈现强氧化性,C或有机物中C失电子被氧化,化合价升高,发生氧化反应,生成CO是氧化产物,B正确;浓H2SO4有强氧化性,Fe在冷的浓H2SO4中产生钝化现象,在加热条件下Fe与浓H2SO4发生氧化还原反应,均不产生H2,C错误;稀H2SO4中S元素没有强氧化性,不能得电子,所以SO2和H2S不是稀H2SO4被还原的产物,故D
错误。
11.工业上制硫酸的设备分为三大部分:沸腾炉、接触室、吸收塔。下面的装置是仿照工业上制备硫酸工艺的流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
请回答下列问题:
(1)写出沸腾炉内煅烧硫铁矿的反应方程式______________________________。
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的______________、______________。
(3)从乙装置中出来的气体有____________________________________。
(4)丙装置的作用为________________,丁中的现象为________________。
(5)本实验设计还存在的较明显缺陷是__________________________________。
答案 (2)接触室 吸收塔 (3)SO2、O2、SO3 (4)吸收SO3 有酸雾产生
(5)缺少尾气吸收装置
解析 乙装置相当于接触室,将SO2催化氧化为SO3,由于该反应是一个可逆反应,故从乙装置中出来的气体含有SO2、O2、SO3;丙装置相当于吸收塔,用浓硫酸吸收SO3;丁装置是用水吸收SO3,SO3溶于水会放出大量的热,使水汽化为水蒸气,从而形成酸雾;本实验中缺少尾气吸收装置。
12.在化学课上,围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是____________(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是____________(填化学式),反应的化学方程式为______________________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有____________(填字母)。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
答案 (3)BCD
解析 (3)根据实验现象及(1)(2)的分析知,在蔗糖与浓硫酸的反应中,浓硫酸具有脱水性、强氧化性和吸水性。
生产中用浓硫酸代替水吸收SO3,制得发烟硫酸(H2SO4·xSO3),将发烟硫酸稀释后可制得密度为1.84 g· cm-3、质量分数为98%的浓硫酸。下列有关工业制硫酸的说法正确的是( )
A.98%的浓硫酸的物质的量浓度为18.4 mol·L-1
B.反应①中FeS2既是氧化剂又是还原剂
C.该条件下反应②中生成的SO3不能转化为SO2
D.将50 g发烟硫酸与50 g H2O混合,可得到100 g质量分数等于50%的硫酸
溶液
A
14.浓硫酸分别和三种钠盐反应,下列分析正确的是( )
A.对比①和②可以说明还原性Br->Cl-
B.①和③相比可说明氧化性Br2>SO2
C.②中试管口白雾是HCl遇水蒸气所致,
能说明酸性H2SO4>HCl
D.③中浓H2SO4被还原成SO2
A
解析 反应①出现红棕色气体,说明产生Br2(g),Br-被氧化,反应②管口出现白雾,白雾是HCl的小液滴,Cl-没有被氧化,说明Br-的还原性强于Cl-,A项正确;反应③产生的气体为SO2,反应③发生Na2SO3+H2SO4===Na2SO4+SO2↑+H2O,不属于氧化还原反应,不能说明Br2的氧化性强于SO2, B错误、D错误;利用浓硫酸高沸点,HCl易挥发,反应②是利用高沸点酸制取低沸点酸,不能说明酸性H2SO4>HCl,C错误。
15.某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)做有关实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是____________(填化学式),写出此过程所发生的2个化学反应方程式: __________________________;_____________________________。
(2)一定质量的Zn与87.5 mL 16.0 mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78 g,产生SO2体积(标准状况下)= ____________ L。
解析 (1)浓硫酸随反应进行浓度变小后,稀硫酸和锌反应生成氢气,所以气体杂质含有氢气;锌和浓硫酸反应生成硫酸锌、二氧化硫和水,故对应的化学方程式为Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,锌和稀硫酸反应生成硫酸锌和氢气,故对应的化学方程式为Zn+H2SO4===ZnSO4+H2↑。
(2)一定质量的Zn与87.5 mL 16.0 mol/L的H2SO4的浓溶液充分反应,反应后称量剩余锌发现质量减少了78.0 g,则参加反应Zn的物质的量为1.2 mol,H2SO4的物质的量为0.087 5 L×16 mol/L=1.4 mol;由于硫酸没有剩余,设与浓硫酸反应的Zn为x mol,与稀硫酸反应的Zn为y mol,则在Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O中参加反应的H2SO4为2x mol、生成的SO2为x mol,在Zn+H2SO4===ZnSO4+H2↑中参加反应的H2SO4为y mol,生成的H2为y mol;由题意可知:x+y=1.2、2x+y=1.4,解得x=0.2,y=1.0;故产生SO2体积(标准状况下)=0.2 mol×22.4 L·mol-1=4.48 L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
①酸性KMnO4溶液的作用是__________________________________;
B中添加的试剂是____________。
②装置C中所装药品为____________,可证实气体X中混有较多量某杂质气体的实验现象是__________________________________________。
答案 (3)①除去SO2气体 浓硫酸
②CuO C中黑色粉末变为红色,D中的白色固体变为蓝色
解析 (3)证明气体中含有氢气,酸性高锰酸钾溶液的作用是吸收生成的SO2气体,则B装置中加浓硫酸吸收气体中混有的水分,装置C将残留的气体通过灼热的氧化铜反应,目的是验证该气体具有还原性,装置D中无水硫酸铜检验水,若变蓝色则C装置中反应生成水,根据元素守恒且该气体具有还原性,则X气体为H2;①由以上分析得,酸性KMnO4溶液的作用是除去SO2气体;B中添加的试剂是浓硫酸;②由以上分析得,装置C中所装药品为CuO;可证实气体X中混有较多量某杂质气体的实验现象是C中黑色粉末变为红色,D中的白色固体变为蓝色。
Thanks!
本课时内容结束
