专题5 第二单元 微粒之间的相互作用力 第一课时 离子键(共64张PPT)
文档属性
| 名称 | 专题5 第二单元 微粒之间的相互作用力 第一课时 离子键(共64张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 21:01:11 | ||
图片预览











文档简介
(共64张PPT)
第二单元 微粒之间的
相互作用力
第一课时 离子键
【课程标准要求】
1.知道化学键的概念。了解离子键的概念与形成,了解离子化合物的概念,会判断离子化合物。
2.能用电子式表示简单的离子化合物。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、离子键及离子化合物
1.化学键
(1)概念:物质中直接相邻的原子或离子之间存在的________________叫做化学键。
(2)类型:________和________是两种常见的化学键。
强烈的相互作用
离子键
共价键
2.离子键
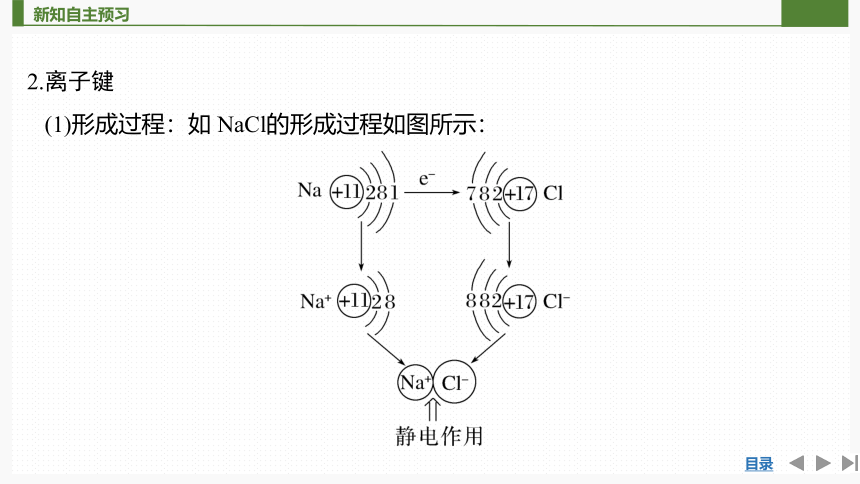
(1)形成过程:如 NaCl的形成过程如图所示:
Na原子和Cl原子最外层电子数分别为1和7,均不稳定,它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过__________结合在一起,形成新物质NaCl。
(2)概念:____________之间存在的强烈的相互作用。
(3)构成离子键的粒子是________和________。
(4)离子键的实质是__________。
3.离子化合物:由____________构成的化合物称为离子化合物。
静电作用
阴、阳离子
阳离子
阴离子
静电作用
阴、阳离子
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)相邻的两个原子之间强烈的相互作用叫做化学键( )
(2)离子键的实质是阴离子、阳离子之间的静电作用( )
(3)活泼金属与活泼非金属化合时易形成离子键( )
(4)构成离子键的粒子是阳离子和阴离子( )
(5)含有离子键的化合物都是离子化合物( )
×
√
√
√
√
二、电子式
1.概念:为了方便表示原子、离子的最外层的电子的排布,在元素符号周围用“·”(小黑点)或“×”(小叉号)表示原子或离子的____________的式子叫做电子式。
最外层电子
2.电子式的书写
(1)原子的电子式:如氢原子 、氯原子 。
(2)简单阳离子的电子式:简单阳离子是原子失去最外层电子后形成的,其电子式就是其阳离子符号,如Na+、Mg2+等。
(3)简单阴离子的电子式:如氯离子(Cl-)的电子式为 、氧离子
(O2-)的电子式为 。
(4)离子化合物的电子式:如氟化镁的电子式为 、
氧化钙的电子式为 。
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
√
×
×
×
二、电子式的书写
一、认识离子键与离子化合物
一、认识离子键与离子化合物
1.离子键
(1)成键微粒:形成离子键的微粒是原子发生了电子得失形成带有电荷的阴、阳离子,即得电子后微粒带负电荷称为阴离子;失电子后微粒带正电荷称为阳离子。
(2)成键本质
(3)成键过程:
如NaCl、K2O、MgCl2、CaS等都是靠离子键结合的。
2.离子化合物
(1)离子化合物的性质
①离子键一般比较牢固,破坏它需要较高的能量,所以离子化合物的熔点一般比较高,常温下为固体。
②离子化合物在溶于水或熔化时,离子键被破坏,形成自由移动的阴、阳离子,能够导电,故离子化合物都是电解质。
(2)常见的离子化合物
①活泼的金属元素与活泼的非金属元素形成的化合物,如NaF、CaCl2等;
②活泼的金属元素与酸根形成的盐类化合物,如Na2CO3、MgSO4等;
③活泼的金属元素与氢氧根形成的碱,如NaOH、Ba(OH)2等;
④铵根与酸根形成的盐类化合物(铵盐),如NH4HCO3、NH4NO3等。
(3)离子键与离子化合物的关系:
①离子化合物中一定含有离子键;含有离子键的化合物一定是离子化合物;
②离子化合物中一定含有阴离子和阳离子;③离子化合物中不一定只含有离子键。如NH4NO3、Na2O2是离子化合物,但在NH4NO3、Na2O2中除了含有离子键外,还含有共价键。
1.下列说法不正确的是( )
A.离子化合物中的阳离子不一定是金属阳离子
B.离子化合物中一定含有离子键
C.离子化合物中一定含有阳离子和阴离子
D.离子化合物一定能导电
解析 固态离子化合物中的阴、阳离子不能自由移动,不能导电,离子化合物一般溶于水或在熔融状态下能导电,D错误。
D
2.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属元素原子与所有非金属元素原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
解析 离子键是使阴、阳离子结合成稳定化合物的静电作用,包括斥力和引力,A项错误;活泼金属元素原子与活泼非金属元素原子间易形成离子键,但也有例外,如AlCl3,B项错误;CaCl2中,两个氯离子(都是阴离子)之间不存在离子键,离子键存在于阴离子和阳离子之间,C项错误;含有离子键的化合物一定是离子化合物,D项正确。
D
3.(2021·江苏常州高一期中)下列各组原子序数所表示的两种元素,能形成AB2型
离子化合物的是( )
A.11和16 B.12和9
C.14和8 D.7和8
B
解析 能形成AB2型离子化合物,说明A、B分别是活泼金属和活泼非金属元素,且A位于第ⅡA、B位于第ⅦA族。11号元素是Na,位于第ⅠA族,16号元素是S,位于第ⅥA族,形成化合物是Na2S,A不符合; 12号元素是Mg,位于第ⅡA族,9号元素是F,位于第ⅦA族,形成化合物是MgF2,故B符合; 14号元素是Si,位于第ⅣA族,8号元素是O,位于第ⅥA族,形成化合物是SiO2不含离子键,故C不符合; 7号元素是N,位于第ⅤA族,8号元素是O,位于第ⅥA族,形成的化合物不是离子化合物,故D不符合。
二、电子式的书写
1.原子的电子式
2.离子的电子式
3.离子化合物的电子式
每个离子都要单独写,而且要符合其实际相邻关系。将离子化合物中的阴、阳离子的电子式按一定顺序排列在一起就是离子化合物的电子式。
4.下列关于电子式的说法不正确的是( )
A.每种元素的原子都可以写出电子式
B.简单阳离子的电子式与它的离子符号相同
C.阴离子的电子式要加方括号表示
D.电子式就是核外电子排布的式子
解析 电子式是指在元素符号的周围用“·”或“×”来表示原子的最外层电子,以简明的表示原子、离子的最外层电子排布的式子,A、B、C正确,D错误。
D
5.下列有关电子式的叙述正确的是( )
C
6.(2021·山东高一期中)下列化学用语的表述不正确的是( )
B
1.下列叙述中,错误的是( )
A.Na原子和Cl原子作用生成NaCl后,其结构的稳定性增强
B.在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与
原子核之间的排斥作用
C.任何微粒在形成离子键的过程中必定有电子的得与失
D.Na与Cl2反应生成NaCl后,体系能量降低
C
解析 活泼的金属原子和活泼的非金属原子之间形成离子化合物,阳离子和阴离子均达到稳定结构,这样体系的能量降低,其结构的稳定性增强, A、B、D正确;离子键的形成只是阴、阳离子间的静电作用,并不一定发生电子的得失,如Na+与OH-结合成NaOH。
2.下列关于离子键的说法错误的是( )
A.离子键是阴、阳离子之间的静电作用
B.离子键是阴、阳离子这样的正、负电荷之间的相互吸引力
C.H-与Ca2+两种微粒之间可以形成离子键
D.F-与K+两种微粒之间可以形成离子键
B
解析 离子键是阴、阳离子之间的静电作用,这种“作用”并不单纯是正、负电荷之间的吸引力。因为离子都有带正电荷的原子核,一般都有带负电荷的电子,所以,阴、阳离子之间既有异性电荷之间的吸引作用,又有同性电荷之间的排斥作用,这些作用的总和达到一定的强烈程度就形成了离子键。H-与
Ca2+是两种带异性电荷的离子,可以形成离子键。F-是带负电荷的阴离子,
K+是带正电荷的阳离子,能形成离子键。
3.下列微粒电子式错误的是( )
B
4.(2021·黑龙江高一期中)AB属于离子型化合物,其中A离子和B离子的电子层结构不同,从原子的最外层电子数看A比B少4,而次外层电子数A比B多6,则该离子化合物可能是( )
A.MgO B.CaO
C.KCl D.MgS
解析 从A、B两元素的原子结构看,B原子只有两个电子层,符合此要求的只有A、B两项;A离子和B离子的电子层结构不同,只有B项符合。
B
5.已知:氢化钠(NaH)是一种离子化合物,其中钠元素是+1价,NaH跟水反应
放出H2。回答下列问题:
(1)在氢化钠中存在的化学键为________。
(2)NaH中的氢离子半径比锂离子半径________。
(3)写出NaH的电子式________。
(4)写出NaH与水反应的化学方程式___________________________________,
在该反应中属于氧化剂的是________,属于还原剂的是________。
答案 (1)离子键 (2)大 (3)Na+[∶H]-
(4)NaH+H2O===NaOH+H2↑ H2O NaH
解析 NaH为离子化合物,由阴离子H-和阳离子Na+构成。Li+与H-的电子层结构相同,但由于Li的核电荷数大,所以离子半径小。
1.下列叙述中正确的是( )
A.化学键只存在于分子之间
B.化学键只存在于离子之间
C.形成化学键的微粒可以是原子也可以是离子
D.化学键是相邻的分子之间强烈的相互作用
解析 化学键是物质中直接相邻的原子或离子之间的强烈的相互作用。在把握概念时注意:①相邻,因为若不相邻,其作用力必然很弱;②原子或离子是成键微粒;③强烈的相互作用区别于弱的相互作用。
C
2.关于氯化钠的形成过程。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其稳定性增强
D.氯化钠是离子化合物
解析 钠原子最外层只有1个电子,当它失去1个电子后形成的Na+具有最外层8个电子的稳定结构,氯原子最外层有7个电子,当它得到1个电子后形成的Cl-具有最外层8个电子的稳定结构,Na+和Cl-通过静电作用形成离子键,从而构成离子化合物NaCl。
B
3.下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( )
A.6和8 B.19和16
C.12和17 D.10和8
解析 C与O不可形成离子化合物,A错误;K与S可形成离子化合物K2S,但不为AB2型,B错误;Ne与O不能形成化合物,D错误。
C
4.下列性质中,可以证明某化合物一定为离子化合物的是( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
解析 熔融状态下能导电是离子化合物的性质。
D
5.下列关于离子键和离子化合物的说法正确的是( )
A.阴、阳离子间通过静电引力形成离子键
B.阴、阳离子间通过离子键一定能形成离子化合物
C.离子化合物一定能导电
D.第ⅠA族与第ⅦA族元素之间一定形成离子化合物
解析 A项,离子键是指阴、阳离子间的静电作用,它包括静电引力和静电斥力作用;B项,通过离子键形成的化合物只能是离子化合物;C项,离子化合物在水溶液中或熔融状态下才能导电;D项,氢元素是非金属元素,与卤族元素不能形成离子化合物。
B
6.下列叙述中不正确的是( )
A.活泼金属元素与活泼非金属元素化合时,一般能形成离子键
B.阴、阳离子通过静电引力所形成的化学键叫做离子键
C.离子所带电荷的符号和数目与原子成键时得失电子有关
D.阴、阳离子之间通过离子键形成的化合物一定是离子化合物
解析 活泼金属元素容易失去电子形成阳离子,活泼非金属元素容易得电子形成阴离子,阴、阳离子之间通过静电作用形成离子键,A正确;静电作用包括静电引力和静电斥力,B错误;原子形成离子键时,失电子带正电荷,得电子带负电荷,且离子所带电荷数与得失电子数一致,C正确;由离子键形成的化合物一定是离子化合物,D正确。
B
7.阳离子和阴离子都具有稀有气体元素原子结构,且阳离子比阴离子少两个电子层的离子化合物是( )
A.MgCl2 B.CaBr2
C.NaF D.KI
解析 选项中的四种化合物都为离子化合物,阳离子和阴离子具有的电子层数为
D
离子 Na+ Mg2+ Ca2+ K+ F- Cl- Br- I-
电子层数 2 2 3 3 2 3 4 5
8.下列有关化学用语正确的是( )
A
9.如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的
是( )
A.M与X、N都不能形成离子键
B.Y、Z和N形成的化合物均为离子化合物
C.N的气态氢化物在水中完全电离成离子属离子化合物
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1∶1
A
10.X元素的原子最外层有7个电子,Y元素的原子与X元素的原子的次外层上都有8个电子,X与Y形成的化合物中两离子的电子层结构相同,以下说法中正确的是( )
A.两元素形成化合物的化学式一定为YX
B.两元素形成的化合物中一定存在离子键
C.两元素原子形成化合物后体系的能量明显升高
D.如果形成化合物的化学式为YX2时,微粒之间不只含有离子键
B
解析 由题意可知X为Cl元素,Y为K元素或Ca元素,可以形成KCl或CaCl2,微粒之间只存在离子键,一旦形成化合物后体系的能量明显降低。
11.设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少 9个;
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出Y元素的名称________________________________________。
(2)X、Y两种元素最高价氧化物对应水化物反应的离子方程式为__________________________________________________________。
(3)写出X、Z形成化合物的电子式________________________________。
12.A、B、C、D是元素周期表中短周期里的四种元素,A能与D形成AD2型离子化合物,AD2中核外电子总数是30;D-的核外电子排布跟Al3+相同;B和C可以形成BC型化合物,BC分子中质子总数是18,BC水溶液是一种强酸。试回答:
(1)上述四种元素的名称分别是
A________________,B___________________, C________________,D________________。
(2)写出化合物AD2的电子式_____________________________________。
(3)A单质与热水反应的化学方程式是__________________________________。
解析 D-的核外电子排布跟Al3+相同,可知D是F元素,AD2中核外电子总数是30,因为核电荷数等于核外电子数,可计算出A的核电荷数等于12,是Mg,BC分子中质子总数是18,BC水溶液是一种强酸,可推知BC是HCl,故A是Mg、B是H、C是Cl、D是F。
13.M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A
14.(2021·福建龙岩高一月考)X、Y、Z、W是原子序数依次增大的不同主族的短周期元素,X、Y的简单离子的核外电子数相同,Y的原子半径是短周期主族元素原子中最大的,Z原子最外层电子数是K层的3倍。下列说法正确的是( )
A.简单离子半径:Y>Z
B.X的最高价氧化物对应水化物的化学式为H3XO4
C.气态氢化物的稳定性:W D.Y与Z、W都能形成离子化合物
D
解析 X、Y、Z、W是原子序数依次增大的不同主族的短周期元素,Y的原子半径是短周期主族元素原子中最大的,则Y为Na;Z原子最外层电子数是K层的3倍,则Z为S,W为Cl;X、Y的简单离子的核外电子数相同,且X、Y、Z、W不同主族,则X为N。电子层数越多,离子半径越大,简单离子半径:YZ,故C错误;Na元素与S、Cl元素分别形成的Na2S、NaCl都是离子化合物,故D正确。
15.(2021·河南郑州高一检测)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。氮化钠(Na3N)是一种实施管制的化学品,它是科学家制备的一种重要的化合物,与水作用可产生NH3。
请回答下列问题:
(1)Na3N的电子式是____________,该化合物是由____________键形成的。
(2)Na3N与盐酸反应生成____________种盐,其电子式分别是______________________、________________________。
(3)Na3N与水的反应属于____________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________r(N3-)(填“>”“=”或
“<”)。
Thanks!
本课时内容结束
第二单元 微粒之间的
相互作用力
第一课时 离子键
【课程标准要求】
1.知道化学键的概念。了解离子键的概念与形成,了解离子化合物的概念,会判断离子化合物。
2.能用电子式表示简单的离子化合物。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、离子键及离子化合物
1.化学键
(1)概念:物质中直接相邻的原子或离子之间存在的________________叫做化学键。
(2)类型:________和________是两种常见的化学键。
强烈的相互作用
离子键
共价键
2.离子键
(1)形成过程:如 NaCl的形成过程如图所示:
Na原子和Cl原子最外层电子数分别为1和7,均不稳定,它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过__________结合在一起,形成新物质NaCl。
(2)概念:____________之间存在的强烈的相互作用。
(3)构成离子键的粒子是________和________。
(4)离子键的实质是__________。
3.离子化合物:由____________构成的化合物称为离子化合物。
静电作用
阴、阳离子
阳离子
阴离子
静电作用
阴、阳离子
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)相邻的两个原子之间强烈的相互作用叫做化学键( )
(2)离子键的实质是阴离子、阳离子之间的静电作用( )
(3)活泼金属与活泼非金属化合时易形成离子键( )
(4)构成离子键的粒子是阳离子和阴离子( )
(5)含有离子键的化合物都是离子化合物( )
×
√
√
√
√
二、电子式
1.概念:为了方便表示原子、离子的最外层的电子的排布,在元素符号周围用“·”(小黑点)或“×”(小叉号)表示原子或离子的____________的式子叫做电子式。
最外层电子
2.电子式的书写
(1)原子的电子式:如氢原子 、氯原子 。
(2)简单阳离子的电子式:简单阳离子是原子失去最外层电子后形成的,其电子式就是其阳离子符号,如Na+、Mg2+等。
(3)简单阴离子的电子式:如氯离子(Cl-)的电子式为 、氧离子
(O2-)的电子式为 。
(4)离子化合物的电子式:如氟化镁的电子式为 、
氧化钙的电子式为 。
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
√
×
×
×
二、电子式的书写
一、认识离子键与离子化合物
一、认识离子键与离子化合物
1.离子键
(1)成键微粒:形成离子键的微粒是原子发生了电子得失形成带有电荷的阴、阳离子,即得电子后微粒带负电荷称为阴离子;失电子后微粒带正电荷称为阳离子。
(2)成键本质
(3)成键过程:
如NaCl、K2O、MgCl2、CaS等都是靠离子键结合的。
2.离子化合物
(1)离子化合物的性质
①离子键一般比较牢固,破坏它需要较高的能量,所以离子化合物的熔点一般比较高,常温下为固体。
②离子化合物在溶于水或熔化时,离子键被破坏,形成自由移动的阴、阳离子,能够导电,故离子化合物都是电解质。
(2)常见的离子化合物
①活泼的金属元素与活泼的非金属元素形成的化合物,如NaF、CaCl2等;
②活泼的金属元素与酸根形成的盐类化合物,如Na2CO3、MgSO4等;
③活泼的金属元素与氢氧根形成的碱,如NaOH、Ba(OH)2等;
④铵根与酸根形成的盐类化合物(铵盐),如NH4HCO3、NH4NO3等。
(3)离子键与离子化合物的关系:
①离子化合物中一定含有离子键;含有离子键的化合物一定是离子化合物;
②离子化合物中一定含有阴离子和阳离子;③离子化合物中不一定只含有离子键。如NH4NO3、Na2O2是离子化合物,但在NH4NO3、Na2O2中除了含有离子键外,还含有共价键。
1.下列说法不正确的是( )
A.离子化合物中的阳离子不一定是金属阳离子
B.离子化合物中一定含有离子键
C.离子化合物中一定含有阳离子和阴离子
D.离子化合物一定能导电
解析 固态离子化合物中的阴、阳离子不能自由移动,不能导电,离子化合物一般溶于水或在熔融状态下能导电,D错误。
D
2.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属元素原子与所有非金属元素原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
解析 离子键是使阴、阳离子结合成稳定化合物的静电作用,包括斥力和引力,A项错误;活泼金属元素原子与活泼非金属元素原子间易形成离子键,但也有例外,如AlCl3,B项错误;CaCl2中,两个氯离子(都是阴离子)之间不存在离子键,离子键存在于阴离子和阳离子之间,C项错误;含有离子键的化合物一定是离子化合物,D项正确。
D
3.(2021·江苏常州高一期中)下列各组原子序数所表示的两种元素,能形成AB2型
离子化合物的是( )
A.11和16 B.12和9
C.14和8 D.7和8
B
解析 能形成AB2型离子化合物,说明A、B分别是活泼金属和活泼非金属元素,且A位于第ⅡA、B位于第ⅦA族。11号元素是Na,位于第ⅠA族,16号元素是S,位于第ⅥA族,形成化合物是Na2S,A不符合; 12号元素是Mg,位于第ⅡA族,9号元素是F,位于第ⅦA族,形成化合物是MgF2,故B符合; 14号元素是Si,位于第ⅣA族,8号元素是O,位于第ⅥA族,形成化合物是SiO2不含离子键,故C不符合; 7号元素是N,位于第ⅤA族,8号元素是O,位于第ⅥA族,形成的化合物不是离子化合物,故D不符合。
二、电子式的书写
1.原子的电子式
2.离子的电子式
3.离子化合物的电子式
每个离子都要单独写,而且要符合其实际相邻关系。将离子化合物中的阴、阳离子的电子式按一定顺序排列在一起就是离子化合物的电子式。
4.下列关于电子式的说法不正确的是( )
A.每种元素的原子都可以写出电子式
B.简单阳离子的电子式与它的离子符号相同
C.阴离子的电子式要加方括号表示
D.电子式就是核外电子排布的式子
解析 电子式是指在元素符号的周围用“·”或“×”来表示原子的最外层电子,以简明的表示原子、离子的最外层电子排布的式子,A、B、C正确,D错误。
D
5.下列有关电子式的叙述正确的是( )
C
6.(2021·山东高一期中)下列化学用语的表述不正确的是( )
B
1.下列叙述中,错误的是( )
A.Na原子和Cl原子作用生成NaCl后,其结构的稳定性增强
B.在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与
原子核之间的排斥作用
C.任何微粒在形成离子键的过程中必定有电子的得与失
D.Na与Cl2反应生成NaCl后,体系能量降低
C
解析 活泼的金属原子和活泼的非金属原子之间形成离子化合物,阳离子和阴离子均达到稳定结构,这样体系的能量降低,其结构的稳定性增强, A、B、D正确;离子键的形成只是阴、阳离子间的静电作用,并不一定发生电子的得失,如Na+与OH-结合成NaOH。
2.下列关于离子键的说法错误的是( )
A.离子键是阴、阳离子之间的静电作用
B.离子键是阴、阳离子这样的正、负电荷之间的相互吸引力
C.H-与Ca2+两种微粒之间可以形成离子键
D.F-与K+两种微粒之间可以形成离子键
B
解析 离子键是阴、阳离子之间的静电作用,这种“作用”并不单纯是正、负电荷之间的吸引力。因为离子都有带正电荷的原子核,一般都有带负电荷的电子,所以,阴、阳离子之间既有异性电荷之间的吸引作用,又有同性电荷之间的排斥作用,这些作用的总和达到一定的强烈程度就形成了离子键。H-与
Ca2+是两种带异性电荷的离子,可以形成离子键。F-是带负电荷的阴离子,
K+是带正电荷的阳离子,能形成离子键。
3.下列微粒电子式错误的是( )
B
4.(2021·黑龙江高一期中)AB属于离子型化合物,其中A离子和B离子的电子层结构不同,从原子的最外层电子数看A比B少4,而次外层电子数A比B多6,则该离子化合物可能是( )
A.MgO B.CaO
C.KCl D.MgS
解析 从A、B两元素的原子结构看,B原子只有两个电子层,符合此要求的只有A、B两项;A离子和B离子的电子层结构不同,只有B项符合。
B
5.已知:氢化钠(NaH)是一种离子化合物,其中钠元素是+1价,NaH跟水反应
放出H2。回答下列问题:
(1)在氢化钠中存在的化学键为________。
(2)NaH中的氢离子半径比锂离子半径________。
(3)写出NaH的电子式________。
(4)写出NaH与水反应的化学方程式___________________________________,
在该反应中属于氧化剂的是________,属于还原剂的是________。
答案 (1)离子键 (2)大 (3)Na+[∶H]-
(4)NaH+H2O===NaOH+H2↑ H2O NaH
解析 NaH为离子化合物,由阴离子H-和阳离子Na+构成。Li+与H-的电子层结构相同,但由于Li的核电荷数大,所以离子半径小。
1.下列叙述中正确的是( )
A.化学键只存在于分子之间
B.化学键只存在于离子之间
C.形成化学键的微粒可以是原子也可以是离子
D.化学键是相邻的分子之间强烈的相互作用
解析 化学键是物质中直接相邻的原子或离子之间的强烈的相互作用。在把握概念时注意:①相邻,因为若不相邻,其作用力必然很弱;②原子或离子是成键微粒;③强烈的相互作用区别于弱的相互作用。
C
2.关于氯化钠的形成过程。下列相关叙述中不正确的是( )
A.钠原子易失去一个电子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其稳定性增强
D.氯化钠是离子化合物
解析 钠原子最外层只有1个电子,当它失去1个电子后形成的Na+具有最外层8个电子的稳定结构,氯原子最外层有7个电子,当它得到1个电子后形成的Cl-具有最外层8个电子的稳定结构,Na+和Cl-通过静电作用形成离子键,从而构成离子化合物NaCl。
B
3.下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( )
A.6和8 B.19和16
C.12和17 D.10和8
解析 C与O不可形成离子化合物,A错误;K与S可形成离子化合物K2S,但不为AB2型,B错误;Ne与O不能形成化合物,D错误。
C
4.下列性质中,可以证明某化合物一定为离子化合物的是( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
解析 熔融状态下能导电是离子化合物的性质。
D
5.下列关于离子键和离子化合物的说法正确的是( )
A.阴、阳离子间通过静电引力形成离子键
B.阴、阳离子间通过离子键一定能形成离子化合物
C.离子化合物一定能导电
D.第ⅠA族与第ⅦA族元素之间一定形成离子化合物
解析 A项,离子键是指阴、阳离子间的静电作用,它包括静电引力和静电斥力作用;B项,通过离子键形成的化合物只能是离子化合物;C项,离子化合物在水溶液中或熔融状态下才能导电;D项,氢元素是非金属元素,与卤族元素不能形成离子化合物。
B
6.下列叙述中不正确的是( )
A.活泼金属元素与活泼非金属元素化合时,一般能形成离子键
B.阴、阳离子通过静电引力所形成的化学键叫做离子键
C.离子所带电荷的符号和数目与原子成键时得失电子有关
D.阴、阳离子之间通过离子键形成的化合物一定是离子化合物
解析 活泼金属元素容易失去电子形成阳离子,活泼非金属元素容易得电子形成阴离子,阴、阳离子之间通过静电作用形成离子键,A正确;静电作用包括静电引力和静电斥力,B错误;原子形成离子键时,失电子带正电荷,得电子带负电荷,且离子所带电荷数与得失电子数一致,C正确;由离子键形成的化合物一定是离子化合物,D正确。
B
7.阳离子和阴离子都具有稀有气体元素原子结构,且阳离子比阴离子少两个电子层的离子化合物是( )
A.MgCl2 B.CaBr2
C.NaF D.KI
解析 选项中的四种化合物都为离子化合物,阳离子和阴离子具有的电子层数为
D
离子 Na+ Mg2+ Ca2+ K+ F- Cl- Br- I-
电子层数 2 2 3 3 2 3 4 5
8.下列有关化学用语正确的是( )
A
9.如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的
是( )
A.M与X、N都不能形成离子键
B.Y、Z和N形成的化合物均为离子化合物
C.N的气态氢化物在水中完全电离成离子属离子化合物
D.Y元素和X元素可以形成Y2X2型化合物,阴、阳离子物质的量之比为1∶1
A
10.X元素的原子最外层有7个电子,Y元素的原子与X元素的原子的次外层上都有8个电子,X与Y形成的化合物中两离子的电子层结构相同,以下说法中正确的是( )
A.两元素形成化合物的化学式一定为YX
B.两元素形成的化合物中一定存在离子键
C.两元素原子形成化合物后体系的能量明显升高
D.如果形成化合物的化学式为YX2时,微粒之间不只含有离子键
B
解析 由题意可知X为Cl元素,Y为K元素或Ca元素,可以形成KCl或CaCl2,微粒之间只存在离子键,一旦形成化合物后体系的能量明显降低。
11.设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少 9个;
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出Y元素的名称________________________________________。
(2)X、Y两种元素最高价氧化物对应水化物反应的离子方程式为__________________________________________________________。
(3)写出X、Z形成化合物的电子式________________________________。
12.A、B、C、D是元素周期表中短周期里的四种元素,A能与D形成AD2型离子化合物,AD2中核外电子总数是30;D-的核外电子排布跟Al3+相同;B和C可以形成BC型化合物,BC分子中质子总数是18,BC水溶液是一种强酸。试回答:
(1)上述四种元素的名称分别是
A________________,B___________________, C________________,D________________。
(2)写出化合物AD2的电子式_____________________________________。
(3)A单质与热水反应的化学方程式是__________________________________。
解析 D-的核外电子排布跟Al3+相同,可知D是F元素,AD2中核外电子总数是30,因为核电荷数等于核外电子数,可计算出A的核电荷数等于12,是Mg,BC分子中质子总数是18,BC水溶液是一种强酸,可推知BC是HCl,故A是Mg、B是H、C是Cl、D是F。
13.M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A
14.(2021·福建龙岩高一月考)X、Y、Z、W是原子序数依次增大的不同主族的短周期元素,X、Y的简单离子的核外电子数相同,Y的原子半径是短周期主族元素原子中最大的,Z原子最外层电子数是K层的3倍。下列说法正确的是( )
A.简单离子半径:Y>Z
B.X的最高价氧化物对应水化物的化学式为H3XO4
C.气态氢化物的稳定性:W
D
解析 X、Y、Z、W是原子序数依次增大的不同主族的短周期元素,Y的原子半径是短周期主族元素原子中最大的,则Y为Na;Z原子最外层电子数是K层的3倍,则Z为S,W为Cl;X、Y的简单离子的核外电子数相同,且X、Y、Z、W不同主族,则X为N。电子层数越多,离子半径越大,简单离子半径:Y
15.(2021·河南郑州高一检测)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。氮化钠(Na3N)是一种实施管制的化学品,它是科学家制备的一种重要的化合物,与水作用可产生NH3。
请回答下列问题:
(1)Na3N的电子式是____________,该化合物是由____________键形成的。
(2)Na3N与盐酸反应生成____________种盐,其电子式分别是______________________、________________________。
(3)Na3N与水的反应属于____________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________r(N3-)(填“>”“=”或
“<”)。
Thanks!
本课时内容结束
