专题5 第一单元 元素周期律和元素周期表 第二课时 元素周期表及应用(共90张PPT)
文档属性
| 名称 | 专题5 第一单元 元素周期律和元素周期表 第二课时 元素周期表及应用(共90张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 21:04:36 | ||
图片预览











文档简介
(共90张PPT)
第二课时
元素周期表及应用
1.知道元素周期表的编排原则以及周期、族的概念,能画出元素周期表的框架。掌握元素周期表的结构和元素在周期表中的位置。
2.知道元素周期表金属元素区和非金属元素区的划分。
3.了解元素周期表、元素周期律在科研和生产实践中的应用。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、元素周期表的结构
1.现行元素周期表的编排原则
(1)原子核外__________相同的元素,按__________递增的顺序从左到右排成横行。每个横行称为一个______。
(2)原子核外______________相同的元素,按__________递增的顺序由上而下排成纵行。每个纵行称为一个____ (8、9、10纵行除外)。
电子层数
原子序数
周期
最外层电子数
电子层数
族
2.元素周期表的结构
(1)元素周期表的结构
一、二、三
四、五、六、七
7
7
1
8、9、10
1
18
8
元素的周期表中:周期序数=__________,主族序数=______________。
(2)常见族的别称
电子层数
最外层电子数
族 别名
ⅠA族(除氢外) __________元素
ⅦA族 ________元素
0族 稀有气体元素
碱金属
卤族
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)元素周期表中有四个长周期、三个短周期( )
(2)同一周期主族元素原子的核外电子层数相同( )
(3)同一周期主族元素原子的最外层电子数不同( )
(4)元素周期表中每个周期均从金属元素开始、非金属元素结束( )
√
√
√
×
二、主族元素性质的递变规律
1.碱金属的性质
(1)物理性质
元素 Li、Na、K、Rb、Cs(原子序数增大)
相同点 除铯外,其余都呈______色,硬度小,延展性好,密度比较____,熔点也比较____,导电、导热性强
银白
小
低
(2)碱金属与水反应的现象
结论:ⅠA族元素金属性随着原子序数的递增而______。
碱金属 Li Na K Rb Cs
与水反应的现象 反应较为缓和,锂浮在水面,并以稳定、适中的速度释放出气体 反应迅速并放热,钠融化成小球 反应迅速,伴有燃烧,轻微爆炸 剧烈反应, 发生爆炸 剧烈反应,
发生剧烈爆炸
增强
2.卤族元素的性质
(1)卤素包括F、Cl、 Br、 I、 At。
(2)卤素单质及其化合物在生活中的用途:牙膏中添加氟化钠可降低患蛀牙的概率,具有强氧化性的氯气可用于自来水和泳池杀菌消毒,碘酒在医疗中用于伤口的消毒等。
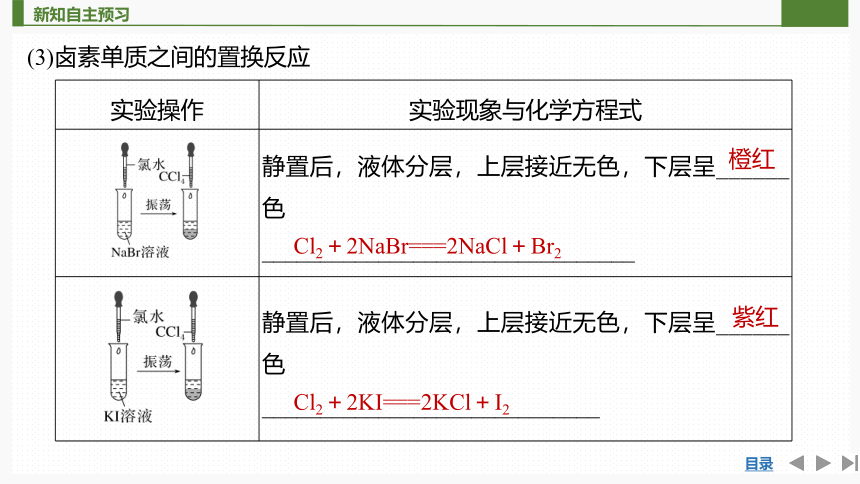
(3)卤素单质之间的置换反应
实验操作 实验现象与化学方程式
静置后,液体分层,上层接近无色,下层呈______色
________________________________
静置后,液体分层,上层接近无色,下层呈______色
_____________________________
橙红
Cl2+2NaBr===2NaCl+Br2
紫红
Cl2+2KI===2KCl+I2
静置后,液体分层,上层接近无色,下层呈______色_________________________________
结论 Cl2→Br2→I2氧化性逐渐______,相应卤素离子还原性逐渐______
紫红
Br2+2KI===2KBr+I2
减弱
增强
3.金属元素与非金属元素的分区及性质递变规律
图中序号所示内容。
①______ ②______ ③______ ④______ ⑤________
⑥______ ⑦______ ⑧________
(1)元素周期表的左下方是金属性最强的元素(钫),右上方是非金属性最强的元素(氟)。碱性最强的是FrOH,酸性最强的含氧酸是HClO4。
(2)分界线附近的元素,既能表现出一定的________,又能表现出一定的__________,故元素的________和__________之间没有严格的界线。
增强
Al
Si
金属
非金属
增强
增强
增强
金属性
非金属性
金属性
非金属性
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)根据元素周期律可知金属性最强的是钫,非金属性最强的是氦( )
(2)K比Na活泼,故K可以从钠盐溶液中置换出Na( )
(3)碱金属元素即ⅠA族元素( )
(4)第3周期元素的主族序数等于它们的最高正化合价( )
(5)HX都极易溶于水,它们的热稳定性随核电荷数增加而增强( )
×
×
×
√
×
三、元素周期表的应用
1.根据同周期、同主族元素性质的递变规律判断元素性质的______ (或______)。
2.应用于元素“______—______—______”的相互推断。
3.寻找新材料和稀有矿产。
4.寻找新物质
(1)在金属与非金属分界线附近寻找________材料。
(2)研究________________附近元素,制造新农药。
(3)在过渡金属元素中寻找________,并通过加入少量稀土元素改善性能。
(4)在ⅣB到ⅥB族的过渡金属元素中寻找________、________的材料,用以制
造火箭、导弹、宇宙飞船等。
强弱
大小
位置
结构
性质
半导体
氟、氯、硫、磷
催化剂
耐高温
耐腐蚀
【微自测】
3.判断正误,正确的打“√”,错误的打“×”。
(1)锗元素属于金属元素,但也具有一定的非金属性( )
(2)金属不可能具有非金属性,非金属不可能具有金属性( )
(3)处于金属与非金属分界线附近的元素常用作催化剂材料( )
(4)周期表中的每个主族元素中都有非金属元素( )
√
×
×
×
二、元素周期表中元素性质递变规律
一、元素周期表的结构与应用
一、元素周期表的结构与应用
1.元素周期表的结构与元素分布
过渡元素:元素周期表中第ⅢB族到第ⅡB族(3~12列)为过渡元素,这些元素都是金属元素,所以又称为过渡金属。
2.元素周期表中重要元素原子序数的关系
(1)同周期第ⅡA族和第ⅢA族元素原子序数差
(2)同主族相邻两元素原子序数的差的情况
①若为第ⅠA、ⅡA族元素,则原子序数的差等于上周期的元素种类数。
②若为第ⅢA族至0族元素,则原子序数的差等于下周期的元素种类数。
3.元素周期表中的方格中各符号的意义
4.元素周期表的简单应用——元素推断
(1)周期表中元素的位置与原子结构的关系推断。
(2)利用“0族定位法”确定元素在周期表中的位置
①掌握或明确0族元素的周期序数和原子序数
0族元素 He Ne Ar Kr Xe Rn Og
周期序数 1 2 3 4 5 6 7
原子序数 2 10 18 36 54 86 118
②比大小定周期:找出与原子序数相邻且比其大的0族元素周期序数,则该元素与此0族元素处于同一周期。
③求差值定族数:若原子序数比相应0族元素的原子序数多1或2,则该元素应位于0族元素的下一个周期的第ⅠA族或第ⅡA族;若原子序数比相应的0族元素的原子序数少1~5,则该元素应位于0族元素所在周期的第ⅦA族~第ⅢA族(17~13列)。
1.(2021·江苏盐城高一期末)下列关于元素周期表的认识中不正确的是( )
A.元素周期表有18个族
B.元素周期表有七个周期
C.元素原子的电子层数等于其所在周期的周期序数
D.主族元素原子的最外层电子数等于其所在族的族序数
解析 元素周期表有7个主族、7个副族、1个0族和1个第Ⅷ族,共16个族,A错误;元素周期表有7个横行,即有七个周期,B正确;元素所在周期的周期序数和原子的电子层数相等,C正确;主族元素所在族的族序数等于该元素原子最外层电子数,D正确。
A
B
2.俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子。这4个原子生成数微秒后衰变成第113号元素的原子。下列有关叙述正确的是( )
A.115号元素位于第六周期
B.113号元素位于第七周期ⅢA族
C.115号和113号元素都是非金属元素
D.镅元素和115号元素不在同一周期
解析 95号镅元素、115号元素、113号元素的原子序数都大于86而小于118,所以都位于第七周期,A、D项错误;115号元素比118号元素的原子序数小3,应在ⅤA族,113号元素在ⅢA族,B项正确;113号元素和115号元素都是金属元素,C项错误。
3.(2021·河南实验中学高一期中)图为元素周期表的一部分,表中的数字为原子
序数,其中M的原子序数为37的是( )
B
二、元素周期表中元素性质递变规律
1.碱金属元素单质化学性质的相似性、递变性和特殊性
(1)碱金属的相似性(用R表示碱金属元素)
(2)碱金属的递变性
①与O2反应:从Li→Cs,与O2反应越来越剧烈,产物越来越复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。
②与H2O(或酸)的反应:从Li→Cs,与H2O(或酸)反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb和Cs遇水发生剧烈爆炸。
(3)最高价氧化物对应水化物的碱性:LiOH2.卤族元素单质化学性质的相似性、递变性和特殊性
(2)递变性
①氧化性与还原性
②与H2反应的难易程度及对应氢化物稳定性(由F2→I2):与H2反应越来越难,生成的氢化物的稳定性逐渐减弱,还原性逐渐增强。
③卤素单质与变价金属(如Fe)反应:2Fe+3X2===2FeX3(X=F、Cl、Br), Fe+I2===FeI2。
(3)特殊性
①溴是常温常压下唯一的液态的非金属单质。
②卤素单质都有毒,溴有很强的腐蚀性,液溴易挥发,保存时要加一些水进行“水封”,碘可升华,遇淀粉溶液变蓝(检验I2)。
③Cl2、Br2、I2易溶于有机溶剂苯、CCl4、汽油等。
④F无正化合价。
3.元素周期表中元素性质递变规律(稀有气体除外)
元素性 质递变 同周期 (左→右) 同主族
(上→下)
原 子 结 构 电子层数 相同 增多
最外层电子数 1个→8个 (第1周期1→2) 相同
原子半径 逐渐减小 逐渐增大
元 素 性 质 原子得电子能力 逐渐增强 逐渐减弱
原子失电子能力 逐渐减弱 逐渐增强
元素的金属性 逐渐减弱 逐渐增强
元素的非金属性 逐渐增强 逐渐减弱
元素的主要化合价 最高正价由+1→+7(O、F除外),最低负价由-4→-1 最高正价数=主族序数(O、F除外)
非金属气态 氢化物 形成 难→易 易→难
稳定性 逐渐增强 逐渐减弱
还原性 逐渐减弱 逐渐增强
最高价氧化物的水化物 酸性 逐渐增强 逐渐减弱
碱性 逐渐减弱 逐渐增强
金属阳离子氧化性 逐渐增强 逐渐减弱
非金属阴离子还原性 逐渐减弱 逐渐增强
4.(2021·河北邢台高一开学考试)下列物质性质的比较中,不正确的是( )
A.原子半径大小:Na>Mg>Al
B.碱性强弱:KOH>NaOH>LiOH
C.最简单气态氢化物的稳定性:HF>HCl>HBr
D.还原性强弱:Cl->Br->I-
D
解析 同一周期元素,原子序数越大,原子半径越小,所以原子半径大小:Na>Mg>Al,A正确;同一主族元素,从上到下元素的金属性逐渐增强。元素的金属性越强,其相应的碱的碱性就越强。由于元素的金属性:K>Na>Li,所以碱性强弱:KOH>NaOH>LiOH,B正确;同一主族元素,从上到下元素的非金属性逐渐减弱。元素的非金属性越强,其相应的简单氢化物稳定性就越强。由于元素的非金属性:F>Cl>Br,所以最简单气态氢化物的稳定性:HF>HCl>HBr,C正确;元素的非金属性越强,其阴离子的还原性就越弱。由于元素的非金属性:Cl>Br>I,所以离子的还原性:Cl-<Br-<I-,D错误。
5.(2021·福建厦门高一期末)下列事实不能用元素周期律解释的是( )
A.碱性:Mg(OH)2>Be(OH)2
B.热稳定性:Na2CO3>NaHCO3
C.酸性:HClO4>H2SO4
D.气态氢化物的稳定性:NH3>PH3
B
解析 A项,元素最高价氧化物对应水化物的碱性与其金属性强弱一致,故碱性:Mg(OH)2>Be(OH)2能用元素周期律解释; B项,热稳定性:Na2CO3> NaHCO3,是碳酸盐和碳酸氢盐的稳定性,与元素的金属性和非金属性无关,不能用元素周期律解释; C项,元素最高价氧化物对应水化物的酸性与其非金属性强弱一致,酸性:HClO4>H2SO4能用元素周期律解释; D项,非金属元素的简单气态氢化物的稳定性与其非金属性强弱一致,气态氢化物的稳定性:NH3>PH3能用元素周期律解释。
6.(2022·江苏南京高一期末)海水中的X、Y、Z、W四种短周期元素在元素周期
表中的位置如下表所示,元素X最高正化合价与最低负化合价的代数和为0。
下列有关说法正确的是( )
A.原子半径:r(X)B.元素X的非金属性比Y的强
C.元素Y的简单气态氢化物的热稳定性比W的弱
D.元素Z最高价氧化物对应的水化物的酸性比X的强
D
X Y
Z W
解析 根据题意,X元素为C或Si,但下一周期的Z和W也为短周期,因此X为C,Y为F,Z为S,W为Cl。同一周期从左到右元素的原子半径逐渐减小,则原子半径:r(X)>r(Y),A错误;同一周期从左到右元素的非金属性逐渐增强,则元素Y非金属性比X强,B错误;非金属性Y>W,则元素Y简单气态氢化物热稳定性强于W,C错误;非金属性Z(S)>X(C),则元素Z最高价氧化物对应的水化物的酸性比X的强,D正确。
1.下列关于元素周期表的说法正确的是( )
A.元素周期表中的族可以简称为“七主七副一0一Ⅷ”共16列
B.元素周期表中ⅢB族到ⅡB族共10个纵行的元素都是金属元素
C.元素周期表中每个短周期都含有8种元素
D.元素周期表中所有元素都是从自然界中发现的
解析 元素周期表中共有16个族,但是共有18列,A错误;第1周期含有2种元素,C错误;有些元素是人工合成的,D错误。
B
2.我国西部地区蕴藏着丰富的锂资源,开发锂的用途是一个重要的科学课题。
关于锂的叙述不正确的是( )
A.锂是较轻的金属
B.LiOH的碱性比NaOH的弱
C.锂的金属性比钠的强
D.锂在空气中燃烧生成Li2O
解析 锂比钠的活泼性弱,在空气中燃烧只生成Li2O,LiOH的碱性比NaOH的弱,锂的金属性比钠的弱,C项错误。
C
3.(2021·河北石家庄高一期中)氮族元素与同周期碳族、氧族、卤族元素相比较,
下列递变规律正确的是( )
A.还原性:SiH4<PH3<HCl
B.原子半径:Si<P<S<Cl
C.非金属性:C<N<O<F
D.酸性:H3PO4<H2SiO3<H2SO4
C
解析 元素的非金属性:Si<P<Cl,还原性:SiH4>PH3>HCl,A错误;同周期从左到右原子半径减小,原子半径:Si>P>S>Cl,B错误;同周期从左到右元素的非金属性增强,非金属性:C<N<O<F,C正确;同周期从左到右元素的非金属性增强,元素最高价氧化物对应水化物酸性增强,酸性:H2SiO3<H3PO4<H2SO4,D错误。
4.(2022·江苏连云港高一期末)短周期主族元素X、Y、Z、M、N的原子序数依次
增大,原子半径及主要化合价见下表:
根据表中信息,判断以下说法正确的是( )
A.离子半径:r(N2-)>r(Z2+)
B.由X、Y两种元素组成的化合物只有一种
A
元素 X Y Z M N
原子半径/pm 66 186 160 143 104
主要化合价 -2 +1 +2 +3 -2、+4、+6
C.相同条件下,简单气态氢化物的热稳定性:N>X
D.元素Y、Z、M中,M原子失电子能力最强
解析 根据元素的化合价和原子半径,N有-2、+4、+6价,N为S,X为O,Y为Na、Z为Mg、M为Al。电子层越多,半径越大,离子半径:r(S2-)>
r(Mg2+), A正确; 由X、Y两种元素组成的化合物可以是Na2O、Na2O2,B错误;周期表中同主族从下到上,元素的非金属性增强,元素的氢化物稳定性增强,相同条件下,简单气态氢化物的热稳定性:H2O>H2S,C错误; Y为Na、Z为Mg、M为Al,同周期从右到左,元素的金属性增强,元素Y、Z、M中,M原子失电子能力最弱,D错误。
5.(1)常见卤素氢化物中最不稳定的是________(写化学式)。
(2)下列单质熔、沸点随原子序数递增而升高的是________(填字母,下同)。
A.碱金属元素 B.卤族元素
(3)下列反应中,更剧烈的是________。
A.钠与水反应 B.钾与水反应
(4)取下列溶液分装两试管,再分别依次加入少量氯水和少量四氯化碳,用力振荡、静置后,四氯化碳层显紫红色的是________。
A.溴化钠溶液 B.碘化钾溶液
答案 (1)HI (2)B (3)B (4)B
解析 常见卤素中碘元素的非金属性最弱,氢化物中最不稳定的是HI;碱金属元素的单质熔、沸点随原子序数递增而降低,卤素单质熔、沸点随原子序数递增而升高;钾比钠活泼,与水反应更剧烈;氯水与NaBr、KI溶液反应分别生成Br2、I2,而二者的四氯化碳溶液分别为橙色、紫红色。
1.以下关于锂、钠、钾、铷、铯的叙述中不正确的是( )
①氢氧化物中碱性最强的是CsOH ②单质熔点最高的是铯 ③单质都是热和电的良导体 ④单质的密度依次增大,且都比水轻 ⑤单质的还原性依次增强 ⑥对应阳离子的氧化性依次增强
A.①③ B.②⑤
C.②④⑥ D.①③⑤
解析 单质熔点最高的应是Li,密度呈增大趋势,K出现反常,Rb、Cs的密度比水大,对应阳离子的氧化性应依次减弱。
C
C
解析 周期序数等于电子层数,主族元素最外层电子数等于主族序数,电子层数是4,最外层5个电子,所以位于第4周期ⅤA族,A项正确;砷是非金属元素,B项正确;非金属性越强最高价氧化物对应水化物的酸性越强,非金属性:P>As,所以酸性:H3AsO4<H3PO4,C项错误;非金属性越强氢化物越稳定,非金属性:P>As,所以稳定性:AsH3<PH3,D项正确。
3.下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强
④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④
C.②④⑤ D.①③⑤
解析 F2、Cl2、Br2、I2氧化性依次减弱,其对应的阴离子F-、Cl-、Br-、I-的还原性依次增强,故①叙述错误,⑤叙述正确;F2、Cl2、Br2、I2的颜色由淡黄绿色→黄绿色→深红棕色→紫黑色逐渐加深,②叙述正确;HF、HCl、HBr、HI的稳定性逐渐减弱,③叙述错误;F2、Cl2、Br2、I2在通常情况下其状态变化为气→液→固,则沸点逐渐升高,④叙述正确,C正确。
C
4.如图表示碱金属的某些性质与核电荷数的变化关系,
则下列各性质中不符合图示关系的是( )
A.还原性 B.与水反应的剧烈程度
C.熔点 D.原子半径
解析 由图可知,随碱金属的核电荷数的增大,碱金属的性质呈增大的趋势,碱金属的还原性增强,碱金属与水反应的剧烈程度增大,随核电荷数的增大,其原子半径增大,A、B、D项正确;随核电荷数的增大,碱金属单质的熔点逐渐减小,C项与图像不符。
C
5.(2021·河南高一期中)下列有关元素周期表的叙述正确的是( )
A.元素周期表中有18个纵行,但却只有16个族,其中第Ⅷ族所含元素种类
最多
B.第3、第4周期中同主族元素的质子数差都是8
C.主族元素的原子,形成单原子离子时的化合价和它的族序数不一定相等
D.简单微粒的核外电子层数等于其所在元素周期表的周期数
C
解析 元素周期表中有18个纵行,但却只有16个族,其中第ⅢB族所含元素种类最多,A错误;周期表中过渡元素左侧第三、第四周期中同主族元素的质子数差都是8,周期表中过渡元素右侧第三、第四周期中同主族元素的质子数差都是18,B错误;主族元素的原子,形成单原子离子时的化合价和它的族序数不一定相等,如阴离子O2-,C正确;简单阴离子微粒的核外电子层数等于其所在元素周期表的周期数,简单阳离子微粒的核外电子层数等于其所在元素周期表中上一周期数,D错误。
6.(2021·河南许昌高一期末)原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原
子序数之和不可能是(镧系、锕系、0族元素除外)( )
A.4x B.4x+6
C.4x+10 D.4x+14
解析 在A、B、C、D四种元素中,同周期的A、C两种元素的原子序数之和为2x,又因同主族各周期相邻的两元素之间的原子序数相差8、18、32。所以四种元素中,同主族的B、D两种元素的原子序数之和可能为2x、2x+10或2x+14。则四种元素的原子序数之和可能为4x、4x+10或4x+14,只有选项B不可能。
B
7.下列关于同主族元素的说法错误的是( )
A.同主族元素随原子序数递增,元素原子的得电子能力逐渐增强
B.同主族元素随原子序数递增,单质氧化能力逐渐减弱
C.同主族元素原子最外层电子数都相同
D.同主族元素的原子半径,随原子序数增大而逐渐增大
解析 同主族元素,最外层电子数相同,随原子序数增大,原子半径逐渐增大,得电子能力逐渐减弱,单质氧化性逐渐减弱,故A错误,B、C、D正确。
A
8.金属元素钫(Fr)在自然界中含量极少,它的21种已知同位素都有放射性,它是碱金属元素中最重的元素。根据钫在周期表中的位置预测其性质,其中不正确的是( )
A.在已知碱金属元素中具有最大的原子半径
B.在空气中燃烧时生成氧化物Fr2O
C.最高价氧化物对应的水化物是极强的碱
D.其单质的熔点比金属钠的熔点低
B
解析 根据“Fr是碱金属元素中最重的元素”,可以得到两个结论:一是它属于碱金属元素;二是它在周期表中处于碱金属元素的最下方。根据同主族元素性质的递变性规律可以知道它的金属性非常强,所以与氧气反应时得到的是复杂的氧化物。
9.下列关于元素周期律的叙述不正确的是( )
A.Na、Mg、Al最外层电子数依次增多,其金属性依次减弱
B.P、S、Cl最高化合价依次升高,对应简单气态氢化物的稳定性依次增强
C.原子半径大小关系为Na<Al<Si<Cl
D.Na、Mg、Al的氢氧化物的碱性依次减弱
解析 P、S、Cl的最高化合价分别为+5、+6、+7,由于P、S、Cl的非金属性依次增强,其所对应的气态氢化物的稳定性也依次增强;原子半径大小关系为Na>Al>Si>Cl;因Na、Mg、Al的金属性依次减弱,则它们的氢氧化物的碱性也依次减弱。
C
10.下列叙述中正确的是( )
B
11.(2021·江苏连云港高一期末)如图是元素
周期表的一部分。回答下列问题:
(1)溴被称为海洋元素。
①溴在元素周期表中位于第____________周期
____________族。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的酸是
____________(填化学式)。
③能够证明溴单质的氧化性强于碘单质的离子方程式是
___________________________________________________________________。
答案 (1)①4 ⅦA ②HClO4
③Br2+2I-===I2+2Br-
解析 (1)①根据氯元素在周期表中位于第3周期ⅦA族,溴与氯位于同一主族,所以溴元素在元素周期表中位于第4周期ⅦA族。②Br为卤族元素,卤族元素从上到下非金属性减弱,最高价含氧酸的酸性也减弱,由于F没有含氧酸,故最强含氧酸是HClO4。③根据氧化剂氧化性大于氧化产物氧化性的规律,用溴与碘化钾反应生成碘和溴化钾,反应的离子方程式:Br2+2I-===I2+2Br-,此反应Br2为氧化剂,碘为氧化产物,所以氧化性:溴大于碘。
答案 (2)①同位素 ②H2Se ③H2SeO3+2SO2+H2O===Se+2H2SO4
12.(2021·湖北荆州高一段考)元素周期表中前七周期的元素种类如表所示:
(1)表中________周期是短周期,________周期是长周期。
(2)第6、7周期比第4、5周期多了14种元素,其原因是____________________。
(3)元素周期表中第________族所含元素种类最多。
周期数 1 2 3 4 5 6 7
元素种类 2 8 8 18 18 32 32
答案 (1)1、2、3 4、5、6、7
(2)第6、7周期在第ⅢB族中出现了镧系、锕系,每个系的一个空格包含了15种元素
(3)ⅢB
(4)请分析周期数与元素种类的关系,预言第八周期最多可能含有的元素种类为________(填字母,下同)。
A.18种 B.32种 C.50种 D.64种
(5)据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb等的碳酸盐)中,查明有116号元素。试推断116号元素应位于元素周期表中的________。
A.第6周期第ⅣA族 B.第7周期第ⅥA族
C.第7周期第Ⅷ族 D.第8周期第ⅥA族
答案 (4)C (5)B
解析 (4)观察每一周期的元素种类发现,它们都是偶数,规律如下:
故第八周期最多可能含有的元素种类为2×52=50种。
(5)根据0族元素的原子序数推断,第7周期0族元素的原子序数为118,位于第18列,116号元素处于第16列,所以116号元素位于第7周期第ⅥA族。
周期数 1 2 3 4 5 6 7
元素 种类 2 2×1 2×12 8 2×4 2×22 8 2×4 2×22 18 2×9 2×32 18 2×9 2×32 32 2×16 2×42 32
2×16
2×42
13.(2021·河北石家庄高一期末)短周期主族元素G、X、Y、Z、W在元素周期表中的相对位置如图所示,其中元素Y的最外层电子数是内层电子数的三倍。下列说法正确的是( )
A.原子半径:Z>W>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.元素G、Y简单气态氢化物的稳定性:G>Y
D.元素X、Z、W、Y的最高正化合价分别与其
主族序数相等
B
解析 根据元素G、X、Y、Z、W在周期表的位置,可知G、X、Y三种元素为第2周元素,Z、W为第3周期元素,其中元素Y的最外层电子数是内层电子数的三倍,可知Y是O元素,则G、X、Z、W四种元素分别是C、N、Si、P四种元素。同一周期的元素,原子序数越大,原子半径越小,则Z>W,X>Y,同一主族元素,原子序数越大,原子半径越大,则W>X,所以四种元素的原子半径大小为Z>W>X>Y(Si>P>N>O), A错误;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,根据元素在周期表位置,
可判断元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:HNO3>H3PO4>H2SiO3(X>W>Z),B正确;元素的非金属性越强,其相应的氢化物的稳定性就越强,根据元素G、Y在周期表的位置,可知非金属性G14.(2021·山东聊城高一期末)下表是部分短周期元素的原子半径及主要化
合价,以下叙述正确的是( )
C
元素代号 L M Q R T
原子半径/nm 0.160 0.143 0.089 0.102 0.074
主要化合价 +2 +3 +2 +6、-2 -2
A.气态氢化物的稳定性为R>T
B.L、M的简单离子半径LC.单质L比Q更容易与稀盐酸反应产生H2
D.L2+与R2-的核外电子数相等
解析 同一周期,左到右,原子半径减小,同一主族,从上到下,原子半径增大;五种元素为1~18号元素,Q、T两种原子半径最小,且Q>T,Q为+2价,Q为Be,T为-2价,T为O;L、M、R原子半径均大于Q、T两种原子半径,三种元素位于第3周期,且原子半径L最大,化合价为+2价,L为Mg,M原子半径略小于镁,化合价为+3价,M为Al,R原子半径较小,化合价为+6、-2价,R为S,即L为Mg,M为Al,Q为Be,R为S,T为O。非金属性
越强,氢化物越稳定,非金属性:O>S,所以稳定性:H2O>H2S,即RM,故B错误;同一主族元素,从上到下,金属性增强,与酸反应越剧烈,所以镁与盐酸反应比铍与盐酸反应剧烈,故C正确;镁离子核外有10个电子,硫离子核外有18个电子,L2+与R2-的核外电子数不相等,故D错误。
15.现有部分短周期元素的性质或原子结构如表所示:
元素编号 元素性质或原子结构
T M层上电子数是K层上电子数的3倍
X 最外层电子数是次外层电子数的2倍
Y 常温下单质为双原子分子,其氢化物水溶液呈碱性
Z 元素最高正价是+7价
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____________________________(填化学式),
理由_____________________________________________________。
答案 (3)Cl b (4)H2CO3 H2CO3是弱酸且是非氧化性酸
Thanks!
本课时内容结束
第二课时
元素周期表及应用
1.知道元素周期表的编排原则以及周期、族的概念,能画出元素周期表的框架。掌握元素周期表的结构和元素在周期表中的位置。
2.知道元素周期表金属元素区和非金属元素区的划分。
3.了解元素周期表、元素周期律在科研和生产实践中的应用。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、元素周期表的结构
1.现行元素周期表的编排原则
(1)原子核外__________相同的元素,按__________递增的顺序从左到右排成横行。每个横行称为一个______。
(2)原子核外______________相同的元素,按__________递增的顺序由上而下排成纵行。每个纵行称为一个____ (8、9、10纵行除外)。
电子层数
原子序数
周期
最外层电子数
电子层数
族
2.元素周期表的结构
(1)元素周期表的结构
一、二、三
四、五、六、七
7
7
1
8、9、10
1
18
8
元素的周期表中:周期序数=__________,主族序数=______________。
(2)常见族的别称
电子层数
最外层电子数
族 别名
ⅠA族(除氢外) __________元素
ⅦA族 ________元素
0族 稀有气体元素
碱金属
卤族
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)元素周期表中有四个长周期、三个短周期( )
(2)同一周期主族元素原子的核外电子层数相同( )
(3)同一周期主族元素原子的最外层电子数不同( )
(4)元素周期表中每个周期均从金属元素开始、非金属元素结束( )
√
√
√
×
二、主族元素性质的递变规律
1.碱金属的性质
(1)物理性质
元素 Li、Na、K、Rb、Cs(原子序数增大)
相同点 除铯外,其余都呈______色,硬度小,延展性好,密度比较____,熔点也比较____,导电、导热性强
银白
小
低
(2)碱金属与水反应的现象
结论:ⅠA族元素金属性随着原子序数的递增而______。
碱金属 Li Na K Rb Cs
与水反应的现象 反应较为缓和,锂浮在水面,并以稳定、适中的速度释放出气体 反应迅速并放热,钠融化成小球 反应迅速,伴有燃烧,轻微爆炸 剧烈反应, 发生爆炸 剧烈反应,
发生剧烈爆炸
增强
2.卤族元素的性质
(1)卤素包括F、Cl、 Br、 I、 At。
(2)卤素单质及其化合物在生活中的用途:牙膏中添加氟化钠可降低患蛀牙的概率,具有强氧化性的氯气可用于自来水和泳池杀菌消毒,碘酒在医疗中用于伤口的消毒等。
(3)卤素单质之间的置换反应
实验操作 实验现象与化学方程式
静置后,液体分层,上层接近无色,下层呈______色
________________________________
静置后,液体分层,上层接近无色,下层呈______色
_____________________________
橙红
Cl2+2NaBr===2NaCl+Br2
紫红
Cl2+2KI===2KCl+I2
静置后,液体分层,上层接近无色,下层呈______色_________________________________
结论 Cl2→Br2→I2氧化性逐渐______,相应卤素离子还原性逐渐______
紫红
Br2+2KI===2KBr+I2
减弱
增强
3.金属元素与非金属元素的分区及性质递变规律
图中序号所示内容。
①______ ②______ ③______ ④______ ⑤________
⑥______ ⑦______ ⑧________
(1)元素周期表的左下方是金属性最强的元素(钫),右上方是非金属性最强的元素(氟)。碱性最强的是FrOH,酸性最强的含氧酸是HClO4。
(2)分界线附近的元素,既能表现出一定的________,又能表现出一定的__________,故元素的________和__________之间没有严格的界线。
增强
Al
Si
金属
非金属
增强
增强
增强
金属性
非金属性
金属性
非金属性
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)根据元素周期律可知金属性最强的是钫,非金属性最强的是氦( )
(2)K比Na活泼,故K可以从钠盐溶液中置换出Na( )
(3)碱金属元素即ⅠA族元素( )
(4)第3周期元素的主族序数等于它们的最高正化合价( )
(5)HX都极易溶于水,它们的热稳定性随核电荷数增加而增强( )
×
×
×
√
×
三、元素周期表的应用
1.根据同周期、同主族元素性质的递变规律判断元素性质的______ (或______)。
2.应用于元素“______—______—______”的相互推断。
3.寻找新材料和稀有矿产。
4.寻找新物质
(1)在金属与非金属分界线附近寻找________材料。
(2)研究________________附近元素,制造新农药。
(3)在过渡金属元素中寻找________,并通过加入少量稀土元素改善性能。
(4)在ⅣB到ⅥB族的过渡金属元素中寻找________、________的材料,用以制
造火箭、导弹、宇宙飞船等。
强弱
大小
位置
结构
性质
半导体
氟、氯、硫、磷
催化剂
耐高温
耐腐蚀
【微自测】
3.判断正误,正确的打“√”,错误的打“×”。
(1)锗元素属于金属元素,但也具有一定的非金属性( )
(2)金属不可能具有非金属性,非金属不可能具有金属性( )
(3)处于金属与非金属分界线附近的元素常用作催化剂材料( )
(4)周期表中的每个主族元素中都有非金属元素( )
√
×
×
×
二、元素周期表中元素性质递变规律
一、元素周期表的结构与应用
一、元素周期表的结构与应用
1.元素周期表的结构与元素分布
过渡元素:元素周期表中第ⅢB族到第ⅡB族(3~12列)为过渡元素,这些元素都是金属元素,所以又称为过渡金属。
2.元素周期表中重要元素原子序数的关系
(1)同周期第ⅡA族和第ⅢA族元素原子序数差
(2)同主族相邻两元素原子序数的差的情况
①若为第ⅠA、ⅡA族元素,则原子序数的差等于上周期的元素种类数。
②若为第ⅢA族至0族元素,则原子序数的差等于下周期的元素种类数。
3.元素周期表中的方格中各符号的意义
4.元素周期表的简单应用——元素推断
(1)周期表中元素的位置与原子结构的关系推断。
(2)利用“0族定位法”确定元素在周期表中的位置
①掌握或明确0族元素的周期序数和原子序数
0族元素 He Ne Ar Kr Xe Rn Og
周期序数 1 2 3 4 5 6 7
原子序数 2 10 18 36 54 86 118
②比大小定周期:找出与原子序数相邻且比其大的0族元素周期序数,则该元素与此0族元素处于同一周期。
③求差值定族数:若原子序数比相应0族元素的原子序数多1或2,则该元素应位于0族元素的下一个周期的第ⅠA族或第ⅡA族;若原子序数比相应的0族元素的原子序数少1~5,则该元素应位于0族元素所在周期的第ⅦA族~第ⅢA族(17~13列)。
1.(2021·江苏盐城高一期末)下列关于元素周期表的认识中不正确的是( )
A.元素周期表有18个族
B.元素周期表有七个周期
C.元素原子的电子层数等于其所在周期的周期序数
D.主族元素原子的最外层电子数等于其所在族的族序数
解析 元素周期表有7个主族、7个副族、1个0族和1个第Ⅷ族,共16个族,A错误;元素周期表有7个横行,即有七个周期,B正确;元素所在周期的周期序数和原子的电子层数相等,C正确;主族元素所在族的族序数等于该元素原子最外层电子数,D正确。
A
B
2.俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子。这4个原子生成数微秒后衰变成第113号元素的原子。下列有关叙述正确的是( )
A.115号元素位于第六周期
B.113号元素位于第七周期ⅢA族
C.115号和113号元素都是非金属元素
D.镅元素和115号元素不在同一周期
解析 95号镅元素、115号元素、113号元素的原子序数都大于86而小于118,所以都位于第七周期,A、D项错误;115号元素比118号元素的原子序数小3,应在ⅤA族,113号元素在ⅢA族,B项正确;113号元素和115号元素都是金属元素,C项错误。
3.(2021·河南实验中学高一期中)图为元素周期表的一部分,表中的数字为原子
序数,其中M的原子序数为37的是( )
B
二、元素周期表中元素性质递变规律
1.碱金属元素单质化学性质的相似性、递变性和特殊性
(1)碱金属的相似性(用R表示碱金属元素)
(2)碱金属的递变性
①与O2反应:从Li→Cs,与O2反应越来越剧烈,产物越来越复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。
②与H2O(或酸)的反应:从Li→Cs,与H2O(或酸)反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb和Cs遇水发生剧烈爆炸。
(3)最高价氧化物对应水化物的碱性:LiOH
(2)递变性
①氧化性与还原性
②与H2反应的难易程度及对应氢化物稳定性(由F2→I2):与H2反应越来越难,生成的氢化物的稳定性逐渐减弱,还原性逐渐增强。
③卤素单质与变价金属(如Fe)反应:2Fe+3X2===2FeX3(X=F、Cl、Br), Fe+I2===FeI2。
(3)特殊性
①溴是常温常压下唯一的液态的非金属单质。
②卤素单质都有毒,溴有很强的腐蚀性,液溴易挥发,保存时要加一些水进行“水封”,碘可升华,遇淀粉溶液变蓝(检验I2)。
③Cl2、Br2、I2易溶于有机溶剂苯、CCl4、汽油等。
④F无正化合价。
3.元素周期表中元素性质递变规律(稀有气体除外)
元素性 质递变 同周期 (左→右) 同主族
(上→下)
原 子 结 构 电子层数 相同 增多
最外层电子数 1个→8个 (第1周期1→2) 相同
原子半径 逐渐减小 逐渐增大
元 素 性 质 原子得电子能力 逐渐增强 逐渐减弱
原子失电子能力 逐渐减弱 逐渐增强
元素的金属性 逐渐减弱 逐渐增强
元素的非金属性 逐渐增强 逐渐减弱
元素的主要化合价 最高正价由+1→+7(O、F除外),最低负价由-4→-1 最高正价数=主族序数(O、F除外)
非金属气态 氢化物 形成 难→易 易→难
稳定性 逐渐增强 逐渐减弱
还原性 逐渐减弱 逐渐增强
最高价氧化物的水化物 酸性 逐渐增强 逐渐减弱
碱性 逐渐减弱 逐渐增强
金属阳离子氧化性 逐渐增强 逐渐减弱
非金属阴离子还原性 逐渐减弱 逐渐增强
4.(2021·河北邢台高一开学考试)下列物质性质的比较中,不正确的是( )
A.原子半径大小:Na>Mg>Al
B.碱性强弱:KOH>NaOH>LiOH
C.最简单气态氢化物的稳定性:HF>HCl>HBr
D.还原性强弱:Cl->Br->I-
D
解析 同一周期元素,原子序数越大,原子半径越小,所以原子半径大小:Na>Mg>Al,A正确;同一主族元素,从上到下元素的金属性逐渐增强。元素的金属性越强,其相应的碱的碱性就越强。由于元素的金属性:K>Na>Li,所以碱性强弱:KOH>NaOH>LiOH,B正确;同一主族元素,从上到下元素的非金属性逐渐减弱。元素的非金属性越强,其相应的简单氢化物稳定性就越强。由于元素的非金属性:F>Cl>Br,所以最简单气态氢化物的稳定性:HF>HCl>HBr,C正确;元素的非金属性越强,其阴离子的还原性就越弱。由于元素的非金属性:Cl>Br>I,所以离子的还原性:Cl-<Br-<I-,D错误。
5.(2021·福建厦门高一期末)下列事实不能用元素周期律解释的是( )
A.碱性:Mg(OH)2>Be(OH)2
B.热稳定性:Na2CO3>NaHCO3
C.酸性:HClO4>H2SO4
D.气态氢化物的稳定性:NH3>PH3
B
解析 A项,元素最高价氧化物对应水化物的碱性与其金属性强弱一致,故碱性:Mg(OH)2>Be(OH)2能用元素周期律解释; B项,热稳定性:Na2CO3> NaHCO3,是碳酸盐和碳酸氢盐的稳定性,与元素的金属性和非金属性无关,不能用元素周期律解释; C项,元素最高价氧化物对应水化物的酸性与其非金属性强弱一致,酸性:HClO4>H2SO4能用元素周期律解释; D项,非金属元素的简单气态氢化物的稳定性与其非金属性强弱一致,气态氢化物的稳定性:NH3>PH3能用元素周期律解释。
6.(2022·江苏南京高一期末)海水中的X、Y、Z、W四种短周期元素在元素周期
表中的位置如下表所示,元素X最高正化合价与最低负化合价的代数和为0。
下列有关说法正确的是( )
A.原子半径:r(X)
C.元素Y的简单气态氢化物的热稳定性比W的弱
D.元素Z最高价氧化物对应的水化物的酸性比X的强
D
X Y
Z W
解析 根据题意,X元素为C或Si,但下一周期的Z和W也为短周期,因此X为C,Y为F,Z为S,W为Cl。同一周期从左到右元素的原子半径逐渐减小,则原子半径:r(X)>r(Y),A错误;同一周期从左到右元素的非金属性逐渐增强,则元素Y非金属性比X强,B错误;非金属性Y>W,则元素Y简单气态氢化物热稳定性强于W,C错误;非金属性Z(S)>X(C),则元素Z最高价氧化物对应的水化物的酸性比X的强,D正确。
1.下列关于元素周期表的说法正确的是( )
A.元素周期表中的族可以简称为“七主七副一0一Ⅷ”共16列
B.元素周期表中ⅢB族到ⅡB族共10个纵行的元素都是金属元素
C.元素周期表中每个短周期都含有8种元素
D.元素周期表中所有元素都是从自然界中发现的
解析 元素周期表中共有16个族,但是共有18列,A错误;第1周期含有2种元素,C错误;有些元素是人工合成的,D错误。
B
2.我国西部地区蕴藏着丰富的锂资源,开发锂的用途是一个重要的科学课题。
关于锂的叙述不正确的是( )
A.锂是较轻的金属
B.LiOH的碱性比NaOH的弱
C.锂的金属性比钠的强
D.锂在空气中燃烧生成Li2O
解析 锂比钠的活泼性弱,在空气中燃烧只生成Li2O,LiOH的碱性比NaOH的弱,锂的金属性比钠的弱,C项错误。
C
3.(2021·河北石家庄高一期中)氮族元素与同周期碳族、氧族、卤族元素相比较,
下列递变规律正确的是( )
A.还原性:SiH4<PH3<HCl
B.原子半径:Si<P<S<Cl
C.非金属性:C<N<O<F
D.酸性:H3PO4<H2SiO3<H2SO4
C
解析 元素的非金属性:Si<P<Cl,还原性:SiH4>PH3>HCl,A错误;同周期从左到右原子半径减小,原子半径:Si>P>S>Cl,B错误;同周期从左到右元素的非金属性增强,非金属性:C<N<O<F,C正确;同周期从左到右元素的非金属性增强,元素最高价氧化物对应水化物酸性增强,酸性:H2SiO3<H3PO4<H2SO4,D错误。
4.(2022·江苏连云港高一期末)短周期主族元素X、Y、Z、M、N的原子序数依次
增大,原子半径及主要化合价见下表:
根据表中信息,判断以下说法正确的是( )
A.离子半径:r(N2-)>r(Z2+)
B.由X、Y两种元素组成的化合物只有一种
A
元素 X Y Z M N
原子半径/pm 66 186 160 143 104
主要化合价 -2 +1 +2 +3 -2、+4、+6
C.相同条件下,简单气态氢化物的热稳定性:N>X
D.元素Y、Z、M中,M原子失电子能力最强
解析 根据元素的化合价和原子半径,N有-2、+4、+6价,N为S,X为O,Y为Na、Z为Mg、M为Al。电子层越多,半径越大,离子半径:r(S2-)>
r(Mg2+), A正确; 由X、Y两种元素组成的化合物可以是Na2O、Na2O2,B错误;周期表中同主族从下到上,元素的非金属性增强,元素的氢化物稳定性增强,相同条件下,简单气态氢化物的热稳定性:H2O>H2S,C错误; Y为Na、Z为Mg、M为Al,同周期从右到左,元素的金属性增强,元素Y、Z、M中,M原子失电子能力最弱,D错误。
5.(1)常见卤素氢化物中最不稳定的是________(写化学式)。
(2)下列单质熔、沸点随原子序数递增而升高的是________(填字母,下同)。
A.碱金属元素 B.卤族元素
(3)下列反应中,更剧烈的是________。
A.钠与水反应 B.钾与水反应
(4)取下列溶液分装两试管,再分别依次加入少量氯水和少量四氯化碳,用力振荡、静置后,四氯化碳层显紫红色的是________。
A.溴化钠溶液 B.碘化钾溶液
答案 (1)HI (2)B (3)B (4)B
解析 常见卤素中碘元素的非金属性最弱,氢化物中最不稳定的是HI;碱金属元素的单质熔、沸点随原子序数递增而降低,卤素单质熔、沸点随原子序数递增而升高;钾比钠活泼,与水反应更剧烈;氯水与NaBr、KI溶液反应分别生成Br2、I2,而二者的四氯化碳溶液分别为橙色、紫红色。
1.以下关于锂、钠、钾、铷、铯的叙述中不正确的是( )
①氢氧化物中碱性最强的是CsOH ②单质熔点最高的是铯 ③单质都是热和电的良导体 ④单质的密度依次增大,且都比水轻 ⑤单质的还原性依次增强 ⑥对应阳离子的氧化性依次增强
A.①③ B.②⑤
C.②④⑥ D.①③⑤
解析 单质熔点最高的应是Li,密度呈增大趋势,K出现反常,Rb、Cs的密度比水大,对应阳离子的氧化性应依次减弱。
C
C
解析 周期序数等于电子层数,主族元素最外层电子数等于主族序数,电子层数是4,最外层5个电子,所以位于第4周期ⅤA族,A项正确;砷是非金属元素,B项正确;非金属性越强最高价氧化物对应水化物的酸性越强,非金属性:P>As,所以酸性:H3AsO4<H3PO4,C项错误;非金属性越强氢化物越稳定,非金属性:P>As,所以稳定性:AsH3<PH3,D项正确。
3.下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强
④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④
C.②④⑤ D.①③⑤
解析 F2、Cl2、Br2、I2氧化性依次减弱,其对应的阴离子F-、Cl-、Br-、I-的还原性依次增强,故①叙述错误,⑤叙述正确;F2、Cl2、Br2、I2的颜色由淡黄绿色→黄绿色→深红棕色→紫黑色逐渐加深,②叙述正确;HF、HCl、HBr、HI的稳定性逐渐减弱,③叙述错误;F2、Cl2、Br2、I2在通常情况下其状态变化为气→液→固,则沸点逐渐升高,④叙述正确,C正确。
C
4.如图表示碱金属的某些性质与核电荷数的变化关系,
则下列各性质中不符合图示关系的是( )
A.还原性 B.与水反应的剧烈程度
C.熔点 D.原子半径
解析 由图可知,随碱金属的核电荷数的增大,碱金属的性质呈增大的趋势,碱金属的还原性增强,碱金属与水反应的剧烈程度增大,随核电荷数的增大,其原子半径增大,A、B、D项正确;随核电荷数的增大,碱金属单质的熔点逐渐减小,C项与图像不符。
C
5.(2021·河南高一期中)下列有关元素周期表的叙述正确的是( )
A.元素周期表中有18个纵行,但却只有16个族,其中第Ⅷ族所含元素种类
最多
B.第3、第4周期中同主族元素的质子数差都是8
C.主族元素的原子,形成单原子离子时的化合价和它的族序数不一定相等
D.简单微粒的核外电子层数等于其所在元素周期表的周期数
C
解析 元素周期表中有18个纵行,但却只有16个族,其中第ⅢB族所含元素种类最多,A错误;周期表中过渡元素左侧第三、第四周期中同主族元素的质子数差都是8,周期表中过渡元素右侧第三、第四周期中同主族元素的质子数差都是18,B错误;主族元素的原子,形成单原子离子时的化合价和它的族序数不一定相等,如阴离子O2-,C正确;简单阴离子微粒的核外电子层数等于其所在元素周期表的周期数,简单阳离子微粒的核外电子层数等于其所在元素周期表中上一周期数,D错误。
6.(2021·河南许昌高一期末)原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原
子序数之和不可能是(镧系、锕系、0族元素除外)( )
A.4x B.4x+6
C.4x+10 D.4x+14
解析 在A、B、C、D四种元素中,同周期的A、C两种元素的原子序数之和为2x,又因同主族各周期相邻的两元素之间的原子序数相差8、18、32。所以四种元素中,同主族的B、D两种元素的原子序数之和可能为2x、2x+10或2x+14。则四种元素的原子序数之和可能为4x、4x+10或4x+14,只有选项B不可能。
B
7.下列关于同主族元素的说法错误的是( )
A.同主族元素随原子序数递增,元素原子的得电子能力逐渐增强
B.同主族元素随原子序数递增,单质氧化能力逐渐减弱
C.同主族元素原子最外层电子数都相同
D.同主族元素的原子半径,随原子序数增大而逐渐增大
解析 同主族元素,最外层电子数相同,随原子序数增大,原子半径逐渐增大,得电子能力逐渐减弱,单质氧化性逐渐减弱,故A错误,B、C、D正确。
A
8.金属元素钫(Fr)在自然界中含量极少,它的21种已知同位素都有放射性,它是碱金属元素中最重的元素。根据钫在周期表中的位置预测其性质,其中不正确的是( )
A.在已知碱金属元素中具有最大的原子半径
B.在空气中燃烧时生成氧化物Fr2O
C.最高价氧化物对应的水化物是极强的碱
D.其单质的熔点比金属钠的熔点低
B
解析 根据“Fr是碱金属元素中最重的元素”,可以得到两个结论:一是它属于碱金属元素;二是它在周期表中处于碱金属元素的最下方。根据同主族元素性质的递变性规律可以知道它的金属性非常强,所以与氧气反应时得到的是复杂的氧化物。
9.下列关于元素周期律的叙述不正确的是( )
A.Na、Mg、Al最外层电子数依次增多,其金属性依次减弱
B.P、S、Cl最高化合价依次升高,对应简单气态氢化物的稳定性依次增强
C.原子半径大小关系为Na<Al<Si<Cl
D.Na、Mg、Al的氢氧化物的碱性依次减弱
解析 P、S、Cl的最高化合价分别为+5、+6、+7,由于P、S、Cl的非金属性依次增强,其所对应的气态氢化物的稳定性也依次增强;原子半径大小关系为Na>Al>Si>Cl;因Na、Mg、Al的金属性依次减弱,则它们的氢氧化物的碱性也依次减弱。
C
10.下列叙述中正确的是( )
B
11.(2021·江苏连云港高一期末)如图是元素
周期表的一部分。回答下列问题:
(1)溴被称为海洋元素。
①溴在元素周期表中位于第____________周期
____________族。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的酸是
____________(填化学式)。
③能够证明溴单质的氧化性强于碘单质的离子方程式是
___________________________________________________________________。
答案 (1)①4 ⅦA ②HClO4
③Br2+2I-===I2+2Br-
解析 (1)①根据氯元素在周期表中位于第3周期ⅦA族,溴与氯位于同一主族,所以溴元素在元素周期表中位于第4周期ⅦA族。②Br为卤族元素,卤族元素从上到下非金属性减弱,最高价含氧酸的酸性也减弱,由于F没有含氧酸,故最强含氧酸是HClO4。③根据氧化剂氧化性大于氧化产物氧化性的规律,用溴与碘化钾反应生成碘和溴化钾,反应的离子方程式:Br2+2I-===I2+2Br-,此反应Br2为氧化剂,碘为氧化产物,所以氧化性:溴大于碘。
答案 (2)①同位素 ②H2Se ③H2SeO3+2SO2+H2O===Se+2H2SO4
12.(2021·湖北荆州高一段考)元素周期表中前七周期的元素种类如表所示:
(1)表中________周期是短周期,________周期是长周期。
(2)第6、7周期比第4、5周期多了14种元素,其原因是____________________。
(3)元素周期表中第________族所含元素种类最多。
周期数 1 2 3 4 5 6 7
元素种类 2 8 8 18 18 32 32
答案 (1)1、2、3 4、5、6、7
(2)第6、7周期在第ⅢB族中出现了镧系、锕系,每个系的一个空格包含了15种元素
(3)ⅢB
(4)请分析周期数与元素种类的关系,预言第八周期最多可能含有的元素种类为________(填字母,下同)。
A.18种 B.32种 C.50种 D.64种
(5)据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb等的碳酸盐)中,查明有116号元素。试推断116号元素应位于元素周期表中的________。
A.第6周期第ⅣA族 B.第7周期第ⅥA族
C.第7周期第Ⅷ族 D.第8周期第ⅥA族
答案 (4)C (5)B
解析 (4)观察每一周期的元素种类发现,它们都是偶数,规律如下:
故第八周期最多可能含有的元素种类为2×52=50种。
(5)根据0族元素的原子序数推断,第7周期0族元素的原子序数为118,位于第18列,116号元素处于第16列,所以116号元素位于第7周期第ⅥA族。
周期数 1 2 3 4 5 6 7
元素 种类 2 2×1 2×12 8 2×4 2×22 8 2×4 2×22 18 2×9 2×32 18 2×9 2×32 32 2×16 2×42 32
2×16
2×42
13.(2021·河北石家庄高一期末)短周期主族元素G、X、Y、Z、W在元素周期表中的相对位置如图所示,其中元素Y的最外层电子数是内层电子数的三倍。下列说法正确的是( )
A.原子半径:Z>W>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.元素G、Y简单气态氢化物的稳定性:G>Y
D.元素X、Z、W、Y的最高正化合价分别与其
主族序数相等
B
解析 根据元素G、X、Y、Z、W在周期表的位置,可知G、X、Y三种元素为第2周元素,Z、W为第3周期元素,其中元素Y的最外层电子数是内层电子数的三倍,可知Y是O元素,则G、X、Z、W四种元素分别是C、N、Si、P四种元素。同一周期的元素,原子序数越大,原子半径越小,则Z>W,X>Y,同一主族元素,原子序数越大,原子半径越大,则W>X,所以四种元素的原子半径大小为Z>W>X>Y(Si>P>N>O), A错误;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,根据元素在周期表位置,
可判断元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:HNO3>H3PO4>H2SiO3(X>W>Z),B正确;元素的非金属性越强,其相应的氢化物的稳定性就越强,根据元素G、Y在周期表的位置,可知非金属性G
合价,以下叙述正确的是( )
C
元素代号 L M Q R T
原子半径/nm 0.160 0.143 0.089 0.102 0.074
主要化合价 +2 +3 +2 +6、-2 -2
A.气态氢化物的稳定性为R>T
B.L、M的简单离子半径L
D.L2+与R2-的核外电子数相等
解析 同一周期,左到右,原子半径减小,同一主族,从上到下,原子半径增大;五种元素为1~18号元素,Q、T两种原子半径最小,且Q>T,Q为+2价,Q为Be,T为-2价,T为O;L、M、R原子半径均大于Q、T两种原子半径,三种元素位于第3周期,且原子半径L最大,化合价为+2价,L为Mg,M原子半径略小于镁,化合价为+3价,M为Al,R原子半径较小,化合价为+6、-2价,R为S,即L为Mg,M为Al,Q为Be,R为S,T为O。非金属性
越强,氢化物越稳定,非金属性:O>S,所以稳定性:H2O>H2S,即R
15.现有部分短周期元素的性质或原子结构如表所示:
元素编号 元素性质或原子结构
T M层上电子数是K层上电子数的3倍
X 最外层电子数是次外层电子数的2倍
Y 常温下单质为双原子分子,其氢化物水溶液呈碱性
Z 元素最高正价是+7价
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____________________________(填化学式),
理由_____________________________________________________。
答案 (3)Cl b (4)H2CO3 H2CO3是弱酸且是非氧化性酸
Thanks!
本课时内容结束
