专题5 第三单元 从微观结构看物质的多样性 第二课时 晶体与非晶体(共56张PPT)
文档属性
| 名称 | 专题5 第三单元 从微观结构看物质的多样性 第二课时 晶体与非晶体(共56张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 21:11:54 | ||
图片预览









文档简介
(共56张PPT)
第二课时
晶体与非晶体
【课程标准要求】
1.熟知晶体的类型及其分类依据,学会判断晶体类型的方法。
2.知道晶体类型与物质性质的关系,会比较晶体的熔、沸点。认识物质的结构决定物质的性质,性质的特点体现了结构的特点。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
晶体与非晶体
1.晶体与非晶体
(1)常见固体物质一般可分为晶体和非晶体。
(2)______ 有规则的几何外形,如氯化钠、金刚石、干冰等。________没有固定的熔点,一般也不具备规则的几何外形。
(3)晶体规则的几何外形是其内部构成微粒有__________的结果。
晶体
非晶体
规则排列
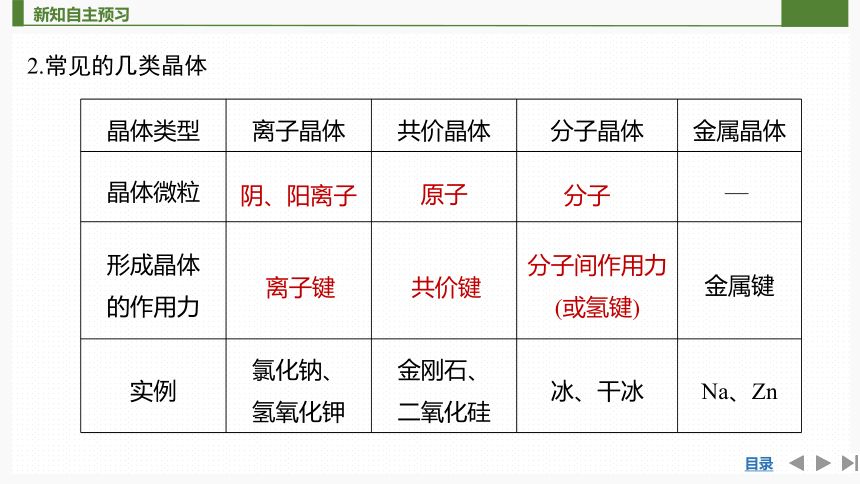
2.常见的几类晶体
晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
晶体微粒 —
形成晶体 的作用力 金属键
实例 氯化钠、 氢氧化钾 金刚石、 二氧化硅 冰、干冰 Na、Zn
阴、阳离子
原子
分子
离子键
共价键
分子间作用力
(或氢键)
【微自测】
判断正误,正确的打“√”,错误的打“×”。
(1)晶体一定是无色透明固体( )
(2)晶体具有固定的熔沸点( )
(3)58.5 g NaCl晶体中含6.02×1023个NaCl分子( )
(4)晶体中微粒间一定存在化学键( )
×
√
×
×
晶体类型和性质的判断
晶体类型和性质的判断
二氧化碳、二氧化硅都是ⅣA族元素的氧化物,但二者的物理性质相差较大。如SiO2硬度大,熔沸点高,而CO2固体俗称干冰,硬度小,熔沸点低,干冰可以用来舞台造雾。
1.如何用实验来证明某固态物质是晶体?
提示:用X射线进行衍射实验,若构成固态物质的微粒在空间呈有规则的重复排列,则该物质是晶体。
2.决定晶体性质的因素有哪些?
提示:晶体的性质如状态、熔点、沸点、硬度等与构成晶体的微粒及微粒间的作用力大小有关。
3.如何简单的判别晶体类型?
提示:通常能导电的是金属晶体;熔融状态下能导电的是离子晶体,熔、沸点低的是分子晶体;熔、沸点很高,硬度大,不导电的是共价晶体。
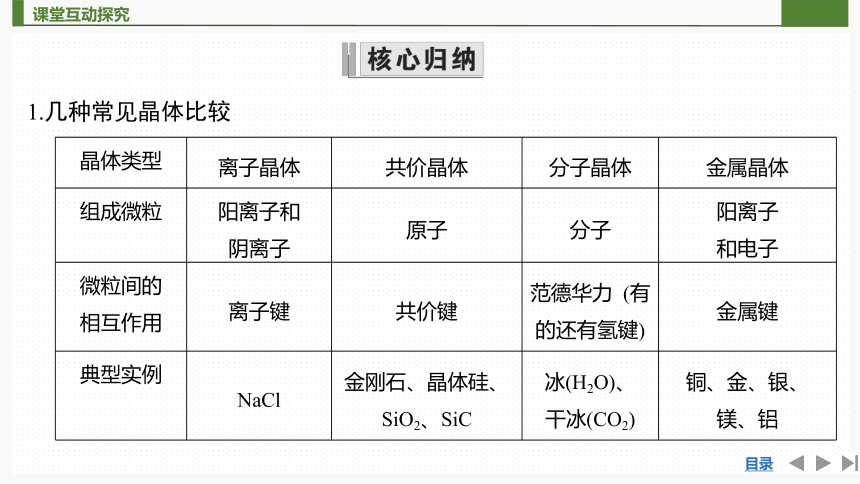
1.几种常见晶体比较
晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
组成微粒 阳离子和 阴离子 原子 分子 阳离子
和电子
微粒间的 相互作用 离子键 共价键 范德华力 (有的还有氢键) 金属键
典型实例 NaCl 金刚石、晶体硅、 SiO2、SiC 冰(H2O)、 干冰(CO2) 铜、金、银、
镁、铝
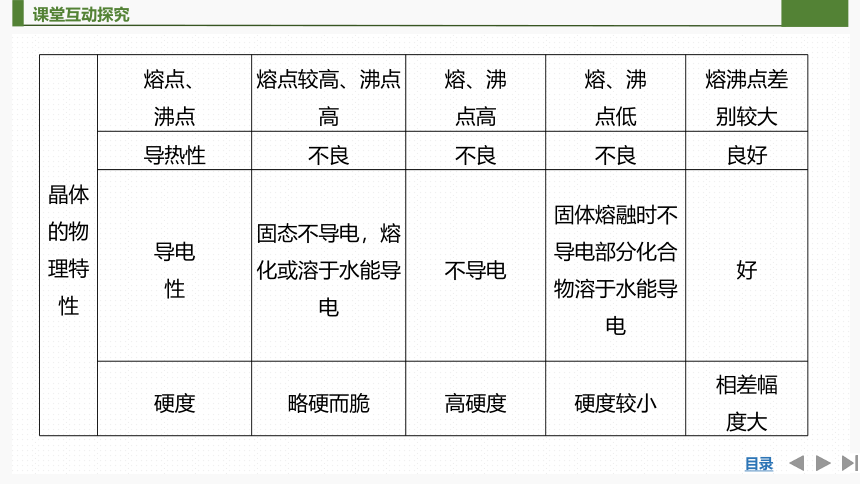
晶体 的物 理特性 熔点、 沸点 熔点较高、沸点高 熔、沸 点高 熔、沸 点低 熔沸点差
别较大
导热性 不良 不良 不良 良好
导电 性 固态不导电,熔化或溶于水能导电 不导电 固体熔融时不导电部分化合物溶于水能导电 好
硬度 略硬而脆 高硬度 硬度较小 相差幅
度大
2.晶体类型的判断
(1)依据晶体的组成微粒及其相互作用力判断
①阴、阳离子——离子键——离子晶体。
②原子——共价键——共价晶体。
③分子——分子间作用力——分子晶体。
(2)依据物质的类别判断
①金属氧化物(如K2O等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。
③常见的共价晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。
(3)依据晶体的熔点判断
①熔点较高,常在几百至1 000多度一般是离子晶体;
②熔点高,常在1 000度至几千度一般是共价晶体;
③熔点低,常在几百度以下至很低温度一般是分子晶体。
④金属晶体多数熔点高,部分较低,如汞常温下为液态。
(4)依据导电性判断
①固态时不导电,熔融状态能够导电是离子晶体;固态或熔化状态均导电是金属晶体
②固态或熔化状态均不导电是分子晶体;
③共价晶体各种状态均不导电。
3.晶体熔沸点高低的判断
(1)先根据晶体的类型判断
不同晶体类型的物质其熔点的一般规律为:共价晶体>离子晶体>分子晶体;但是要注意金属晶体的熔、沸点有的很高,如钨、铂等,有的则很低,如汞、铯等。
(2)同一晶体类型的物质,需比较晶体内部结构粒子间作用力,作用力越大,熔沸点越高
①共价晶体中,原子半径越小,形成共价键的键能越大,其晶体熔沸点越高。如熔点:金刚石>碳化硅>晶体硅。
②离子晶体中,阴、阳离子的电荷数越大,离子半径越小,则离子间作用就越强,其离子晶体熔沸点越高。如熔点:MgO>NaCl>KCl。
③分子晶体:含有氢键的分子晶体熔沸点较高。组成和结构相似的物质,相对分子质量越大,熔沸点越高,如熔沸点:HI>HBr>HCl。
由上述可知,同类晶体熔沸点比较思路为:共价晶体看共价键键能→键长→原子半径;分子晶体看分子间作用力→相对分子质量;离子晶体看离子键强弱→离子所带电荷多少、离子半径。
1.下列不属于晶体的特点的是( )
A.具有规则的几何外形
B.具有固定的沸点
C.具有固定的熔点
D.一定是无色透明的固体
解析 晶体具有规则的几何外形,具有固定的熔、沸点。
D
2.下列各组中,既含有离子晶体、分子晶体,又含有共价晶体的是( )
A.KCl、H2SO4、P4 B.CO2、Na3PO4、Mg
C.NH4F、C60、金刚石 D.Si、SiO2、K2CO3
解析 A项,H2SO4和P4都是分子晶体;B项,Mg是金属晶体;D项,Si和SiO2都是共价晶体。
C
3.下表给出几种物质的熔、沸点:
判断下列有关说法中错误的是( )
A.SiCl4是分子晶体
B.单质B可能是共价晶体
C.AlCl3加热能升华
D.NaCl中离子键的强度比MgCl2中的小
D
NaCl MgCl2 AlCl3 SiCl4 单质B
熔点/℃ 801 710 180 68 2 300
沸点/℃ 1 465 1 418 160 57 2 500
解析 由表中所给熔、沸点数据,可知SiCl4的熔、沸点最低,应为分子晶体;单质B的熔、沸点最高,因此为共价晶体;AlCl3的沸点低于熔点,故可升华;NaCl的熔点沸点高于MgCl2的熔点沸点,表明NaCl中离子键的强度比MgCl2中的大。
1.下列关于晶体与非晶体的说法中,错误的是( )
A.晶体具有规则的几何外形和固定的熔点
B.玻璃属于晶体
C.非晶体没有固定的熔点
D.晶体和非晶体,一般指的是固体
解析 玻璃没有固定的熔点,属于非晶体。
B
2.下列物质呈固态时必定属于分子晶体的是( )
A.非金属氧化物
B.金属氧化物
C.非金属单质
D.常温下呈气态的物质
解析 二氧化硅是非金属氧化物,属于共价晶体,A错误;氧化钠是金属氧化物,属于离子晶体,B错误;金刚石是非金属单质,属于共价晶体,C错误;常温下呈气态的物质,说明其熔、沸点都很低,属于分子晶体,D正确。
D
3.下列说法正确的是( )
A.共价晶体中直接相邻的原子都以共价键相结合
B.金属晶体的熔点都比分子晶体的熔点高
C.干冰升华时,分子内共价键会发生断裂
D.Na2O2晶体中阴、阳离子个数比为1∶1
解析 金属晶体的熔点不一定比分子晶体的高,如Hg常温下为液态,B错误;干冰为分子晶体,升华时克服分子间作用力,分子内共价键不变,C错误;Na2O2晶体中阴、阳离子个数比为1∶2,D错误。
A
4.下表对晶体的说法中错误的是( )
C
选项 A B C D
晶体 名称 氯化钾 干冰 石英 碘
晶体中 的微粒 阴、阳 离子 分子 原子 分子
微粒间 的作用 离子键 分子间 作用力 离子键 分子间
作用力
解析 氯化钾为离子晶体,微粒间作用力为离子键;干冰和碘都是分子晶体,微粒间作用力为分子间作用力;石英是共价晶体,微粒间作用力为共价键,C错误。
5.(1)K2SO4熔化,粒子间克服了________的作用;二氧化硅熔化,粒子间克服
了________的作用;碘的升华,粒子间克服了________的作用。
(2)下列六种晶体:①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石,它们的
熔点从低到高的顺序为________(填序号)。
(3)A、B、C、D四种晶体的性质如下,判断其晶体类型:
A.固态时能导电,能溶于盐酸,________。
B.能溶于CS2,不溶于水,________。
C.固态时不导电,液态时能导电,可溶于水,________。
D.固态、液态时均不导电,熔点为3 500 ℃,________。
答案 (1)离子键 共价键 分子间作用力
(2)①⑤③②④⑥ (3)金属晶体 分子晶体 离子晶体 共价晶体
解析 (1)K2SO4是离子晶体,离子晶体熔化时需要克服离子键;二氧化硅是共价晶体,共价晶体熔化时需克服共价键;碘为分子晶体,熔化时需克服分子间作用力。(2)先把六种晶体分类,共价晶体:④⑥;离子晶体:②;金属晶体:③;分子晶体:①⑤。由于C原子半径小于硅原子半径,所以金刚石的熔点高于晶体硅的熔点。CO2和CS2同属于分子晶体,CS2的熔点高于CO2。Na在常温下呈固态,而CS2是液态,CO2是气态,所以Na的熔点高于CS2和CO2的熔点。(3)据四种晶体的性质即可判断四种晶体分别为金属晶体、分子晶体、离子晶体、共价晶体。
1.我们熟悉的食盐、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。
下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否具有规则几何外形的固体
B.是否具有固定组成的物质
C.是否具有美观对称的外形
D.内部构成微粒是否在空间呈有规则的重复排列
D
解析 有规则几何外形或美观对称的固体不一定都是晶体,如玻璃; 具有固定组成的物质也不一定是晶体,如某些无定形体也具有固定的组成。晶体和非晶体的本质区别在于微观结构不同。
2.下列晶体中属于共价晶体的是( )
A.氖 B.食盐
C.干冰 D.金刚石
解析 氖、干冰属于分子晶体,食盐属于离子晶体,金刚石属于共价晶体。
D
3.下列物质性质的变化规律与化学键强弱无关的是( )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
A
解析 A项,F2、Cl2、Br2、I2形成的晶体为分子晶体,熔化时仅破坏分子间作用力,与化学键无关;B项,热稳定性是指物质受热分解的难易程度,而HX分解时要破坏H—X键,从HF到HI共价键牢固性能依次减小,故其稳定性依次减弱;C项,由于金刚石中碳碳键的键能大于晶体硅中硅硅键的键能,因此金刚石的硬度、熔点、沸点较晶体硅高;D项,NaX为离子晶体,熔化时破坏离子键。
4.有关晶体的下列说法中,正确的是( )
A.晶体中分子间作用力越大,分子越稳定
B.共价晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
解析 A项,晶体中分子间作用力大小与分子的稳定性没有关系;C项,冰融化时水分子中共价键不发生断裂;D项,氯化钠熔化时离子键被破坏。
B
5.下列各组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是( )
A.Na2O和SiO2熔化 B.冰和金刚石熔化
C.氯化钠和蔗糖熔化 D.碘和干冰升华
解析 Na2O熔化克服离子键,SiO2熔化克服共价键,类型不同,故A错误;冰是分子晶体,金刚石是共价晶体,晶体类型不同,克服的作用力类型不同,故B错误;氯化钠熔化克服离子键,蔗糖熔化克服分子间作用力,类型不同,故C错误;碘和干冰均属于分子晶体,升华时均克服分子间作用力,类型相同,故D项正确。
D
6.下列说法一定正确的是( )
A.形成水溶液导电的一定是离子晶体
B.熔融态导电的一定是离子晶体
C.共价化合物形成的晶体一定是分子晶体
D.固态不导电、熔融态导电的一定是离子晶体
解析 部分分子晶体和离子晶体的水溶液能导电。固态不导电、熔融态导电是离子晶体区别其他晶体的性质。共价化合物形成的晶体可能是分子晶体,如干冰;也可能是共价晶体,如石英。
D
7.下列叙述正确的是 ( )
A.构成分子晶体的微粒一定含有共价键
B.离子晶体中一定只含有离子键
C.同主族元素形成的氧化物的晶体类型一定相同
D.熔化时无须破坏化学键的晶体一定是分子晶体
解析 稀有气体形成的分子晶体中无化学键,A项错误;离子晶体中一定含有离子键,也可能含有共价键,如NaOH,B项错误;在ⅣA族中,碳的氧化物CO、CO2形成的晶体为分子晶体,硅的氧化物SiO2属共价晶体,C项错误;分子晶体熔化时破坏的是分子间作用力,无化学键的破坏,D项正确。
D
8.下列物质中,化学式能准确表示物质的分子组成的是( )
A.氯化钠晶体(NaCl) B.干冰(CO2)
C.水晶(SiO2) D.氩气(Ar2)
解析 A项,氯化钠晶体是离子晶体,而离子晶体中没有单个分子,错误;C项,SiO2是共价晶体,共价晶体中没有单个分子,错误;D项,氩气是单原子分子,错误。
B
9.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。
下列一定能说明CaF2是离子晶体的实验是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C
解析 离子晶体中含有离子键,离子键在熔融状态下能够被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体为离子晶体的实验依据。
10.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.共价晶体 B.分子晶体
C.离子晶体 D.金属晶体
解析 元素A和B的原子序数都小于18,B元素原子的M层电子数为(a-b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素原子的次外层为K层,即b=2,有2个电子层,所以a=8-2=6,故A为氧元素,B原子的M层电子数为6-2=4,故B为硅元素,A、B两元素所形成的化合物为SiO2,属于共价晶体。
A
11.有几种晶体:A.水晶,B.冰醋酸,C.白磷,D.金刚石,E.晶体氩,F.干冰。
(1)属于分子晶体的是________,直接由原子构成的分子晶体是________。
(2)属于共价晶体的化合物是________。
(3)直接由原子构成的晶体是________。
(4)受热熔化时,化学键不发生变化的是________,需克服共价键的是________。
答案 (1)B、C、E、F E (2)A
(3)A、D、E (4)B、C、F A、D
解析 分子晶体由分子构成,有B、C、E、F。晶体氩是单原子分子;共价晶体和单原子分子晶体都由原子直接构成,共价晶体有A、D,但化合物只有A;分子晶体熔化时,一般不破坏化学键;共价晶体熔化时,破坏化学键。
12.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:>3 550 Li:181 HF:-84 NaCl:801
硅晶体:1 410 Na:98 HCl:-114 KCl:776
硼晶体:2 300 K:64 HBr:-87 RbCl:718
二氧化硅:1 723 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。
(2)B组晶体属于________晶体。
(3)C组晶体属于________晶体,晶体含有的作用力有________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
答案 (1)共价 共价键 (2)金属
(3)分子 分子间作用力、共价键 (4)②④
解析 根据题给各组物质的熔点差异,可判断出A组物质为共价晶体,B组为金属晶体,C组为分子晶体,D组为离子晶体。
13.下列各组物质中,按熔点由低到高的顺序排列正确的是( )
A.Cl2、Br2、I2 B.CO2、SiO2 、 KCl
C.O2、I2、Hg D.SiC、NaCl、SO2
A
解析 Cl2、Br2、I2的晶体属于分子晶体,且组成和结构相似,随着相对分子质量的增大,分子间作用力增大,晶体的熔点逐渐升高,A正确。CO2、KCl、SiO2的晶体分别属于分子晶体、离子晶体、共价晶体,熔点:共价晶体>离子晶体>分子晶体,B错误。常温、常压下,O2为气态,I2为固态,Hg为液态,C错误。SiC、NaCl、SO2的晶体分别为共价晶体、离子晶体、分子晶体,它们的熔点逐渐降低,D错误。
14.SiCl4的分子结构与CCl4类似,对其作出如下推测,其中不正确的是
( )
A.SiCl4晶体是分子晶体
B.常温常压下SiCl4是气体
C.SiCl4的分子内部原子以共价键结合
D.SiCl4熔点高于CCl4
B
解析 A项, SiCl4与CCl4结构相似,CCl4属于分子晶体,则SiCl4晶体是分子晶体;B项,常温常压下CCl4是液体,SiCl4与CCl4结构相似,故SiCl4是液体;C项, CCl4分子内部原子以共价键结合,则SiCl4分子内部原子以共价键结合;D项,组成和结构相似的分子晶体的相对分子质量越大,熔点越高,则SiCl4熔点高于CCl4。
15.A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A________,B________,C________,D________(填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是____________(填化学式);
(3)C的单质是________(填“共价”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于________晶体。
答案 (1)碳 氧 硅 钠 (2)Si>Na>O2 (3)共价 离子
解析 由A、B、C、D都是短周期主族元素,A、C处于同一主族,且原子半径:C>A,可知C比A的原子序数大8;C原子核内的质子数等于A、B原子核内的质子数之和,则B的原子序数为8,B是氧;C原子最外层电子数是D原子最外层电子数的4倍,C原子最外层电子数不应是8,则D原子最外层电子数为1,结合原子半径的大小关系可知D是钠,C是硅,A是碳。
Thanks!
本课时内容结束
第二课时
晶体与非晶体
【课程标准要求】
1.熟知晶体的类型及其分类依据,学会判断晶体类型的方法。
2.知道晶体类型与物质性质的关系,会比较晶体的熔、沸点。认识物质的结构决定物质的性质,性质的特点体现了结构的特点。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
晶体与非晶体
1.晶体与非晶体
(1)常见固体物质一般可分为晶体和非晶体。
(2)______ 有规则的几何外形,如氯化钠、金刚石、干冰等。________没有固定的熔点,一般也不具备规则的几何外形。
(3)晶体规则的几何外形是其内部构成微粒有__________的结果。
晶体
非晶体
规则排列
2.常见的几类晶体
晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
晶体微粒 —
形成晶体 的作用力 金属键
实例 氯化钠、 氢氧化钾 金刚石、 二氧化硅 冰、干冰 Na、Zn
阴、阳离子
原子
分子
离子键
共价键
分子间作用力
(或氢键)
【微自测】
判断正误,正确的打“√”,错误的打“×”。
(1)晶体一定是无色透明固体( )
(2)晶体具有固定的熔沸点( )
(3)58.5 g NaCl晶体中含6.02×1023个NaCl分子( )
(4)晶体中微粒间一定存在化学键( )
×
√
×
×
晶体类型和性质的判断
晶体类型和性质的判断
二氧化碳、二氧化硅都是ⅣA族元素的氧化物,但二者的物理性质相差较大。如SiO2硬度大,熔沸点高,而CO2固体俗称干冰,硬度小,熔沸点低,干冰可以用来舞台造雾。
1.如何用实验来证明某固态物质是晶体?
提示:用X射线进行衍射实验,若构成固态物质的微粒在空间呈有规则的重复排列,则该物质是晶体。
2.决定晶体性质的因素有哪些?
提示:晶体的性质如状态、熔点、沸点、硬度等与构成晶体的微粒及微粒间的作用力大小有关。
3.如何简单的判别晶体类型?
提示:通常能导电的是金属晶体;熔融状态下能导电的是离子晶体,熔、沸点低的是分子晶体;熔、沸点很高,硬度大,不导电的是共价晶体。
1.几种常见晶体比较
晶体类型 离子晶体 共价晶体 分子晶体 金属晶体
组成微粒 阳离子和 阴离子 原子 分子 阳离子
和电子
微粒间的 相互作用 离子键 共价键 范德华力 (有的还有氢键) 金属键
典型实例 NaCl 金刚石、晶体硅、 SiO2、SiC 冰(H2O)、 干冰(CO2) 铜、金、银、
镁、铝
晶体 的物 理特性 熔点、 沸点 熔点较高、沸点高 熔、沸 点高 熔、沸 点低 熔沸点差
别较大
导热性 不良 不良 不良 良好
导电 性 固态不导电,熔化或溶于水能导电 不导电 固体熔融时不导电部分化合物溶于水能导电 好
硬度 略硬而脆 高硬度 硬度较小 相差幅
度大
2.晶体类型的判断
(1)依据晶体的组成微粒及其相互作用力判断
①阴、阳离子——离子键——离子晶体。
②原子——共价键——共价晶体。
③分子——分子间作用力——分子晶体。
(2)依据物质的类别判断
①金属氧化物(如K2O等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。
③常见的共价晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。
(3)依据晶体的熔点判断
①熔点较高,常在几百至1 000多度一般是离子晶体;
②熔点高,常在1 000度至几千度一般是共价晶体;
③熔点低,常在几百度以下至很低温度一般是分子晶体。
④金属晶体多数熔点高,部分较低,如汞常温下为液态。
(4)依据导电性判断
①固态时不导电,熔融状态能够导电是离子晶体;固态或熔化状态均导电是金属晶体
②固态或熔化状态均不导电是分子晶体;
③共价晶体各种状态均不导电。
3.晶体熔沸点高低的判断
(1)先根据晶体的类型判断
不同晶体类型的物质其熔点的一般规律为:共价晶体>离子晶体>分子晶体;但是要注意金属晶体的熔、沸点有的很高,如钨、铂等,有的则很低,如汞、铯等。
(2)同一晶体类型的物质,需比较晶体内部结构粒子间作用力,作用力越大,熔沸点越高
①共价晶体中,原子半径越小,形成共价键的键能越大,其晶体熔沸点越高。如熔点:金刚石>碳化硅>晶体硅。
②离子晶体中,阴、阳离子的电荷数越大,离子半径越小,则离子间作用就越强,其离子晶体熔沸点越高。如熔点:MgO>NaCl>KCl。
③分子晶体:含有氢键的分子晶体熔沸点较高。组成和结构相似的物质,相对分子质量越大,熔沸点越高,如熔沸点:HI>HBr>HCl。
由上述可知,同类晶体熔沸点比较思路为:共价晶体看共价键键能→键长→原子半径;分子晶体看分子间作用力→相对分子质量;离子晶体看离子键强弱→离子所带电荷多少、离子半径。
1.下列不属于晶体的特点的是( )
A.具有规则的几何外形
B.具有固定的沸点
C.具有固定的熔点
D.一定是无色透明的固体
解析 晶体具有规则的几何外形,具有固定的熔、沸点。
D
2.下列各组中,既含有离子晶体、分子晶体,又含有共价晶体的是( )
A.KCl、H2SO4、P4 B.CO2、Na3PO4、Mg
C.NH4F、C60、金刚石 D.Si、SiO2、K2CO3
解析 A项,H2SO4和P4都是分子晶体;B项,Mg是金属晶体;D项,Si和SiO2都是共价晶体。
C
3.下表给出几种物质的熔、沸点:
判断下列有关说法中错误的是( )
A.SiCl4是分子晶体
B.单质B可能是共价晶体
C.AlCl3加热能升华
D.NaCl中离子键的强度比MgCl2中的小
D
NaCl MgCl2 AlCl3 SiCl4 单质B
熔点/℃ 801 710 180 68 2 300
沸点/℃ 1 465 1 418 160 57 2 500
解析 由表中所给熔、沸点数据,可知SiCl4的熔、沸点最低,应为分子晶体;单质B的熔、沸点最高,因此为共价晶体;AlCl3的沸点低于熔点,故可升华;NaCl的熔点沸点高于MgCl2的熔点沸点,表明NaCl中离子键的强度比MgCl2中的大。
1.下列关于晶体与非晶体的说法中,错误的是( )
A.晶体具有规则的几何外形和固定的熔点
B.玻璃属于晶体
C.非晶体没有固定的熔点
D.晶体和非晶体,一般指的是固体
解析 玻璃没有固定的熔点,属于非晶体。
B
2.下列物质呈固态时必定属于分子晶体的是( )
A.非金属氧化物
B.金属氧化物
C.非金属单质
D.常温下呈气态的物质
解析 二氧化硅是非金属氧化物,属于共价晶体,A错误;氧化钠是金属氧化物,属于离子晶体,B错误;金刚石是非金属单质,属于共价晶体,C错误;常温下呈气态的物质,说明其熔、沸点都很低,属于分子晶体,D正确。
D
3.下列说法正确的是( )
A.共价晶体中直接相邻的原子都以共价键相结合
B.金属晶体的熔点都比分子晶体的熔点高
C.干冰升华时,分子内共价键会发生断裂
D.Na2O2晶体中阴、阳离子个数比为1∶1
解析 金属晶体的熔点不一定比分子晶体的高,如Hg常温下为液态,B错误;干冰为分子晶体,升华时克服分子间作用力,分子内共价键不变,C错误;Na2O2晶体中阴、阳离子个数比为1∶2,D错误。
A
4.下表对晶体的说法中错误的是( )
C
选项 A B C D
晶体 名称 氯化钾 干冰 石英 碘
晶体中 的微粒 阴、阳 离子 分子 原子 分子
微粒间 的作用 离子键 分子间 作用力 离子键 分子间
作用力
解析 氯化钾为离子晶体,微粒间作用力为离子键;干冰和碘都是分子晶体,微粒间作用力为分子间作用力;石英是共价晶体,微粒间作用力为共价键,C错误。
5.(1)K2SO4熔化,粒子间克服了________的作用;二氧化硅熔化,粒子间克服
了________的作用;碘的升华,粒子间克服了________的作用。
(2)下列六种晶体:①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石,它们的
熔点从低到高的顺序为________(填序号)。
(3)A、B、C、D四种晶体的性质如下,判断其晶体类型:
A.固态时能导电,能溶于盐酸,________。
B.能溶于CS2,不溶于水,________。
C.固态时不导电,液态时能导电,可溶于水,________。
D.固态、液态时均不导电,熔点为3 500 ℃,________。
答案 (1)离子键 共价键 分子间作用力
(2)①⑤③②④⑥ (3)金属晶体 分子晶体 离子晶体 共价晶体
解析 (1)K2SO4是离子晶体,离子晶体熔化时需要克服离子键;二氧化硅是共价晶体,共价晶体熔化时需克服共价键;碘为分子晶体,熔化时需克服分子间作用力。(2)先把六种晶体分类,共价晶体:④⑥;离子晶体:②;金属晶体:③;分子晶体:①⑤。由于C原子半径小于硅原子半径,所以金刚石的熔点高于晶体硅的熔点。CO2和CS2同属于分子晶体,CS2的熔点高于CO2。Na在常温下呈固态,而CS2是液态,CO2是气态,所以Na的熔点高于CS2和CO2的熔点。(3)据四种晶体的性质即可判断四种晶体分别为金属晶体、分子晶体、离子晶体、共价晶体。
1.我们熟悉的食盐、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。
下列关于晶体和非晶体的本质区别的叙述中,正确的是( )
A.是否具有规则几何外形的固体
B.是否具有固定组成的物质
C.是否具有美观对称的外形
D.内部构成微粒是否在空间呈有规则的重复排列
D
解析 有规则几何外形或美观对称的固体不一定都是晶体,如玻璃; 具有固定组成的物质也不一定是晶体,如某些无定形体也具有固定的组成。晶体和非晶体的本质区别在于微观结构不同。
2.下列晶体中属于共价晶体的是( )
A.氖 B.食盐
C.干冰 D.金刚石
解析 氖、干冰属于分子晶体,食盐属于离子晶体,金刚石属于共价晶体。
D
3.下列物质性质的变化规律与化学键强弱无关的是( )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
A
解析 A项,F2、Cl2、Br2、I2形成的晶体为分子晶体,熔化时仅破坏分子间作用力,与化学键无关;B项,热稳定性是指物质受热分解的难易程度,而HX分解时要破坏H—X键,从HF到HI共价键牢固性能依次减小,故其稳定性依次减弱;C项,由于金刚石中碳碳键的键能大于晶体硅中硅硅键的键能,因此金刚石的硬度、熔点、沸点较晶体硅高;D项,NaX为离子晶体,熔化时破坏离子键。
4.有关晶体的下列说法中,正确的是( )
A.晶体中分子间作用力越大,分子越稳定
B.共价晶体中共价键越强,熔点越高
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
解析 A项,晶体中分子间作用力大小与分子的稳定性没有关系;C项,冰融化时水分子中共价键不发生断裂;D项,氯化钠熔化时离子键被破坏。
B
5.下列各组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是( )
A.Na2O和SiO2熔化 B.冰和金刚石熔化
C.氯化钠和蔗糖熔化 D.碘和干冰升华
解析 Na2O熔化克服离子键,SiO2熔化克服共价键,类型不同,故A错误;冰是分子晶体,金刚石是共价晶体,晶体类型不同,克服的作用力类型不同,故B错误;氯化钠熔化克服离子键,蔗糖熔化克服分子间作用力,类型不同,故C错误;碘和干冰均属于分子晶体,升华时均克服分子间作用力,类型相同,故D项正确。
D
6.下列说法一定正确的是( )
A.形成水溶液导电的一定是离子晶体
B.熔融态导电的一定是离子晶体
C.共价化合物形成的晶体一定是分子晶体
D.固态不导电、熔融态导电的一定是离子晶体
解析 部分分子晶体和离子晶体的水溶液能导电。固态不导电、熔融态导电是离子晶体区别其他晶体的性质。共价化合物形成的晶体可能是分子晶体,如干冰;也可能是共价晶体,如石英。
D
7.下列叙述正确的是 ( )
A.构成分子晶体的微粒一定含有共价键
B.离子晶体中一定只含有离子键
C.同主族元素形成的氧化物的晶体类型一定相同
D.熔化时无须破坏化学键的晶体一定是分子晶体
解析 稀有气体形成的分子晶体中无化学键,A项错误;离子晶体中一定含有离子键,也可能含有共价键,如NaOH,B项错误;在ⅣA族中,碳的氧化物CO、CO2形成的晶体为分子晶体,硅的氧化物SiO2属共价晶体,C项错误;分子晶体熔化时破坏的是分子间作用力,无化学键的破坏,D项正确。
D
8.下列物质中,化学式能准确表示物质的分子组成的是( )
A.氯化钠晶体(NaCl) B.干冰(CO2)
C.水晶(SiO2) D.氩气(Ar2)
解析 A项,氯化钠晶体是离子晶体,而离子晶体中没有单个分子,错误;C项,SiO2是共价晶体,共价晶体中没有单个分子,错误;D项,氩气是单原子分子,错误。
B
9.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。
下列一定能说明CaF2是离子晶体的实验是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C
解析 离子晶体中含有离子键,离子键在熔融状态下能够被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体为离子晶体的实验依据。
10.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.共价晶体 B.分子晶体
C.离子晶体 D.金属晶体
解析 元素A和B的原子序数都小于18,B元素原子的M层电子数为(a-b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素原子的次外层为K层,即b=2,有2个电子层,所以a=8-2=6,故A为氧元素,B原子的M层电子数为6-2=4,故B为硅元素,A、B两元素所形成的化合物为SiO2,属于共价晶体。
A
11.有几种晶体:A.水晶,B.冰醋酸,C.白磷,D.金刚石,E.晶体氩,F.干冰。
(1)属于分子晶体的是________,直接由原子构成的分子晶体是________。
(2)属于共价晶体的化合物是________。
(3)直接由原子构成的晶体是________。
(4)受热熔化时,化学键不发生变化的是________,需克服共价键的是________。
答案 (1)B、C、E、F E (2)A
(3)A、D、E (4)B、C、F A、D
解析 分子晶体由分子构成,有B、C、E、F。晶体氩是单原子分子;共价晶体和单原子分子晶体都由原子直接构成,共价晶体有A、D,但化合物只有A;分子晶体熔化时,一般不破坏化学键;共价晶体熔化时,破坏化学键。
12.现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:>3 550 Li:181 HF:-84 NaCl:801
硅晶体:1 410 Na:98 HCl:-114 KCl:776
硼晶体:2 300 K:64 HBr:-87 RbCl:718
二氧化硅:1 723 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。
(2)B组晶体属于________晶体。
(3)C组晶体属于________晶体,晶体含有的作用力有________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
答案 (1)共价 共价键 (2)金属
(3)分子 分子间作用力、共价键 (4)②④
解析 根据题给各组物质的熔点差异,可判断出A组物质为共价晶体,B组为金属晶体,C组为分子晶体,D组为离子晶体。
13.下列各组物质中,按熔点由低到高的顺序排列正确的是( )
A.Cl2、Br2、I2 B.CO2、SiO2 、 KCl
C.O2、I2、Hg D.SiC、NaCl、SO2
A
解析 Cl2、Br2、I2的晶体属于分子晶体,且组成和结构相似,随着相对分子质量的增大,分子间作用力增大,晶体的熔点逐渐升高,A正确。CO2、KCl、SiO2的晶体分别属于分子晶体、离子晶体、共价晶体,熔点:共价晶体>离子晶体>分子晶体,B错误。常温、常压下,O2为气态,I2为固态,Hg为液态,C错误。SiC、NaCl、SO2的晶体分别为共价晶体、离子晶体、分子晶体,它们的熔点逐渐降低,D错误。
14.SiCl4的分子结构与CCl4类似,对其作出如下推测,其中不正确的是
( )
A.SiCl4晶体是分子晶体
B.常温常压下SiCl4是气体
C.SiCl4的分子内部原子以共价键结合
D.SiCl4熔点高于CCl4
B
解析 A项, SiCl4与CCl4结构相似,CCl4属于分子晶体,则SiCl4晶体是分子晶体;B项,常温常压下CCl4是液体,SiCl4与CCl4结构相似,故SiCl4是液体;C项, CCl4分子内部原子以共价键结合,则SiCl4分子内部原子以共价键结合;D项,组成和结构相似的分子晶体的相对分子质量越大,熔点越高,则SiCl4熔点高于CCl4。
15.A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A________,B________,C________,D________(填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是____________(填化学式);
(3)C的单质是________(填“共价”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于________晶体。
答案 (1)碳 氧 硅 钠 (2)Si>Na>O2 (3)共价 离子
解析 由A、B、C、D都是短周期主族元素,A、C处于同一主族,且原子半径:C>A,可知C比A的原子序数大8;C原子核内的质子数等于A、B原子核内的质子数之和,则B的原子序数为8,B是氧;C原子最外层电子数是D原子最外层电子数的4倍,C原子最外层电子数不应是8,则D原子最外层电子数为1,结合原子半径的大小关系可知D是钠,C是硅,A是碳。
Thanks!
本课时内容结束
