专题5 第三单元 从微观结构看物质的多样性 第一课时 同素异形体 同分异构现象(共64张PPT)
文档属性
| 名称 | 专题5 第三单元 从微观结构看物质的多样性 第一课时 同素异形体 同分异构现象(共64张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-30 21:14:37 | ||
图片预览










文档简介
(共64张PPT)
第三单元 从微观结构看物质的多样性
第一课时 同素异形体 同分异构现象
【课程标准要求】
1.以同素异形现象、同分异构现象为例,认识物质的多样性与微观结构有关。学会同素异形体、同分异构体的判断方法。
2.认识物质的结构决定物质的性质,性质的特点体现了结构的特点。
3.利用结构模型,研究物质的微观结构。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、同素异形现象
1.同素异形现象和同素异形体
(1)同一种元素能够形成几种不同的单质,这种现象称为______________。
(2)同一种元素可形成不同单质,这些单质之间互称为这种元素的____________。
同素异形现象
同素异形体
2.常见的同素异形体
(1)碳的同素异形体
物质 金刚石 石墨 足球烯 (C60)
物理 性质 颜色 状态 无色透 明固体 灰黑色固体
硬度 熔点 坚硬、熔 点很高 质软、熔点高 硬度小、
熔点低
导电性 不导电 导电 不导电
微观 结构 每个碳原子与相邻的____个碳原子以共价键结合,形成__________结构 ______结构,层内碳原子间以________结合,排列成平面六边形平面网状结构,层间碳原子间存在______________ 由______个碳原子形成的封闭笼状分子,形似足球,称为“足球烯”
差异分析 碳原子的__________和__________不同 4
空间网状
层状
共价键
分子间作用力
60
成键方式
排列方式
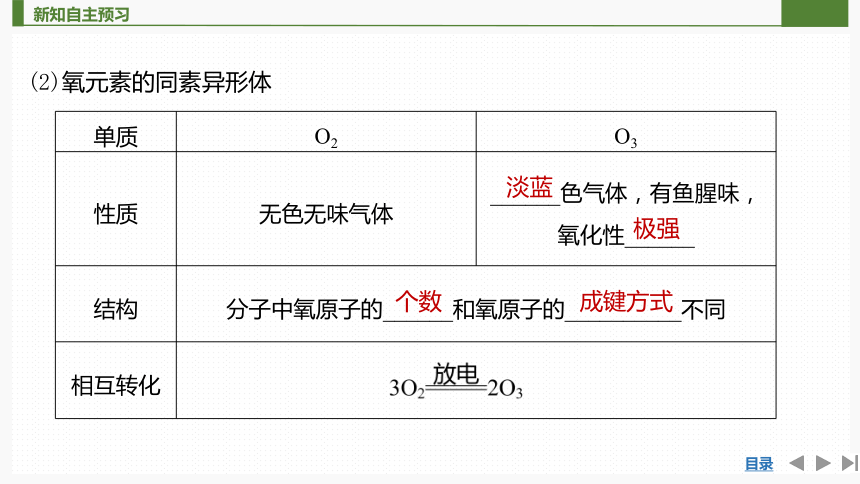
(2)氧元素的同素异形体
单质 O2 O3
性质 无色无味气体 ______色气体,有鱼腥味,氧化性______
结构 分子中氧原子的______和氧原子的__________不同 相互转化 淡蓝
极强
个数
成键方式
(3)磷元素的同素异形体
单质 白磷 红磷
性质 ______固体,有剧毒。白磷在空气中能自燃,应保存在冷水中 ______色固体,在空气中能稳定存在,在加热或点燃时也能燃烧
结构 白磷分子和红磷分子中磷原子的个数和磷原子的成键方式______ 蜡状
红棕
不同
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)18O和16O互称为同素异形体( )
(2)碳单质的同素异形体有金刚石、石墨和C60( )
(3)水、重水、超重水互为同素异形体( )
(4)12C、14C、C60互为同素异形体( )
×
√
×
×
二、同分异构现象 同分异构体
1.基本概念
(1)同分异构现象:化合物具有相同的________但具有__________的现象。
(2)同分异构体:________相同而结构______的化合物互称为同分异构体。
同分异构现象主要表现在有机化合物中。
分子式
不同结构
分子式
不同
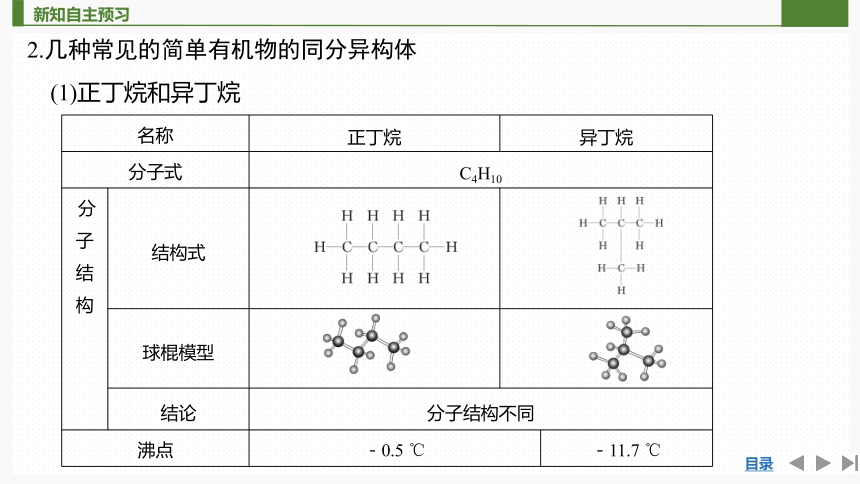
2.几种常见的简单有机物的同分异构体
(1)正丁烷和异丁烷
名称 正丁烷 异丁烷 分子式 C4H10 分子 结 构 结构式 球棍模型 结论 分子结构不同 沸点 -0.5 ℃ -11.7 ℃
(2)乙醇和二甲醚
名称 乙醇 二甲醚
分子式 C2H6O 分子 结构 结构 式
结论 分子结构______ 性质 沸点 78 ℃ -23 ℃
物理性质______,化学性质______ 不同
不同
不同
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
×
√
×
√
二、从微观和宏观相结合的视角分析同分异构现象
一、同素异形现象和同素异形体
一、同素异形现象和同素异形体
澳大利亚研究人员开发出被称为第五形态的固体碳,这种新的碳结构称作纳米泡沫碳,它的外形类似海绵,密度极小,并且有磁性。
1.纳米泡沫碳与金刚石之间是什么关系?
提示:纳米泡沫碳与金刚石是碳元素形成的不同单质,二者互为同素异形体。
2.同素异形体之间物理性质和化学性质是否相同?同素异形体之间的相互转化是化学变化还是物理变化?
提示:同素异形体物理性质不同,化学性质可能相似。同素异形体之间的转
化属于化学变化。
1.同素异形体的实质和微观组成
2.产生同素异形现象的原因
(1)同素异形体对象是指单质,不是指同位素和核素,也不是指化合物。
(2)互为同素异形体的不同单质是由同一种元素形成的,构成它们的原子的核电荷数相同,中子数可以相同,也可以不相同。
(1)组成分子的原子个数不同。如氧气(O2)和臭氧(O3)。
(2)晶体中原子的排列方式不同。如金刚石和石墨。
3.同素异形体的性质
(1)由于分子组成或晶体结构不同,同素异形体的性质存在区别,即物理性质差异很大。
(2)化学性质有些相似,有些相差很大,存在活泼性的差异。如金刚石硬度很大,不能导电,而石墨硬度较小,层与层之间能滑动,导电性能好;但两者化学性质相似(与O2反应、具有还原性等)。
1.闪电时空气中有臭氧生成。下列说法正确的是( )
A.O3和O2互为同位素
B.O2比O3稳定
C.等体积O3和O2含有相同质子数
D.O3与O2的相互转变是物理变化
解析 O2和O3互为同素异形体,A不正确;不知道温度、压强,不能确定O2、O3的物质的量,也就是不能确定质子数,C不正确;同素异形体之间的转化属于化学变化,D不正确。
B
2.下列叙述正确的是( )
A.由碳元素的单质组成的物质一定是纯净物
B.金刚石和石墨具有相似的化学性质
C.金刚石转化为石墨,有单质生成,该反应属于氧化还原反应
D.C60是新发现的一种碳的化合物
解析 碳元素的单质有多种,由碳元素的单质组成的物质可能是纯净物,也可能是混合物,A错误;金刚石和石墨组成元素相同,具有相似的化学性质,B正确;金刚石转化为石墨,元素价态不变,该反应属于非氧化还原反应,C错误;C60是单质,D错误。
B
3.科学家发现的C60是一种新的分子,它是空心的,具有类似足球的结构,被称为“分子足球”。最近日本科学家确认世界上还存在一种“分子足球”N60,它与C60的结构相似,而且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60,下列说法中正确的是( )
A.N60是化合物,不是单质
B.N60与14N都是氮的同位素
C.N60没有同素异形体
D.N60的发现开辟了能源世界的新天地,N60将会成为较好的火箭燃料
解析 N60是单质,同位素的研究对象是原子,N60与N2互为同素异形体。
D
二、从微观和宏观相结合的视角分析同分异构现象
1.四角度认识同分异构体
(1)从物质看:互为同分异构体的物质只能是化合物。它们之间的转化属于化学变化,若共存则为混合物。
(2)从分子式看:互为同分异构体的化合物,其分子式相同,相对分子质量也相同,但相对分子质量相同的化合物分子式不一定相同,如甲酸(HCOOH)和乙醇(CH3CH2OH)的相对分子质量均为46。
(3)从结构看:互为同分异构体的化合物,空间结构不同。
(4)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似。
2.同位素、同素异形体和同分异构体的比较
(1)同位素、同素异形体和同分异构体的比较
同位素 同素异形体 同分异构体
定义 具有相同质子数和不同的中子数的同一元素的不同原子互称同位素 由同种元素形成的不同单质叫做这种元素的同素异形体 分子式相同,但结构不同的化合物互称为同分异构体
研究对象 原子 单质 化合物
相同点 质子数相同,皆为原子 元素种类相同,皆为单质 分子式相同,皆为化合物
不同点 中子数不同,原子种类不同 原子个数不同,或原子结合方式不同 分子内原子的连接方式不同
实例 12C、13C、14C; 1H、2H、3H等 金刚石、石墨、C60;红磷、白磷;O2、O3等 正丁烷、异丁烷等
(2)联系
(1)在辨析同位素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
(2)同种元素可以有多种不同的同位素原子,所以原子种类的数目远多于元素种类的数目。
(3)自然界中,元素的各种同位素的含量基本保持不变。元素的平均相对原子质量都有确定值。
(4)相对分子质量相同的两化合物不一定是同分异构体(如CO和C2H4不是同分异构体)。
4.科学家发现C60后,近年又合成了许多球形分子,如C50、C70、C120、C540等,
它们互称为( )
A.同一种物质 B.同分异构体
C.同素异形体 D.同位素
解析 C60与C50、C70、C120、C540均是由碳元素组成的不同单质,互为同素异形体。
C
5.下列说法不正确的是( )
A
6.下列各对物质中,属于同分异构体的是( )
D
解析 白磷和红磷两者属于同素异形体;干冰和CO2是同一种物质,只是状态不同;C项属于同一种物质;D项中两者的分子式均为C6H14,结构不同,属于同分异构体,符合题意。
1.关于金刚石、石墨、C60的下列说法中,不正确的是( )
A.它们都是由碳元素组成的单质
B.它们都是电的良导体
C.它们的原子排列方式各不相同
D.它们的化学性质几乎相同
解析 金刚石、石墨和C60都是由碳元素组成的单质,它们都是碳元素的同素异形体;由于其结构中各原子的排列方式不同,而使其物理性质差异较大,如金刚石不导电,石墨能导电等。但它们的化学性质几乎完全相同,如都能在一定条件下与O2完全反应生成二氧化碳。
B
2.互为同分异构体的物质一定不可能具有( )
A.相同的分子式
B.相同的结构
C.相似的化学性质
D.相同的相对分子质量
解析 互为同分异构体的物质的分子式相同,其相对分子质量也相同,但其结构不同,化学性质不一定相似。
B
3.下列各组物质中,关系不正确的是( )
解析 H2和D2是由氢元素的不同同位素形成的氢气单质,既不是同位素也不是同素异形体。
A
4.观察下列几种物质的化学式或者结构简式。
其中:(1)互为同分异构体的是________(填序号,下同);
(2)互为同位素的是________;
(3)互为同素异形体的是________;
(4)是同种物质的是________。
答案 (1)①和②、⑤和⑥ (2) 和
(3)⑨和⑩ (4)⑦和⑧
解析 (1)①和②、⑤和⑥,分子式分别相同,但结构不同,互为同分异构体。
(2) 和 的质子数相同,中子数不同,互为同位素。
(3)⑨和⑩是同种元素形成的不同单质,互为同素异形体。
(4)⑦和⑧是同一种物质。
1.下列各组中,互称为同素异形体的是( )
A.12C和14C B.水和冰
C.C(金刚石)和C60 D.CO和CO2
解析 12C和 14C互为同位素;水和冰是同一物质的不同状态;C(金刚石)和C60互称为同素异形体;CO和CO2是碳元素常见的两种氧化物。
C
2.氢元素有1H(氕)、 2H(氘)、 3H(氚)三种原子,下列说法正确的是( )
A.1H、 2H、 3H为同素异形体
B.1H、 2H、 3H互为同位素
C.1H、 2H、 3H的中子数相同
D.1H、 2H、 3H为同分异构体
解析 同位素的定义:质子数相同而中子数不同的同一元素的不同原子。
B
D
4.下列说法中正确的是( )
A.SO2、SO3互为同分异构体
B.两种化合物的组成元素相同,且各元素的质量分数也相同,则二者一定是
同分异构体
C.相对分子质量相同的几种化合物,互称为同分异构体
D.组成元素的质量分数相同,且相对分子质量也相同的不同化合物,互为同
分异构体
D
解析 SO2和SO3分子式不同,A错误;若两种化合物的组成元素相同,各元素的质量分数也相同,则它们的最简式必定相同,最简式相同的化合物可能是同分异构体,也可能不是同分异构体,B错误;相对分子质量相同的物质是很多的,如无机物中的H2SO4和H3PO4,又如有机物中的C2H6O(乙醇)和CH2O2(甲酸),这些物质都具有相同的相对分子质量,但由于它们的分子组成不同,所以它们不是同分异构体,C错误;当不同化合物组成元素的质量分数相同,相对分子质量也相同时,其分子式一定相同,因此这样的不同化合物互为同分异构体,D正确。
5.碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常
的力学、电学和化学性能。下列关于碳纳米管的说法不正确的是( )
A.碳纳米管属于一种有机合成纤维
B.碳纳米管与金刚石互为同素异形体
C.常温下,碳纳米管具有较好的稳定性
D.碳纳米管比表面积大,可用作新型储氢材料
A
解析 碳纳米管是由碳元素形成的单质,不是有机物,A项错误;B项,碳纳米管与金刚石都是碳元素形成的单质,互为同素异形体,正确;C项,碳纳米管由于是碳单质,常温下性质稳定,正确;D项,由于碳纳米管比表面积大,可吸附氢,所以可用作新型储氢材料,正确。
6.下列关于同分异构体的说法错误的是( )
A.具有相同相对分子质量和不同结构的化合物互称为同分异构体
B.互称为同分异构体的物质一定不是同种物质
C.同分异构体之间物理性质一定不同,化学性质不一定相同
D.同分异构体一定具有相同的相对分子质量
解析 N2与CO、C2H4具有相同的相对分子质量和不同的结构,但不是同分异构体,A错误。
A
7.下列各组物质中,两者互为同分异构体的是( )
①CuSO4·5H2O和CuSO4·3H2O
②NH4CNO与CO(NH2)2
③CH3CH2OH和CH3—O—CH3
A.①②③ B.②③ C.①③ D.①②
解析 ①中两种物质化学式不同,不属于同分异构体。②中和③中的物质分子式分别相同,故②中两种物质互为同分异构体,③中两种物质互为同分异构体。
B
B
解析 黑磷也是磷元素组成的单质,与白磷互为同素异形体,A错误;类比石墨的导电性知B正确;白磷、黑磷是不同的物质,C错误;黑磷性质稳定,D错误。
9.硫可以形成分子式为S2、S4、S6、S8的单质,其中S8的分子结构如图所示。下
列有关说法正确的是( )
A.S2、S4、S6、S8互为同位素
B.S2的摩尔质量为32 g·mol-1
C.硫的单质在足量的空气中完全燃烧可生成SO3
D.1 mol S8单质中含有的S—S键个数为8NA
D
解析 S2、S4、S6、S8都是由硫元素形成的单质,互为同素异形体,A错误;S2的摩尔质量为64 g·mol-1,B错误;硫单质在空气中燃烧只能生成SO2,而不能生成SO3,C错误;由图可知,1个S8分子中含有8个S—S键,D正确。
A
解析 a和b具有相同的分子组成,但分子结构不同,a中的2个Cl原子处于相邻位置,而b中的2个Cl原子处于相对位置,所以a和b互为同分异构体。
11.(2021·江苏常州高一期中)下列物质中:
(1)互为同分异构体的有_________________________________________;
(2)互为同素异形体的有__________________________________________;
(3)属于同位素的有______________________________________________;
(4)属于同一种物质的有___________________________________________。
答案 (1)②⑤ (2)③⑧ (3)⑥⑦ (4)①④
12.硫通常是一种淡黄色晶体。有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个分子中硫原子的个数不同,可用Sx表示。对三种蒸气测定结果是:
(1)橙色蒸气密度折算到标准状况后是11.43 g·L-1,则它的化学式是________。
(2)红棕色蒸气的质量是相同状况下同体积空气的6.62倍,则它的化学式是________。
(3)无色蒸气对氢气的相对密度是64,则它的化学式是________。此事实说明硫有________。
答案 (1)S8 (2)S6 (3)S4 多种同素异形体
解析 由题意知:(1)中硫蒸气的相对分子质量为M=11.43×22.4≈256,其单质的分子式为S8。(2)中硫蒸气的相对分子质量为M=29×6.62≈192,其单质的分子式为S6。(3)中硫蒸气的相对分子质量为M=64×2=128,其单质的分子式为S4。综上分析,可知硫元素有多种同素异形体。
13.从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示。下列关于石墨烯的说法正确的是( )
A.具有良好的导电性
B.与C60互为同位素
C.与金刚石互为同位素
D.不能与氧气发生反应
A
解析 石墨可以导电,因此石墨烯具有良好的导电性,A正确;石墨烯是碳元素的单质,与C60互为同素异形体,B错误;石墨烯与金刚石互为同素异形体,C错误;石墨能被氧气氧化,因此石墨烯也能与氧气发生反应,D错误。
14.短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元
素的原子内层电子数是最外层电子数的一半,则下列说法不正确的是( )
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的化合物是共价化合物
C.W得电子能力比Q弱
D.X有多种同素异形体,而Y不存在同素异形体
D
X Y
Z W Q
解析 依题意可先确定X为碳(C)元素,再根据其他元素在周期表中的位置可确定Y、Z、W、Q分别为氧(O)、硅(Si)、硫(S)和氯(Cl)。Na与S可形成类似Na2O2的化合物Na2S2,A正确;SiO2是共价化合物, B正确;S的得电子能力比Cl弱,C正确;氧存在同素异形体O2和O3,D错误。
15.今有原子序数依次增大的A、B、C、D、E、F六种短周期主族元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,且均能生成盐和水。D和E的电子层结构见下表:
元素 最外层电子数 次外层电子数
D x x+4
E x+1 x+4
在一般情况下,B元素的单质不能与A、C、D、E元素的单质化合。请按要求填空:
(1)各元素的元素符号分别为A________,B__________,C__________,D__________, E__________,F__________。
(2)D的氢化物的化学式为________,E的氢化物的化学式为________,两者的稳定性:________>________。
(3)原子序数介于E和F之间的元素R能形成R2、R8等几种单质,这几种单质之间的关系是________。
答案 (1)Na Mg Al Si P Cl (2)SiH4 PH3 PH3 SiH4
(3)互为同素异形体
解析 由x+4=8可知x=4,D、E分别为Si、P元素;由性质信息推测C的氢氧化物具有两性,C为Al元素,则A为Na元素。由“最外层共有11个电子”可知F为Cl元素。由“原子序数依次增大”可知B为Mg元素。
Thanks!
本课时内容结束
第三单元 从微观结构看物质的多样性
第一课时 同素异形体 同分异构现象
【课程标准要求】
1.以同素异形现象、同分异构现象为例,认识物质的多样性与微观结构有关。学会同素异形体、同分异构体的判断方法。
2.认识物质的结构决定物质的性质,性质的特点体现了结构的特点。
3.利用结构模型,研究物质的微观结构。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、同素异形现象
1.同素异形现象和同素异形体
(1)同一种元素能够形成几种不同的单质,这种现象称为______________。
(2)同一种元素可形成不同单质,这些单质之间互称为这种元素的____________。
同素异形现象
同素异形体
2.常见的同素异形体
(1)碳的同素异形体
物质 金刚石 石墨 足球烯 (C60)
物理 性质 颜色 状态 无色透 明固体 灰黑色固体
硬度 熔点 坚硬、熔 点很高 质软、熔点高 硬度小、
熔点低
导电性 不导电 导电 不导电
微观 结构 每个碳原子与相邻的____个碳原子以共价键结合,形成__________结构 ______结构,层内碳原子间以________结合,排列成平面六边形平面网状结构,层间碳原子间存在______________ 由______个碳原子形成的封闭笼状分子,形似足球,称为“足球烯”
差异分析 碳原子的__________和__________不同 4
空间网状
层状
共价键
分子间作用力
60
成键方式
排列方式
(2)氧元素的同素异形体
单质 O2 O3
性质 无色无味气体 ______色气体,有鱼腥味,氧化性______
结构 分子中氧原子的______和氧原子的__________不同 相互转化 淡蓝
极强
个数
成键方式
(3)磷元素的同素异形体
单质 白磷 红磷
性质 ______固体,有剧毒。白磷在空气中能自燃,应保存在冷水中 ______色固体,在空气中能稳定存在,在加热或点燃时也能燃烧
结构 白磷分子和红磷分子中磷原子的个数和磷原子的成键方式______ 蜡状
红棕
不同
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)18O和16O互称为同素异形体( )
(2)碳单质的同素异形体有金刚石、石墨和C60( )
(3)水、重水、超重水互为同素异形体( )
(4)12C、14C、C60互为同素异形体( )
×
√
×
×
二、同分异构现象 同分异构体
1.基本概念
(1)同分异构现象:化合物具有相同的________但具有__________的现象。
(2)同分异构体:________相同而结构______的化合物互称为同分异构体。
同分异构现象主要表现在有机化合物中。
分子式
不同结构
分子式
不同
2.几种常见的简单有机物的同分异构体
(1)正丁烷和异丁烷
名称 正丁烷 异丁烷 分子式 C4H10 分子 结 构 结构式 球棍模型 结论 分子结构不同 沸点 -0.5 ℃ -11.7 ℃
(2)乙醇和二甲醚
名称 乙醇 二甲醚
分子式 C2H6O 分子 结构 结构 式
结论 分子结构______ 性质 沸点 78 ℃ -23 ℃
物理性质______,化学性质______ 不同
不同
不同
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
×
√
×
√
二、从微观和宏观相结合的视角分析同分异构现象
一、同素异形现象和同素异形体
一、同素异形现象和同素异形体
澳大利亚研究人员开发出被称为第五形态的固体碳,这种新的碳结构称作纳米泡沫碳,它的外形类似海绵,密度极小,并且有磁性。
1.纳米泡沫碳与金刚石之间是什么关系?
提示:纳米泡沫碳与金刚石是碳元素形成的不同单质,二者互为同素异形体。
2.同素异形体之间物理性质和化学性质是否相同?同素异形体之间的相互转化是化学变化还是物理变化?
提示:同素异形体物理性质不同,化学性质可能相似。同素异形体之间的转
化属于化学变化。
1.同素异形体的实质和微观组成
2.产生同素异形现象的原因
(1)同素异形体对象是指单质,不是指同位素和核素,也不是指化合物。
(2)互为同素异形体的不同单质是由同一种元素形成的,构成它们的原子的核电荷数相同,中子数可以相同,也可以不相同。
(1)组成分子的原子个数不同。如氧气(O2)和臭氧(O3)。
(2)晶体中原子的排列方式不同。如金刚石和石墨。
3.同素异形体的性质
(1)由于分子组成或晶体结构不同,同素异形体的性质存在区别,即物理性质差异很大。
(2)化学性质有些相似,有些相差很大,存在活泼性的差异。如金刚石硬度很大,不能导电,而石墨硬度较小,层与层之间能滑动,导电性能好;但两者化学性质相似(与O2反应、具有还原性等)。
1.闪电时空气中有臭氧生成。下列说法正确的是( )
A.O3和O2互为同位素
B.O2比O3稳定
C.等体积O3和O2含有相同质子数
D.O3与O2的相互转变是物理变化
解析 O2和O3互为同素异形体,A不正确;不知道温度、压强,不能确定O2、O3的物质的量,也就是不能确定质子数,C不正确;同素异形体之间的转化属于化学变化,D不正确。
B
2.下列叙述正确的是( )
A.由碳元素的单质组成的物质一定是纯净物
B.金刚石和石墨具有相似的化学性质
C.金刚石转化为石墨,有单质生成,该反应属于氧化还原反应
D.C60是新发现的一种碳的化合物
解析 碳元素的单质有多种,由碳元素的单质组成的物质可能是纯净物,也可能是混合物,A错误;金刚石和石墨组成元素相同,具有相似的化学性质,B正确;金刚石转化为石墨,元素价态不变,该反应属于非氧化还原反应,C错误;C60是单质,D错误。
B
3.科学家发现的C60是一种新的分子,它是空心的,具有类似足球的结构,被称为“分子足球”。最近日本科学家确认世界上还存在一种“分子足球”N60,它与C60的结构相似,而且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60,下列说法中正确的是( )
A.N60是化合物,不是单质
B.N60与14N都是氮的同位素
C.N60没有同素异形体
D.N60的发现开辟了能源世界的新天地,N60将会成为较好的火箭燃料
解析 N60是单质,同位素的研究对象是原子,N60与N2互为同素异形体。
D
二、从微观和宏观相结合的视角分析同分异构现象
1.四角度认识同分异构体
(1)从物质看:互为同分异构体的物质只能是化合物。它们之间的转化属于化学变化,若共存则为混合物。
(2)从分子式看:互为同分异构体的化合物,其分子式相同,相对分子质量也相同,但相对分子质量相同的化合物分子式不一定相同,如甲酸(HCOOH)和乙醇(CH3CH2OH)的相对分子质量均为46。
(3)从结构看:互为同分异构体的化合物,空间结构不同。
(4)从性质看:互为同分异构体的化合物,物理性质不同,化学性质可能相似。
2.同位素、同素异形体和同分异构体的比较
(1)同位素、同素异形体和同分异构体的比较
同位素 同素异形体 同分异构体
定义 具有相同质子数和不同的中子数的同一元素的不同原子互称同位素 由同种元素形成的不同单质叫做这种元素的同素异形体 分子式相同,但结构不同的化合物互称为同分异构体
研究对象 原子 单质 化合物
相同点 质子数相同,皆为原子 元素种类相同,皆为单质 分子式相同,皆为化合物
不同点 中子数不同,原子种类不同 原子个数不同,或原子结合方式不同 分子内原子的连接方式不同
实例 12C、13C、14C; 1H、2H、3H等 金刚石、石墨、C60;红磷、白磷;O2、O3等 正丁烷、异丁烷等
(2)联系
(1)在辨析同位素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
(2)同种元素可以有多种不同的同位素原子,所以原子种类的数目远多于元素种类的数目。
(3)自然界中,元素的各种同位素的含量基本保持不变。元素的平均相对原子质量都有确定值。
(4)相对分子质量相同的两化合物不一定是同分异构体(如CO和C2H4不是同分异构体)。
4.科学家发现C60后,近年又合成了许多球形分子,如C50、C70、C120、C540等,
它们互称为( )
A.同一种物质 B.同分异构体
C.同素异形体 D.同位素
解析 C60与C50、C70、C120、C540均是由碳元素组成的不同单质,互为同素异形体。
C
5.下列说法不正确的是( )
A
6.下列各对物质中,属于同分异构体的是( )
D
解析 白磷和红磷两者属于同素异形体;干冰和CO2是同一种物质,只是状态不同;C项属于同一种物质;D项中两者的分子式均为C6H14,结构不同,属于同分异构体,符合题意。
1.关于金刚石、石墨、C60的下列说法中,不正确的是( )
A.它们都是由碳元素组成的单质
B.它们都是电的良导体
C.它们的原子排列方式各不相同
D.它们的化学性质几乎相同
解析 金刚石、石墨和C60都是由碳元素组成的单质,它们都是碳元素的同素异形体;由于其结构中各原子的排列方式不同,而使其物理性质差异较大,如金刚石不导电,石墨能导电等。但它们的化学性质几乎完全相同,如都能在一定条件下与O2完全反应生成二氧化碳。
B
2.互为同分异构体的物质一定不可能具有( )
A.相同的分子式
B.相同的结构
C.相似的化学性质
D.相同的相对分子质量
解析 互为同分异构体的物质的分子式相同,其相对分子质量也相同,但其结构不同,化学性质不一定相似。
B
3.下列各组物质中,关系不正确的是( )
解析 H2和D2是由氢元素的不同同位素形成的氢气单质,既不是同位素也不是同素异形体。
A
4.观察下列几种物质的化学式或者结构简式。
其中:(1)互为同分异构体的是________(填序号,下同);
(2)互为同位素的是________;
(3)互为同素异形体的是________;
(4)是同种物质的是________。
答案 (1)①和②、⑤和⑥ (2) 和
(3)⑨和⑩ (4)⑦和⑧
解析 (1)①和②、⑤和⑥,分子式分别相同,但结构不同,互为同分异构体。
(2) 和 的质子数相同,中子数不同,互为同位素。
(3)⑨和⑩是同种元素形成的不同单质,互为同素异形体。
(4)⑦和⑧是同一种物质。
1.下列各组中,互称为同素异形体的是( )
A.12C和14C B.水和冰
C.C(金刚石)和C60 D.CO和CO2
解析 12C和 14C互为同位素;水和冰是同一物质的不同状态;C(金刚石)和C60互称为同素异形体;CO和CO2是碳元素常见的两种氧化物。
C
2.氢元素有1H(氕)、 2H(氘)、 3H(氚)三种原子,下列说法正确的是( )
A.1H、 2H、 3H为同素异形体
B.1H、 2H、 3H互为同位素
C.1H、 2H、 3H的中子数相同
D.1H、 2H、 3H为同分异构体
解析 同位素的定义:质子数相同而中子数不同的同一元素的不同原子。
B
D
4.下列说法中正确的是( )
A.SO2、SO3互为同分异构体
B.两种化合物的组成元素相同,且各元素的质量分数也相同,则二者一定是
同分异构体
C.相对分子质量相同的几种化合物,互称为同分异构体
D.组成元素的质量分数相同,且相对分子质量也相同的不同化合物,互为同
分异构体
D
解析 SO2和SO3分子式不同,A错误;若两种化合物的组成元素相同,各元素的质量分数也相同,则它们的最简式必定相同,最简式相同的化合物可能是同分异构体,也可能不是同分异构体,B错误;相对分子质量相同的物质是很多的,如无机物中的H2SO4和H3PO4,又如有机物中的C2H6O(乙醇)和CH2O2(甲酸),这些物质都具有相同的相对分子质量,但由于它们的分子组成不同,所以它们不是同分异构体,C错误;当不同化合物组成元素的质量分数相同,相对分子质量也相同时,其分子式一定相同,因此这样的不同化合物互为同分异构体,D正确。
5.碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常
的力学、电学和化学性能。下列关于碳纳米管的说法不正确的是( )
A.碳纳米管属于一种有机合成纤维
B.碳纳米管与金刚石互为同素异形体
C.常温下,碳纳米管具有较好的稳定性
D.碳纳米管比表面积大,可用作新型储氢材料
A
解析 碳纳米管是由碳元素形成的单质,不是有机物,A项错误;B项,碳纳米管与金刚石都是碳元素形成的单质,互为同素异形体,正确;C项,碳纳米管由于是碳单质,常温下性质稳定,正确;D项,由于碳纳米管比表面积大,可吸附氢,所以可用作新型储氢材料,正确。
6.下列关于同分异构体的说法错误的是( )
A.具有相同相对分子质量和不同结构的化合物互称为同分异构体
B.互称为同分异构体的物质一定不是同种物质
C.同分异构体之间物理性质一定不同,化学性质不一定相同
D.同分异构体一定具有相同的相对分子质量
解析 N2与CO、C2H4具有相同的相对分子质量和不同的结构,但不是同分异构体,A错误。
A
7.下列各组物质中,两者互为同分异构体的是( )
①CuSO4·5H2O和CuSO4·3H2O
②NH4CNO与CO(NH2)2
③CH3CH2OH和CH3—O—CH3
A.①②③ B.②③ C.①③ D.①②
解析 ①中两种物质化学式不同,不属于同分异构体。②中和③中的物质分子式分别相同,故②中两种物质互为同分异构体,③中两种物质互为同分异构体。
B
B
解析 黑磷也是磷元素组成的单质,与白磷互为同素异形体,A错误;类比石墨的导电性知B正确;白磷、黑磷是不同的物质,C错误;黑磷性质稳定,D错误。
9.硫可以形成分子式为S2、S4、S6、S8的单质,其中S8的分子结构如图所示。下
列有关说法正确的是( )
A.S2、S4、S6、S8互为同位素
B.S2的摩尔质量为32 g·mol-1
C.硫的单质在足量的空气中完全燃烧可生成SO3
D.1 mol S8单质中含有的S—S键个数为8NA
D
解析 S2、S4、S6、S8都是由硫元素形成的单质,互为同素异形体,A错误;S2的摩尔质量为64 g·mol-1,B错误;硫单质在空气中燃烧只能生成SO2,而不能生成SO3,C错误;由图可知,1个S8分子中含有8个S—S键,D正确。
A
解析 a和b具有相同的分子组成,但分子结构不同,a中的2个Cl原子处于相邻位置,而b中的2个Cl原子处于相对位置,所以a和b互为同分异构体。
11.(2021·江苏常州高一期中)下列物质中:
(1)互为同分异构体的有_________________________________________;
(2)互为同素异形体的有__________________________________________;
(3)属于同位素的有______________________________________________;
(4)属于同一种物质的有___________________________________________。
答案 (1)②⑤ (2)③⑧ (3)⑥⑦ (4)①④
12.硫通常是一种淡黄色晶体。有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个分子中硫原子的个数不同,可用Sx表示。对三种蒸气测定结果是:
(1)橙色蒸气密度折算到标准状况后是11.43 g·L-1,则它的化学式是________。
(2)红棕色蒸气的质量是相同状况下同体积空气的6.62倍,则它的化学式是________。
(3)无色蒸气对氢气的相对密度是64,则它的化学式是________。此事实说明硫有________。
答案 (1)S8 (2)S6 (3)S4 多种同素异形体
解析 由题意知:(1)中硫蒸气的相对分子质量为M=11.43×22.4≈256,其单质的分子式为S8。(2)中硫蒸气的相对分子质量为M=29×6.62≈192,其单质的分子式为S6。(3)中硫蒸气的相对分子质量为M=64×2=128,其单质的分子式为S4。综上分析,可知硫元素有多种同素异形体。
13.从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示。下列关于石墨烯的说法正确的是( )
A.具有良好的导电性
B.与C60互为同位素
C.与金刚石互为同位素
D.不能与氧气发生反应
A
解析 石墨可以导电,因此石墨烯具有良好的导电性,A正确;石墨烯是碳元素的单质,与C60互为同素异形体,B错误;石墨烯与金刚石互为同素异形体,C错误;石墨能被氧气氧化,因此石墨烯也能与氧气发生反应,D错误。
14.短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元
素的原子内层电子数是最外层电子数的一半,则下列说法不正确的是( )
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的化合物是共价化合物
C.W得电子能力比Q弱
D.X有多种同素异形体,而Y不存在同素异形体
D
X Y
Z W Q
解析 依题意可先确定X为碳(C)元素,再根据其他元素在周期表中的位置可确定Y、Z、W、Q分别为氧(O)、硅(Si)、硫(S)和氯(Cl)。Na与S可形成类似Na2O2的化合物Na2S2,A正确;SiO2是共价化合物, B正确;S的得电子能力比Cl弱,C正确;氧存在同素异形体O2和O3,D错误。
15.今有原子序数依次增大的A、B、C、D、E、F六种短周期主族元素。已知A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,且均能生成盐和水。D和E的电子层结构见下表:
元素 最外层电子数 次外层电子数
D x x+4
E x+1 x+4
在一般情况下,B元素的单质不能与A、C、D、E元素的单质化合。请按要求填空:
(1)各元素的元素符号分别为A________,B__________,C__________,D__________, E__________,F__________。
(2)D的氢化物的化学式为________,E的氢化物的化学式为________,两者的稳定性:________>________。
(3)原子序数介于E和F之间的元素R能形成R2、R8等几种单质,这几种单质之间的关系是________。
答案 (1)Na Mg Al Si P Cl (2)SiH4 PH3 PH3 SiH4
(3)互为同素异形体
解析 由x+4=8可知x=4,D、E分别为Si、P元素;由性质信息推测C的氢氧化物具有两性,C为Al元素,则A为Na元素。由“最外层共有11个电子”可知F为Cl元素。由“原子序数依次增大”可知B为Mg元素。
Thanks!
本课时内容结束
