【同步课件集】2013-2014学年高中化学选修四:专题二 第三单元 化学平衡的移动 探究课件(苏教版选修4)
文档属性
| 名称 | 【同步课件集】2013-2014学年高中化学选修四:专题二 第三单元 化学平衡的移动 探究课件(苏教版选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-10-28 18:44:50 | ||
图片预览








文档简介
课件28张PPT。第三单元 化学平衡的移动影响化学反应速率的外界因素有哪些?
提示 浓度、温度、压强、催化剂。
达到平衡时,正 、逆反应速率相等,若改变外界条件,使反应速率改变,v正不等于v逆,平衡是否会移动?
提示 会,若外界条件改变,使v正≠v逆,则平衡会移动,直到建立新的平衡。1.2.了解化学平衡移动的概念和影响平衡移动的因素。
理解温度、浓度、压强的改变对化学平衡移动的影响。
应用化学平衡移动原理和化学反应速率相关知识选择合成氨的条件。1.2.3.化学平衡状态的移动
通过改变反应条件(温度、_____、气体反应的_____),而使平衡状态_________的现象,叫化学平衡状态的移动,简称_________。
影响化学平衡移动的因素
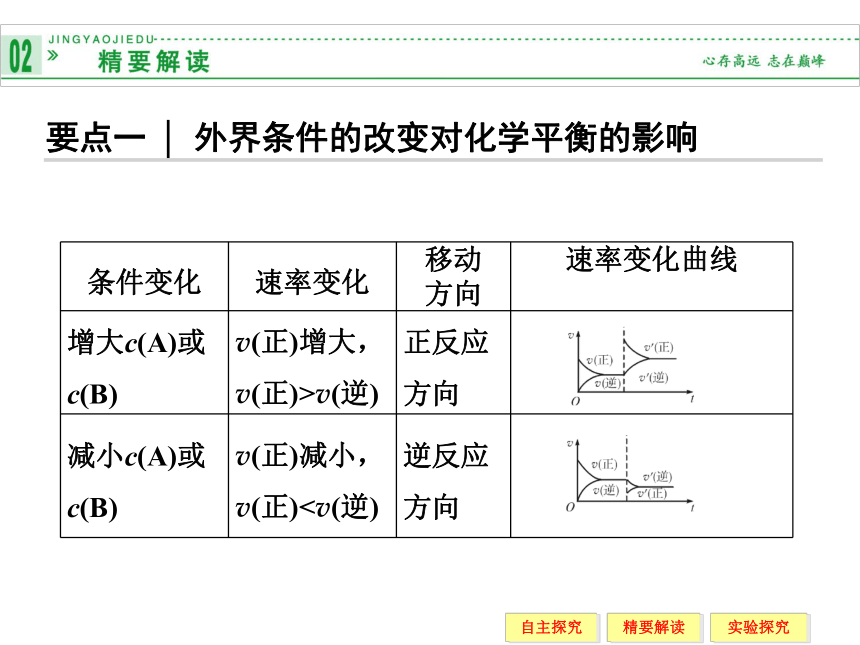
(1)浓度的影响
_____反应物浓度或_____生成物浓度,平衡向正反应方向移动;_____反应物浓度或_____生成物浓度,平衡向逆反应方向移动。
1.2.浓度压强发生变化平衡移动增大减小减小增大(3)压强的影响
其他条件不变时,增大压强,会使平衡向着_____________的方向移动;减小压强,会使平衡向着_____________的方向移动。
(4)催化剂
由于催化剂能够_________地改变正、逆反应速率,因此它对化学平衡的移动_____影响,但是使用催化剂,能改变反应到达平衡所需的_____。
勒夏特列原理
如果改变影响化学平衡的一个因素(如:_____、_____以及__________________________),平衡将向着_________________的方向移动。气体体积缩小气体体积增大同等程度没有时间3.温度压强参加反应的化学物质的浓度能够减弱这种改变【慎思1】提示 因为C(s)的浓度为一常数,故增加其用量,化学反应速率不变,平衡不发生移动;若增加H2O(g)的量,则H2O(g)的浓度增大,使v(正)>v(逆),平衡向正反应方向移动。 对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是 ( )。
A.加入一种反应物 B.增大体系的压强
C.升高温度 D.使用催化剂
解析 当一个平衡体系中有固体存在时,增大固体的量(注意区别于增大固体的接触面积)不会引起反应速率的变化,平衡不移动;对于一个反应前后气体物质的量不变的可逆反应,压强的变化不会引起平衡的移动;升高温度,化学平衡一定发生移动,因为任何化学反应都伴随着能量的变化(吸热或放热);使用催化剂可以同等程度地改变正、逆反应速率,所以化学平衡不移动。
答案 C【慎思2】 续表
续表
【例1】?下列说法正确的是 ( )。
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动答案 C
升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热反应方向移动。
【体验1】?解析:该反应是一个气体体积增大的吸热反应。加压,平衡向左移动,A的浓度增大,v正增加;减压、平衡向右移动,A的浓度减小,v正减小;减小C的浓度,平衡向右移动,A的浓度减小,v正减小;降温平衡向逆反应方向移动,A的浓度增大,v正减小。
答案:DA.加压 B.减压
C.减小C的浓度 D.降温
化学平衡图像题的解答原则
(1)“定一议二”原则
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的意义三个量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系和确定纵坐标所表示的量,讨论横坐标与曲线的关系。如图:这类图像的分析方法是“定一议二”,当有多条曲线及两个以上条件时,要固定其中一个条件,分析其他条件之间的关系,必要时,作一辅助线分析。
(2)“先拐先平,数值大”原则
在化学平衡图像中,先出现拐点的反应先达到平衡,先出现拐点的曲线表示的温度较高(如图A)或表示的压强较大(如图B)。图A表示T2>T1,正反应是放热反应。
图B表示p1<p2,A是反应物,正反应为气体总体积缩小的反应,即a+b>c。【例2】?下列有关说法正确的是 ( )。
A.x=2,反应开始2 min内,v(B)=0.1 mol·L-1·min-1
B.t1时改变的条件是降温,平衡逆向移动C.t2时改变的条件可能是增大c(C),平衡时B的物质的量
分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催
化剂,c(B)不变答案 D解答图像问题的方法技巧
(1)不管是速率图像还是平衡图像,都要搞清纵、横坐标的含义,都要与化学原理相联系,特别是与平衡移动原理相联系。
(2)三步分析法:一看反应速率是增大还是减小;二看v(正)、v(逆)的相对大小;三看化学平衡移动的方向。
(3)四要素分析法:看曲线的起点;看曲线的变化趋势;看曲线的转折点;看曲线的终点。【体验2】?解析 随着温度的升高,化学平衡应向吸热反应方向移动,即向逆反应方向移动,所以生成物C的体积分数减小,反应物的含量增大,反应物的转化率减小。
增大体系的压强,由于反应的两边都是气态物质,所以正反应和逆反应的速率都增大。而加入催化剂,只能加快反应速率,缩短达到平衡的时间,不能使平衡移动,所以达到平衡后,各组分的浓度及体积分数应该不变。等压下,升高温度,平衡向逆向移动,A的转化率降低。
答案 A【实验目的】
浓度、温度对化学平衡移动的影响
【实验仪器】
试管、胶头滴管、烧杯、装有NO2气体的连通烧瓶
【实验药品】
0.005 mol·L-1 FeCl3溶液、饱和FeCl3溶液、0.01
mol·L-1 KSCN溶液、1 mol·L-1 KSCN溶液、0.01
mol·L-1 NaOH溶液。实验探究十二 外界因素对化学平衡移动的影响
(1)影响化学平衡因素的界定:化学平衡发生移动的本质原因是________,所以影响化学平衡的因素可以从分析影响该原因的因素入手。
(2)研究的思路与方法
①研究对象的选择,现有以下可逆反应:【案例】其中,A适合于研究________对平衡的影响,B适合于研究________对平衡的影响。(填字母:a.浓度、b.温度、c.压强)②研究方法:采用控制其他因素不变,改变其中一个因素的方法,并进行对比实验。
(3)单一因素对化学平衡移动影响的实验研究:
①浓度②温度解析 (1)化学平衡状态的本质是正、逆反应速率相等,是反应混合物中各组分的含量保持不变。如果改变了外界条件,使正、逆反应速率不再相等,平衡就发生了移动。(2)反应A中NO2为红棕色,N2O4为无色,非常容易借助颜色的变化来研究温度以及压强对平衡的影响;而B为溶液中进行的反应,适合研究浓度对平衡的影响。(3)①加入浓FeCl3溶液后,平衡正向移动,使Fe(SCN)3浓度增大,红色加深;加入浓KSCN溶液后,平衡同样向正反应方向移动,引起混合物颜色加深;加入NaOH固体后,与FeCl3反应,引起平衡逆向移动,颜色变浅。②由于该反应放热,放入热水中的瓶内由于平衡逆向移动,引起NO2浓度增大,颜色加深;反之,放入冷水中的瓶内颜色变浅。(4)由此可以得出勒夏特列原理。
答案 (1)v(正)≠v(逆)(或正反应速率与逆反应速率不相等) (2)b、c a
(3)①
②
(4)①在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,v(正)、v(逆)的量减小,但减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数增大的方向移动。
提示 浓度、温度、压强、催化剂。
达到平衡时,正 、逆反应速率相等,若改变外界条件,使反应速率改变,v正不等于v逆,平衡是否会移动?
提示 会,若外界条件改变,使v正≠v逆,则平衡会移动,直到建立新的平衡。1.2.了解化学平衡移动的概念和影响平衡移动的因素。
理解温度、浓度、压强的改变对化学平衡移动的影响。
应用化学平衡移动原理和化学反应速率相关知识选择合成氨的条件。1.2.3.化学平衡状态的移动
通过改变反应条件(温度、_____、气体反应的_____),而使平衡状态_________的现象,叫化学平衡状态的移动,简称_________。
影响化学平衡移动的因素
(1)浓度的影响
_____反应物浓度或_____生成物浓度,平衡向正反应方向移动;_____反应物浓度或_____生成物浓度,平衡向逆反应方向移动。
1.2.浓度压强发生变化平衡移动增大减小减小增大(3)压强的影响
其他条件不变时,增大压强,会使平衡向着_____________的方向移动;减小压强,会使平衡向着_____________的方向移动。
(4)催化剂
由于催化剂能够_________地改变正、逆反应速率,因此它对化学平衡的移动_____影响,但是使用催化剂,能改变反应到达平衡所需的_____。
勒夏特列原理
如果改变影响化学平衡的一个因素(如:_____、_____以及__________________________),平衡将向着_________________的方向移动。气体体积缩小气体体积增大同等程度没有时间3.温度压强参加反应的化学物质的浓度能够减弱这种改变【慎思1】提示 因为C(s)的浓度为一常数,故增加其用量,化学反应速率不变,平衡不发生移动;若增加H2O(g)的量,则H2O(g)的浓度增大,使v(正)>v(逆),平衡向正反应方向移动。 对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是 ( )。
A.加入一种反应物 B.增大体系的压强
C.升高温度 D.使用催化剂
解析 当一个平衡体系中有固体存在时,增大固体的量(注意区别于增大固体的接触面积)不会引起反应速率的变化,平衡不移动;对于一个反应前后气体物质的量不变的可逆反应,压强的变化不会引起平衡的移动;升高温度,化学平衡一定发生移动,因为任何化学反应都伴随着能量的变化(吸热或放热);使用催化剂可以同等程度地改变正、逆反应速率,所以化学平衡不移动。
答案 C【慎思2】 续表
续表
【例1】?下列说法正确的是 ( )。
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动答案 C
升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热反应方向移动。
【体验1】?解析:该反应是一个气体体积增大的吸热反应。加压,平衡向左移动,A的浓度增大,v正增加;减压、平衡向右移动,A的浓度减小,v正减小;减小C的浓度,平衡向右移动,A的浓度减小,v正减小;降温平衡向逆反应方向移动,A的浓度增大,v正减小。
答案:DA.加压 B.减压
C.减小C的浓度 D.降温
化学平衡图像题的解答原则
(1)“定一议二”原则
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的意义三个量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系和确定纵坐标所表示的量,讨论横坐标与曲线的关系。如图:这类图像的分析方法是“定一议二”,当有多条曲线及两个以上条件时,要固定其中一个条件,分析其他条件之间的关系,必要时,作一辅助线分析。
(2)“先拐先平,数值大”原则
在化学平衡图像中,先出现拐点的反应先达到平衡,先出现拐点的曲线表示的温度较高(如图A)或表示的压强较大(如图B)。图A表示T2>T1,正反应是放热反应。
图B表示p1<p2,A是反应物,正反应为气体总体积缩小的反应,即a+b>c。【例2】?下列有关说法正确的是 ( )。
A.x=2,反应开始2 min内,v(B)=0.1 mol·L-1·min-1
B.t1时改变的条件是降温,平衡逆向移动C.t2时改变的条件可能是增大c(C),平衡时B的物质的量
分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催
化剂,c(B)不变答案 D解答图像问题的方法技巧
(1)不管是速率图像还是平衡图像,都要搞清纵、横坐标的含义,都要与化学原理相联系,特别是与平衡移动原理相联系。
(2)三步分析法:一看反应速率是增大还是减小;二看v(正)、v(逆)的相对大小;三看化学平衡移动的方向。
(3)四要素分析法:看曲线的起点;看曲线的变化趋势;看曲线的转折点;看曲线的终点。【体验2】?解析 随着温度的升高,化学平衡应向吸热反应方向移动,即向逆反应方向移动,所以生成物C的体积分数减小,反应物的含量增大,反应物的转化率减小。
增大体系的压强,由于反应的两边都是气态物质,所以正反应和逆反应的速率都增大。而加入催化剂,只能加快反应速率,缩短达到平衡的时间,不能使平衡移动,所以达到平衡后,各组分的浓度及体积分数应该不变。等压下,升高温度,平衡向逆向移动,A的转化率降低。
答案 A【实验目的】
浓度、温度对化学平衡移动的影响
【实验仪器】
试管、胶头滴管、烧杯、装有NO2气体的连通烧瓶
【实验药品】
0.005 mol·L-1 FeCl3溶液、饱和FeCl3溶液、0.01
mol·L-1 KSCN溶液、1 mol·L-1 KSCN溶液、0.01
mol·L-1 NaOH溶液。实验探究十二 外界因素对化学平衡移动的影响
(1)影响化学平衡因素的界定:化学平衡发生移动的本质原因是________,所以影响化学平衡的因素可以从分析影响该原因的因素入手。
(2)研究的思路与方法
①研究对象的选择,现有以下可逆反应:【案例】其中,A适合于研究________对平衡的影响,B适合于研究________对平衡的影响。(填字母:a.浓度、b.温度、c.压强)②研究方法:采用控制其他因素不变,改变其中一个因素的方法,并进行对比实验。
(3)单一因素对化学平衡移动影响的实验研究:
①浓度②温度解析 (1)化学平衡状态的本质是正、逆反应速率相等,是反应混合物中各组分的含量保持不变。如果改变了外界条件,使正、逆反应速率不再相等,平衡就发生了移动。(2)反应A中NO2为红棕色,N2O4为无色,非常容易借助颜色的变化来研究温度以及压强对平衡的影响;而B为溶液中进行的反应,适合研究浓度对平衡的影响。(3)①加入浓FeCl3溶液后,平衡正向移动,使Fe(SCN)3浓度增大,红色加深;加入浓KSCN溶液后,平衡同样向正反应方向移动,引起混合物颜色加深;加入NaOH固体后,与FeCl3反应,引起平衡逆向移动,颜色变浅。②由于该反应放热,放入热水中的瓶内由于平衡逆向移动,引起NO2浓度增大,颜色加深;反之,放入冷水中的瓶内颜色变浅。(4)由此可以得出勒夏特列原理。
答案 (1)v(正)≠v(逆)(或正反应速率与逆反应速率不相等) (2)b、c a
(3)①
②
(4)①在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,v(正)、v(逆)的量减小,但减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数增大的方向移动。
