【同步课件集】2013-2014学年高中化学选修四:专题三 溶液中的离子反应 专题归纳探究课件(苏教版选修4)
文档属性
| 名称 | 【同步课件集】2013-2014学年高中化学选修四:专题三 溶液中的离子反应 专题归纳探究课件(苏教版选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 587.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-10-28 18:51:55 | ||
图片预览






文档简介
课件20张PPT。请分别用一句话表达下列关键词:
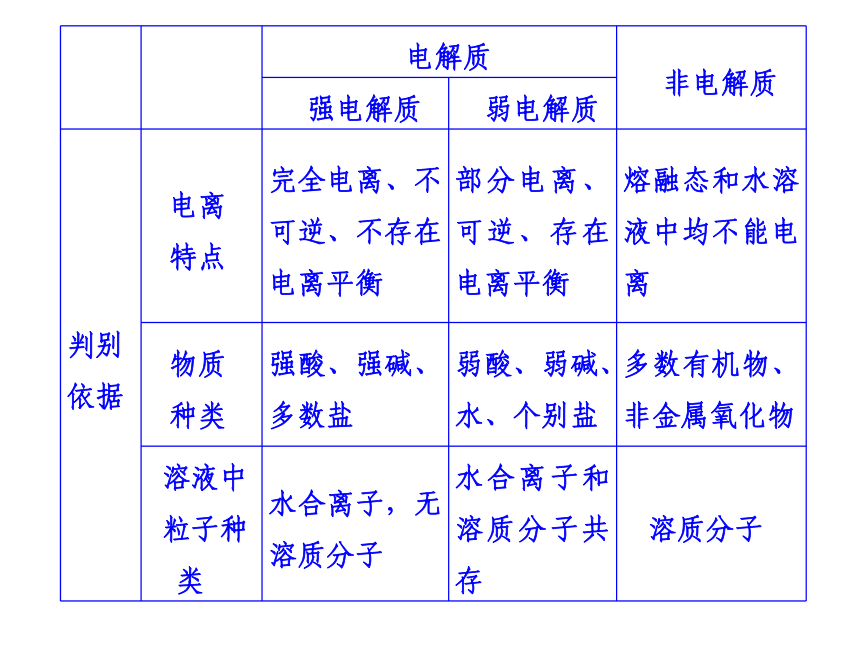
电解质与非电解质、强电解质与弱电解质 弱电解质的电离 平衡 盐类的水解 沉淀溶解平衡
提示 电解质与非电解质、强电解质与弱电解质专题归纳整合弱电解质的电离平衡:在一定条件下,弱电解质电离成离子的速率和离子结合成弱电解质分子的速率相等时,即达到电离平衡。
盐类的水解:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应。
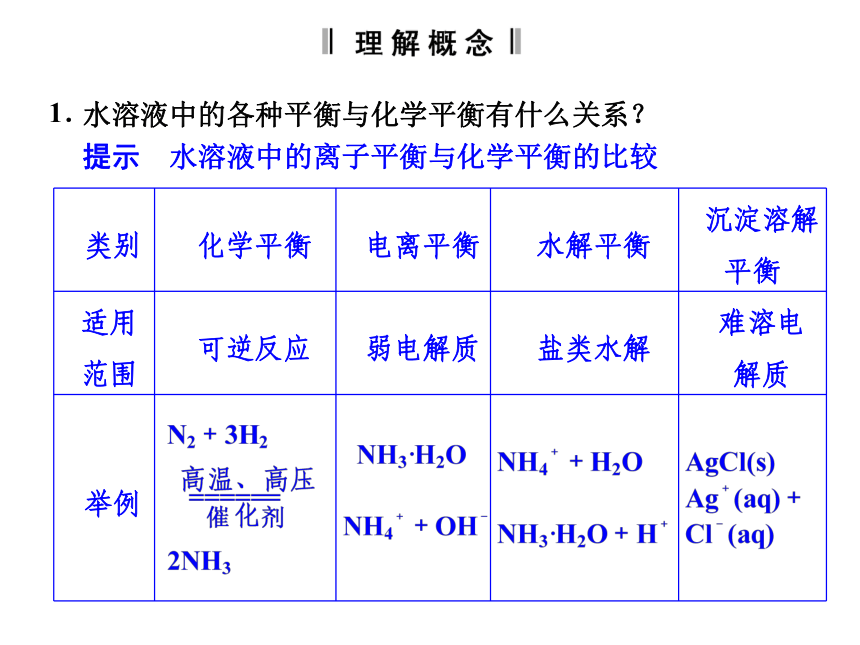
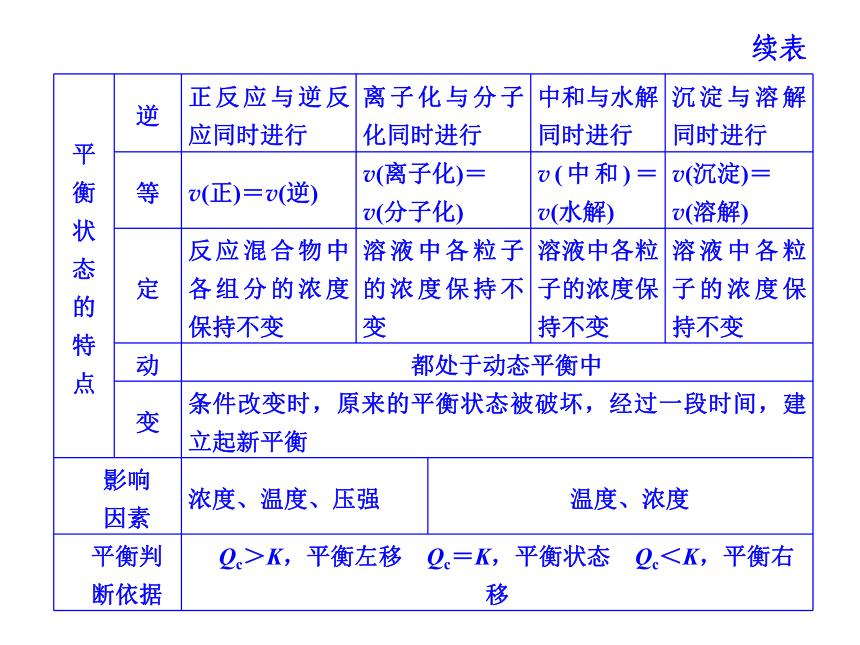
沉淀溶解平衡:像AgCl这种难溶的电解质在水溶液中,在一定温度下,当沉淀溶解和生成的速率相等时,得到AgCl的饱和溶液,即建立下列动态平衡:水溶液中的各种平衡与化学平衡有什么关系?
提示 水溶液中的离子平衡与化学平衡的比较1. 续表如何对等体积混合后溶液的pH进行定量计算和定性判断?
提示 (1)跟水混合(以下“前”均指“混合前”,“后”均指“混合后”)
①强酸:pH(后)≈pH(前)+0.3
②强碱:pH(后)≈pH(前)-0.3
③弱酸:pH(后)略小于pH(前 )+0.3(因混合后酸的电离程度增大)
④弱碱:pH(后)略大于pH(前)-0.3(因混合后碱的电离程度增大)
(2)酸碱相互混合
①强酸与强碱:先求出混合前酸中总的n(H+)及碱中总的n(OH-),然后比较它们的大小,判断过量后再计算。若
n(H+)=n(OH-),则pH(后)=7。
若n(H+)>n(OH-),酸过量:由c(H+)(过量)求pH(后)。2.若n(H+)<n(OH-),碱过量:由c(OH-)(过量)先求c(H+),再求pH(后)。
若已知酸中pH(A)和碱中pH(B),等体积混合又有
pH(A)+pH(B)=14,则恰好中和。
pH(A)+pH(B)>14,则碱过量。
pH(A)+pH(B)<14,则酸过量。
注意 若是强酸与强酸或强碱与强碱等体积混合,当它们的pH差值为2或大于2时,则酸中pH大者可折为水,碱中pH小者可折为水。如pH=3的盐酸与pH=5的稀硫酸等体积混合,pH(后)≈3+0.3,pH=10的Ba(OH)2与pH=13的KOH等体积混合,pH(后)≈13-0.3。②弱酸与强碱:
pH(A)+pH(B)≤14,则酸过量,一般显酸性(因一般电离大于水解)。
pH(A)+pH(B)>14,则表示酸中已电离c(H+)小于碱中已电离c(OH-),等体积混合后可能显酸性、中性、碱性。
③弱碱与强酸:
pH(A)+pH(B)≥14,则碱过量,一般显碱性(电离一般大于水解)。
pH(A)+pH(B)<14,则表示酸中已电离c(H+)大于碱中已电离c(OH-),等体积混合后可能显酸性、中性、碱性。如何用实验方法证明某物质是弱电解质?
提示 要证明某电解质是弱电解质,关键在于一个“弱”字,即证明它只是部分电离或其溶液中存在电离平衡。以一元弱酸HA为例,证明它是弱电解质的常用方法有:溶液中的平衡包括电离平衡、水解平衡、溶解平衡等内容,在此基础上延伸出强弱电解质、离子共存问题、水的电离、溶液中离子浓度大小的判断、溶液的pH、影响弱电解质电离的外界因素、影响盐类水解的外界因素。在近年的高考命题中对主要内容的考核:(1)平衡的基本原理;(2)强弱电解质的区别,以及与溶液导电能力的关系;(3)影响水的电离平衡的因素;(4)溶液中离子浓度大小的判断;(5)溶液中的几个守恒(电荷、物料、质子守恒);(6)混合溶液中(不反应的或能反应的)各种量的判断;(7)离子共存问题。几个值得注意的问题:学科思想培养三 水溶液中的各种平衡思想在解题中的应用无论电解质还是非电解质,都是指化合物;
有些物质虽然难溶于水,但还属于强电解质,其溶解部分完全电离;
有些物质溶于水后能导电,但却是非电解质,因为导电的原因是该物质与水反应生成的电解质能电离出自由移动的离子;
强电解质的导电能力不一定比弱电解质强,关键看水中自由移动离子的浓度;
电解质溶液浓度越大,导电能力不一定越强;
发生水解的盐溶液不一定呈酸性或碱性,可能呈中性;
影响水的电离平衡的一般规律是酸、碱抑制水电离,而能水解的盐一般促进水电离;
多元弱酸是分步电离的,在发生中和反应或较强酸制较弱酸时也是分步进行的,第一步电离远大于其第二步电离;
1.2.3.4.5.6.7.8.弱酸不一定不能制强酸;
水的离子积常数只与温度有关而与浓度无关,与平衡常数的含义相当;
溶液越稀,越有利于电离;
比较反应速率时,弱电解质关注已电离的离子,考虑反应的量时,弱电解质关注本身的物质的量(即已电离和未电离的)。9.10.11.12. 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:【例】?回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
①v(A)=3v(B) ②混合气体的密度保持不变 ③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变(2)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q________0(填“大于”或“小于”)。①若平衡时,甲、乙两容器中A的物质的量相等,则x=____________。
若平衡时,甲、乙两容器中A的物质的量不相等,则x=____________。
②平衡时甲中A的体积分数为________。
③若平衡时两容器的压强不相等,则两容器中压强之比为________。Ⅱ.(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______m2(选填“<”、“=”或“>”)。
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1________V2(填“<”“=”或“>”)。Ⅲ.已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2(氯化亚砜)极易和水发生如下反应:SOCl2+H2O===SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是____________________。
Ⅳ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)·cn(Bm-),称为难溶电解质的溶度积。
①在25 ℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是____________________;
②下列叙述不正确的是________(填字母)。
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25 ℃ 时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液
中的溶度积相同
C.25 ℃ 时,饱和AgCl、AgI、Ag2S溶液中所含Ag+浓度相
同(2)升高温度,平衡向吸热方向移动,平衡常数增大,平衡向正反应方向移动,故正反应为吸热反应,Q>0。③压强之比等于物质的量之比,计算出甲乙两组平衡时气体总物质的量。
Ⅱ.(1)弱酸在稀释过程中电离程度增大,所以pH变化较慢,b为醋酸。弱酸只能部分电离,当pH相等时,醋酸浓度较大,消耗Zn粒更多。
(2)醋酸稀释后,电离程度增大,要得到相同pH的醋酸,加水要多一些。
Ⅲ.制取无水ZnCl2,需要在HCl气氛中,并且及时把水除掉。
Ⅳ.①AgI黄色沉淀转化成更难溶的Ag2S黑色沉淀。②C项,饱和溶液AgCl、AgI、Ag2S的Ksp均不同,所以Ag+浓度也必然不同。答案 Ⅰ.(1)③④ (2)大于 (3)①2 4 ②0.6 ③8∶5
Ⅱ.(1)b < (2)<
Ⅲ.夺去ZnCl2·xH2O中的水,同时生成HCl,它可以抑制ZnCl2的水解
Ⅳ.①加KI溶液先出现黄色沉淀,加Na2S溶液最后出现黑色沉淀 ②C
电解质与非电解质、强电解质与弱电解质 弱电解质的电离 平衡 盐类的水解 沉淀溶解平衡
提示 电解质与非电解质、强电解质与弱电解质专题归纳整合弱电解质的电离平衡:在一定条件下,弱电解质电离成离子的速率和离子结合成弱电解质分子的速率相等时,即达到电离平衡。
盐类的水解:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应。
沉淀溶解平衡:像AgCl这种难溶的电解质在水溶液中,在一定温度下,当沉淀溶解和生成的速率相等时,得到AgCl的饱和溶液,即建立下列动态平衡:水溶液中的各种平衡与化学平衡有什么关系?
提示 水溶液中的离子平衡与化学平衡的比较1. 续表如何对等体积混合后溶液的pH进行定量计算和定性判断?
提示 (1)跟水混合(以下“前”均指“混合前”,“后”均指“混合后”)
①强酸:pH(后)≈pH(前)+0.3
②强碱:pH(后)≈pH(前)-0.3
③弱酸:pH(后)略小于pH(前 )+0.3(因混合后酸的电离程度增大)
④弱碱:pH(后)略大于pH(前)-0.3(因混合后碱的电离程度增大)
(2)酸碱相互混合
①强酸与强碱:先求出混合前酸中总的n(H+)及碱中总的n(OH-),然后比较它们的大小,判断过量后再计算。若
n(H+)=n(OH-),则pH(后)=7。
若n(H+)>n(OH-),酸过量:由c(H+)(过量)求pH(后)。2.若n(H+)<n(OH-),碱过量:由c(OH-)(过量)先求c(H+),再求pH(后)。
若已知酸中pH(A)和碱中pH(B),等体积混合又有
pH(A)+pH(B)=14,则恰好中和。
pH(A)+pH(B)>14,则碱过量。
pH(A)+pH(B)<14,则酸过量。
注意 若是强酸与强酸或强碱与强碱等体积混合,当它们的pH差值为2或大于2时,则酸中pH大者可折为水,碱中pH小者可折为水。如pH=3的盐酸与pH=5的稀硫酸等体积混合,pH(后)≈3+0.3,pH=10的Ba(OH)2与pH=13的KOH等体积混合,pH(后)≈13-0.3。②弱酸与强碱:
pH(A)+pH(B)≤14,则酸过量,一般显酸性(因一般电离大于水解)。
pH(A)+pH(B)>14,则表示酸中已电离c(H+)小于碱中已电离c(OH-),等体积混合后可能显酸性、中性、碱性。
③弱碱与强酸:
pH(A)+pH(B)≥14,则碱过量,一般显碱性(电离一般大于水解)。
pH(A)+pH(B)<14,则表示酸中已电离c(H+)大于碱中已电离c(OH-),等体积混合后可能显酸性、中性、碱性。如何用实验方法证明某物质是弱电解质?
提示 要证明某电解质是弱电解质,关键在于一个“弱”字,即证明它只是部分电离或其溶液中存在电离平衡。以一元弱酸HA为例,证明它是弱电解质的常用方法有:溶液中的平衡包括电离平衡、水解平衡、溶解平衡等内容,在此基础上延伸出强弱电解质、离子共存问题、水的电离、溶液中离子浓度大小的判断、溶液的pH、影响弱电解质电离的外界因素、影响盐类水解的外界因素。在近年的高考命题中对主要内容的考核:(1)平衡的基本原理;(2)强弱电解质的区别,以及与溶液导电能力的关系;(3)影响水的电离平衡的因素;(4)溶液中离子浓度大小的判断;(5)溶液中的几个守恒(电荷、物料、质子守恒);(6)混合溶液中(不反应的或能反应的)各种量的判断;(7)离子共存问题。几个值得注意的问题:学科思想培养三 水溶液中的各种平衡思想在解题中的应用无论电解质还是非电解质,都是指化合物;
有些物质虽然难溶于水,但还属于强电解质,其溶解部分完全电离;
有些物质溶于水后能导电,但却是非电解质,因为导电的原因是该物质与水反应生成的电解质能电离出自由移动的离子;
强电解质的导电能力不一定比弱电解质强,关键看水中自由移动离子的浓度;
电解质溶液浓度越大,导电能力不一定越强;
发生水解的盐溶液不一定呈酸性或碱性,可能呈中性;
影响水的电离平衡的一般规律是酸、碱抑制水电离,而能水解的盐一般促进水电离;
多元弱酸是分步电离的,在发生中和反应或较强酸制较弱酸时也是分步进行的,第一步电离远大于其第二步电离;
1.2.3.4.5.6.7.8.弱酸不一定不能制强酸;
水的离子积常数只与温度有关而与浓度无关,与平衡常数的含义相当;
溶液越稀,越有利于电离;
比较反应速率时,弱电解质关注已电离的离子,考虑反应的量时,弱电解质关注本身的物质的量(即已电离和未电离的)。9.10.11.12. 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:【例】?回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
①v(A)=3v(B) ②混合气体的密度保持不变 ③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变(2)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q________0(填“大于”或“小于”)。①若平衡时,甲、乙两容器中A的物质的量相等,则x=____________。
若平衡时,甲、乙两容器中A的物质的量不相等,则x=____________。
②平衡时甲中A的体积分数为________。
③若平衡时两容器的压强不相等,则两容器中压强之比为________。Ⅱ.(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______m2(选填“<”、“=”或“>”)。
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1________V2(填“<”“=”或“>”)。Ⅲ.已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2(氯化亚砜)极易和水发生如下反应:SOCl2+H2O===SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是____________________。
Ⅳ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)·cn(Bm-),称为难溶电解质的溶度积。
①在25 ℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是____________________;
②下列叙述不正确的是________(填字母)。
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25 ℃ 时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液
中的溶度积相同
C.25 ℃ 时,饱和AgCl、AgI、Ag2S溶液中所含Ag+浓度相
同(2)升高温度,平衡向吸热方向移动,平衡常数增大,平衡向正反应方向移动,故正反应为吸热反应,Q>0。③压强之比等于物质的量之比,计算出甲乙两组平衡时气体总物质的量。
Ⅱ.(1)弱酸在稀释过程中电离程度增大,所以pH变化较慢,b为醋酸。弱酸只能部分电离,当pH相等时,醋酸浓度较大,消耗Zn粒更多。
(2)醋酸稀释后,电离程度增大,要得到相同pH的醋酸,加水要多一些。
Ⅲ.制取无水ZnCl2,需要在HCl气氛中,并且及时把水除掉。
Ⅳ.①AgI黄色沉淀转化成更难溶的Ag2S黑色沉淀。②C项,饱和溶液AgCl、AgI、Ag2S的Ksp均不同,所以Ag+浓度也必然不同。答案 Ⅰ.(1)③④ (2)大于 (3)①2 4 ②0.6 ③8∶5
Ⅱ.(1)b < (2)<
Ⅲ.夺去ZnCl2·xH2O中的水,同时生成HCl,它可以抑制ZnCl2的水解
Ⅳ.①加KI溶液先出现黄色沉淀,加Na2S溶液最后出现黑色沉淀 ②C
