人教版九年级化学上册第三单元构成物质的奥秘 复习学案(含答案解析版)
文档属性
| 名称 | 人教版九年级化学上册第三单元构成物质的奥秘 复习学案(含答案解析版) |
|
|
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-02 10:13:43 | ||
图片预览





文档简介
中小学教育资源及组卷应用平台
第三单元 物质构成的奥秘 复习学案
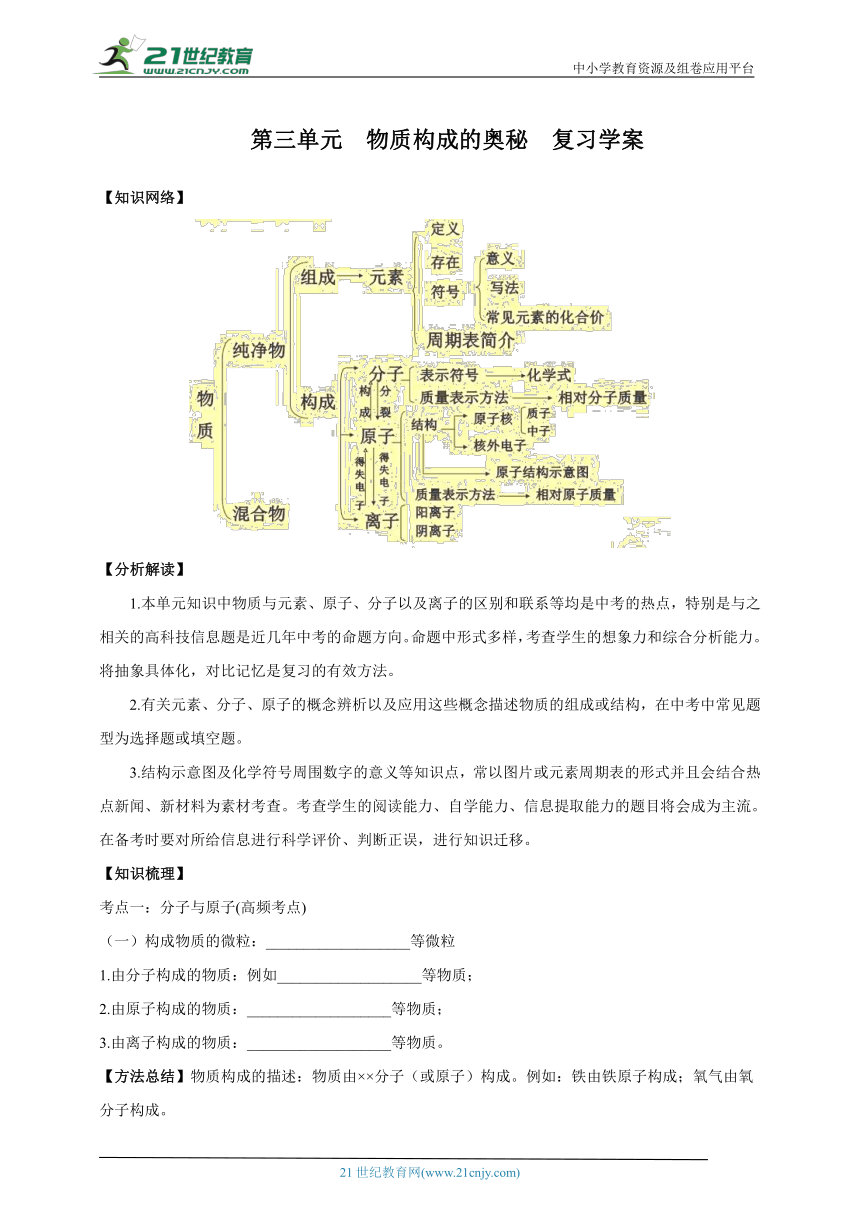
【知识网络】
【分析解读】
1.本单元知识中物质与元素、原子、分子以及离子的区别和联系等均是中考的热点,特别是与之相关的高科技信息题是近几年中考的命题方向。命题中形式多样,考查学生的想象力和综合分析能力。将抽象具体化,对比记忆是复习的有效方法。
2.有关元素、分子、原子的概念辨析以及应用这些概念描述物质的组成或结构,在中考中常见题型为选择题或填空题。
3.结构示意图及化学符号周围数字的意义等知识点,常以图片或元素周期表的形式并且会结合热点新闻、新材料为素材考查。考查学生的阅读能力、自学能力、信息提取能力的题目将会成为主流。在备考时要对所给信息进行科学评价、判断正误,进行知识迁移。
【知识梳理】
考点一:分子与原子(高频考点)
(一)构成物质的微粒:___________________等微粒
1.由分子构成的物质:例如___________________等物质;
2.由原子构成的物质:___________________等物质;
3.由离子构成的物质:___________________等物质。
【方法总结】物质构成的描述:物质由××分子(或原子)构成。例如:铁由铁原子构成;氧气由氧分子构成。
(二)分子与原子的区别和联系
分子 原子
相同点 都是构成物质的一种粒子;_________、_________都非常小,彼此之间有间隔,总是在不停地_________,同种分子(或原子)性质_________,不同种分子(或原子)性质_________。
不同点 在_________中,分子可以再分为_________ 在化学反应中,原子不可以再分为,是_________中最小的粒子。
相互关系 分子由原子构成的,在_________中,分子可以再分为原子,原子可以_________为新分子
应用 ①物理变化只是构成物质的__________________发生了变化;②化学变化是生成了__________________;③混合物是___________________________构成的;④纯净物是__________________构成的
【方法总结】①分子是保持物质化学性质的“最小粒子”,不是“唯一粒子”;
② “保持”的含义是指构成该物质的每一个分子与该物质的化学性质是一致的;
③分子只能保持物质的化学性质,而物质的物理性质需要大量的集合体一起来共同体现,单个分子无法体现物质的物理性质。
④ “最小”不是绝对意义上的最小,而是“保持物质化学性质的最小”。
(三)用微粒的性质解释常见现象
分子的性质 解释 举例(以水为例)
分子的_______和_________都很小 常用来解释质量或体积很小的物质中所含分子的数目巨大或一个分子的质量或体积非常小等 1个水分子的质量约是3×10-26 kg,1滴水中大约有1.67×1021个水分子
分子在永不停息地做无规则________ 无规则 指速度大小、运动方向等物理量不同且无规律 水分子都在_________,但分子运动的速率并不一样
运动 a.温度升高,分子运动的速率加快;b.温度降低,分子运动的速率减慢,但不可能停止运动 水蒸发成水蒸气,水分子运动速率_________;水冷凝成冰,水分子运动________
分子之间有_________ a.物质膨胀,分子间的间隔增大;b.物质压缩或冷凝,分子间的间隔减小,但不可能没有间隔 水蒸发成水蒸气,水分子间的间隔_________;水冷凝成冰,水分子间的间隔_________
分子的种类决定其化学性质 a.分子相同的物质是同种物质,且化学性质_________;b.分子不同的物质是不同物质,且性质_________ 水与冰的化学式都是H2O,属于_______物质,化学性质________;水与双氧水化学式分别为H2O和H2O2,不是同种物质,_________不同
【方法总结】通过化学变化生成的物质是与反应物性质不同的新物质,分子不同,化学性质不同;通过物理变化形成的物质是与反应物的大小、状态等不同的同种物质,分子相同、化学性质相同。
(四)分子运动现象的实验
实验装置图:
实验现象:过一段时间,B烧杯中溶液_________,A烧杯中溶液_________;
原因分析:A中浓氨水有_________,氨气分子运动到B中与水反应生成氨水,氨水显_________,能使酚酞溶液变红。
考点二:原子的构成(常见考点)
1.原子的构成
由于原子核内质子所带电荷和核外电子的电荷_________相等、且_________相反,因此,整个原子_________电性。
【方法总结】①原子核位于原子中心,绝大多数由质子和中子构成(有一种氢原子的原子核内只含1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子的质量很小,可以忽略不计。②每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原子的种类。 ③在原子中:核电荷数=质子数=核外电子数。④原子核内的质子数不一定等于中子数,如钠原子中,质子数为11,中子数为12。⑤并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
2. 相对原子质量
(1)定义:国际上以一种___________________________作为标准,其他原子的质量跟它相比所得的数值,就是这种原子的相对原子质量。
(2)计算公式:某原子的相对原子质量=该原子的实际质量/ (碳—12原子质量的1/12)
(3)相对原子质量=_________+_________
3.核外电子的排布
(1)核外电子排布的初步知识
①通常用_________表明运动着的电子离核远近的不同。
②元素原子核外电子最少的有1层,最多的有7层,最外层电子最多不超过_________个(只有第1层的不超过_________个)。
(2)原子结构示意图
①原子结构示意图的含义
说明:圆圈表示原子核,里面的数字表示_________;弧线表示_________,上面的数字表示每一个电子层上的_________
②原子结构与元素性质的关系
元素种类 最外层电子数 元素的性质 结论
金属元素 _________个 原子易_________电子 _________决定了元素的化学性质
非金属元素 _________个 原子易_________电子
稀有气体元素 _________个(氦2个) 不易得、失电子,稳定
考点三:离子(高频考点)
1.概念:离子是带电的_________或_________,带正电的离子叫_________,带负电的离子叫_________。
2. 表示方法:在元素符号右上角标明_________和_________,数字在_________,符号在_________。若数字为1时,可省略不写。
3.分类及形成:阳离子(由于原子_________电子而形成)带_________电
阴离子(由于原子_________电子而形成)带_________电
【方法总结】原子变为离子时,质子数、元素种类没有改变;电子数、最外层电子数发生了改变。
4.离子符号表示的意义:表示一个某种离子;表示带n个单位某种电荷的离子。
5.离子中质子数与电子数的关系:
阳离子:质子数_________电子数 阴离子:质子数_________电子数
【方法总结】①判断是否为稳定结构:最外层电子数为8(一个电子层时为2)个电子的是相对稳定结构;②判断化学性质是否相似:最外层电子数(只有一个电子层的除外)相同的粒子,化学性质相似。
考点四:元素及元素周期表(高频考点)
1.元素
定义 具有相同_________(_________)的一类原子的总称
分布 在地壳中排前四位的元素_____、_____、_____、_____,其中含量最多的金属元素为_____。
三个决定 决定元素种类:__________(__________)
决定元素化学性质:_______________
决定原子的质量:__________
分类 金属元素、非金属元素和稀有气体元素
【方法总结】物质、元素、微粒之间的关系
2.元素和原子的区别与联系
项目 元 素 原 子
定义 具有相同核电荷数的一类原子的总称 化学变化中的最小粒子
区别 ①宏观概念,只表示种类不表示个数②表示物质的________组成③可以组成单质或化合物④根据质子数和中子数分类 ①微观概念,既表示种类又表示个数②表示物质的________构成③可以构成分子,也可以直接构成物质。④根据质子数(核电荷数)分类
联系 ①元素是具有相同核电荷数(即质子数)的一类原子的总称②原子核内的________决定元素的种类,即同种元素的原子核电荷数(即质子数)一定相同③若原子的最外层电子数相同,则它们的化学性质________ (H、He除外)
【方法总结】①元素属于宏观概念,只讲种类,不讲个数。 ②同种元素的原子,核电核数一定相同;而核电核数相同的粒子不一定属于同种元素,如Na+和NH4+; ③同种元素的离子因所带的电荷数不同,性质也不同,如Fe2+、Fe3+。 ④同种原子和其所形成的离子一定是同种元素,如Na和Na+。
3.元素符号
(1)元素符号书写原则:国际上统一采用元素的________名称的第一个大写字母来表示元素,若第一个字母相同,就再加一个小写字母来区别。
(2)元素符号表示的意义:
宏观:表示一种________,如O表示氧元素。
微观:表示该元素的一个________,如O表示一个氧原子。
【方法总结】①由原子直接构成的物质(金属、某些固态非金属和稀有气体),它们的元素符号还可以表示该物质。如Fe表示:铁元素,一个铁原子,铁(这种单质)。②元素符号前面的数字不是1时,只表示原子的个数。如:2H只表示2个氢原子。
4.元素周期表
①定义:根据元素的原子结构和性质,将已知的100多种元素按原子序数科学有序地排列起来所得的表叫元素周期表。为了便于查找,元素周期表按元素原子核电荷数递增的顺序给元素编了号,叫原子序数。
原子序数=________数=________数=________数
周期数=________数
②分区:在周期表中对金属、非金属元素用不同的颜色做了分区,并标出了元素的相对原子质量。
③元素周期表的结构
A.每一格
B.每一横行(周期):周期表每一________行叫一个周期,共有_____个横行,有_____个周期。
C.每一纵行(族):周期表中共有18个_____行,每一纵行叫做一个族(8、9、10三个纵行共同组成一个族),共有_____个族。
知识梳理参考答案
考点一: 分子与原子(高频考点)
(一)
1.水、二氧化碳、氢气、氧气
2.金属、稀有气体、金刚石、石墨
3.氯化钠、氢氧化钠、高锰酸钾
(二)质量 体积 运动 相同 不同 化学反应 原子 化学变化
化学变化 重新组合 分子(或原子)间隔 新的分子(或原子)
不同分子(或不同原子或不同分子与原子) 同种分子(或原子)
(三)质量 体积 运动 运动 加快 减慢 间隔 增大 减少 相同 不相同 相同
(四)变红 不变色 挥发性 碱性
考点二:原子的构成(常见考点)
1. 电量 电性 不显
2. (1)碳原子(碳—12)质量的1/12
(3)质子数 中子数
3. (1)①电子层 ②8 2
(2)①核电荷数 电子层 电子数
②<4 失 ≥4 得 8 最外层电子数
考点三:离子(高频考点)
1.原子 原子团 阳离子 阴离子。
2.电性 电荷数 前 后
3.失去 正 得到 负
4.
5.> <
考点四:元素及元素周期表(高频考点)
1. 核电荷数 质子数 氧 硅 铝 铁 铝 质子数 核电荷数 最外层电子数 原子核
2.宏观 微观 质子数 相似
3.元素符号
(1)拉丁文
(2)元素 原子
4.元素周期表
①质子 核电荷 核外电子 电子层
③B横 7 7 C.纵 16
中考真题回顾
1.(甘南州)如果用“”表示氢原子,用“”表示氧原子,则下图中表示一个水分子的是( )
A. B. C. D.
【答案】A。
【解析】一个水分子由两个氢原子和一个氧原子构成,根据选项中图示可知A正确。
2.(湘潭)干冰升华为二氧化碳气体的过程中发生改变的是( )
A.原子种类 B.原子大小 C.分子间隔 D.分子种类
【答案】C。
【解析】干冰升华为二氧化碳气体的过程中,二氧化碳分子之间的间隔变大。
3.(益阳)保持水的化学性质的最小微粒是( )
A.水分子 B.氢原子
C.氧原子 D.氢原子和氧原子
【答案】A。
【解析】分子是保持物质化学性质的最小粒子,水是由水分子构成,所以保持水的化学性质的最小微粒是水分子。
4.(济南)玫瑰花开,满园飘香。在远处就能闻到玫瑰花香,从分子角度解释,主要原因是( )
A.分子之间有间隔 B.分子的质量很小
C.分子的体积很小 D.分子在不断地运动
【答案】D。
【解析】我们在远处就能闻到玫瑰花香,是因为花香中含有的分子是在不断的运动的,向四周扩散,使人们闻到花香。
5.(丹东)用微粒的观点解释下列事实,错误的是( )
A.“遥知不是雪,为有暗香来”﹣﹣﹣﹣分子是不断运动的
B.水通电分解,生成氢气和氧气﹣﹣﹣水是由氢分子和氧分子构成的
C.水蒸发为水蒸气时体积变大﹣﹣﹣分子之间有间隔
D.氧气支持燃烧,氮气不支持燃烧﹣﹣﹣不同种分子化学性质不同
【答案】B。
【解析】A、“遥知不是雪,唯有暗香来”,诗人在远处就能闻到淡淡的梅花香味,是因为梅花花香中含有的分子是在不断的运动的,向四周扩散,使诗人闻到梅花花香,故选项说法正确。
B、水通电分解,生成氢气和氧气,是因为水分子分裂成了氢原子和氧原子,然后氢原子、氧原子分别重新组合形成氢分子、氧分子,大量的氢分子、氧分子分别聚集成氢气、氧气,该事实说明分子是可以再分的,故选项解释错误。
C、水蒸发为水蒸气时体积变大,是因为温度升高,水分子间的间隔变大,故选项解释正确。
D、氧气支持燃烧,氮气不支持燃烧,是因为它们分子的构成不同,不同种的分子性质不同,故选项解释正确。
6.(杭州)南京理工大学胡炳成团队用新方法制得了NaN5 3H2O.该化合物中含有N5﹣等微粒。已知N为7号元素,则下列有关说法正确的是( )
A.N5﹣是一种单质
B.1个N5﹣带1个单位的正电荷
C.1个N5﹣中共含有35个质子
D.1个N5﹣中共含有35个电子
【答案】C。
【解析】氮原子的质子数和电子数均为7,N5的质子数和电子数均为7×5=35;N5﹣中是N5得到一个电子得到的微粒,所以每个N5﹣中含有35个质子和36个电子。
A、N5﹣是一种离子,带一个单位的负电荷,故错误;
B、1个N5﹣带1个单位的负电荷,故错误;
C、每个N5﹣中含有35个质子,故正确;
D、每个N5﹣中含有36个电子,故错误。
7.(重庆)碳12是指含6个中子的碳原子。下列对氧16和氧18两种氧原子的说法正确的是( )
A.质子数相同 B.质量相同
C.电子数不相同 D.16和18表示原子个数
【答案】A。
【解析】A、氧16和氧18两种氧原子的质子数相同,属于同种元素,故正确;
B、氧16和氧18两种氧原子的质子数相同,但中子数不同,质量不同,故错误;
C、氧16和氧18两种氧原子的质子数相同,因此电子数相同,故错误;
D、16和18表示原子中质子数和中子数之和,故错误。
8.(临沂)从微观的角度来回答下列问题:
(1)保持水的化学性质的微粒是 。
(2)水通电分解过程中,不变的微粒是 。
(3)用湿抹布擦过的桌面,一段时间后变干的原因是 。
9.(东平)如图是著名科学家卢瑟福发现原子科学结构的实验示意图。
(1)这个实验的名称是 。
(2)原子核所带的正电荷数简称为 。
(3)原子核的特点是 ,原子核外有一个相对较大的空间,其实验证据是 。
10.(威海)征服原子﹣﹣揭开原子的神秘面纱
伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是﹣﹣一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。
(1)1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
1811年,意大利化学家阿伏伽德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
1897年,汤姆森通过实验发现了 ,进一步发展了原子。分子论。汤姆森主要是纠正了“道尔顿原子论” 中的观点。
1911年,声瑟福又通过实验,推测原子是由 构成,并提出了沿用至今的现代原子结构理论。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆森和卢瑟福这样。对实验现象进行解释的过程叫做 。
原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了
来表达他们的理论成果。
【答案】(l)电子;原子不可再分;原子核和核外电子;(2)推理;模型。
【解析】(1)1897年,汤姆森通过实验发现了电子,纠正了“道尔顿原子论”原子不可再分的观点;根据原子的构成考虑;
(2)在科学研究中,像汤姆森和卢瑟福这样。对实验现象进行解释的过程叫做推理;为了帮助人们理解原子的结构,这三位科学家都运用了模型进行演示。
11.(台州)电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集 中分布的呢?1910 年英国科学家卢瑟福进行了著名的 α 粒子轰击金箔实验。实验做法如 图:
绝大多数 α 粒子穿过金箔后仍沿原来的方向前进,但是有少数 α 粒子却发生了较大的偏 转,并且有极少数 α 粒子的偏转超过 90°,有的甚至几乎达到 180°,像是被金箔弹了回 来。
【猜想与假设】α 粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明 显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否 则大角度的散射是不可能的。
【解释与结论】
(1)大多数 α 粒子不改变原来的运动方向,原因是 。
(2)若原子质量、正电荷在原子内均匀分布,则极少数 α 粒子就 (填“会”或“不 会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结 构上”中的“很小的结构”指的是 。
(3)科学家对原子结构的探究经历了三个过程,通过 α 粒子散射实验,你认为原子结构为 以下的 。
【答案】(1)原子内部绝大部分空间是空的;(2)不会;原子核;(3)C。
【解析】(1)绝大多数α粒子穿过后方向不变,这是由于它们穿过了原子内部的空间,这也说明原子内部绝大部分空间是空的;
(2)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生大角度散射。原子中“很小的结构”指的是原子核;
(3)由α粒子散射实验可推断,原子是由具有原子中心带正电的原子核和核外带负电的电子构成,与C模型最相符。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第三单元 物质构成的奥秘 复习学案
【知识网络】
【分析解读】
1.本单元知识中物质与元素、原子、分子以及离子的区别和联系等均是中考的热点,特别是与之相关的高科技信息题是近几年中考的命题方向。命题中形式多样,考查学生的想象力和综合分析能力。将抽象具体化,对比记忆是复习的有效方法。
2.有关元素、分子、原子的概念辨析以及应用这些概念描述物质的组成或结构,在中考中常见题型为选择题或填空题。
3.结构示意图及化学符号周围数字的意义等知识点,常以图片或元素周期表的形式并且会结合热点新闻、新材料为素材考查。考查学生的阅读能力、自学能力、信息提取能力的题目将会成为主流。在备考时要对所给信息进行科学评价、判断正误,进行知识迁移。
【知识梳理】
考点一:分子与原子(高频考点)
(一)构成物质的微粒:___________________等微粒
1.由分子构成的物质:例如___________________等物质;
2.由原子构成的物质:___________________等物质;
3.由离子构成的物质:___________________等物质。
【方法总结】物质构成的描述:物质由××分子(或原子)构成。例如:铁由铁原子构成;氧气由氧分子构成。
(二)分子与原子的区别和联系
分子 原子
相同点 都是构成物质的一种粒子;_________、_________都非常小,彼此之间有间隔,总是在不停地_________,同种分子(或原子)性质_________,不同种分子(或原子)性质_________。
不同点 在_________中,分子可以再分为_________ 在化学反应中,原子不可以再分为,是_________中最小的粒子。
相互关系 分子由原子构成的,在_________中,分子可以再分为原子,原子可以_________为新分子
应用 ①物理变化只是构成物质的__________________发生了变化;②化学变化是生成了__________________;③混合物是___________________________构成的;④纯净物是__________________构成的
【方法总结】①分子是保持物质化学性质的“最小粒子”,不是“唯一粒子”;
② “保持”的含义是指构成该物质的每一个分子与该物质的化学性质是一致的;
③分子只能保持物质的化学性质,而物质的物理性质需要大量的集合体一起来共同体现,单个分子无法体现物质的物理性质。
④ “最小”不是绝对意义上的最小,而是“保持物质化学性质的最小”。
(三)用微粒的性质解释常见现象
分子的性质 解释 举例(以水为例)
分子的_______和_________都很小 常用来解释质量或体积很小的物质中所含分子的数目巨大或一个分子的质量或体积非常小等 1个水分子的质量约是3×10-26 kg,1滴水中大约有1.67×1021个水分子
分子在永不停息地做无规则________ 无规则 指速度大小、运动方向等物理量不同且无规律 水分子都在_________,但分子运动的速率并不一样
运动 a.温度升高,分子运动的速率加快;b.温度降低,分子运动的速率减慢,但不可能停止运动 水蒸发成水蒸气,水分子运动速率_________;水冷凝成冰,水分子运动________
分子之间有_________ a.物质膨胀,分子间的间隔增大;b.物质压缩或冷凝,分子间的间隔减小,但不可能没有间隔 水蒸发成水蒸气,水分子间的间隔_________;水冷凝成冰,水分子间的间隔_________
分子的种类决定其化学性质 a.分子相同的物质是同种物质,且化学性质_________;b.分子不同的物质是不同物质,且性质_________ 水与冰的化学式都是H2O,属于_______物质,化学性质________;水与双氧水化学式分别为H2O和H2O2,不是同种物质,_________不同
【方法总结】通过化学变化生成的物质是与反应物性质不同的新物质,分子不同,化学性质不同;通过物理变化形成的物质是与反应物的大小、状态等不同的同种物质,分子相同、化学性质相同。
(四)分子运动现象的实验
实验装置图:
实验现象:过一段时间,B烧杯中溶液_________,A烧杯中溶液_________;
原因分析:A中浓氨水有_________,氨气分子运动到B中与水反应生成氨水,氨水显_________,能使酚酞溶液变红。
考点二:原子的构成(常见考点)
1.原子的构成
由于原子核内质子所带电荷和核外电子的电荷_________相等、且_________相反,因此,整个原子_________电性。
【方法总结】①原子核位于原子中心,绝大多数由质子和中子构成(有一种氢原子的原子核内只含1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子的质量很小,可以忽略不计。②每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原子的种类。 ③在原子中:核电荷数=质子数=核外电子数。④原子核内的质子数不一定等于中子数,如钠原子中,质子数为11,中子数为12。⑤并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
2. 相对原子质量
(1)定义:国际上以一种___________________________作为标准,其他原子的质量跟它相比所得的数值,就是这种原子的相对原子质量。
(2)计算公式:某原子的相对原子质量=该原子的实际质量/ (碳—12原子质量的1/12)
(3)相对原子质量=_________+_________
3.核外电子的排布
(1)核外电子排布的初步知识
①通常用_________表明运动着的电子离核远近的不同。
②元素原子核外电子最少的有1层,最多的有7层,最外层电子最多不超过_________个(只有第1层的不超过_________个)。
(2)原子结构示意图
①原子结构示意图的含义
说明:圆圈表示原子核,里面的数字表示_________;弧线表示_________,上面的数字表示每一个电子层上的_________
②原子结构与元素性质的关系
元素种类 最外层电子数 元素的性质 结论
金属元素 _________个 原子易_________电子 _________决定了元素的化学性质
非金属元素 _________个 原子易_________电子
稀有气体元素 _________个(氦2个) 不易得、失电子,稳定
考点三:离子(高频考点)
1.概念:离子是带电的_________或_________,带正电的离子叫_________,带负电的离子叫_________。
2. 表示方法:在元素符号右上角标明_________和_________,数字在_________,符号在_________。若数字为1时,可省略不写。
3.分类及形成:阳离子(由于原子_________电子而形成)带_________电
阴离子(由于原子_________电子而形成)带_________电
【方法总结】原子变为离子时,质子数、元素种类没有改变;电子数、最外层电子数发生了改变。
4.离子符号表示的意义:表示一个某种离子;表示带n个单位某种电荷的离子。
5.离子中质子数与电子数的关系:
阳离子:质子数_________电子数 阴离子:质子数_________电子数
【方法总结】①判断是否为稳定结构:最外层电子数为8(一个电子层时为2)个电子的是相对稳定结构;②判断化学性质是否相似:最外层电子数(只有一个电子层的除外)相同的粒子,化学性质相似。
考点四:元素及元素周期表(高频考点)
1.元素
定义 具有相同_________(_________)的一类原子的总称
分布 在地壳中排前四位的元素_____、_____、_____、_____,其中含量最多的金属元素为_____。
三个决定 决定元素种类:__________(__________)
决定元素化学性质:_______________
决定原子的质量:__________
分类 金属元素、非金属元素和稀有气体元素
【方法总结】物质、元素、微粒之间的关系
2.元素和原子的区别与联系
项目 元 素 原 子
定义 具有相同核电荷数的一类原子的总称 化学变化中的最小粒子
区别 ①宏观概念,只表示种类不表示个数②表示物质的________组成③可以组成单质或化合物④根据质子数和中子数分类 ①微观概念,既表示种类又表示个数②表示物质的________构成③可以构成分子,也可以直接构成物质。④根据质子数(核电荷数)分类
联系 ①元素是具有相同核电荷数(即质子数)的一类原子的总称②原子核内的________决定元素的种类,即同种元素的原子核电荷数(即质子数)一定相同③若原子的最外层电子数相同,则它们的化学性质________ (H、He除外)
【方法总结】①元素属于宏观概念,只讲种类,不讲个数。 ②同种元素的原子,核电核数一定相同;而核电核数相同的粒子不一定属于同种元素,如Na+和NH4+; ③同种元素的离子因所带的电荷数不同,性质也不同,如Fe2+、Fe3+。 ④同种原子和其所形成的离子一定是同种元素,如Na和Na+。
3.元素符号
(1)元素符号书写原则:国际上统一采用元素的________名称的第一个大写字母来表示元素,若第一个字母相同,就再加一个小写字母来区别。
(2)元素符号表示的意义:
宏观:表示一种________,如O表示氧元素。
微观:表示该元素的一个________,如O表示一个氧原子。
【方法总结】①由原子直接构成的物质(金属、某些固态非金属和稀有气体),它们的元素符号还可以表示该物质。如Fe表示:铁元素,一个铁原子,铁(这种单质)。②元素符号前面的数字不是1时,只表示原子的个数。如:2H只表示2个氢原子。
4.元素周期表
①定义:根据元素的原子结构和性质,将已知的100多种元素按原子序数科学有序地排列起来所得的表叫元素周期表。为了便于查找,元素周期表按元素原子核电荷数递增的顺序给元素编了号,叫原子序数。
原子序数=________数=________数=________数
周期数=________数
②分区:在周期表中对金属、非金属元素用不同的颜色做了分区,并标出了元素的相对原子质量。
③元素周期表的结构
A.每一格
B.每一横行(周期):周期表每一________行叫一个周期,共有_____个横行,有_____个周期。
C.每一纵行(族):周期表中共有18个_____行,每一纵行叫做一个族(8、9、10三个纵行共同组成一个族),共有_____个族。
知识梳理参考答案
考点一: 分子与原子(高频考点)
(一)
1.水、二氧化碳、氢气、氧气
2.金属、稀有气体、金刚石、石墨
3.氯化钠、氢氧化钠、高锰酸钾
(二)质量 体积 运动 相同 不同 化学反应 原子 化学变化
化学变化 重新组合 分子(或原子)间隔 新的分子(或原子)
不同分子(或不同原子或不同分子与原子) 同种分子(或原子)
(三)质量 体积 运动 运动 加快 减慢 间隔 增大 减少 相同 不相同 相同
(四)变红 不变色 挥发性 碱性
考点二:原子的构成(常见考点)
1. 电量 电性 不显
2. (1)碳原子(碳—12)质量的1/12
(3)质子数 中子数
3. (1)①电子层 ②8 2
(2)①核电荷数 电子层 电子数
②<4 失 ≥4 得 8 最外层电子数
考点三:离子(高频考点)
1.原子 原子团 阳离子 阴离子。
2.电性 电荷数 前 后
3.失去 正 得到 负
4.
5.> <
考点四:元素及元素周期表(高频考点)
1. 核电荷数 质子数 氧 硅 铝 铁 铝 质子数 核电荷数 最外层电子数 原子核
2.宏观 微观 质子数 相似
3.元素符号
(1)拉丁文
(2)元素 原子
4.元素周期表
①质子 核电荷 核外电子 电子层
③B横 7 7 C.纵 16
中考真题回顾
1.(甘南州)如果用“”表示氢原子,用“”表示氧原子,则下图中表示一个水分子的是( )
A. B. C. D.
【答案】A。
【解析】一个水分子由两个氢原子和一个氧原子构成,根据选项中图示可知A正确。
2.(湘潭)干冰升华为二氧化碳气体的过程中发生改变的是( )
A.原子种类 B.原子大小 C.分子间隔 D.分子种类
【答案】C。
【解析】干冰升华为二氧化碳气体的过程中,二氧化碳分子之间的间隔变大。
3.(益阳)保持水的化学性质的最小微粒是( )
A.水分子 B.氢原子
C.氧原子 D.氢原子和氧原子
【答案】A。
【解析】分子是保持物质化学性质的最小粒子,水是由水分子构成,所以保持水的化学性质的最小微粒是水分子。
4.(济南)玫瑰花开,满园飘香。在远处就能闻到玫瑰花香,从分子角度解释,主要原因是( )
A.分子之间有间隔 B.分子的质量很小
C.分子的体积很小 D.分子在不断地运动
【答案】D。
【解析】我们在远处就能闻到玫瑰花香,是因为花香中含有的分子是在不断的运动的,向四周扩散,使人们闻到花香。
5.(丹东)用微粒的观点解释下列事实,错误的是( )
A.“遥知不是雪,为有暗香来”﹣﹣﹣﹣分子是不断运动的
B.水通电分解,生成氢气和氧气﹣﹣﹣水是由氢分子和氧分子构成的
C.水蒸发为水蒸气时体积变大﹣﹣﹣分子之间有间隔
D.氧气支持燃烧,氮气不支持燃烧﹣﹣﹣不同种分子化学性质不同
【答案】B。
【解析】A、“遥知不是雪,唯有暗香来”,诗人在远处就能闻到淡淡的梅花香味,是因为梅花花香中含有的分子是在不断的运动的,向四周扩散,使诗人闻到梅花花香,故选项说法正确。
B、水通电分解,生成氢气和氧气,是因为水分子分裂成了氢原子和氧原子,然后氢原子、氧原子分别重新组合形成氢分子、氧分子,大量的氢分子、氧分子分别聚集成氢气、氧气,该事实说明分子是可以再分的,故选项解释错误。
C、水蒸发为水蒸气时体积变大,是因为温度升高,水分子间的间隔变大,故选项解释正确。
D、氧气支持燃烧,氮气不支持燃烧,是因为它们分子的构成不同,不同种的分子性质不同,故选项解释正确。
6.(杭州)南京理工大学胡炳成团队用新方法制得了NaN5 3H2O.该化合物中含有N5﹣等微粒。已知N为7号元素,则下列有关说法正确的是( )
A.N5﹣是一种单质
B.1个N5﹣带1个单位的正电荷
C.1个N5﹣中共含有35个质子
D.1个N5﹣中共含有35个电子
【答案】C。
【解析】氮原子的质子数和电子数均为7,N5的质子数和电子数均为7×5=35;N5﹣中是N5得到一个电子得到的微粒,所以每个N5﹣中含有35个质子和36个电子。
A、N5﹣是一种离子,带一个单位的负电荷,故错误;
B、1个N5﹣带1个单位的负电荷,故错误;
C、每个N5﹣中含有35个质子,故正确;
D、每个N5﹣中含有36个电子,故错误。
7.(重庆)碳12是指含6个中子的碳原子。下列对氧16和氧18两种氧原子的说法正确的是( )
A.质子数相同 B.质量相同
C.电子数不相同 D.16和18表示原子个数
【答案】A。
【解析】A、氧16和氧18两种氧原子的质子数相同,属于同种元素,故正确;
B、氧16和氧18两种氧原子的质子数相同,但中子数不同,质量不同,故错误;
C、氧16和氧18两种氧原子的质子数相同,因此电子数相同,故错误;
D、16和18表示原子中质子数和中子数之和,故错误。
8.(临沂)从微观的角度来回答下列问题:
(1)保持水的化学性质的微粒是 。
(2)水通电分解过程中,不变的微粒是 。
(3)用湿抹布擦过的桌面,一段时间后变干的原因是 。
9.(东平)如图是著名科学家卢瑟福发现原子科学结构的实验示意图。
(1)这个实验的名称是 。
(2)原子核所带的正电荷数简称为 。
(3)原子核的特点是 ,原子核外有一个相对较大的空间,其实验证据是 。
10.(威海)征服原子﹣﹣揭开原子的神秘面纱
伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是﹣﹣一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。
(1)1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
1811年,意大利化学家阿伏伽德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
1897年,汤姆森通过实验发现了 ,进一步发展了原子。分子论。汤姆森主要是纠正了“道尔顿原子论” 中的观点。
1911年,声瑟福又通过实验,推测原子是由 构成,并提出了沿用至今的现代原子结构理论。
(2)道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆森和卢瑟福这样。对实验现象进行解释的过程叫做 。
原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了
来表达他们的理论成果。
【答案】(l)电子;原子不可再分;原子核和核外电子;(2)推理;模型。
【解析】(1)1897年,汤姆森通过实验发现了电子,纠正了“道尔顿原子论”原子不可再分的观点;根据原子的构成考虑;
(2)在科学研究中,像汤姆森和卢瑟福这样。对实验现象进行解释的过程叫做推理;为了帮助人们理解原子的结构,这三位科学家都运用了模型进行演示。
11.(台州)电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集 中分布的呢?1910 年英国科学家卢瑟福进行了著名的 α 粒子轰击金箔实验。实验做法如 图:
绝大多数 α 粒子穿过金箔后仍沿原来的方向前进,但是有少数 α 粒子却发生了较大的偏 转,并且有极少数 α 粒子的偏转超过 90°,有的甚至几乎达到 180°,像是被金箔弹了回 来。
【猜想与假设】α 粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明 显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否 则大角度的散射是不可能的。
【解释与结论】
(1)大多数 α 粒子不改变原来的运动方向,原因是 。
(2)若原子质量、正电荷在原子内均匀分布,则极少数 α 粒子就 (填“会”或“不 会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结 构上”中的“很小的结构”指的是 。
(3)科学家对原子结构的探究经历了三个过程,通过 α 粒子散射实验,你认为原子结构为 以下的 。
【答案】(1)原子内部绝大部分空间是空的;(2)不会;原子核;(3)C。
【解析】(1)绝大多数α粒子穿过后方向不变,这是由于它们穿过了原子内部的空间,这也说明原子内部绝大部分空间是空的;
(2)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生大角度散射。原子中“很小的结构”指的是原子核;
(3)由α粒子散射实验可推断,原子是由具有原子中心带正电的原子核和核外带负电的电子构成,与C模型最相符。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
