第二章 第三节 物质的量 第一课时 物质的量的单位——摩尔(共58张ppt)
文档属性
| 名称 | 第二章 第三节 物质的量 第一课时 物质的量的单位——摩尔(共58张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 16:09:59 | ||
图片预览











文档简介
(共58张PPT)
第三节 物质的量
第一课时 物质的量的单位
第二章 海水中的重要元素——钠和氯
——摩尔
【课程标准要求】
1.了解物质的量及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量之间的相互关系进行简单计算。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、物质的量的单位——摩尔
1.物质的量
(1)物质的量是表示含有______________的集合体的物理量,用符号____表示。
(2)物质的量的单位为______,简称摩,符号为mol。
一定数目粒子
n
摩尔
2.阿伏加德罗常数
(1)阿伏加德罗常数:____________任何粒子的粒子数叫做阿伏加德罗常数,符号为______,通常用____________________表示。
(2)物质的量、阿伏加德罗常数与粒子数(N)之间的关系:n=_____。
1 mol
NA
6.02×1023 mol-1
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)物质的量可以理解为物质的微观粒子数目( )
(2)摩尔是国际单位制中七个基本物理量之一( )
(3)阿伏加德罗常数就是6.02×1023( )
答案 (1)× (2)× (3)×
二、摩尔质量
1.1 mol物质的质量
(1)1 mol不同物质中所含的粒子数是相同的,即约含有____________________个粒子,由于不同粒子的质量可能不同,1 mol不同物质的质量也可能不同。
(2)1 mol任何粒子(或物质)的质量以克为单位时,其数值都与该粒子的相对原子质量或______________相等。
6.02×1023
相对分子质量
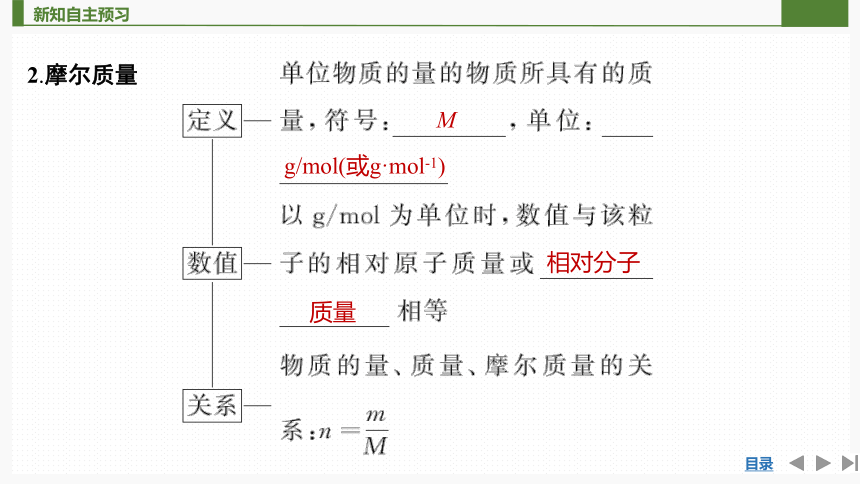
2.摩尔质量
M
g/mol(或g·mol-1)
相对分子
质量
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)氢氧化钠的摩尔质量为40 g( )
(2)1摩尔氧原子的质量就是氧的相对原子质量( )
(3)H2SO4的摩尔质量为96 g/mol( )
(4)1 mol CO2的质量以克为单位时,在数值上等于CO2的相对分子质量( )
答案 (1)× (2)× (3)× (4)√
二、物质的量、物质的质量、微粒数目之间的计算关系
一、物质的量和摩尔质量
一、物质的量和摩尔质量
对四个概念的深化理解
物质的量 物理量,“物质的量”四个字是一个整体,不能添字、漏字或换字,如不能说成“物质量”、“物质的质量”、“物质的数量”等
摩尔 用摩尔作物质的量的单位,可用来描述所有任何微观粒子,如原子、分子、离子、电子、质子、中子等,也可以是这些微粒的特定组合,如1 mol NaOH
阿伏加德 罗常数 NA的基准是1 mol粒子集合体所含的粒子数约为6.02×1023,表示微观粒子数目时,可以用NA来表示,也可以用6.02×1023 mol-1表示,如1 mol O2中含有氧分子数为NA个或6.02×1023个
摩尔质量 (1)适用于任何微观粒子
(2)混合物的摩尔质量一般称为平均摩尔质量
(3)以g/mol为单位时数值上等于物质的相对原子(分子)质量(单位为1),等于1 mol物质的质量(单位:g)
(1)使用摩尔做单位时,必须指明微粒的种类。如1 mol H2中含有2 mol H,含1 mol H的H2的物质的量为0.5 mol。其标准的写法是“数字+mol+化学式”,例如2 mol HCl即表示2 mol的氯化氢分子。
(2)物质的量只能用来表示微观粒子集体的多少,不能用来表示宏观物体的多少。
(3)计算“粒子数”要明确计算分子数还是原子数或电子数等,如1 mol CH4中含有4 mol H,而不是1 mol H。
1.下列叙述中不正确的是( )
A.2 mol铁原子 B.1 mol Fe3+
C.0.5 mol氧 D.0.5 mol氮气
解析 0.5 mol氧,是指0.5 mol氧气还是0.5 mol氧原子不清楚,指代不明确,故C错误。
C
2.下列叙述错误的是( )
A.1 mol任何物质都含有6.02×1023个分子
B.1 mol Ne中含有6.02×1024个电子
C.1 mol H2O中含有2 mol H和1 mol O
D.1 mol H2O中含有3 mol原子
A
解析 物质并不都是由分子构成的,有些物质是由离子或原子构成的,比如NaCl是由离子构成,金刚石由原子构成的,A错误;1个氖原子核外有10个电子,则1 mol Ne含有6.02×1024个电子,B正确;1 mol H2O中含有2 mol H和1 mol O,C正确;1 mol H2O中含有2 mol H和1 mol O,共含有3 mol原子,D正确。
3.下列说法中正确的是( )
D
二、物质的量、物质的质量、微粒数目之间的计算关系
物质与构成粒子的物质的量的关系
4.0.5 mol O2中含有( )
A.1个氧原子 B.1 mol氧分子
C.NA个氧原子 D.0.5个氧分子
解析 0.5 mol O2中含有0.5 mol氧分子,氧分子数为3.01×1023(0.5NA),含有的氧原子数为6.02×1023(NA)。
C
5.下列说法正确的是( )
A.32 g O2所含的原子数目为NA
B.0.5 mol H2SO4含有的原子数目为3.5NA
C.HNO3的摩尔质量是63 g
D.0.5NA个氯气(Cl2)分子的物质的量是1 mol
B
6.(1)5.3 g Na2CO3的物质的量为________,含有Na+数为________。
(2)含有3.01×1023个氢原子的CH4的物质的量为________,质量为________。
答案 (1)0.05 mol 6.02×1022 (2)0.125 mol 2 g
7.32 g A分子中分子个数为3.01×1023个,则A的相对分子质量为________,摩尔质量为________。
答案 64 64 g/mol
1.下列说法中正确的是( )
A.摩尔是表示物质质量的单位
B.物质的量就是指物质的质量
C.摩尔是表示物质所含微粒个数的物理量
D.物质的量适用于计量分子、原子、离子等粒子的集合体
解析 摩尔是物质的量的单位,故A、C两项错误;物质的量表示含有一定数目粒子的集合体,故B错误,D正确。
D
2.下列说法中正确的是( )
A.二氧化碳的摩尔质量为44 g
B.1摩尔氧原子的质量就是氧的相对原子质量
C.H2SO4的摩尔质量为96 g/mol
D.1 mol CO2的分子数为NA
解析 二氧化碳的摩尔质量为44 g/mol,A错误;1摩尔氧原子的质量在数值上就等于氧的相对原子质量,但单位不同,B错误;H2SO4的摩尔质量为98 g/mol,C错误;国际上规定,1 mol任何微粒的个数均为NA个,则1 mol CO2的分子数为NA,D正确。
D
3.下列叙述正确的是( )
A.1 mol任何物质的质量都等于该物质的相对分子质量
B.H的摩尔质量是1 g/mol
C.1 mol H2O的质量是18 g/mol
D.SO2的摩尔质量为64 g
解析 A项质量和相对分子质量单位不一样,错误;C项1 mol H2O的质量是18 g,错误;D项SO2的摩尔质量是64 g·mol-1,错误。
B
4.15 g A和10.5 g,恰好B完全反应,生成7.2 g C、1.8 g D和0.3 mol E,则E的摩尔质量为( )
A.100 g·mol-1 B.27.5 g·mol-1 C.55 g·mol-1 D.16.5 g·mol-1
C
5.按要求填写下列空白:
答案 (1)1 23 (2)2.709×1024 72
(3)0.5 48 6.02×1023 2.107×1024
1.下列对于物质的量理解正确的是( )
A.物质的量是国际单位制的一个基本单位
B.摩尔质量就是相对原子质量或相对分子质量
C.1 mol氧气含1.204×1024个氧原子
D.1 mol氢含6.02×1023个H2
C
解析 摩尔是物质的量的单位,物质的量(而不是摩尔)是国际科学界建议采用的一种物理量,故A错误;摩尔质量以g/mol为单位时在数值上等于相对原子质量或相对分子质量,但两者的含义和单位不相同,故B错误。由于O2是双原子分子,1 mol氧气含2NA个氧原子,所以含氧原子数为1.204×1024,故C正确;使用摩尔时应指明基本微粒的名称,正确的说法是:1 mol氢气(而不是氢)含6.02×1023个H2,故D错误。
2.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.摩尔是七个基本物理量之一
B.阿伏加德罗常数就是6.02×1023 mol-1
C.1 mol氢的质量是2 g
D.1 mol CH4的质量与NA个CH4分子的质量之和相等
解析 摩尔是物质的量的单位,A项错误;6.02×1023 mol-1是阿伏加德罗常数的近似值,B项错误;“氢”指代不明,C项错误。
D
3.下列物质中,摩尔质量最大的是( )
A.10 mL H2O B.0.8 mol H2SO4
C.54 g Al D.1 g CaCO3
解析 A、B、C、D中四种物质的摩尔质量分别为18 g·mol-1、98 g·mol-1、27 g·mol-1、100 g·mol-1,摩尔质量最大的是D项。
D
4.若1 g N2中含有x个原子,则阿伏加德罗常数是( )
C
5.所含有原子总数与1 mol NH3所含原子总数相同的是( )
A.1 mol O2 B.2 mol Cl2
C.1 mol H2O D.2 mol CO2
解析 1 mol NH3所含原子总数为4NA。1 mol O2所含原子总数为2NA,A错误;2 mol Cl2所含原子总数为4NA,B正确;1 mol H2O所含原子总数为3NA,C错误; 2 mol CO2所含原子总数为6NA,D错误。
B
6.下列说法错误的是( )
A.1 mol N2和CO的混合气体中所含原子数为2NA
B.16 g O2和O3的混合气体中所含原子数为NA
C.等物质的量的Na2O2和Na2O所含有阴离子数目相同
D.17 g OH-含有电子数为9NA
D
7.下列说法正确的是( )
A.1 mol SO3的质量是80 g/mol B.Mg2+的摩尔质量是24 g
C.CO的摩尔质量是28 g/mol D.氮的摩尔质量是28 g/mol
解析 质量的单位是g,1 mol SO3的质量是80 g,A项错误;摩尔质量的单位是g/mol,Mg2+的摩尔质量是24 g/mol,B项错误;摩尔质量在数值上等于相对分子质量,故CO的摩尔质量是28 g/mol,C项正确;氮可以指氮原子,还可以是氮气分子,选项中没有指明微粒的种类,无法求算摩尔质量,D项错误。
C
8.已知硫酸中含有3.01×1023个氧原子,硫酸的物质的量是( )
A.0.500 mol B.1.00 mol
C.0.250 mol D.0.125 mol
D
9.一个一氧化氮(NO)分子质量为a g,一个二氧化氮(NO2)分子质量为b g,NA表示阿伏加德罗常数,则氧原子的摩尔质量为( )
A.(a-b)NA g·mol-1 B.(b-a)NA g·mol-1
C.(a-b)NA g D.(b-a)NA
解析 一个氧原子的质量为b g-a g=(b-a) g,1 mol氧原子的质量为(b-a)NA g,则氧原子的摩尔质量为(b-a)NA g·mol-1。
B
10.双氢青蒿素的分子式为C15H24O5,相对分子质量为284。下列关于双氢青蒿素的说法正确的是( )
A.NA个双氢青蒿素的质量为284 g·mol-1
B.原子个数均为NA的C、H、O三种原子的质量比为6∶1∶8
C.14.2 g双氢青蒿素中含有的原子总数为2.2NA
D.含有NA个碳原子的双氢青蒿素的物质的量为1 mol
C
解析 质量的单位是g,不是g·mol-1,A错误;当摩尔质量的单位是g·mol-1时,原子个数均为NA的C、H、O三种原子的物质的量为1 mol,分别乘以各自的摩尔质量12 g·mol-1、1 g·mol-1、16 g·mol-1,得到质量比为12∶1∶16,B错误;14.2 g双氢青蒿素的物质的量是14.2 g÷284 g·mol-1=0.05 mol,由于一个分子中含有的原子个数是44,所以0.05 mol双氢青蒿素中含有的原子总数为2.2NA,C正确;一个双氢青蒿素分子中含有15个碳原子,含有NA个碳原子的双氢青蒿素的物质的量为1 mol÷15≈0.067 mol,D错误。
11.有五种物质:①6 g 氢气;②0.5 mol 二氧化碳;③1.204×1024个氯化氢分子;④147 g硫酸;⑤92 g乙醇(C2H5OH)。回答下列问题(填序号):
(1)物质的量最大的是________。
(2)所含分子数最多的是________。
(3)含有原子个数最多的是________。
(4)质量最大的是________。
答案 (1)① (2)① (3)⑤ (4)④
解析 首先“见量化摩”,以物质的量为核心再进行转换。①n(H2)=3 mol;②n(CO2)=0.5 mol;③n(HCl)=2 mol;④n(H2SO4)=1.5 mol;⑤n(C2H5OH)=2 mol。物质的量最大的是①,所含分子数最多的是①。①~⑤物质中所含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,所含原子个数最多的是⑤。①~⑤物质的质量分别为6 g、22 g、73 g、147 g、92 g,质量最大的是④。
12.(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)含0.4 mol Al3+的Al2(SO4)3中所含的硫酸根离子的物质的量是________ mol。
(3)相同质量的CO2、CO的物质的量之比为________;氧原子的个数之比为________。
(4)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________。
答案 (1) 0.4NA或2.408×1023 (2)0.6
(3)7∶11 14∶11 (4)95 g/mol
13.草酸(分子式为H2C2O4,沸点为150 ℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体内。下列有关判断不正确的是( )
A.草酸的摩尔质量是90 g/mol
B.草酸中碳元素的质量分数为13.3%
C.1 mol草酸中约含有6.02×1023个草酸分子
D.1 mol草酸的质量为90 g
B
14.用NA表示阿伏加德罗常数的值。下列说法中正确的是( )
A.2.4 g金属镁变成镁离子时失去的电子数为0.4NA
B.2 g氢气中含有的原子数为NA
C.3.01×1023个氮分子中含有的原子数为2NA
D.17 g氨气中含有的电子数为10NA
D
解析 2.4 g Mg的物质的量为0.1 mol,而1 mol Mg变成Mg2+时失去2 mol电子,所以2.4 g Mg应失去0.2NA个电子,A项错误;H2为双原子分子,2 g氢气即1 mol H2,应含有2 mol H,原子个数为2NA,B项错误;N2为双原子分子,3.01×1023个氮气分子中所含原子数应为2×3.01×1023,即NA,C项错误;D中17 g NH3的物质的量为1 mol,含有的电子数为10NA,D项正确。
15.已知12.4 g Na2R中含有Na+ 0.4 mol。
(1)Na2R的摩尔质量为________。
(2)R的相对原子质量为________。
(3)若Na2R中含R的质量为1.6 g,则Na2R的物质的量为________。
答案 (1)62 g·mol-1 (2)16
(3)0.1 mol
解析 (1)Na2R的物质的量为0.2 mol,其摩尔质量为12.4 g÷0.2 mol=62 g·mol-1。
(2)R的摩尔质量为62 g·mol-1-2×23 g·mol-1=16 g·mol-1。
(3)1.6 g R的物质的量n(R)=1.6 g÷16 g·mol-1=0.1 mol,n(Na2R)=n(R)=0.1 mol。
Thanks!
本讲内容结束
第三节 物质的量
第一课时 物质的量的单位
第二章 海水中的重要元素——钠和氯
——摩尔
【课程标准要求】
1.了解物质的量及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量之间的相互关系进行简单计算。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、物质的量的单位——摩尔
1.物质的量
(1)物质的量是表示含有______________的集合体的物理量,用符号____表示。
(2)物质的量的单位为______,简称摩,符号为mol。
一定数目粒子
n
摩尔
2.阿伏加德罗常数
(1)阿伏加德罗常数:____________任何粒子的粒子数叫做阿伏加德罗常数,符号为______,通常用____________________表示。
(2)物质的量、阿伏加德罗常数与粒子数(N)之间的关系:n=_____。
1 mol
NA
6.02×1023 mol-1
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)物质的量可以理解为物质的微观粒子数目( )
(2)摩尔是国际单位制中七个基本物理量之一( )
(3)阿伏加德罗常数就是6.02×1023( )
答案 (1)× (2)× (3)×
二、摩尔质量
1.1 mol物质的质量
(1)1 mol不同物质中所含的粒子数是相同的,即约含有____________________个粒子,由于不同粒子的质量可能不同,1 mol不同物质的质量也可能不同。
(2)1 mol任何粒子(或物质)的质量以克为单位时,其数值都与该粒子的相对原子质量或______________相等。
6.02×1023
相对分子质量
2.摩尔质量
M
g/mol(或g·mol-1)
相对分子
质量
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)氢氧化钠的摩尔质量为40 g( )
(2)1摩尔氧原子的质量就是氧的相对原子质量( )
(3)H2SO4的摩尔质量为96 g/mol( )
(4)1 mol CO2的质量以克为单位时,在数值上等于CO2的相对分子质量( )
答案 (1)× (2)× (3)× (4)√
二、物质的量、物质的质量、微粒数目之间的计算关系
一、物质的量和摩尔质量
一、物质的量和摩尔质量
对四个概念的深化理解
物质的量 物理量,“物质的量”四个字是一个整体,不能添字、漏字或换字,如不能说成“物质量”、“物质的质量”、“物质的数量”等
摩尔 用摩尔作物质的量的单位,可用来描述所有任何微观粒子,如原子、分子、离子、电子、质子、中子等,也可以是这些微粒的特定组合,如1 mol NaOH
阿伏加德 罗常数 NA的基准是1 mol粒子集合体所含的粒子数约为6.02×1023,表示微观粒子数目时,可以用NA来表示,也可以用6.02×1023 mol-1表示,如1 mol O2中含有氧分子数为NA个或6.02×1023个
摩尔质量 (1)适用于任何微观粒子
(2)混合物的摩尔质量一般称为平均摩尔质量
(3)以g/mol为单位时数值上等于物质的相对原子(分子)质量(单位为1),等于1 mol物质的质量(单位:g)
(1)使用摩尔做单位时,必须指明微粒的种类。如1 mol H2中含有2 mol H,含1 mol H的H2的物质的量为0.5 mol。其标准的写法是“数字+mol+化学式”,例如2 mol HCl即表示2 mol的氯化氢分子。
(2)物质的量只能用来表示微观粒子集体的多少,不能用来表示宏观物体的多少。
(3)计算“粒子数”要明确计算分子数还是原子数或电子数等,如1 mol CH4中含有4 mol H,而不是1 mol H。
1.下列叙述中不正确的是( )
A.2 mol铁原子 B.1 mol Fe3+
C.0.5 mol氧 D.0.5 mol氮气
解析 0.5 mol氧,是指0.5 mol氧气还是0.5 mol氧原子不清楚,指代不明确,故C错误。
C
2.下列叙述错误的是( )
A.1 mol任何物质都含有6.02×1023个分子
B.1 mol Ne中含有6.02×1024个电子
C.1 mol H2O中含有2 mol H和1 mol O
D.1 mol H2O中含有3 mol原子
A
解析 物质并不都是由分子构成的,有些物质是由离子或原子构成的,比如NaCl是由离子构成,金刚石由原子构成的,A错误;1个氖原子核外有10个电子,则1 mol Ne含有6.02×1024个电子,B正确;1 mol H2O中含有2 mol H和1 mol O,C正确;1 mol H2O中含有2 mol H和1 mol O,共含有3 mol原子,D正确。
3.下列说法中正确的是( )
D
二、物质的量、物质的质量、微粒数目之间的计算关系
物质与构成粒子的物质的量的关系
4.0.5 mol O2中含有( )
A.1个氧原子 B.1 mol氧分子
C.NA个氧原子 D.0.5个氧分子
解析 0.5 mol O2中含有0.5 mol氧分子,氧分子数为3.01×1023(0.5NA),含有的氧原子数为6.02×1023(NA)。
C
5.下列说法正确的是( )
A.32 g O2所含的原子数目为NA
B.0.5 mol H2SO4含有的原子数目为3.5NA
C.HNO3的摩尔质量是63 g
D.0.5NA个氯气(Cl2)分子的物质的量是1 mol
B
6.(1)5.3 g Na2CO3的物质的量为________,含有Na+数为________。
(2)含有3.01×1023个氢原子的CH4的物质的量为________,质量为________。
答案 (1)0.05 mol 6.02×1022 (2)0.125 mol 2 g
7.32 g A分子中分子个数为3.01×1023个,则A的相对分子质量为________,摩尔质量为________。
答案 64 64 g/mol
1.下列说法中正确的是( )
A.摩尔是表示物质质量的单位
B.物质的量就是指物质的质量
C.摩尔是表示物质所含微粒个数的物理量
D.物质的量适用于计量分子、原子、离子等粒子的集合体
解析 摩尔是物质的量的单位,故A、C两项错误;物质的量表示含有一定数目粒子的集合体,故B错误,D正确。
D
2.下列说法中正确的是( )
A.二氧化碳的摩尔质量为44 g
B.1摩尔氧原子的质量就是氧的相对原子质量
C.H2SO4的摩尔质量为96 g/mol
D.1 mol CO2的分子数为NA
解析 二氧化碳的摩尔质量为44 g/mol,A错误;1摩尔氧原子的质量在数值上就等于氧的相对原子质量,但单位不同,B错误;H2SO4的摩尔质量为98 g/mol,C错误;国际上规定,1 mol任何微粒的个数均为NA个,则1 mol CO2的分子数为NA,D正确。
D
3.下列叙述正确的是( )
A.1 mol任何物质的质量都等于该物质的相对分子质量
B.H的摩尔质量是1 g/mol
C.1 mol H2O的质量是18 g/mol
D.SO2的摩尔质量为64 g
解析 A项质量和相对分子质量单位不一样,错误;C项1 mol H2O的质量是18 g,错误;D项SO2的摩尔质量是64 g·mol-1,错误。
B
4.15 g A和10.5 g,恰好B完全反应,生成7.2 g C、1.8 g D和0.3 mol E,则E的摩尔质量为( )
A.100 g·mol-1 B.27.5 g·mol-1 C.55 g·mol-1 D.16.5 g·mol-1
C
5.按要求填写下列空白:
答案 (1)1 23 (2)2.709×1024 72
(3)0.5 48 6.02×1023 2.107×1024
1.下列对于物质的量理解正确的是( )
A.物质的量是国际单位制的一个基本单位
B.摩尔质量就是相对原子质量或相对分子质量
C.1 mol氧气含1.204×1024个氧原子
D.1 mol氢含6.02×1023个H2
C
解析 摩尔是物质的量的单位,物质的量(而不是摩尔)是国际科学界建议采用的一种物理量,故A错误;摩尔质量以g/mol为单位时在数值上等于相对原子质量或相对分子质量,但两者的含义和单位不相同,故B错误。由于O2是双原子分子,1 mol氧气含2NA个氧原子,所以含氧原子数为1.204×1024,故C正确;使用摩尔时应指明基本微粒的名称,正确的说法是:1 mol氢气(而不是氢)含6.02×1023个H2,故D错误。
2.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.摩尔是七个基本物理量之一
B.阿伏加德罗常数就是6.02×1023 mol-1
C.1 mol氢的质量是2 g
D.1 mol CH4的质量与NA个CH4分子的质量之和相等
解析 摩尔是物质的量的单位,A项错误;6.02×1023 mol-1是阿伏加德罗常数的近似值,B项错误;“氢”指代不明,C项错误。
D
3.下列物质中,摩尔质量最大的是( )
A.10 mL H2O B.0.8 mol H2SO4
C.54 g Al D.1 g CaCO3
解析 A、B、C、D中四种物质的摩尔质量分别为18 g·mol-1、98 g·mol-1、27 g·mol-1、100 g·mol-1,摩尔质量最大的是D项。
D
4.若1 g N2中含有x个原子,则阿伏加德罗常数是( )
C
5.所含有原子总数与1 mol NH3所含原子总数相同的是( )
A.1 mol O2 B.2 mol Cl2
C.1 mol H2O D.2 mol CO2
解析 1 mol NH3所含原子总数为4NA。1 mol O2所含原子总数为2NA,A错误;2 mol Cl2所含原子总数为4NA,B正确;1 mol H2O所含原子总数为3NA,C错误; 2 mol CO2所含原子总数为6NA,D错误。
B
6.下列说法错误的是( )
A.1 mol N2和CO的混合气体中所含原子数为2NA
B.16 g O2和O3的混合气体中所含原子数为NA
C.等物质的量的Na2O2和Na2O所含有阴离子数目相同
D.17 g OH-含有电子数为9NA
D
7.下列说法正确的是( )
A.1 mol SO3的质量是80 g/mol B.Mg2+的摩尔质量是24 g
C.CO的摩尔质量是28 g/mol D.氮的摩尔质量是28 g/mol
解析 质量的单位是g,1 mol SO3的质量是80 g,A项错误;摩尔质量的单位是g/mol,Mg2+的摩尔质量是24 g/mol,B项错误;摩尔质量在数值上等于相对分子质量,故CO的摩尔质量是28 g/mol,C项正确;氮可以指氮原子,还可以是氮气分子,选项中没有指明微粒的种类,无法求算摩尔质量,D项错误。
C
8.已知硫酸中含有3.01×1023个氧原子,硫酸的物质的量是( )
A.0.500 mol B.1.00 mol
C.0.250 mol D.0.125 mol
D
9.一个一氧化氮(NO)分子质量为a g,一个二氧化氮(NO2)分子质量为b g,NA表示阿伏加德罗常数,则氧原子的摩尔质量为( )
A.(a-b)NA g·mol-1 B.(b-a)NA g·mol-1
C.(a-b)NA g D.(b-a)NA
解析 一个氧原子的质量为b g-a g=(b-a) g,1 mol氧原子的质量为(b-a)NA g,则氧原子的摩尔质量为(b-a)NA g·mol-1。
B
10.双氢青蒿素的分子式为C15H24O5,相对分子质量为284。下列关于双氢青蒿素的说法正确的是( )
A.NA个双氢青蒿素的质量为284 g·mol-1
B.原子个数均为NA的C、H、O三种原子的质量比为6∶1∶8
C.14.2 g双氢青蒿素中含有的原子总数为2.2NA
D.含有NA个碳原子的双氢青蒿素的物质的量为1 mol
C
解析 质量的单位是g,不是g·mol-1,A错误;当摩尔质量的单位是g·mol-1时,原子个数均为NA的C、H、O三种原子的物质的量为1 mol,分别乘以各自的摩尔质量12 g·mol-1、1 g·mol-1、16 g·mol-1,得到质量比为12∶1∶16,B错误;14.2 g双氢青蒿素的物质的量是14.2 g÷284 g·mol-1=0.05 mol,由于一个分子中含有的原子个数是44,所以0.05 mol双氢青蒿素中含有的原子总数为2.2NA,C正确;一个双氢青蒿素分子中含有15个碳原子,含有NA个碳原子的双氢青蒿素的物质的量为1 mol÷15≈0.067 mol,D错误。
11.有五种物质:①6 g 氢气;②0.5 mol 二氧化碳;③1.204×1024个氯化氢分子;④147 g硫酸;⑤92 g乙醇(C2H5OH)。回答下列问题(填序号):
(1)物质的量最大的是________。
(2)所含分子数最多的是________。
(3)含有原子个数最多的是________。
(4)质量最大的是________。
答案 (1)① (2)① (3)⑤ (4)④
解析 首先“见量化摩”,以物质的量为核心再进行转换。①n(H2)=3 mol;②n(CO2)=0.5 mol;③n(HCl)=2 mol;④n(H2SO4)=1.5 mol;⑤n(C2H5OH)=2 mol。物质的量最大的是①,所含分子数最多的是①。①~⑤物质中所含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,所含原子个数最多的是⑤。①~⑤物质的质量分别为6 g、22 g、73 g、147 g、92 g,质量最大的是④。
12.(1)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等。
(2)含0.4 mol Al3+的Al2(SO4)3中所含的硫酸根离子的物质的量是________ mol。
(3)相同质量的CO2、CO的物质的量之比为________;氧原子的个数之比为________。
(4)19 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩尔质量是________。
答案 (1) 0.4NA或2.408×1023 (2)0.6
(3)7∶11 14∶11 (4)95 g/mol
13.草酸(分子式为H2C2O4,沸点为150 ℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体内。下列有关判断不正确的是( )
A.草酸的摩尔质量是90 g/mol
B.草酸中碳元素的质量分数为13.3%
C.1 mol草酸中约含有6.02×1023个草酸分子
D.1 mol草酸的质量为90 g
B
14.用NA表示阿伏加德罗常数的值。下列说法中正确的是( )
A.2.4 g金属镁变成镁离子时失去的电子数为0.4NA
B.2 g氢气中含有的原子数为NA
C.3.01×1023个氮分子中含有的原子数为2NA
D.17 g氨气中含有的电子数为10NA
D
解析 2.4 g Mg的物质的量为0.1 mol,而1 mol Mg变成Mg2+时失去2 mol电子,所以2.4 g Mg应失去0.2NA个电子,A项错误;H2为双原子分子,2 g氢气即1 mol H2,应含有2 mol H,原子个数为2NA,B项错误;N2为双原子分子,3.01×1023个氮气分子中所含原子数应为2×3.01×1023,即NA,C项错误;D中17 g NH3的物质的量为1 mol,含有的电子数为10NA,D项正确。
15.已知12.4 g Na2R中含有Na+ 0.4 mol。
(1)Na2R的摩尔质量为________。
(2)R的相对原子质量为________。
(3)若Na2R中含R的质量为1.6 g,则Na2R的物质的量为________。
答案 (1)62 g·mol-1 (2)16
(3)0.1 mol
解析 (1)Na2R的物质的量为0.2 mol,其摩尔质量为12.4 g÷0.2 mol=62 g·mol-1。
(2)R的摩尔质量为62 g·mol-1-2×23 g·mol-1=16 g·mol-1。
(3)1.6 g R的物质的量n(R)=1.6 g÷16 g·mol-1=0.1 mol,n(Na2R)=n(R)=0.1 mol。
Thanks!
本讲内容结束
