第二章 第三节 物质的量 第三课时 物质的量浓度(共102张ppt)
文档属性
| 名称 | 第二章 第三节 物质的量 第三课时 物质的量浓度(共102张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 16:17:58 | ||
图片预览











文档简介
(共102张PPT)
第三课时 物质的量浓度
第二章 海水中的重要元素——钠和氯
【课程标准要求】
1.了解物质的量浓度及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、溶液组成的表示方法
1.溶质的质量分数
(1)概念:溶液中的______质量与______质量之比。
(2)表达式:w(溶质)=______________________。
溶质
溶液
2.溶液的物质的量浓度
(1)概念:表示单位______的溶液里所含溶质B的__________。
(2)符号:______,常用单位:________________。
(3)表达式:______________,其中的“V”指的是溶液的体积,而非溶剂的体积。
体积
物质的量
cB
mol·L-1
3.简单计算
(1)已知溶液中某种离子的浓度,求其他离子的浓度
溶液中阴、阳离子的物质的量浓度之比=化学组成中的离子个数之比。
(2)已知一定体积的溶液中溶质的质量计算溶液的物质的量浓度
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)0.1 mol/L Na2CO3溶液中,Na+的物质的量浓度为0.1 mol/L( )
(2)将58.5 g NaCl投入1 000 mL水中形成的溶液的物质的量浓度为1 mol/L( )
(3)从200 mL 0.1 mol/L盐酸中取出50 mL溶液,其物质的量浓度仍为0.1 mol/L( )
(4)将25 g CuSO4·5H2O溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 mol/L( )
答案 (1)× (2)× (3)√ (4)√
二、配制一定物质的量浓度的溶液
1.配制一定物质的量浓度溶液专用仪器——容量瓶
(1)容量瓶的结构(以100 mL为例)与规格
温度
刻度线
50 mL
100 mL
250 mL
500 mL
1 000 mL
(2)容量瓶的使用注意事项
①使用前要检验容量瓶是否严密漏水。检验程序:加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
②使用后应将容量瓶洗净。
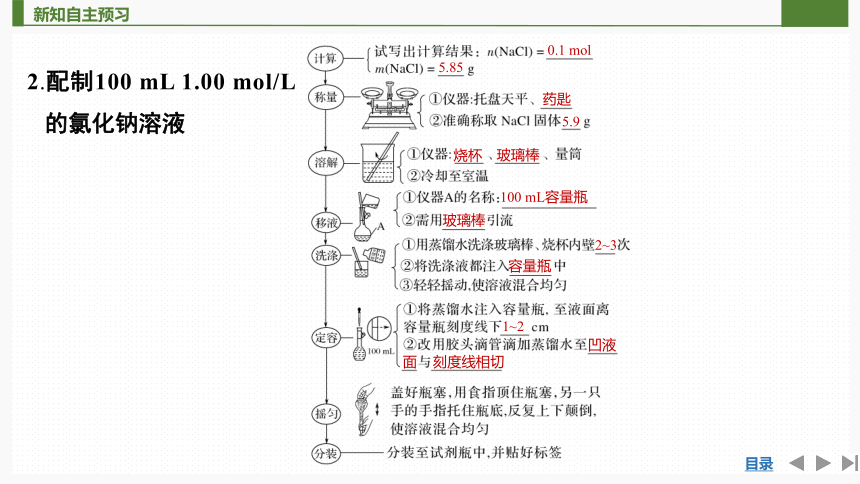
2.配制100 mL 1.00 mol/L 的氯化钠溶液
0.1 mol
5.85
药匙
5.9
烧杯
玻璃棒
100 mL容量瓶
玻璃棒
2~3
容量瓶
1~2
凹液
面
刻度线相切
【微自测】
2.下列描述中,正确的打“√”,错误的打“×”
(1)容量瓶在使用前应检查是否漏液( )
(2)配制1 L 0.1 mol·L-1硫酸铜溶液,需要25 g CuSO4·5H2O( )
(3)用固体配制溶液时,可直接将固体在容量瓶中进行溶解( )
(4)配制一定物质的量浓度溶液时,两次使用玻璃棒,其作用分别是搅拌和引流( )
答案 (1)√ (2)√ (3)× (4)√
二、配制一定物质的量浓度溶液的操作和误差分析
一、物质的量浓度与溶质的质量分数的比较与相互换算
一、物质的量浓度与溶质的质量分数的比较与相互换算
1.20 ℃时饱和NaCl溶液的密度为ρ g·cm-3,物质的量浓度为c mol·L-1,则下列说法中不正确的是( )
D
2.现有0.270 kg质量分数为10%的CuCl2溶液,若溶液的体积为1.0 L。下列说法中不正确的是( )
A.该溶液中Cl-的物质的量为0.4 mol
B.CuCl2的物质的量浓度为0.2 mol·L-1
C.该溶液中c(Cu2+)与0.1 mol·L-1 MgCl2溶液中c(Cl-)相等
D.该溶液与200 mL 1.0 mol·L-1 NaOH溶液混合,Cu2+恰好完全生成Cu(OH)2沉淀
D
解析 CuCl2的摩尔质量为135 g·mol-1,则0.270 kg质量分数为10%的CuCl2溶液中n(CuCl2)=(270 g×10%)/(135 g·mol-1)=0.2 mol,该溶液中n(Cl-)=0.2 mol×2=0.4 mol,A正确;溶液的体积为1.0 L,则有c(CuCl2)=0.2 mol/1.0 L=0.2 mol·L-1,B正确;该溶液中c(Cu2+)=0.2 mol·L-1,0.1 mol·L-1 MgCl2溶液中c(Cl-)=0.1 mol·L-1×2=0.2 mol·L-1,C正确;该溶液中含有0.2 mol Cu2+,200 mL 1.0 mol·L-1 NaOH溶液中含有0.2 mol OH-,结合反应Cu2++2OH-===Cu(OH)2↓可知,反应后Cu2+仍剩余0.1 mol,D错误。
3.(1)物质的量浓度为2 mol·L-1的H2SO4溶液250 mL,含H2SO4的物质的量为________。
(2)已知75 mL 2 mol·L-1的NaOH溶液的质量为80 g,则该溶液中溶质的质量分数为________。
答案 (1)0.5 mol (2)7.5%
二、配制一定物质的量浓度溶液的操作和误差分析
如图是实验室配制一定物质的量浓度溶液的操作过程:
1.在上图操作中,向容量瓶中转移溶液时玻璃棒的作用是什么?玻璃棒的下端为什么应靠在容量瓶刻度线以下的内壁上?
提示 向容量瓶中转移溶液时玻璃棒的作用是引流,以防止溶液外洒而造成损失。如果玻璃棒下端靠在容量瓶刻度线以上的内壁上,刻度线以上的内壁上附着的液体不能及时流下,定容后造成溶液体积偏大。
2.配制一定物质的量浓度溶液时,为什么一定要洗涤烧杯内壁和玻璃棒?
提示 因为移液后的烧杯内壁和玻璃棒上沾有少量的溶质,必须用蒸馏水洗涤,使溶质全部转入容量瓶中,否则会造成实验误差。
3.定容加蒸馏水时不慎超过了刻度线,是否可用胶头滴管将超过了刻度线的液体吸出?向容量瓶转移溶液时不慎有液滴洒在容量瓶外面,应如何处理?能否补加溶质?
提示 均不可以。因超过了刻度线的液体不是多加入的蒸馏水,而是含有溶质的溶液,用胶头滴管将其吸出,溶质会减少,也无其他方法进行弥补处理,实验失败,只能重新配制;因为洒落在容量瓶外的溶质的量无法确定,所以无法进行溶质补加,只能重新配制。
1.容量瓶操作使用的两个“四”
(1)容量瓶的四个关键“操作”
(2)容量瓶使用的四个“不能”
2.一定物质的量浓度溶液配制操作总结
3.溶液配制的误差分析
②容量瓶定容时仰视、俯视对结果的影响分析(如下图)
a.仰视刻度线(如图a):加水量高于基准线(刻度线),溶液体积偏大,c偏低。
b.俯视刻度线(如图b):加水量低于基准线(刻度线),溶液体积偏小,c偏高。
(2)误差分析示例
以配制100 mL 1.00 mol·L-1 氯化钠溶液为例
实验操作 n V c
①计算结果m=5.85 g,称5.9 g 偏大 不变 偏大
②砝码生锈(没有脱落) 偏大 不变 偏大
③少量氯化钠沾在滤纸上 偏小 不变 偏小
④转移溶液时有少量液体溅出 偏小 不变 偏小
⑤容量瓶内有少量水 不变 不变 不变
⑥未洗涤或洗涤液未注入容量瓶 偏小 不变 偏小
⑦定容时仰视 不变 偏大 偏小
⑧超过刻度线,吸出一部分水 偏小 不变 偏小
⑨摇匀后液面下降,补充水 不变 偏大 偏小
1.配制一定物质的量浓度的溶液,若是固体溶质,则计算所需质量,用天平称量;若是液体溶质,则要换算成其体积,用量筒量取。
2.定容时,视线从刻度线切入与凹液面最低处在一条水平线上,“眼高(俯视)水低(V偏小)”、“眼低(仰视)水高(V偏大)”。
4.实验室中需要0.2 mol·L-1的CuSO4溶液450 mL,配制时应选用的容量瓶的规格和称取胆矾的质量分别是( )
A.500 mL 25.0 g B.450 mL 22.5 g
C.450 mL 14.4 g D.500 mL 16.0 g
解析 没有450 mL的容量瓶,则需要配制500 mL溶液,CuSO4的物质的量是0.2 mol·L-1×0.5 L=0.1 mol,因此需要胆矾的质量是0.1 mol×250 g·mol-1=25.0 g。
A
5.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
解析 A项,托盘天平称量时,应为“左物右码”,错误;B项,用玻璃棒搅拌能加速溶解,正确;C项,转移溶液时需要用玻璃棒引流,错误;D项,定容时,胶头滴管不能伸入容量瓶内,错误。
B
6.使用容量瓶配制溶液时,由于操作不当,会引起误差。下列情况一定会使所配溶液浓度偏低的是( )
①用天平称量时,被称量物与砝码的位置放颠倒了
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,仰视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①②⑤ B.②④⑤ C.③④⑤ D.①②④⑤
B
解析 天平称量时使用游码,被称量物与砝码的位置放颠倒了,物质的质量=砝码的质量-游码的质量,质量偏小,浓度偏低,若不使用游码,物质的质量=砝码的质量,对质量无影响,浓度不变;定容时,仰视容量瓶的刻度线,体积偏大,浓度偏低;定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,体积偏大,浓度偏低。
微专题6 物质的量浓度的计算
微专题7 阿伏加德罗常数的正误判断
微专题6 物质的量浓度的计算
2.溶液稀释和混合的计算
(1)溶液稀释的计算
稀释前后溶质的物质的量和质量都保持不变。
c(浓)·V(浓)=c(稀)·V(稀),
m(浓)·w(浓)=m(稀)·w(稀)。
(2)混合规律
①语言描述:同一溶质不同浓度的两溶液相混合,混合后,溶质的总物质的量(或总质量)等于混合前两溶液中溶质的物质的量之和(或质量之和)。
②公式:c1·V1+c2·V2=c(混)·V(混)
3.溶质质量分数w与物质的量浓度c之间的换算
类型一 气体溶于水所得溶液中物质的量浓度的计算
[典例1] (2021·周口高一检测)标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A
答案 3 mol/L
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.25 mol·L-1 D.0.5 mol·L-1
解析 设Na+浓度为x,根据电荷守恒可知,0.3 mol·L-1×1+x×1=0.4 mol·L-1×2,x=0.5 mol·L-1。
D
2.用100 mL 0.3 mol·L-1的氢氧化钠溶液和300 mL 0.25 mol·L-1的硫酸混合加水稀释到500 mL,混合液中H+的物质的量浓度为( )
A.0.36 mol·L-1 B.0.24 mol·L-1
C.0.45 mol·L-1 D.0.09 mol·L-1
解析 设混合后溶质硫酸的物质的量浓度为a,则0.3 L×0.25 mol·L-1-(0.1 L×0.3 mol·L-1)÷2=0.5 L×a,解得:a=0.12 mol·L-1,混合稀释后溶液中c(H+)=2c(H2SO4)=2×0.12 mol·L-1=0.24 mol·L-1。
B
C
4.(2021·阜新高一检测)取100 mL 0.3 mol·L-1的硫酸溶液和200 mL 0.25 mol·L-1的硫酸溶液混合后加水稀释至400 mL,该混合溶液中硫酸的物质的量浓度是( )
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
B
5.下图是某市售盐酸试剂瓶标签上的部分数据。
则该盐酸的物质的量浓度是( )
A.3 mol·L-1 B.8.4 mol·L-1 C.11.8 mol·L-1 D.0.5 mol·L-1
C
盐酸
化学式:HCl
相对分子质量:36.5
外观:合格
密度:1.18 g·cm-3
HCl的质量分数:36.5%
符合GB622-89
微专题7 阿伏加德罗常数的正误判断
1.解答阿伏加德罗常数正误判断类题目的思维模型
2.阿伏加德罗常数正误判断中常见的陷阱
考查方向 注意问题
气体摩尔体积的适用条件 凡是出现物质的体积,首先考虑是否为气体,再考虑条件是否为标准状况(0 ℃,1.01×105 Pa)
物质的聚集状态 在标准状况下是液体或固体的物质,有H2O、酒精、苯、CCl4、SO3、NO2等
物质的微观结构 ①注意某些物质分子中的原子个数,如Ne、O3、P4等;②注意一些物质中的离子数目,如Na2O2、NaHSO4等
1.下列有关阿伏加德罗常数(NA表示阿伏加德罗常数的值)的说法正确的是( )
A.标准状况下,32 g SO2中含有0.5NA个O2
B.常温常压下,11 g CO2中含有0.75NA个原子
C.标准状况下,NA个苯分子的体积约为22.4 L
D.1 L 0.3 mol/L的NaCl溶液中含有0.3NA个NaCl分子
解析 SO2中只含有SO2分子,不含O2;11 g CO2的物质的量是0.25 mol,含有0.75 mol原子,即0.75NA个原子;标准状况下,NA个苯分子为1 mol,其体积不是22.4 L;NaCl是离子化合物,由Na+和Cl-离子构成,不存在NaCl分子。
B
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.4.6 g Na与水完全反应生成2.24 L H2
B.0.1 mol/L MgCl2溶液中含有的Cl-数为0.2NA
C.1 mol氯气与足量的铜反应,转移电子数为NA
D.2.8 g CO和N2的混合气中,所含原子总数为0.2NA
D
解析 4.6 g Na的物质的量为0.2 mol,与水完全反应生成0.1 mol H2,在标准状况下的体积为2.24 L,其他条件下则不一定,A项错误;题目未指明0.1 mol/L MgCl2溶液的体积,无法确定所含Cl-数目,B项错误;1 mol Cl2与铜反应生成1 mol CuCl2,转移电子数为2NA,C项错误;CO和N2的摩尔质量都是28 g/mol,且均为双原子分子,2.8 g CO和N2的混合气体总物质的量为0.1 mol,则所含原子总数为0.2NA,D项正确。
3.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L氯气中所含的原子数为NA
B.常温常压下,22.4 L氢气中所含的电子数为2NA
C.4 ℃时,5.4 mL水中所含的水分子数约为0.3NA
D.100 mL 0.2 mol/L K2SO4溶液中所含离子总数为60NA
C
解析 常温常压下,11.2 L氯气的物质的量不是0.5 mol,则所含原子数不是NA,A错误;1个H2分子含有2个电子,常温常压下22.4 L氢气的物质的量不是1 mol,则所含电子数不是2NA,B错误;4 ℃时水的密度为1 g/mL,5.4 mL水的质量为5.4 g,其物质的量为0.3 mol,故所含水分子数为0.3NA,C正确;100 mL 0.2 mol/L K2SO4溶液中含有0.02 mol K2SO4,离子的总物质的量为0.06 mol,故溶液中所含离子总数为0.06NA,D错误。
1.配制一定物质的量浓度的硫酸溶液,不需用的仪器是( )
解析 实验室配制一定物质的量浓度的溶液,一定要用到的仪器是容量瓶、烧杯、玻璃棒、胶头滴管;若溶质为固体还需要托盘天平、药匙等仪器,若溶质为液体(或浓溶液)还需要量筒(或滴定管、移液管)等仪器。
C
2.在100 mL的溶液中溶有0.1 mol NaCl和0.1 mol MgCl2,此溶液中Cl-的物质的量浓度为( )
A.3 mol·L-1 B.2 mol·L-1
C.0.3 mol·L-1 D.0.2 mol·L-1
A
3.下列溶液中物质的量浓度为1 mol·L-1的是( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
D
4.用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是( )
A.定容时加水加多了,用滴管吸出溶液至刻度线
B.定容时仰视刻度线
C.没有洗涤溶解NaCl固体的烧杯和玻璃棒
D.称量NaCl固体时砝码上有杂质
D
解析 A项,用滴管吸出溶液使n(NaCl)减小,浓度偏低;B项,定容时仰视刻度线,溶液的体积偏大,浓度偏低;C项,未洗涤烧杯、玻璃棒,n(NaCl)减小,浓度偏低;D项,砝码上有杂质使本身质量偏大,称量NaCl的质量偏大,浓度偏高。
5.某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示。该小组欲配制450 mL 0.2 mol·L-1的稀硫酸溶液:
硫酸:
化学纯(CP)(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
(1)所需试剂瓶内硫酸溶液的体积为________ mL。
(2)所用量筒和容量瓶的规格为________和________。
(3)浓硫酸稀释时的操作是_____________________________________。
(4)下列为该小组的操作,可能导致配制溶液浓度偏高的是________。
A.移液前未冷却至室温 B.定容时加水多了,用滴管吸出
C.定容时俯视刻度线
(5)下图是该小组转移溶液的示意图,图中的错误是________________。
答案 (1)5.4 (2)10 mL量筒 500 mL容量瓶
(3)向烧杯中加入一定量的水,再将浓硫酸沿烧杯内壁慢慢倒入,并用
玻璃棒不断搅拌 (4)AC (5)①未用玻璃棒引流;②未采用500 mL容量瓶
解析 欲配制450 mL的H2SO4溶液需选取500 mL的容量瓶,在转移溶液时应用玻璃棒引流。
1.(2021·临沂高一检测)下列有关容量瓶的使用叙述正确的是( )
A.容量瓶不能用作长期贮存试剂的容器,但是当溶液配制完后,可以用来存放配制的试剂
B.用500 mL的容量瓶可以直接配制480 mL溶液
C.容量瓶不可以用来溶解固体,但是可以用来稀释浓的溶液
D.容量瓶不可以用来加热,但是锥形瓶可以用来加热
解析 容量瓶是配制一定物质的量浓度溶液的专用仪器,不能用来溶解固体、不能用于稀释浓溶液、不能长期贮存溶液、不能加热。
D
2.下列溶液中,跟100 mL 0.5 mol·L-1 NaCl溶液中所含的Cl-物质的量浓度相同的是( )
A.100 mL 0.5 mol·L-1 MgCl2溶液
B.200 mL 0.25 mol·L-1 AlCl3溶液
C.50 mL 1 mol·L-1 NaCl溶液
D.25 mL 0.5 mol·L-1 HCl溶液
解析 物质的量浓度与溶液的体积无关,100 mL 0.5 mol·L-1 NaCl溶液中c(Cl-)=0.5 mol·L-1,而A、B、C、D项中,c(Cl-)分别为1 mol·L-1、0.75 mol·L-1、1 mol·L-1、0.5 mol·L-1,D项正确。
D
3.如图表示配制一定物质的量浓度的NaCl溶液的部分操作示意图,其中有错误的是( )
解析 定容时,视线应与凹液面的最低点在同一水平线上。
C
4.标准状况下,2.24 L HCl气体溶于水中配成100 mL溶液,溶液密度为ρ g·mL-1,则所得溶液中溶质的物质的量浓度为( )
A
5.如图是实验室配制好的两瓶NaOH溶液的标签(14%的NaOH溶液的密度为1.14 g·cm-3)。
14%的NaOH溶液的物质的量浓度及从瓶中取出20 mL该溶液中含有溶质的质量分别是( )
A.4.0 mol·L-1 3.2 g B.2.0 mol·L-1 3.2 g
C.4.0 mol·L-1 6.4 g D.2.0 mol·L-1 6.4 g
A
6.下列有关仪器使用方法或实验操作正确的是( )
A.洗净的容量瓶可以放进烘箱中烘干
B.配制溶液定容的操作图示:
C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏高
D.用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余的液体
C
解析 洗净的容量瓶不能放进烘箱中烘干,会影响其准确度,A错误;定容操作,应用胶头滴管定容,B错误;用容量瓶配制溶液,定容时俯视刻度线,使溶液体积偏小,所配溶液浓度偏高,C正确。用容量瓶配制溶液时,若加水超过刻度线,应重新配制,D错误。
7.实验室欲用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,下列说法正确的是( )
A.要完成实验需称取10.6 g Na2CO3·10H2O晶体
B.本实验需用到的仪器有天平、药匙、玻璃棒、烧杯、500 mL容量瓶
C.配制时若容量瓶不干燥,含有少量蒸馏水会导致溶液浓度偏低
D.定容时俯视刻度线会导致溶液浓度偏高
D
8.(2021·荆州高一检测)下列关于0.1 mol·L-1 Ba(NO3)2溶液的正确说法是( )
B
9.实验室里需用480 mL 0.1 mol·L-1的硫酸铜溶液,若选取500 mL容量瓶进行配制,以下操作中正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾配成500 mL溶液
D
解析 500 mL容量瓶只能配500 mL溶液,因而配500 mL 0.1 mol·L-1 CuSO4溶液时,需CuSO4的质量为:0.1 mol·L-1×0.5 L×160 g·mol-1=8 g或需CuSO4·5H2O的质量为:0.1 mol·L-1×0.5 L×250 g·mol-1=12.5 g,加水配成500 mL溶液。
10.在溶液的配制过程中会引起浓度偏高的是( )
A.配制500 mL 0.1 mol/L 的硫酸铜溶液,用托盘天平称取胆矾8.0 g
B.配制NaOH溶液时,NaOH固体放在烧杯中称量时间过长
C.定容时,仰视刻度线
D.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
D
解析 配制500 mL 0.1 mol/L 的硫酸铜溶液,需要称取胆矾的质量为0.5 L×0.1 mol/L×250 g/mol=12.5 g,称取的质量偏少,浓度偏低,故A错误;配制NaOH溶液时,NaOH固体放在烧杯中称量时间过长,会吸收空气中的水蒸气和二氧化碳,导致氢氧化钠的质量偏少,浓度偏低,故B错误;定容时,仰视刻度线,导致溶液的体积偏大,浓度偏低,故C错误;配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容,导致溶液的正常温度下体积偏小,浓度偏高,故D正确。
11.将117 g NaCl溶于水配制成1 L溶液,
(1)该溶液中NaCl的物质的量浓度为________,溶液中Cl-的物质的量浓度为________。
(2)配制1 mol·L-1的NaCl溶液500 mL,需该溶液的体积为________。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为________,通入HCl气体的体积(标准状况下)为________。
答案 (1)2 mol·L-1 2 mol·L-1
(2)0.25 L (3)1 mol·L-1 22.4 L
12.将24.4 g氢氧化钠固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。
(1)该溶液中氢氧化钠的物质的量浓度为________。
(2)该溶液中氢氧化钠的质量分数为________。
(3)从该溶液中取出10 mL,含氢氧化钠的质量为________,含氢氧化钠的物质的量为________。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为________。
答案 (1)6.1 mol·L-1 (2)20%
(3)2.44 g 0.061 mol (4)0.61 mol·L-1
13.某校化学兴趣小组在实验室中发现一瓶溶液,标签上标有“CaCl2 0.1 mol·L-1”的字样,下面是该小组成员对该溶液的叙述,正确的是( )
A.配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中
B.Ca2+和Cl-的物质的量浓度都是0.1 mol·L-1
C.从试剂瓶中取该溶液的一半,则所得溶液的物质的量浓度为0.05 mol·L-1
D.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1 mol·L-1
D
解析 A项,所得溶液的体积不是1 L,错误;B项,Cl-的浓度是0.2 mol·L-1,Ca2+的浓度是0.1 mol·L-1,错误;C项,溶液具有均一性,所得溶液的浓度仍为0.1 mol·L-1,错误;D项,溶液中Cl-的浓度为0.2 mol/L,稀释1倍,浓度减半,故稀释后Cl-的浓度为0.1 mol·L-1,正确。
14.相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是( )
D
15.实验室欲用氢氧化钠固体配制1.0 mol·L-1的氢氧化钠溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
⑨摇动
其正确的操作顺序为__________________________________________。
必须用到的玻璃仪器有烧杯、胶头滴管、_______________________。
②①③⑧⑤⑥⑨⑦④
250 mL容量瓶、玻璃棒
解析 (1)配制1.0 mol·L-1 氢氧化钠溶液的步骤:计算所需氢氧化钠固体的质量→用托盘天平称量→在烧杯中溶解→冷却至室温→向容量瓶中转移溶液→洗涤烧杯及玻璃棒→摇动容量瓶→向容量瓶中加水定容→上下颠倒摇匀容量瓶。根据实验步骤即判断出所用仪器还有250 mL容量瓶和玻璃棒。
(2)某同学欲称量氢氧化钠的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g 氢氧化钠。
27.4
10.0
解析 (2)该同学将砝码与烧杯放反了,所以称得烧杯的质量为(20 g+10 g)-2.6 g=27.4 g,应称氢氧化钠质量为1.0 mol·L-1×0.25 L×40 g·mol-1=10.0 g。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________(填字母)。
A.所用氢氧化钠已经潮解
B.向容量瓶中加水未到刻度线
C.有少量氢氧化钠溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g氢氧化钠(1 g以下用游码)时误用了“左码右物”方法
查漏
B
解析 (3)使用容量瓶的第一步操作为查漏。(4)A项,所称氢氧化钠的质量(物质的量)偏小,浓度偏低;B项,所得溶液体积偏小,浓度偏高;C项,所得溶液NaOH的物质的量偏小,浓度偏低;D项,左码右物称量时,m物+m游码=m砝码,故所称物体质量偏小,浓度偏低。
Thanks!
本讲内容结束
第三课时 物质的量浓度
第二章 海水中的重要元素——钠和氯
【课程标准要求】
1.了解物质的量浓度及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、溶液组成的表示方法
1.溶质的质量分数
(1)概念:溶液中的______质量与______质量之比。
(2)表达式:w(溶质)=______________________。
溶质
溶液
2.溶液的物质的量浓度
(1)概念:表示单位______的溶液里所含溶质B的__________。
(2)符号:______,常用单位:________________。
(3)表达式:______________,其中的“V”指的是溶液的体积,而非溶剂的体积。
体积
物质的量
cB
mol·L-1
3.简单计算
(1)已知溶液中某种离子的浓度,求其他离子的浓度
溶液中阴、阳离子的物质的量浓度之比=化学组成中的离子个数之比。
(2)已知一定体积的溶液中溶质的质量计算溶液的物质的量浓度
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)0.1 mol/L Na2CO3溶液中,Na+的物质的量浓度为0.1 mol/L( )
(2)将58.5 g NaCl投入1 000 mL水中形成的溶液的物质的量浓度为1 mol/L( )
(3)从200 mL 0.1 mol/L盐酸中取出50 mL溶液,其物质的量浓度仍为0.1 mol/L( )
(4)将25 g CuSO4·5H2O溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 mol/L( )
答案 (1)× (2)× (3)√ (4)√
二、配制一定物质的量浓度的溶液
1.配制一定物质的量浓度溶液专用仪器——容量瓶
(1)容量瓶的结构(以100 mL为例)与规格
温度
刻度线
50 mL
100 mL
250 mL
500 mL
1 000 mL
(2)容量瓶的使用注意事项
①使用前要检验容量瓶是否严密漏水。检验程序:加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
②使用后应将容量瓶洗净。
2.配制100 mL 1.00 mol/L 的氯化钠溶液
0.1 mol
5.85
药匙
5.9
烧杯
玻璃棒
100 mL容量瓶
玻璃棒
2~3
容量瓶
1~2
凹液
面
刻度线相切
【微自测】
2.下列描述中,正确的打“√”,错误的打“×”
(1)容量瓶在使用前应检查是否漏液( )
(2)配制1 L 0.1 mol·L-1硫酸铜溶液,需要25 g CuSO4·5H2O( )
(3)用固体配制溶液时,可直接将固体在容量瓶中进行溶解( )
(4)配制一定物质的量浓度溶液时,两次使用玻璃棒,其作用分别是搅拌和引流( )
答案 (1)√ (2)√ (3)× (4)√
二、配制一定物质的量浓度溶液的操作和误差分析
一、物质的量浓度与溶质的质量分数的比较与相互换算
一、物质的量浓度与溶质的质量分数的比较与相互换算
1.20 ℃时饱和NaCl溶液的密度为ρ g·cm-3,物质的量浓度为c mol·L-1,则下列说法中不正确的是( )
D
2.现有0.270 kg质量分数为10%的CuCl2溶液,若溶液的体积为1.0 L。下列说法中不正确的是( )
A.该溶液中Cl-的物质的量为0.4 mol
B.CuCl2的物质的量浓度为0.2 mol·L-1
C.该溶液中c(Cu2+)与0.1 mol·L-1 MgCl2溶液中c(Cl-)相等
D.该溶液与200 mL 1.0 mol·L-1 NaOH溶液混合,Cu2+恰好完全生成Cu(OH)2沉淀
D
解析 CuCl2的摩尔质量为135 g·mol-1,则0.270 kg质量分数为10%的CuCl2溶液中n(CuCl2)=(270 g×10%)/(135 g·mol-1)=0.2 mol,该溶液中n(Cl-)=0.2 mol×2=0.4 mol,A正确;溶液的体积为1.0 L,则有c(CuCl2)=0.2 mol/1.0 L=0.2 mol·L-1,B正确;该溶液中c(Cu2+)=0.2 mol·L-1,0.1 mol·L-1 MgCl2溶液中c(Cl-)=0.1 mol·L-1×2=0.2 mol·L-1,C正确;该溶液中含有0.2 mol Cu2+,200 mL 1.0 mol·L-1 NaOH溶液中含有0.2 mol OH-,结合反应Cu2++2OH-===Cu(OH)2↓可知,反应后Cu2+仍剩余0.1 mol,D错误。
3.(1)物质的量浓度为2 mol·L-1的H2SO4溶液250 mL,含H2SO4的物质的量为________。
(2)已知75 mL 2 mol·L-1的NaOH溶液的质量为80 g,则该溶液中溶质的质量分数为________。
答案 (1)0.5 mol (2)7.5%
二、配制一定物质的量浓度溶液的操作和误差分析
如图是实验室配制一定物质的量浓度溶液的操作过程:
1.在上图操作中,向容量瓶中转移溶液时玻璃棒的作用是什么?玻璃棒的下端为什么应靠在容量瓶刻度线以下的内壁上?
提示 向容量瓶中转移溶液时玻璃棒的作用是引流,以防止溶液外洒而造成损失。如果玻璃棒下端靠在容量瓶刻度线以上的内壁上,刻度线以上的内壁上附着的液体不能及时流下,定容后造成溶液体积偏大。
2.配制一定物质的量浓度溶液时,为什么一定要洗涤烧杯内壁和玻璃棒?
提示 因为移液后的烧杯内壁和玻璃棒上沾有少量的溶质,必须用蒸馏水洗涤,使溶质全部转入容量瓶中,否则会造成实验误差。
3.定容加蒸馏水时不慎超过了刻度线,是否可用胶头滴管将超过了刻度线的液体吸出?向容量瓶转移溶液时不慎有液滴洒在容量瓶外面,应如何处理?能否补加溶质?
提示 均不可以。因超过了刻度线的液体不是多加入的蒸馏水,而是含有溶质的溶液,用胶头滴管将其吸出,溶质会减少,也无其他方法进行弥补处理,实验失败,只能重新配制;因为洒落在容量瓶外的溶质的量无法确定,所以无法进行溶质补加,只能重新配制。
1.容量瓶操作使用的两个“四”
(1)容量瓶的四个关键“操作”
(2)容量瓶使用的四个“不能”
2.一定物质的量浓度溶液配制操作总结
3.溶液配制的误差分析
②容量瓶定容时仰视、俯视对结果的影响分析(如下图)
a.仰视刻度线(如图a):加水量高于基准线(刻度线),溶液体积偏大,c偏低。
b.俯视刻度线(如图b):加水量低于基准线(刻度线),溶液体积偏小,c偏高。
(2)误差分析示例
以配制100 mL 1.00 mol·L-1 氯化钠溶液为例
实验操作 n V c
①计算结果m=5.85 g,称5.9 g 偏大 不变 偏大
②砝码生锈(没有脱落) 偏大 不变 偏大
③少量氯化钠沾在滤纸上 偏小 不变 偏小
④转移溶液时有少量液体溅出 偏小 不变 偏小
⑤容量瓶内有少量水 不变 不变 不变
⑥未洗涤或洗涤液未注入容量瓶 偏小 不变 偏小
⑦定容时仰视 不变 偏大 偏小
⑧超过刻度线,吸出一部分水 偏小 不变 偏小
⑨摇匀后液面下降,补充水 不变 偏大 偏小
1.配制一定物质的量浓度的溶液,若是固体溶质,则计算所需质量,用天平称量;若是液体溶质,则要换算成其体积,用量筒量取。
2.定容时,视线从刻度线切入与凹液面最低处在一条水平线上,“眼高(俯视)水低(V偏小)”、“眼低(仰视)水高(V偏大)”。
4.实验室中需要0.2 mol·L-1的CuSO4溶液450 mL,配制时应选用的容量瓶的规格和称取胆矾的质量分别是( )
A.500 mL 25.0 g B.450 mL 22.5 g
C.450 mL 14.4 g D.500 mL 16.0 g
解析 没有450 mL的容量瓶,则需要配制500 mL溶液,CuSO4的物质的量是0.2 mol·L-1×0.5 L=0.1 mol,因此需要胆矾的质量是0.1 mol×250 g·mol-1=25.0 g。
A
5.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
解析 A项,托盘天平称量时,应为“左物右码”,错误;B项,用玻璃棒搅拌能加速溶解,正确;C项,转移溶液时需要用玻璃棒引流,错误;D项,定容时,胶头滴管不能伸入容量瓶内,错误。
B
6.使用容量瓶配制溶液时,由于操作不当,会引起误差。下列情况一定会使所配溶液浓度偏低的是( )
①用天平称量时,被称量物与砝码的位置放颠倒了
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,仰视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①②⑤ B.②④⑤ C.③④⑤ D.①②④⑤
B
解析 天平称量时使用游码,被称量物与砝码的位置放颠倒了,物质的质量=砝码的质量-游码的质量,质量偏小,浓度偏低,若不使用游码,物质的质量=砝码的质量,对质量无影响,浓度不变;定容时,仰视容量瓶的刻度线,体积偏大,浓度偏低;定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,体积偏大,浓度偏低。
微专题6 物质的量浓度的计算
微专题7 阿伏加德罗常数的正误判断
微专题6 物质的量浓度的计算
2.溶液稀释和混合的计算
(1)溶液稀释的计算
稀释前后溶质的物质的量和质量都保持不变。
c(浓)·V(浓)=c(稀)·V(稀),
m(浓)·w(浓)=m(稀)·w(稀)。
(2)混合规律
①语言描述:同一溶质不同浓度的两溶液相混合,混合后,溶质的总物质的量(或总质量)等于混合前两溶液中溶质的物质的量之和(或质量之和)。
②公式:c1·V1+c2·V2=c(混)·V(混)
3.溶质质量分数w与物质的量浓度c之间的换算
类型一 气体溶于水所得溶液中物质的量浓度的计算
[典例1] (2021·周口高一检测)标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A
答案 3 mol/L
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.25 mol·L-1 D.0.5 mol·L-1
解析 设Na+浓度为x,根据电荷守恒可知,0.3 mol·L-1×1+x×1=0.4 mol·L-1×2,x=0.5 mol·L-1。
D
2.用100 mL 0.3 mol·L-1的氢氧化钠溶液和300 mL 0.25 mol·L-1的硫酸混合加水稀释到500 mL,混合液中H+的物质的量浓度为( )
A.0.36 mol·L-1 B.0.24 mol·L-1
C.0.45 mol·L-1 D.0.09 mol·L-1
解析 设混合后溶质硫酸的物质的量浓度为a,则0.3 L×0.25 mol·L-1-(0.1 L×0.3 mol·L-1)÷2=0.5 L×a,解得:a=0.12 mol·L-1,混合稀释后溶液中c(H+)=2c(H2SO4)=2×0.12 mol·L-1=0.24 mol·L-1。
B
C
4.(2021·阜新高一检测)取100 mL 0.3 mol·L-1的硫酸溶液和200 mL 0.25 mol·L-1的硫酸溶液混合后加水稀释至400 mL,该混合溶液中硫酸的物质的量浓度是( )
A.0.1 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
B
5.下图是某市售盐酸试剂瓶标签上的部分数据。
则该盐酸的物质的量浓度是( )
A.3 mol·L-1 B.8.4 mol·L-1 C.11.8 mol·L-1 D.0.5 mol·L-1
C
盐酸
化学式:HCl
相对分子质量:36.5
外观:合格
密度:1.18 g·cm-3
HCl的质量分数:36.5%
符合GB622-89
微专题7 阿伏加德罗常数的正误判断
1.解答阿伏加德罗常数正误判断类题目的思维模型
2.阿伏加德罗常数正误判断中常见的陷阱
考查方向 注意问题
气体摩尔体积的适用条件 凡是出现物质的体积,首先考虑是否为气体,再考虑条件是否为标准状况(0 ℃,1.01×105 Pa)
物质的聚集状态 在标准状况下是液体或固体的物质,有H2O、酒精、苯、CCl4、SO3、NO2等
物质的微观结构 ①注意某些物质分子中的原子个数,如Ne、O3、P4等;②注意一些物质中的离子数目,如Na2O2、NaHSO4等
1.下列有关阿伏加德罗常数(NA表示阿伏加德罗常数的值)的说法正确的是( )
A.标准状况下,32 g SO2中含有0.5NA个O2
B.常温常压下,11 g CO2中含有0.75NA个原子
C.标准状况下,NA个苯分子的体积约为22.4 L
D.1 L 0.3 mol/L的NaCl溶液中含有0.3NA个NaCl分子
解析 SO2中只含有SO2分子,不含O2;11 g CO2的物质的量是0.25 mol,含有0.75 mol原子,即0.75NA个原子;标准状况下,NA个苯分子为1 mol,其体积不是22.4 L;NaCl是离子化合物,由Na+和Cl-离子构成,不存在NaCl分子。
B
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.4.6 g Na与水完全反应生成2.24 L H2
B.0.1 mol/L MgCl2溶液中含有的Cl-数为0.2NA
C.1 mol氯气与足量的铜反应,转移电子数为NA
D.2.8 g CO和N2的混合气中,所含原子总数为0.2NA
D
解析 4.6 g Na的物质的量为0.2 mol,与水完全反应生成0.1 mol H2,在标准状况下的体积为2.24 L,其他条件下则不一定,A项错误;题目未指明0.1 mol/L MgCl2溶液的体积,无法确定所含Cl-数目,B项错误;1 mol Cl2与铜反应生成1 mol CuCl2,转移电子数为2NA,C项错误;CO和N2的摩尔质量都是28 g/mol,且均为双原子分子,2.8 g CO和N2的混合气体总物质的量为0.1 mol,则所含原子总数为0.2NA,D项正确。
3.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L氯气中所含的原子数为NA
B.常温常压下,22.4 L氢气中所含的电子数为2NA
C.4 ℃时,5.4 mL水中所含的水分子数约为0.3NA
D.100 mL 0.2 mol/L K2SO4溶液中所含离子总数为60NA
C
解析 常温常压下,11.2 L氯气的物质的量不是0.5 mol,则所含原子数不是NA,A错误;1个H2分子含有2个电子,常温常压下22.4 L氢气的物质的量不是1 mol,则所含电子数不是2NA,B错误;4 ℃时水的密度为1 g/mL,5.4 mL水的质量为5.4 g,其物质的量为0.3 mol,故所含水分子数为0.3NA,C正确;100 mL 0.2 mol/L K2SO4溶液中含有0.02 mol K2SO4,离子的总物质的量为0.06 mol,故溶液中所含离子总数为0.06NA,D错误。
1.配制一定物质的量浓度的硫酸溶液,不需用的仪器是( )
解析 实验室配制一定物质的量浓度的溶液,一定要用到的仪器是容量瓶、烧杯、玻璃棒、胶头滴管;若溶质为固体还需要托盘天平、药匙等仪器,若溶质为液体(或浓溶液)还需要量筒(或滴定管、移液管)等仪器。
C
2.在100 mL的溶液中溶有0.1 mol NaCl和0.1 mol MgCl2,此溶液中Cl-的物质的量浓度为( )
A.3 mol·L-1 B.2 mol·L-1
C.0.3 mol·L-1 D.0.2 mol·L-1
A
3.下列溶液中物质的量浓度为1 mol·L-1的是( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
D
4.用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是( )
A.定容时加水加多了,用滴管吸出溶液至刻度线
B.定容时仰视刻度线
C.没有洗涤溶解NaCl固体的烧杯和玻璃棒
D.称量NaCl固体时砝码上有杂质
D
解析 A项,用滴管吸出溶液使n(NaCl)减小,浓度偏低;B项,定容时仰视刻度线,溶液的体积偏大,浓度偏低;C项,未洗涤烧杯、玻璃棒,n(NaCl)减小,浓度偏低;D项,砝码上有杂质使本身质量偏大,称量NaCl的质量偏大,浓度偏高。
5.某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示。该小组欲配制450 mL 0.2 mol·L-1的稀硫酸溶液:
硫酸:
化学纯(CP)(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
(1)所需试剂瓶内硫酸溶液的体积为________ mL。
(2)所用量筒和容量瓶的规格为________和________。
(3)浓硫酸稀释时的操作是_____________________________________。
(4)下列为该小组的操作,可能导致配制溶液浓度偏高的是________。
A.移液前未冷却至室温 B.定容时加水多了,用滴管吸出
C.定容时俯视刻度线
(5)下图是该小组转移溶液的示意图,图中的错误是________________。
答案 (1)5.4 (2)10 mL量筒 500 mL容量瓶
(3)向烧杯中加入一定量的水,再将浓硫酸沿烧杯内壁慢慢倒入,并用
玻璃棒不断搅拌 (4)AC (5)①未用玻璃棒引流;②未采用500 mL容量瓶
解析 欲配制450 mL的H2SO4溶液需选取500 mL的容量瓶,在转移溶液时应用玻璃棒引流。
1.(2021·临沂高一检测)下列有关容量瓶的使用叙述正确的是( )
A.容量瓶不能用作长期贮存试剂的容器,但是当溶液配制完后,可以用来存放配制的试剂
B.用500 mL的容量瓶可以直接配制480 mL溶液
C.容量瓶不可以用来溶解固体,但是可以用来稀释浓的溶液
D.容量瓶不可以用来加热,但是锥形瓶可以用来加热
解析 容量瓶是配制一定物质的量浓度溶液的专用仪器,不能用来溶解固体、不能用于稀释浓溶液、不能长期贮存溶液、不能加热。
D
2.下列溶液中,跟100 mL 0.5 mol·L-1 NaCl溶液中所含的Cl-物质的量浓度相同的是( )
A.100 mL 0.5 mol·L-1 MgCl2溶液
B.200 mL 0.25 mol·L-1 AlCl3溶液
C.50 mL 1 mol·L-1 NaCl溶液
D.25 mL 0.5 mol·L-1 HCl溶液
解析 物质的量浓度与溶液的体积无关,100 mL 0.5 mol·L-1 NaCl溶液中c(Cl-)=0.5 mol·L-1,而A、B、C、D项中,c(Cl-)分别为1 mol·L-1、0.75 mol·L-1、1 mol·L-1、0.5 mol·L-1,D项正确。
D
3.如图表示配制一定物质的量浓度的NaCl溶液的部分操作示意图,其中有错误的是( )
解析 定容时,视线应与凹液面的最低点在同一水平线上。
C
4.标准状况下,2.24 L HCl气体溶于水中配成100 mL溶液,溶液密度为ρ g·mL-1,则所得溶液中溶质的物质的量浓度为( )
A
5.如图是实验室配制好的两瓶NaOH溶液的标签(14%的NaOH溶液的密度为1.14 g·cm-3)。
14%的NaOH溶液的物质的量浓度及从瓶中取出20 mL该溶液中含有溶质的质量分别是( )
A.4.0 mol·L-1 3.2 g B.2.0 mol·L-1 3.2 g
C.4.0 mol·L-1 6.4 g D.2.0 mol·L-1 6.4 g
A
6.下列有关仪器使用方法或实验操作正确的是( )
A.洗净的容量瓶可以放进烘箱中烘干
B.配制溶液定容的操作图示:
C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏高
D.用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余的液体
C
解析 洗净的容量瓶不能放进烘箱中烘干,会影响其准确度,A错误;定容操作,应用胶头滴管定容,B错误;用容量瓶配制溶液,定容时俯视刻度线,使溶液体积偏小,所配溶液浓度偏高,C正确。用容量瓶配制溶液时,若加水超过刻度线,应重新配制,D错误。
7.实验室欲用Na2CO3·10H2O晶体配制100 mL 1 mol/L的Na2CO3溶液,下列说法正确的是( )
A.要完成实验需称取10.6 g Na2CO3·10H2O晶体
B.本实验需用到的仪器有天平、药匙、玻璃棒、烧杯、500 mL容量瓶
C.配制时若容量瓶不干燥,含有少量蒸馏水会导致溶液浓度偏低
D.定容时俯视刻度线会导致溶液浓度偏高
D
8.(2021·荆州高一检测)下列关于0.1 mol·L-1 Ba(NO3)2溶液的正确说法是( )
B
9.实验室里需用480 mL 0.1 mol·L-1的硫酸铜溶液,若选取500 mL容量瓶进行配制,以下操作中正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾配成500 mL溶液
D
解析 500 mL容量瓶只能配500 mL溶液,因而配500 mL 0.1 mol·L-1 CuSO4溶液时,需CuSO4的质量为:0.1 mol·L-1×0.5 L×160 g·mol-1=8 g或需CuSO4·5H2O的质量为:0.1 mol·L-1×0.5 L×250 g·mol-1=12.5 g,加水配成500 mL溶液。
10.在溶液的配制过程中会引起浓度偏高的是( )
A.配制500 mL 0.1 mol/L 的硫酸铜溶液,用托盘天平称取胆矾8.0 g
B.配制NaOH溶液时,NaOH固体放在烧杯中称量时间过长
C.定容时,仰视刻度线
D.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
D
解析 配制500 mL 0.1 mol/L 的硫酸铜溶液,需要称取胆矾的质量为0.5 L×0.1 mol/L×250 g/mol=12.5 g,称取的质量偏少,浓度偏低,故A错误;配制NaOH溶液时,NaOH固体放在烧杯中称量时间过长,会吸收空气中的水蒸气和二氧化碳,导致氢氧化钠的质量偏少,浓度偏低,故B错误;定容时,仰视刻度线,导致溶液的体积偏大,浓度偏低,故C错误;配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容,导致溶液的正常温度下体积偏小,浓度偏高,故D正确。
11.将117 g NaCl溶于水配制成1 L溶液,
(1)该溶液中NaCl的物质的量浓度为________,溶液中Cl-的物质的量浓度为________。
(2)配制1 mol·L-1的NaCl溶液500 mL,需该溶液的体积为________。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为________,通入HCl气体的体积(标准状况下)为________。
答案 (1)2 mol·L-1 2 mol·L-1
(2)0.25 L (3)1 mol·L-1 22.4 L
12.将24.4 g氢氧化钠固体溶于水配成100 mL溶液,其密度为1.219 g·mL-1。
(1)该溶液中氢氧化钠的物质的量浓度为________。
(2)该溶液中氢氧化钠的质量分数为________。
(3)从该溶液中取出10 mL,含氢氧化钠的质量为________,含氢氧化钠的物质的量为________。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为________。
答案 (1)6.1 mol·L-1 (2)20%
(3)2.44 g 0.061 mol (4)0.61 mol·L-1
13.某校化学兴趣小组在实验室中发现一瓶溶液,标签上标有“CaCl2 0.1 mol·L-1”的字样,下面是该小组成员对该溶液的叙述,正确的是( )
A.配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中
B.Ca2+和Cl-的物质的量浓度都是0.1 mol·L-1
C.从试剂瓶中取该溶液的一半,则所得溶液的物质的量浓度为0.05 mol·L-1
D.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1 mol·L-1
D
解析 A项,所得溶液的体积不是1 L,错误;B项,Cl-的浓度是0.2 mol·L-1,Ca2+的浓度是0.1 mol·L-1,错误;C项,溶液具有均一性,所得溶液的浓度仍为0.1 mol·L-1,错误;D项,溶液中Cl-的浓度为0.2 mol/L,稀释1倍,浓度减半,故稀释后Cl-的浓度为0.1 mol·L-1,正确。
14.相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是( )
D
15.实验室欲用氢氧化钠固体配制1.0 mol·L-1的氢氧化钠溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
⑨摇动
其正确的操作顺序为__________________________________________。
必须用到的玻璃仪器有烧杯、胶头滴管、_______________________。
②①③⑧⑤⑥⑨⑦④
250 mL容量瓶、玻璃棒
解析 (1)配制1.0 mol·L-1 氢氧化钠溶液的步骤:计算所需氢氧化钠固体的质量→用托盘天平称量→在烧杯中溶解→冷却至室温→向容量瓶中转移溶液→洗涤烧杯及玻璃棒→摇动容量瓶→向容量瓶中加水定容→上下颠倒摇匀容量瓶。根据实验步骤即判断出所用仪器还有250 mL容量瓶和玻璃棒。
(2)某同学欲称量氢氧化钠的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g 氢氧化钠。
27.4
10.0
解析 (2)该同学将砝码与烧杯放反了,所以称得烧杯的质量为(20 g+10 g)-2.6 g=27.4 g,应称氢氧化钠质量为1.0 mol·L-1×0.25 L×40 g·mol-1=10.0 g。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________(填字母)。
A.所用氢氧化钠已经潮解
B.向容量瓶中加水未到刻度线
C.有少量氢氧化钠溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g氢氧化钠(1 g以下用游码)时误用了“左码右物”方法
查漏
B
解析 (3)使用容量瓶的第一步操作为查漏。(4)A项,所称氢氧化钠的质量(物质的量)偏小,浓度偏低;B项,所得溶液体积偏小,浓度偏高;C项,所得溶液NaOH的物质的量偏小,浓度偏低;D项,左码右物称量时,m物+m游码=m砝码,故所称物体质量偏小,浓度偏低。
Thanks!
本讲内容结束
