第三章 第一节 铁及其化合物 第二课时 铁盐和亚铁盐(共113张ppt)
文档属性
| 名称 | 第三章 第一节 铁及其化合物 第二课时 铁盐和亚铁盐(共113张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 16:19:26 | ||
图片预览











文档简介
(共113张PPT)
第二课时 铁盐和亚铁盐
第三章 铁 金属材料
【课程标准要求】
1.结合真实情境中的应用实例或通过实验探究,了解铁盐和亚铁盐的主要性质,了解它们在生产、生活中的应用。
2.能从物质的类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化,设计实验进行初步验证,并能分析、解释有关实验现象。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
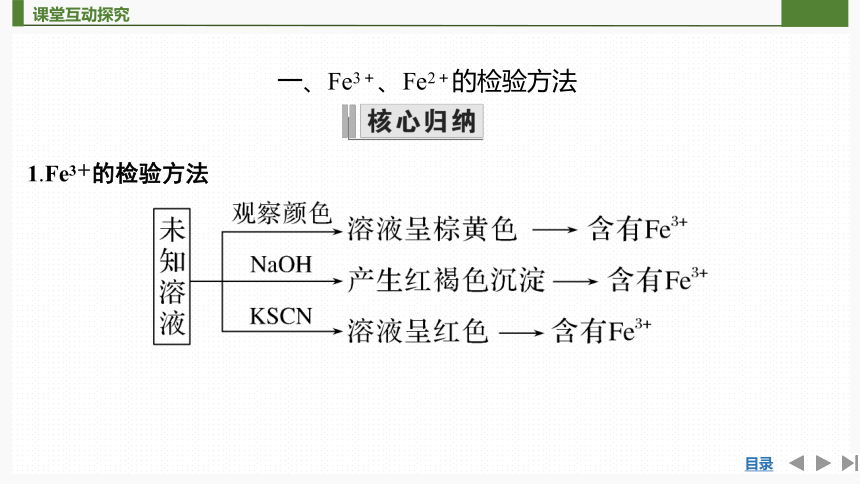
一、Fe3+和Fe2+的检验方法
(1)滴加KSCN溶液,溶液直接变红色,该溶液中含有__________。
(2)滴加KSCN溶液,无明显现象,再加新制氯水溶液变红色,该溶液中含有__________。
Fe3+
Fe2+
【微自测】
1.下列描述中,正确的打“√”,错误的打“×”。
(1)向某溶液中滴加KSCN溶液,溶液变成红色,则该溶液中一定含有Fe3+,一定不含Fe2+( )
(2)向某溶液中先滴加几滴氯水,再滴加KSCN溶液,溶液变成红色,则该溶液中一定含有Fe2+( )
(3)向含Fe3+的溶液中滴加KSCN溶液,溶液中产生红色沉淀( )
答案 (1)× (2)× (3)×
二、铁盐、亚铁盐的性质与转化
(1)Fe2+与Fe3+的转化实验(如图)
(2)现象与结论
①在盛有氯化铁溶液的试管中加适量铁粉振荡后,溶液变成______色,再加KSCN溶液,溶液________,再加入氯水后,溶液变成____色。
②上述实验中有关反应的离子方程式是2Fe3++Fe===3Fe2+、2Fe2++Cl2===2Fe3++2Cl-。
③由上述实验可知:Fe3+遇到______的还原剂,会被还原成Fe2+;Fe2+在______氧化剂的作用下,会被氧化成Fe3+。
浅绿
不变色
红
较强
较强
【微自测】
2.下列描述中,正确的打“√”,错误的打“×”。
(1)在FeCl2溶液中加入锌片,溶液逐渐由浅绿色变为无色( )
(2)向FeCl2溶液中滴加氯水,溶液变为棕黄色,则Fe2+具有还原性( )
(3)向FeCl2溶液中滴加酸化的H2O2溶液,溶液变为棕黄色,并产生大量无色气体( )
(4)在FeCl3溶液中加入足量铁粉,溶液由棕黄色变为浅绿色,则Fe具有还原性( )
答案 (1)√ (2)√ (3)× (4)√
二、铁盐、亚铁盐的性质与转化
一、Fe3+、Fe2+的检验方法
一、Fe3+、Fe2+的检验方法
1.Fe3+的检验方法
2.Fe2+的检验方法
3.三种不同情境下检验Fe2+的注意事项
1.为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH溶液 B.铁片
C.KSCN溶液 D.石蕊溶液
解析 FeCl2变质会被氧化为FeCl3,Fe3+遇KSCN溶液变红色,故可用KSCN溶液检验溶液是否变红色,来判断是否变质。
C
2.下列各试剂中,不能用来鉴别FeSO4和Fe2(SO4)3的是( )
A.NaOH溶液 B.酸性KMnO4溶液
C.BaCl2溶液 D.KSCN溶液
解析 A项,FeSO4溶液遇NaOH溶液生成白色沉淀并迅速变为灰绿色,最后变成红褐色,Fe2(SO4)3与NaOH溶液生成红褐色沉淀,可鉴别,错误;B项,亚铁离子能使酸性KMnO4溶液褪色,可鉴别,错误;C项,二者均与氯化钡溶液反应生成白色硫酸钡沉淀,不能鉴别,正确;D项,加入KSCN溶液呈红色的是硫酸铁,没有明显现象的是硫酸亚铁,可鉴别,错误。
C
3.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液,溶液变成红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,再加入KSCN溶液,溶液变成红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,立刻得到红褐色沉淀,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液,得到白色沉淀,一段时间后观察到沉淀颜色逐渐变成红褐色,说明原溶液中只含有Fe2+,不含Mg2+
C
解析 滴入KSCN溶液,溶液变成红色,说明原溶液中含有Fe3+,但不能说明原溶液中不含Fe2+,A项错误;向某溶液中通入Cl2,再加入KSCN溶液,溶液变成红色,不能说明原溶液中含有Fe2+,因为如果原溶液中含有Fe3+,无论其是否含有Fe2+,都会出现相同的现象,B项错误;加入NaOH溶液,立刻得到红褐色沉淀Fe(OH)3,说明原溶液中含有Fe3+,C项正确;D项中操作和现象说明原溶液中肯定含有Fe2+,可能含有Mg2+,因为若生成Mg(OH)2白色沉淀,会被红褐色沉淀掩盖,D项错误。
二、铁盐、亚铁盐的性质与转化
[实验1]
FeSO4溶液与氯水反应:
向加有KSCN溶液的FeSO4溶液中滴加氯水,溶液变成红色。
1.写出上述颜色变化涉及反应的离子方程式,从氧化还原的角度判断含铁物质在反应中表现什么性质?
提示 2Fe2++Cl2===2Fe3++2Cl-、Fe3++3SCN-===Fe(SCN)3;Fe2+表现还原性。
[实验2]
FeCl3溶液与锌粉的反应
向FeCl3溶液中加入少量锌粉,溶液变成浅绿色,再加入足量锌粉,溶液变成无色。
2.写出上述颜色变化涉及反应的离子方程式,从氧化还原的角度判断含铁物质在反应中表现什么性质?
提示 2Fe3++Zn===2Fe2++Zn2+,Fe3+表现氧化性;
Fe2++Zn===Zn2++Fe,Fe2+表现氧化性。
[实验3] 利用覆铜板制作图案
实验原理 利用FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀
实验操作 取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案
实验现象 用油性笔画出的图案处不被腐蚀,洗净后板上留下设计的图案
3.写出上述用“腐蚀液”制作图案过程中发生反应的化学方程式,从氧化还原的角度判断含铁物质在反应中表现什么性质?
提示 2FeCl3+Cu===CuCl2+2FeCl2;Fe3+表现氧化性。
1.从氧化还原反应视角分析“铁三角”转化关系
Fe、Fe2+、Fe3+之间的相互转化关系如图(常称为“铁三角”)所示。
(1)Fe只具有还原性,被氧化成Fe2+或Fe3+。
(2)Fe2+既有氧化性又具有还原性
(3)Fe3+具有较强的氧化性,可被还原为Fe2+或Fe
(1)金属阳离子被还原不一定得到金属单质,如Fe3+被还原时可能得到的是Fe2+。
(2)虽然Fe2+既有氧化性又有还原性,但以还原性为主要特征。
(3)不同价态铁元素间的转化合理选择氧化剂判断:Fe0→Fe+2需要失去2个电子,容易转化,需弱氧化剂即可,而Fe+2→Fe+3只需失去1个电子,需要强氧化剂才能实现。
2.“铁三角”转化关系的应用
(1)含Fe2+、Fe3+的分离、除杂方法
①FeCl3溶液(FeCl2):加足量氯水或通入足量Cl2。
②FeCl2溶液(FeCl3):加足量铁粉,充分反应后过滤。
③FeSO4溶液(CuSO4):加足量铁粉,充分反应后过滤。
④除去废水中Fe2+,先将废水中的Fe2+氧化为Fe3+(如通入Cl2或加入H2O2),再调节溶液的pH,使Fe3+转化为红褐色的Fe(OH)3沉淀过滤除去。
4.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应 ③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.①③ C.①②③ D.全部
B
解析 ①中Cl2的氧化性强,它能将铁氧化为FeCl3,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原为氯化亚铁;②中Fe与稀硫酸反应只能生成FeSO4;③在溶液中Fe2+被Cl2氧化生成Fe3+;④中Fe与盐酸反应生成FeCl2和H2、Fe2O3与盐酸反应生成FeCl3和水,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
5.制印刷电路板铜常用氯化铁溶液作为“腐蚀液”。向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列判断一定错误的是( )
A.烧杯中有铜、无铁
B.烧杯中铁、铜都无
C.烧杯中铁、铜都有
D.烧杯中有铁、无铜
D
解析 烧杯中有铜、无铁,说明铁已全部反应完,铜部分反应或没反应,符合逻辑,故A不选;烧杯中铁、铜都无,说明铁全部反应完后,Fe3+也将铜全部氧化了,符合逻辑,故B不选;烧杯中铁、铜都有,说明Fe3+只氧化了部分铁就没有了,故C不选;烧杯中有铁、无铜,说明铜先被氧化了,不符合反应的先后顺序,故D选。
6.为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
A
实验操作 实验现象 离子反应 实验结论
A 在氯化亚铁溶液中通入氯气 溶液由浅绿色变成棕黄色 2Fe2++Cl2===2Fe3++2Cl- Fe2+具有还原性
B 在氯化亚铁溶液中加入锌片 溶液由浅绿色变成无色 Fe2++Zn===Fe+Zn2+ Zn具有还原性
C 在氯化铁溶液中加入铁粉 溶液由棕黄色变成浅绿色 Fe3++Fe===2Fe2+ 铁单质具有还原性
D 在氯化铁溶液中加入铜粉 溶液由蓝色变成棕黄色 2Fe3++Cu===2Fe2++Cu2+ Fe3+具有氧化性
解析 氯气能够将Fe2+(浅绿色)氧化为Fe3+(棕黄色),A项正确;锌置换出铁,锌逐渐溶解,溶液变为无色,且析出黑色固体,实验现象错误,实验结论应是Fe2+具有氧化性,B项错误;C项,离子方程式错误,正确的离子方程式应为2Fe3++Fe===3Fe2+,C项错误;D项,实验现象应该是铜粉逐渐溶解,溶液由棕黄色变为蓝色,D项错误。
微专题8 补铁剂中铁元素的探究及应用
微专题9 利用“价—类”二维图认识铁及其化合物的关系
微专题8 补铁剂中铁元素的探究及应用
某品牌补铁剂(主要成分是FeSO4),商标如下图
铁是人体必需的微量元素之一,铁元素在人体中具有造血功能,参与血红蛋白、细胞色素及各种酶的合成。铁能形成血红素,而血红素在人体中主要起供氧的作用,它能够携带氧气,供应给人体的各个细胞和器官,让人的身体的各个部位都能正常运转。人体缺铁时,常会服用补铁剂来补充铁元素,补铁剂与维生素C同时服用,补铁效果更好。
查阅资料可知,Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色。
1.补铁剂中铁元素的化合价是多少?为什么补铁剂与维生素C一起服用效果更好?
提示 补铁剂中铁元素的化合价是+2价,具有还原性,因维生素C的还原性比Fe2+强,因此补铁剂与维生素C一起服用,可以防止补铁剂中的Fe2+被氧化。
2.如何检验补铁剂中的铁元素的存在形式?描述实验操作和现象。
提示 取密封的补铁剂(若为固体先用煮沸的蒸馏水溶解)于试管中,向其中先加入KSCN溶液,无明显现象,再向溶液中加入氯水,溶液变为红色。
3.按照如下方法,对补铁剂进行实验,出现什么现象说明补铁剂已经部分变质。
提示 甲:高锰酸钾溶液的紫红色褪去;乙:溶液变为红色。
1.食品中铁元素的测定问题总结
(1)检验铁元素是否存在的依据:把样品中的铁元素转变为Fe3+,Fe3+遇KSCN溶液变为红色。
(2)实验中必须用到的试剂为双氧水(或氯水)、KSCN溶液。
(3)实验操作中根据选择的不同样品,可以考虑采用灼烧的方法,也可以用研磨的方法,也可以考虑用溶剂溶解,最后得到的试液一定要加入双氧水(或氯水)将其中的铁元素氧化为三价铁,然后加入KSCN溶液,看是否变红来检验是否存在铁元素。
2.补铁剂存放及使用的注意事项
(1)补铁剂的有效成分是亚铁盐(如FeSO4),Fe2+被氧化为Fe3+而失去补铁作用,因此需密封、隔绝O2存放,服用补铁剂时搭配维生素C可以增强补铁效果,这是因为维生素C可将Fe3+还原为Fe2+。
(2)服用补铁剂时不能和茶水同饮,因为茶水中含大量的鞣酸,鞣酸与Fe2+反应生成鞣酸亚铁,它的性质不稳定,很快被氧化成鞣酸铁而呈蓝黑色。
1.(2021·朝阳区模拟)探究补铁剂[主要成分:氯化血红素(含+2价铁)、富锌蛋白粉、维生素C、乳酸、葡萄糖浆]中铁元素是否变质。先取少量补铁剂,用酸性丙酮溶解后制成溶液。下列说法不正确的是( )
实验Ⅰ 取待测液,加入少量KSCN溶液,无明显现象;再加入少量H2O2,溶液不变红
实验Ⅱ 取实验Ⅰ所得溶液,再加入少量KSCN溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色
实验Ⅲ 取实验Ⅰ所得溶液,加入少量盐酸溶液,无明显现象,继续加入H2O2至过量,溶液先变红后褪色
A.实验Ⅰ中加入KSCN溶液无明显现象,与KSCN溶液的用量无关
B.实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素C还原了
C.实验Ⅲ中溶液红色褪去,可能是H2O2将SCN-氧化了
D.实验说明,该补铁剂中+2价铁在酸性条件下才能被H2O2氧化
答案 D
解析 取实验Ⅰ所得溶液,再加入少量KSCN溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色,说明与KSCN溶液的用量无关,故A正确;维生素C具有还原性,实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素C还原了,故B正确;H2O2具有强氧化性,SCN-具有还原性,继续加入H2O2至过量,溶液先变红后褪色,溶液红色褪去,可能是H2O2将SCN-氧化了,故C正确;没有对照实验,无法说明中性、碱性条件下,该补铁剂中+2价铁能否被H2O2氧化,故D错误。
2.铁是人体必需的微量元素之一,补铁剂中的Fe2+在空气中很容易被氧化成Fe3+,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂和维生素C一起服用的科学性。
[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象](1)A试管中溶液变________色,B试管中无明显现象。
[实验结论](2)维生素C具有________(填“氧化性”或“还原性”),能防止Fe2+被氧化为Fe3+,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用](3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有________(填“酸性”或“碱性”)。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意_______________________________________________(写一条即可)。
答案 (1)红 (2)还原性 (3)酸性
(4)避免与氧化性物质接触(或避免与碱性物质接触)
解析 (1)Fe3+与SCN-结合而使溶液呈红色。(2)向FeCl3溶液中加入足量维生素C后,再加入KSCN溶液,溶液不变红色,说明Fe3+被维生素C还原,即维生素C具有还原性。(3)将维生素C与NaHCO3放入水中,立即有大量CO2产生,说明维生素C具有酸性。(4)由实验(2)、(3)可知,维生素C具有还原性和酸性,故烹调蔬菜时应避免与氧化性物质或碱性物质接触。
3.(2021·台州期末)某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验:
Ⅰ.向试管中加入液体补血剂2 mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色。学生甲认为此补血剂含铁量很低,属不合格产品。
(1)你认为学生甲的观点合理吗?__________________________________
解析 (1)因补血剂的成分是Fe2+,滴加KSCN溶液,溶液显示淡红色,说明Fe3+的浓度低;
不合理
Ⅱ.学生乙认为还应进一步探究实验,他将学生甲所得溶液分成三份,分别加入了氯水、溴水、碘水。发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化。请回答下列问题:
(2)根据乙的上述实验说明补血剂中的铁为________价。
(3)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因
___________________________________________________________。
(4)请写出加入氯水后对应的离子反应方程式____________________________。
(5)请根据乙同学的实验现象进一步推断,氯、溴的单质可将铁单质氧化成________价铁,而Fe与I2反应的产物应该是________。
+2
有少量的亚铁离子被氧化
Cl2+2Fe2+===2Cl-+2Fe3+
+3
FeI2
解析 (2)因加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+,而Fe2+能被氧化剂如氯气、液溴所氧化,则原溶液中铁的化合价为+2价;(3)因Fe2+氧化生成Fe3+,Fe3+遇SCN-变红,所以向补血剂溶液中滴加KSCN溶液,显示淡红色的原因有少量的亚铁离子被氧化;(4)因Fe2+与Cl2反应生成Fe3+和Cl-:Cl2+2Fe2+===2Cl-+2Fe3+;(5)根据加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+;加入碘水的试管颜色无明显变化,说明Fe2+与I2不反应;
Ⅲ.学生丙也做了与学生甲同样的实验后,将所得的淡红色溶液分成两份继续进行实验:
试回答下列问题:
(6)请写出丙的实验①中淡红色褪去的离子方程式__________________________。
(7)关于③中的实验现象,丙同学提出了假设:过量的双氧水将SCN-氧化了。请你设计一个实验方案验证丙的假设________________________________________
_____________________________________________________________________。
Fe+2Fe3+===3Fe2+
取少量加入过量双氧水后血红色褪去的溶液,
往其中加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了
解析 (6)加入少量铁粉,将Fe3+还原为Fe2+,淡红色褪去,反应的离子方程式为:Fe+2Fe3+===3Fe2+;(7)根据Fe3+检验方法,溶液中继续加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了。
微专题9 利用“价—类”二维图认识铁及其化合物的关系
1.构建铁及其化合物的“价—类”二维图
(1)同价态的铁及其化合物之间的转化
从物质分类的角度理解铁及其化合物的性质与转化
①FeO、Fe2O3都是碱性氧化物,都能与酸发生反应。
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
②FeSO4和FeCl3都属于盐,都能和碱发生反应生成氢氧化物沉淀。
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
③Fe(OH)2和Fe(OH)3都属于碱,都能与酸发生中和反应。
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
(2)不同价态的铁及其化合物的转化。从元素化合价的角度理解铁及其化合物的氧化性和还原性。
2.元素及其化合物“价—类”二维视角的应用
物质类别和元素价态,是学习元素及其化合物性质的重要认识视角。
(1)基于物质类别和元素价态,可以更全面预测物质的性质。例如Fe2O3物质类别属于金属氧化物,可以预测它可能与酸发生反应;从元素价态来看,Fe2O3中铁元素是+3价,为铁元素的高价态,可以预测它具有氧化性,可能与具有还原性的物质发生反应。
(2)基于物质类别和元素价态,还可以设计物质间转化制备的途径。例如,要想从单质铁获得FeSO4,既可以基于物质类别设计从金属单质与酸反应、金属单质与盐的置换反应获得,还可以基于元素价态设计单质铁与+3价铁反应得到+2价铁。
1.元素的“价—类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的“价—类”二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是( )
答案 C
解析 铁与高温水蒸气反应时,生成Fe3O4,A错误;FeO是一种黑色粉末,不稳定,在空气中受热,迅速反应生成Fe3O4,B错误;加热Fe(OH)3分解生成Fe2O3,而Fe(OH)3不溶于水,D错误。
2.如图为铁及其化合物的“价—类”二维图。利用如图可以从不同角度研究含铁物质的性质及其转化关系。下列分析结果不正确的是( )
A.二维图缺失的类别①应填“单质”,
化学式②应填“Fe(OH)3”
B.从物质类别分析,Fe2O3属于碱性氧
化物,可以与稀盐酸反应
C.从化合价角度分析,FeO既有氧化性又有还原性
D.从物质转化角度分析,Fe2O3和FeCl3都可以通过一步反应直接转化成②
D
解析 铁单质的化合价为0,二维图缺失的类别①单质;三价铁形成的氢氧化物是氢氧化铁,则化学式②Fe(OH)3,A正确;从物质类别分析,Fe2O3属于碱性氧化物,可以与稀盐酸反应生成氯化铁和水,B正确;从化合价角度分析,FeO既有还原性又有氧化性,C正确;氧化铁是碱性氧化物,不溶于水不能一步反应生成氢氧化铁,FeCl3可以通过一步反应和氢氧化钠溶液反应,直接转化成氢氧化铁,D错误。
3.铁及其化合物的“价—类”二维图如下。
回答下列问题:
(1)预测Fe2+既有氧化性又有还原性,其依据是
___________________________________________________________。
(2)检验溶液中的Fe3+,常用的试剂是______________。
解析 (1)Fe2+中Fe元素显+2价,处于中间价态,既有氧化性又有还原性。
铁元素为+2价,处于中间价态
KSCN溶液
(3)氧化铁和铝粉可用于野外焊接钢轨,发生置换反应,用化学方程式表示反应原理___________________________________________________________。
(4)白色的Fe(OH)2在空气中极不稳定,最终变为红褐色物质,请解释其原因(用化学方程式回答)______________________________________________。
(5)向FeCl2溶液中滴加氯水,反应的离子方程式是
___________________________________________________________。
解析 (3)氧化铁与铝粉发生置换反应,生成Fe和Al2O3,结合得失电子守恒和原子守恒写出化学方程式。(4)Fe(OH)2具有较强还原性,易被空气中的O2氧化,最终生成红褐色的Fe(OH)3,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe2++Cl2===2Fe3++2Cl-
1.能将溶液中的Fe3+转化为Fe2+的是( )
A.Cu B.NH3·H2O C.Cl2 D.KSCN
解析 能将溶液中的Fe3+转化为Fe2+的物质具有还原性,Cu是常见的还原剂,氯气常做氧化剂,铁离子和氨水以及硫氰化钾之间发生复分解反应。
A
2.要除去FeCl2溶液中少量的FeCl3,可行的方法是( )
A.滴入KSCN溶液
B.通入氯气
C.加入适量铜粉并过滤
D.加入适量铁粉并过滤
解析 KSCN溶液只能检验Fe3+的存在,A错误;通入氯气将FeCl2氧化为FeCl3,B错误;加入铜粉发生Cu+2Fe3+===2Fe2++Cu2+,引入新杂质Cu2+,C错误;加入铁粉发生Fe+2Fe3+===3Fe2+,过滤除去剩余铁粉,得到纯净FeCl2溶液,D正确。
D
3.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )
A.只有④ B.只有③ C.③和④均错 D.全部错误
C
解析 ①铁离子与铁反应生成浅绿色的亚铁离子,故①正确;②铁离子与硫氰化钾溶液反应显红色,据此能够检验铁离子,故②正确;③硫酸铜与氯化铁不发生反应,混合后溶液不会变成无色,故③错误;④氯化铁与硝酸银反应生成白色氯化银沉淀,该性质不是铁离子的性质,故④错误;⑤铁离子与氢氧化钠溶液反应生成红褐色氢氧化铁沉淀,据此可以检验是否存在铁离子,故⑤正确。
4.已知如下三个实验均能发生化学反应:
下列判断正确的是( )
A.实验①中铁作还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
A
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中
解析 实验①中铁作还原剂,则氧化性:Cu2+>Fe2+;实验②中Fe2+只表现还原性;实验③中发生的反应为2FeCl3+Cu===2FeCl2+CuCl2,该反应不是置换反应,分析可知氧化性:Fe3+>Cu2+。综上分析可知氧化性:Fe3+>Cu2+>Fe2+。
5.(1)某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用上述所给物质写出体现Fe2+具有还原性的化学方程式:
___________________________________________________________。
解析 (1)在反应中Fe2+作还原剂,体现其还原性,因此应选择氧化剂,所以选用氯水,发生的反应为2FeCl2+Cl2===2FeCl3。
2FeCl2+Cl2===2FeCl3
(2)设计实验方案,完成下列表格。
探究内容 探究Fe3+具有氧化性
实验方案 取少量0.1 mol·L-1的FeCl3溶液,向溶液中加入足量铁粉,再加入少量KSCN溶液
实验现象 加入铁粉后,溶液颜色变为________;加入KSCN溶液后,溶液________
(3)该兴趣小组为探究“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,该反应的离子方程式为_____________________________________________。
浅绿色
不变色
Fe2++Zn===Zn2++Fe
解析 (2)向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe===3Fe2+,所以溶液由棕黄色变为浅绿色。向FeCl2溶液中滴加硫氰化钾溶液不变红。(3)向FeCl2溶液中加入锌粉,发生离子反应为Zn+Fe2+===Fe+Zn2+。
1.向硫酸铁溶液中加入维生素C溶液,Fe3+转化为Fe2+,据此得到的结论错误的是( )
B
2.在离子方程式2Fe3++Fe===3Fe2+中,Fe3+可能代表的物质是( )
A.FeSO4 B.FeCl3 C.Fe2O3 D.Fe(OH)3
解析 硫酸亚铁在水中完全电离出亚铁离子,故A错误;氯化铁在水中完全电离出铁离子,故B正确;在书写离子方程式时氧化铁不能拆开,要写成化学式,故C错误;氢氧化铁难溶于水,在书写离子方程式时氢氧化铁不能拆开,要写成化学式,故D错误。
B
3.下列试剂不能使Fe2+转化为Fe3+的是( )
①氯水 ②NaCl溶液 ③酸性KMnO4 ④H2O2溶液 ⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④ C.②④⑤ D.②⑤⑥
解析 Fe2+具有还原性,要把Fe2+转化为Fe3+需要加入强氧化剂,题中氯水、酸性KMnO4溶液、H2O2溶液,具有强氧化性,可以使Fe2+转化为Fe3+,而NaCl溶液、盐酸、NaNO3溶液不具强氧化性,不能使Fe2+转化为Fe3+,故选②⑤⑥,选D。
D
4.(2021·金华方格外国语学校)下列关于“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]的说法不正确的是( )
A.具有较强的还原性,可使高锰酸钾酸性溶液褪色
B.可用于治疗缺铁性贫血,还可用于制造红色颜料铁红(Fe2O3)、磁性氧化铁(Fe3O4)等
C.加水溶解,再滴加KSCN溶液,若溶液变红色,说明摩尔盐已氧化变质
D.加水溶解,与过量NaOH溶液反应的离子方程式:Fe2++2OH-===Fe(OH)2↓
D
5.某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,然后白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+, 一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
D
解析 加入NaOH溶液,开始时有白色絮状沉淀生成,则不存在Fe3+,否则生成红褐色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,说明含有Fe2+,是亚铁离子的特征性质和反应现象,反应为:Fe2++2OH-===Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3,由于红褐色可掩盖白色,则不能证明是否含有Mg2+。
6.某同学模拟2019年春晚节目《魔壶》进行实验。将“魔壶”中盛有的FeCl3溶液依次倒入分别盛有约1 mL ①KSCN、②AgNO3、③NaOH浓溶液的3个烧杯中,实验现象各异。下列有关说法正确的是( )
A.烧杯①中,有血红色沉淀生成
B.烧杯②中,发生了氧化还原反应
C.烧杯③中,反应后所得分散系属于胶体
D.若用FeCl2溶液代替FeCl3溶液进行上述实验,实验现象各异
D
解析 FeCl3溶液和KSCN溶液反应生成血红色的硫氰化铁溶液,不是沉淀,A错误;FeCl3溶液和AgNO3溶液发生反应生成AgCl沉淀,该反应为复分解反应,不是氧化还原反应,B错误;FeCl3溶液和NaOH溶液反应生成的Fe(OH)3为红褐色沉淀,所以反应后所得分散系为悬浊液,不是胶体,C错误;若用FeCl2溶液代替FeCl3溶液进行上述实验,FeCl2溶液和KSCN溶液不反应,没有现象,FeCl2溶液和AgNO3溶液反应生成AgCl白色沉淀,FeCl2溶液和NaOH溶液反应生成Fe(OH)2白色沉淀,然后迅速变成灰绿色,最后变成红褐色,因此三个烧杯中的现象各异,D正确。
7.在FeCl3、CuCl2和HCl的混合液中加入铁粉,待反应结束,所剩固体滤出后不能被磁铁吸引,则反应后溶液不可能大量存在的阳离子是( )
A.H+ B.Fe3+ C.Fe2+ D.Cu2+
解析 铁粉先和FeCl3反应,再和CuCl2反应,最后再和HCl反应,充分反应后,所剩固体滤出后不能被磁铁吸引,则固体为Cu,因为三价铁离子会和Cu反应生成二价铁,所以一定有Fe2+,一定没有Fe3+;反应没有Fe剩余,所以H+和Cu2+可能过量,所以H+和Cu2+可能有;故不可能大量存在的阳离子是Fe3+。
B
8.富脂食品密封保存往往需要在包装袋内装一小包脱氧剂(有效成分是还原铁粉),某小组为探究脱氧剂中铁粉是否变质,取少量样品溶于稀盐酸,再进行下列实验,下列有关实验现象和结论的说法正确的是( )
A.若加盐酸时有气体产生,则证明脱氧剂未变质
B.若滴加KSCN溶液,无明显变化,再滴加氯水显血红色,则证明脱氧剂未变质
C.若滴加KSCN溶液,溶液显血红色,则证明脱氧剂已变质
D.若加入铜粉充分反应后,溶液呈蓝色,则证明脱氧剂已完全变质
C
解析 若加盐酸时有气体产生,说明样品中还有铁粉,但不证明脱氧剂未变质也可能部分变质,A错误;若滴加KSCN溶液,无明显变化,说明加入盐酸后的溶液中没有Fe3+,这可能是Fe+2Fe3+===3Fe2+,也可能是变质时Fe就被氧化为FeO,再滴加氯水显血红色,故不能证明脱氧剂未变质,B错误;若滴加KSCN溶液,溶液显血红色,说明加入盐酸后的溶液中含有Fe3+,所以证明脱氧剂已变质,C正确;若加入铜粉充分反应后,溶液呈蓝色,说明加入盐酸后的溶液中含有Fe3+,发生Cu+2Fe3+===Cu2++2Fe2+,但不能证明脱氧剂已完全变质,还可能是部分被氧化,D错误。
9.将2.8 g铁粉加入50 mL 3 mol·L-1的氯化铁溶液中,充分反应后,下列有关说法正确的是( )
A.铁粉有剩余,溶液呈浅绿色
B.往溶液中滴入KSCN溶液,不显红色
C.氧化产物和还原产物的物质的量之比为2∶1
D.反应后的溶液中Fe2+和Fe3+物质的量之比为3∶1
D
10.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+;
下列试剂及加入试剂顺序能达到实验目的的是( )
B
试剂 选项 甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
解析 甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。只有酸性KMnO4溶液符合条件,现象是紫色变浅(或褪去)。乙组,在Fe2+存在的条件下,检验Fe3+,用KSCN溶液检验Fe3+,Fe2+无干扰。
11.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为___________________________________________________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________________________________________________。
防止氯化亚铁被氧化
Cl2+2Fe2+===2Fe3++2Cl-
隔离空气(排除氧气对实验的影响)
解析 (1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;(2)氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+===2Fe3++2Cl-;(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响;
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于2支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在I-过量的情况下,溶液中仍含有________(填离子符号)。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________________。
Fe3+
2Fe2++H2O2+2H+===2Fe3++2H2O
解析 (4)①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,反应的离子方程式为:2I-+2Fe3+===2Fe2++I2,②第二支试管中加入1滴KSCN溶液,溶液变红,说明在I-过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+===2Fe3++2H2O。
12.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是___________________________________________________________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:___________________________________________________________。
解析 (1)检验Fe3+常用KSCN溶液,如果溶液变为血红色,说明含有Fe3+,反之不含有;(2)Cu和Fe3+反应的离子反应方程式为Cu+2Fe3+===2Fe2++Cu2+;
KSCN
溶液变成血红色
2Fe3++Cu===2Fe2++Cu2+
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
Fe
HCl
解析 (3)本实验目的是回收铜和制取纯净的FeCl3,向废液中加入过量的铁屑,然后过滤,滤液为FeCl2,滤渣为Cu和Fe,因为铁能与盐酸反应,铜和盐酸不反应,因此滤渣③中加入过量的盐酸,过滤,得到金属铜,两种滤液合并,通入氯气,把Fe2+氧化成Fe3+;
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:
___________________________________________________________。
C
2Fe2++Cl2===2Fe3++2Cl-
解析 (4)检验某溶液中不含Fe3+,含Fe2+,应先加KSCN溶液,溶液不变红,说明不含Fe3+,再加入氧化剂,溶液变红,说明原溶液中含Fe2+,不含Fe3+,氧化剂不能是酸性高锰酸钾溶液,因为高锰酸钾溶液能氧化KSCN,故选项C正确;(5)⑥为氯气,发生的离子反应方程式为2Fe2++Cl2===2Fe3++2Cl-。
13.某兴趣小组进行某补血剂中铁元素含量的测定实验流程如下:
B
14.用FeCl3溶液蚀刻印刷电路板,发生反应:2FeCl3+Cu===2FeCl2+CuCl2。分别取适量蚀刻后的溶液进行实验,下列实验结论一定正确的是( )
A.通入Cl2,再滴入KSCN溶液,溶液变红,说明所得溶液中已不含Fe2+
B.加入铁粉,充分反应,有固体剩余,说明所得溶液中已不含Fe3+
C.滴加足量稀硝酸,充分反应,则所得溶液中n(Fe3+)=2n(Cu2+)
D.滴加足量NaOH溶液,充分反应,则所得沉淀中n[Fe(OH)2]=3n[Cu(OH)2]
B
解析 检验Fe2+先加入KSCN溶液后通入氯气,如果先通入Cl2,Cl2能氧化Fe2+生成Fe3+而干扰Fe2+的检验,而无法判断原溶液是否含有Fe2+,故A错误;加入Fe粉,有固体剩余,无论固体是Fe还是Cu,都能与Fe3+反应,所以只要有固体剩余,反应后的溶液中一定不含Fe3+,故B正确;稀硝酸具有强氧化性,能氧化Fe2+生成Fe3+,但是原来刻蚀液中可能还含有未反应的Fe3+,所以无法判断加入足量硝酸后的溶液中n(Fe3+)、n(Cu2+)关系,故C错误;加入足量NaOH溶液,分别生成Fe(OH)2、Cu(OH)2,根据方程式2FeCl3+Cu===2FeCl2+CuCl2知,最终得到的沉淀n[Fe(OH)2]=2n[Cu(OH)2],故D错误。
15.某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显红色
(1)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表达)
______________________________、_________________________________。
(2)由实验ⅱ得出的结论是______________________________________。
解析 (1)FeSO4溶液与氢氧化钠反应生成白色沉淀氢氧化亚铁,氢氧化亚铁易被氧化为氢氧化铁,所以预期现象是产生白色沉淀、后变为灰绿色、最后出现红褐色沉淀。(2)Fe3+遇KSCN溶液变红,溶液X加入1滴KSCN溶液,溶液显红色,说明含有Fe2(SO4)3,则假设a不成立。
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
化肥中肯定有Fe2(SO4)3(假设a不成立)
为进一步验证假设,小组同学进行了以下实验:
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显红色,
颜色比ⅲ深
(3)实验ⅳ中氯水参加反应的离子方程式是______________________________。
(4)通过以上实验,可得到的结论是
___________________________________________________________。
Cl2+2Fe2+===2Cl-+2Fe3+
化肥成分含有FeSO4和Fe2(SO4)3(假设b成立)
解析 (3)实验ⅳ:溶液X中加入1滴KSCN溶液,再加入1 mL氯水,颜色比ⅲ深,说明Fe2+被氯水氧化为Fe3+,反应的离子方程式是Cl2+2Fe2+===2Cl-+2Fe3+。(4)实验ⅲ,溶液X中加入1滴KSCN溶液,再加入1 mL水,溶液显红色,说明含有Fe3+,综合实验ⅲ、ⅳ,可得到的结论是化肥成分含有FeSO4和Fe2(SO4)3(假设b成立)。
Thanks!
本讲内容结束
第二课时 铁盐和亚铁盐
第三章 铁 金属材料
【课程标准要求】
1.结合真实情境中的应用实例或通过实验探究,了解铁盐和亚铁盐的主要性质,了解它们在生产、生活中的应用。
2.能从物质的类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化,设计实验进行初步验证,并能分析、解释有关实验现象。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、Fe3+和Fe2+的检验方法
(1)滴加KSCN溶液,溶液直接变红色,该溶液中含有__________。
(2)滴加KSCN溶液,无明显现象,再加新制氯水溶液变红色,该溶液中含有__________。
Fe3+
Fe2+
【微自测】
1.下列描述中,正确的打“√”,错误的打“×”。
(1)向某溶液中滴加KSCN溶液,溶液变成红色,则该溶液中一定含有Fe3+,一定不含Fe2+( )
(2)向某溶液中先滴加几滴氯水,再滴加KSCN溶液,溶液变成红色,则该溶液中一定含有Fe2+( )
(3)向含Fe3+的溶液中滴加KSCN溶液,溶液中产生红色沉淀( )
答案 (1)× (2)× (3)×
二、铁盐、亚铁盐的性质与转化
(1)Fe2+与Fe3+的转化实验(如图)
(2)现象与结论
①在盛有氯化铁溶液的试管中加适量铁粉振荡后,溶液变成______色,再加KSCN溶液,溶液________,再加入氯水后,溶液变成____色。
②上述实验中有关反应的离子方程式是2Fe3++Fe===3Fe2+、2Fe2++Cl2===2Fe3++2Cl-。
③由上述实验可知:Fe3+遇到______的还原剂,会被还原成Fe2+;Fe2+在______氧化剂的作用下,会被氧化成Fe3+。
浅绿
不变色
红
较强
较强
【微自测】
2.下列描述中,正确的打“√”,错误的打“×”。
(1)在FeCl2溶液中加入锌片,溶液逐渐由浅绿色变为无色( )
(2)向FeCl2溶液中滴加氯水,溶液变为棕黄色,则Fe2+具有还原性( )
(3)向FeCl2溶液中滴加酸化的H2O2溶液,溶液变为棕黄色,并产生大量无色气体( )
(4)在FeCl3溶液中加入足量铁粉,溶液由棕黄色变为浅绿色,则Fe具有还原性( )
答案 (1)√ (2)√ (3)× (4)√
二、铁盐、亚铁盐的性质与转化
一、Fe3+、Fe2+的检验方法
一、Fe3+、Fe2+的检验方法
1.Fe3+的检验方法
2.Fe2+的检验方法
3.三种不同情境下检验Fe2+的注意事项
1.为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH溶液 B.铁片
C.KSCN溶液 D.石蕊溶液
解析 FeCl2变质会被氧化为FeCl3,Fe3+遇KSCN溶液变红色,故可用KSCN溶液检验溶液是否变红色,来判断是否变质。
C
2.下列各试剂中,不能用来鉴别FeSO4和Fe2(SO4)3的是( )
A.NaOH溶液 B.酸性KMnO4溶液
C.BaCl2溶液 D.KSCN溶液
解析 A项,FeSO4溶液遇NaOH溶液生成白色沉淀并迅速变为灰绿色,最后变成红褐色,Fe2(SO4)3与NaOH溶液生成红褐色沉淀,可鉴别,错误;B项,亚铁离子能使酸性KMnO4溶液褪色,可鉴别,错误;C项,二者均与氯化钡溶液反应生成白色硫酸钡沉淀,不能鉴别,正确;D项,加入KSCN溶液呈红色的是硫酸铁,没有明显现象的是硫酸亚铁,可鉴别,错误。
C
3.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液,溶液变成红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,再加入KSCN溶液,溶液变成红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,立刻得到红褐色沉淀,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液,得到白色沉淀,一段时间后观察到沉淀颜色逐渐变成红褐色,说明原溶液中只含有Fe2+,不含Mg2+
C
解析 滴入KSCN溶液,溶液变成红色,说明原溶液中含有Fe3+,但不能说明原溶液中不含Fe2+,A项错误;向某溶液中通入Cl2,再加入KSCN溶液,溶液变成红色,不能说明原溶液中含有Fe2+,因为如果原溶液中含有Fe3+,无论其是否含有Fe2+,都会出现相同的现象,B项错误;加入NaOH溶液,立刻得到红褐色沉淀Fe(OH)3,说明原溶液中含有Fe3+,C项正确;D项中操作和现象说明原溶液中肯定含有Fe2+,可能含有Mg2+,因为若生成Mg(OH)2白色沉淀,会被红褐色沉淀掩盖,D项错误。
二、铁盐、亚铁盐的性质与转化
[实验1]
FeSO4溶液与氯水反应:
向加有KSCN溶液的FeSO4溶液中滴加氯水,溶液变成红色。
1.写出上述颜色变化涉及反应的离子方程式,从氧化还原的角度判断含铁物质在反应中表现什么性质?
提示 2Fe2++Cl2===2Fe3++2Cl-、Fe3++3SCN-===Fe(SCN)3;Fe2+表现还原性。
[实验2]
FeCl3溶液与锌粉的反应
向FeCl3溶液中加入少量锌粉,溶液变成浅绿色,再加入足量锌粉,溶液变成无色。
2.写出上述颜色变化涉及反应的离子方程式,从氧化还原的角度判断含铁物质在反应中表现什么性质?
提示 2Fe3++Zn===2Fe2++Zn2+,Fe3+表现氧化性;
Fe2++Zn===Zn2++Fe,Fe2+表现氧化性。
[实验3] 利用覆铜板制作图案
实验原理 利用FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀
实验操作 取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案
实验现象 用油性笔画出的图案处不被腐蚀,洗净后板上留下设计的图案
3.写出上述用“腐蚀液”制作图案过程中发生反应的化学方程式,从氧化还原的角度判断含铁物质在反应中表现什么性质?
提示 2FeCl3+Cu===CuCl2+2FeCl2;Fe3+表现氧化性。
1.从氧化还原反应视角分析“铁三角”转化关系
Fe、Fe2+、Fe3+之间的相互转化关系如图(常称为“铁三角”)所示。
(1)Fe只具有还原性,被氧化成Fe2+或Fe3+。
(2)Fe2+既有氧化性又具有还原性
(3)Fe3+具有较强的氧化性,可被还原为Fe2+或Fe
(1)金属阳离子被还原不一定得到金属单质,如Fe3+被还原时可能得到的是Fe2+。
(2)虽然Fe2+既有氧化性又有还原性,但以还原性为主要特征。
(3)不同价态铁元素间的转化合理选择氧化剂判断:Fe0→Fe+2需要失去2个电子,容易转化,需弱氧化剂即可,而Fe+2→Fe+3只需失去1个电子,需要强氧化剂才能实现。
2.“铁三角”转化关系的应用
(1)含Fe2+、Fe3+的分离、除杂方法
①FeCl3溶液(FeCl2):加足量氯水或通入足量Cl2。
②FeCl2溶液(FeCl3):加足量铁粉,充分反应后过滤。
③FeSO4溶液(CuSO4):加足量铁粉,充分反应后过滤。
④除去废水中Fe2+,先将废水中的Fe2+氧化为Fe3+(如通入Cl2或加入H2O2),再调节溶液的pH,使Fe3+转化为红褐色的Fe(OH)3沉淀过滤除去。
4.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应 ③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.①③ C.①②③ D.全部
B
解析 ①中Cl2的氧化性强,它能将铁氧化为FeCl3,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原为氯化亚铁;②中Fe与稀硫酸反应只能生成FeSO4;③在溶液中Fe2+被Cl2氧化生成Fe3+;④中Fe与盐酸反应生成FeCl2和H2、Fe2O3与盐酸反应生成FeCl3和水,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
5.制印刷电路板铜常用氯化铁溶液作为“腐蚀液”。向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列判断一定错误的是( )
A.烧杯中有铜、无铁
B.烧杯中铁、铜都无
C.烧杯中铁、铜都有
D.烧杯中有铁、无铜
D
解析 烧杯中有铜、无铁,说明铁已全部反应完,铜部分反应或没反应,符合逻辑,故A不选;烧杯中铁、铜都无,说明铁全部反应完后,Fe3+也将铜全部氧化了,符合逻辑,故B不选;烧杯中铁、铜都有,说明Fe3+只氧化了部分铁就没有了,故C不选;烧杯中有铁、无铜,说明铜先被氧化了,不符合反应的先后顺序,故D选。
6.为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
A
实验操作 实验现象 离子反应 实验结论
A 在氯化亚铁溶液中通入氯气 溶液由浅绿色变成棕黄色 2Fe2++Cl2===2Fe3++2Cl- Fe2+具有还原性
B 在氯化亚铁溶液中加入锌片 溶液由浅绿色变成无色 Fe2++Zn===Fe+Zn2+ Zn具有还原性
C 在氯化铁溶液中加入铁粉 溶液由棕黄色变成浅绿色 Fe3++Fe===2Fe2+ 铁单质具有还原性
D 在氯化铁溶液中加入铜粉 溶液由蓝色变成棕黄色 2Fe3++Cu===2Fe2++Cu2+ Fe3+具有氧化性
解析 氯气能够将Fe2+(浅绿色)氧化为Fe3+(棕黄色),A项正确;锌置换出铁,锌逐渐溶解,溶液变为无色,且析出黑色固体,实验现象错误,实验结论应是Fe2+具有氧化性,B项错误;C项,离子方程式错误,正确的离子方程式应为2Fe3++Fe===3Fe2+,C项错误;D项,实验现象应该是铜粉逐渐溶解,溶液由棕黄色变为蓝色,D项错误。
微专题8 补铁剂中铁元素的探究及应用
微专题9 利用“价—类”二维图认识铁及其化合物的关系
微专题8 补铁剂中铁元素的探究及应用
某品牌补铁剂(主要成分是FeSO4),商标如下图
铁是人体必需的微量元素之一,铁元素在人体中具有造血功能,参与血红蛋白、细胞色素及各种酶的合成。铁能形成血红素,而血红素在人体中主要起供氧的作用,它能够携带氧气,供应给人体的各个细胞和器官,让人的身体的各个部位都能正常运转。人体缺铁时,常会服用补铁剂来补充铁元素,补铁剂与维生素C同时服用,补铁效果更好。
查阅资料可知,Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色。
1.补铁剂中铁元素的化合价是多少?为什么补铁剂与维生素C一起服用效果更好?
提示 补铁剂中铁元素的化合价是+2价,具有还原性,因维生素C的还原性比Fe2+强,因此补铁剂与维生素C一起服用,可以防止补铁剂中的Fe2+被氧化。
2.如何检验补铁剂中的铁元素的存在形式?描述实验操作和现象。
提示 取密封的补铁剂(若为固体先用煮沸的蒸馏水溶解)于试管中,向其中先加入KSCN溶液,无明显现象,再向溶液中加入氯水,溶液变为红色。
3.按照如下方法,对补铁剂进行实验,出现什么现象说明补铁剂已经部分变质。
提示 甲:高锰酸钾溶液的紫红色褪去;乙:溶液变为红色。
1.食品中铁元素的测定问题总结
(1)检验铁元素是否存在的依据:把样品中的铁元素转变为Fe3+,Fe3+遇KSCN溶液变为红色。
(2)实验中必须用到的试剂为双氧水(或氯水)、KSCN溶液。
(3)实验操作中根据选择的不同样品,可以考虑采用灼烧的方法,也可以用研磨的方法,也可以考虑用溶剂溶解,最后得到的试液一定要加入双氧水(或氯水)将其中的铁元素氧化为三价铁,然后加入KSCN溶液,看是否变红来检验是否存在铁元素。
2.补铁剂存放及使用的注意事项
(1)补铁剂的有效成分是亚铁盐(如FeSO4),Fe2+被氧化为Fe3+而失去补铁作用,因此需密封、隔绝O2存放,服用补铁剂时搭配维生素C可以增强补铁效果,这是因为维生素C可将Fe3+还原为Fe2+。
(2)服用补铁剂时不能和茶水同饮,因为茶水中含大量的鞣酸,鞣酸与Fe2+反应生成鞣酸亚铁,它的性质不稳定,很快被氧化成鞣酸铁而呈蓝黑色。
1.(2021·朝阳区模拟)探究补铁剂[主要成分:氯化血红素(含+2价铁)、富锌蛋白粉、维生素C、乳酸、葡萄糖浆]中铁元素是否变质。先取少量补铁剂,用酸性丙酮溶解后制成溶液。下列说法不正确的是( )
实验Ⅰ 取待测液,加入少量KSCN溶液,无明显现象;再加入少量H2O2,溶液不变红
实验Ⅱ 取实验Ⅰ所得溶液,再加入少量KSCN溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色
实验Ⅲ 取实验Ⅰ所得溶液,加入少量盐酸溶液,无明显现象,继续加入H2O2至过量,溶液先变红后褪色
A.实验Ⅰ中加入KSCN溶液无明显现象,与KSCN溶液的用量无关
B.实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素C还原了
C.实验Ⅲ中溶液红色褪去,可能是H2O2将SCN-氧化了
D.实验说明,该补铁剂中+2价铁在酸性条件下才能被H2O2氧化
答案 D
解析 取实验Ⅰ所得溶液,再加入少量KSCN溶液,无明显现象;再加入H2O2溶液,溶液变为红褐色,说明与KSCN溶液的用量无关,故A正确;维生素C具有还原性,实验Ⅰ中加入H2O2溶液后不变红,可能是H2O2被维生素C还原了,故B正确;H2O2具有强氧化性,SCN-具有还原性,继续加入H2O2至过量,溶液先变红后褪色,溶液红色褪去,可能是H2O2将SCN-氧化了,故C正确;没有对照实验,无法说明中性、碱性条件下,该补铁剂中+2价铁能否被H2O2氧化,故D错误。
2.铁是人体必需的微量元素之一,补铁剂中的Fe2+在空气中很容易被氧化成Fe3+,影响铁元素在人体中的吸收利用。某实验小组进行如图所示的对照实验,验证补铁剂和维生素C一起服用的科学性。
[实验操作]第一步:在A、B两支试管中加入对比试剂;第二步:振荡;第三步:滴加KSCN溶液。
[实验现象](1)A试管中溶液变________色,B试管中无明显现象。
[实验结论](2)维生素C具有________(填“氧化性”或“还原性”),能防止Fe2+被氧化为Fe3+,所以补铁剂和维生素C一起服用具有科学依据。
[生活应用](3)某品牌泡腾片的主要成分为维生素C和NaHCO3,放入水中立即产生大量气泡(CO2)使口感更好,说明维生素C具有________(填“酸性”或“碱性”)。
(4)为防止烹调时蔬菜中维生素C的损失,烹调蔬菜应注意_______________________________________________(写一条即可)。
答案 (1)红 (2)还原性 (3)酸性
(4)避免与氧化性物质接触(或避免与碱性物质接触)
解析 (1)Fe3+与SCN-结合而使溶液呈红色。(2)向FeCl3溶液中加入足量维生素C后,再加入KSCN溶液,溶液不变红色,说明Fe3+被维生素C还原,即维生素C具有还原性。(3)将维生素C与NaHCO3放入水中,立即有大量CO2产生,说明维生素C具有酸性。(4)由实验(2)、(3)可知,维生素C具有还原性和酸性,故烹调蔬菜时应避免与氧化性物质或碱性物质接触。
3.(2021·台州期末)某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验:
Ⅰ.向试管中加入液体补血剂2 mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色。学生甲认为此补血剂含铁量很低,属不合格产品。
(1)你认为学生甲的观点合理吗?__________________________________
解析 (1)因补血剂的成分是Fe2+,滴加KSCN溶液,溶液显示淡红色,说明Fe3+的浓度低;
不合理
Ⅱ.学生乙认为还应进一步探究实验,他将学生甲所得溶液分成三份,分别加入了氯水、溴水、碘水。发现加入氯水、溴水后溶液呈血红色,颜色明显加深,加入碘水的试管颜色无明显变化。请回答下列问题:
(2)根据乙的上述实验说明补血剂中的铁为________价。
(3)向补血剂溶液中滴加KSCN溶液,显示淡红色的原因
___________________________________________________________。
(4)请写出加入氯水后对应的离子反应方程式____________________________。
(5)请根据乙同学的实验现象进一步推断,氯、溴的单质可将铁单质氧化成________价铁,而Fe与I2反应的产物应该是________。
+2
有少量的亚铁离子被氧化
Cl2+2Fe2+===2Cl-+2Fe3+
+3
FeI2
解析 (2)因加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+,而Fe2+能被氧化剂如氯气、液溴所氧化,则原溶液中铁的化合价为+2价;(3)因Fe2+氧化生成Fe3+,Fe3+遇SCN-变红,所以向补血剂溶液中滴加KSCN溶液,显示淡红色的原因有少量的亚铁离子被氧化;(4)因Fe2+与Cl2反应生成Fe3+和Cl-:Cl2+2Fe2+===2Cl-+2Fe3+;(5)根据加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+;加入碘水的试管颜色无明显变化,说明Fe2+与I2不反应;
Ⅲ.学生丙也做了与学生甲同样的实验后,将所得的淡红色溶液分成两份继续进行实验:
试回答下列问题:
(6)请写出丙的实验①中淡红色褪去的离子方程式__________________________。
(7)关于③中的实验现象,丙同学提出了假设:过量的双氧水将SCN-氧化了。请你设计一个实验方案验证丙的假设________________________________________
_____________________________________________________________________。
Fe+2Fe3+===3Fe2+
取少量加入过量双氧水后血红色褪去的溶液,
往其中加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了
解析 (6)加入少量铁粉,将Fe3+还原为Fe2+,淡红色褪去,反应的离子方程式为:Fe+2Fe3+===3Fe2+;(7)根据Fe3+检验方法,溶液中继续加入过量KSCN溶液,若溶液变红则说明是过量的双氧水将SCN-氧化了。
微专题9 利用“价—类”二维图认识铁及其化合物的关系
1.构建铁及其化合物的“价—类”二维图
(1)同价态的铁及其化合物之间的转化
从物质分类的角度理解铁及其化合物的性质与转化
①FeO、Fe2O3都是碱性氧化物,都能与酸发生反应。
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
②FeSO4和FeCl3都属于盐,都能和碱发生反应生成氢氧化物沉淀。
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
③Fe(OH)2和Fe(OH)3都属于碱,都能与酸发生中和反应。
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
(2)不同价态的铁及其化合物的转化。从元素化合价的角度理解铁及其化合物的氧化性和还原性。
2.元素及其化合物“价—类”二维视角的应用
物质类别和元素价态,是学习元素及其化合物性质的重要认识视角。
(1)基于物质类别和元素价态,可以更全面预测物质的性质。例如Fe2O3物质类别属于金属氧化物,可以预测它可能与酸发生反应;从元素价态来看,Fe2O3中铁元素是+3价,为铁元素的高价态,可以预测它具有氧化性,可能与具有还原性的物质发生反应。
(2)基于物质类别和元素价态,还可以设计物质间转化制备的途径。例如,要想从单质铁获得FeSO4,既可以基于物质类别设计从金属单质与酸反应、金属单质与盐的置换反应获得,还可以基于元素价态设计单质铁与+3价铁反应得到+2价铁。
1.元素的“价—类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的“价—类”二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是( )
答案 C
解析 铁与高温水蒸气反应时,生成Fe3O4,A错误;FeO是一种黑色粉末,不稳定,在空气中受热,迅速反应生成Fe3O4,B错误;加热Fe(OH)3分解生成Fe2O3,而Fe(OH)3不溶于水,D错误。
2.如图为铁及其化合物的“价—类”二维图。利用如图可以从不同角度研究含铁物质的性质及其转化关系。下列分析结果不正确的是( )
A.二维图缺失的类别①应填“单质”,
化学式②应填“Fe(OH)3”
B.从物质类别分析,Fe2O3属于碱性氧
化物,可以与稀盐酸反应
C.从化合价角度分析,FeO既有氧化性又有还原性
D.从物质转化角度分析,Fe2O3和FeCl3都可以通过一步反应直接转化成②
D
解析 铁单质的化合价为0,二维图缺失的类别①单质;三价铁形成的氢氧化物是氢氧化铁,则化学式②Fe(OH)3,A正确;从物质类别分析,Fe2O3属于碱性氧化物,可以与稀盐酸反应生成氯化铁和水,B正确;从化合价角度分析,FeO既有还原性又有氧化性,C正确;氧化铁是碱性氧化物,不溶于水不能一步反应生成氢氧化铁,FeCl3可以通过一步反应和氢氧化钠溶液反应,直接转化成氢氧化铁,D错误。
3.铁及其化合物的“价—类”二维图如下。
回答下列问题:
(1)预测Fe2+既有氧化性又有还原性,其依据是
___________________________________________________________。
(2)检验溶液中的Fe3+,常用的试剂是______________。
解析 (1)Fe2+中Fe元素显+2价,处于中间价态,既有氧化性又有还原性。
铁元素为+2价,处于中间价态
KSCN溶液
(3)氧化铁和铝粉可用于野外焊接钢轨,发生置换反应,用化学方程式表示反应原理___________________________________________________________。
(4)白色的Fe(OH)2在空气中极不稳定,最终变为红褐色物质,请解释其原因(用化学方程式回答)______________________________________________。
(5)向FeCl2溶液中滴加氯水,反应的离子方程式是
___________________________________________________________。
解析 (3)氧化铁与铝粉发生置换反应,生成Fe和Al2O3,结合得失电子守恒和原子守恒写出化学方程式。(4)Fe(OH)2具有较强还原性,易被空气中的O2氧化,最终生成红褐色的Fe(OH)3,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe2++Cl2===2Fe3++2Cl-
1.能将溶液中的Fe3+转化为Fe2+的是( )
A.Cu B.NH3·H2O C.Cl2 D.KSCN
解析 能将溶液中的Fe3+转化为Fe2+的物质具有还原性,Cu是常见的还原剂,氯气常做氧化剂,铁离子和氨水以及硫氰化钾之间发生复分解反应。
A
2.要除去FeCl2溶液中少量的FeCl3,可行的方法是( )
A.滴入KSCN溶液
B.通入氯气
C.加入适量铜粉并过滤
D.加入适量铁粉并过滤
解析 KSCN溶液只能检验Fe3+的存在,A错误;通入氯气将FeCl2氧化为FeCl3,B错误;加入铜粉发生Cu+2Fe3+===2Fe2++Cu2+,引入新杂质Cu2+,C错误;加入铁粉发生Fe+2Fe3+===3Fe2+,过滤除去剩余铁粉,得到纯净FeCl2溶液,D正确。
D
3.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )
A.只有④ B.只有③ C.③和④均错 D.全部错误
C
解析 ①铁离子与铁反应生成浅绿色的亚铁离子,故①正确;②铁离子与硫氰化钾溶液反应显红色,据此能够检验铁离子,故②正确;③硫酸铜与氯化铁不发生反应,混合后溶液不会变成无色,故③错误;④氯化铁与硝酸银反应生成白色氯化银沉淀,该性质不是铁离子的性质,故④错误;⑤铁离子与氢氧化钠溶液反应生成红褐色氢氧化铁沉淀,据此可以检验是否存在铁离子,故⑤正确。
4.已知如下三个实验均能发生化学反应:
下列判断正确的是( )
A.实验①中铁作还原剂
B.实验②中Fe2+既显氧化性又显还原性
C.实验③中发生的是置换反应
D.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
A
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴氯水 将铜丝放入氯化铁溶液中
解析 实验①中铁作还原剂,则氧化性:Cu2+>Fe2+;实验②中Fe2+只表现还原性;实验③中发生的反应为2FeCl3+Cu===2FeCl2+CuCl2,该反应不是置换反应,分析可知氧化性:Fe3+>Cu2+。综上分析可知氧化性:Fe3+>Cu2+>Fe2+。
5.(1)某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用上述所给物质写出体现Fe2+具有还原性的化学方程式:
___________________________________________________________。
解析 (1)在反应中Fe2+作还原剂,体现其还原性,因此应选择氧化剂,所以选用氯水,发生的反应为2FeCl2+Cl2===2FeCl3。
2FeCl2+Cl2===2FeCl3
(2)设计实验方案,完成下列表格。
探究内容 探究Fe3+具有氧化性
实验方案 取少量0.1 mol·L-1的FeCl3溶液,向溶液中加入足量铁粉,再加入少量KSCN溶液
实验现象 加入铁粉后,溶液颜色变为________;加入KSCN溶液后,溶液________
(3)该兴趣小组为探究“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,该反应的离子方程式为_____________________________________________。
浅绿色
不变色
Fe2++Zn===Zn2++Fe
解析 (2)向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe===3Fe2+,所以溶液由棕黄色变为浅绿色。向FeCl2溶液中滴加硫氰化钾溶液不变红。(3)向FeCl2溶液中加入锌粉,发生离子反应为Zn+Fe2+===Fe+Zn2+。
1.向硫酸铁溶液中加入维生素C溶液,Fe3+转化为Fe2+,据此得到的结论错误的是( )
B
2.在离子方程式2Fe3++Fe===3Fe2+中,Fe3+可能代表的物质是( )
A.FeSO4 B.FeCl3 C.Fe2O3 D.Fe(OH)3
解析 硫酸亚铁在水中完全电离出亚铁离子,故A错误;氯化铁在水中完全电离出铁离子,故B正确;在书写离子方程式时氧化铁不能拆开,要写成化学式,故C错误;氢氧化铁难溶于水,在书写离子方程式时氢氧化铁不能拆开,要写成化学式,故D错误。
B
3.下列试剂不能使Fe2+转化为Fe3+的是( )
①氯水 ②NaCl溶液 ③酸性KMnO4 ④H2O2溶液 ⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④ C.②④⑤ D.②⑤⑥
解析 Fe2+具有还原性,要把Fe2+转化为Fe3+需要加入强氧化剂,题中氯水、酸性KMnO4溶液、H2O2溶液,具有强氧化性,可以使Fe2+转化为Fe3+,而NaCl溶液、盐酸、NaNO3溶液不具强氧化性,不能使Fe2+转化为Fe3+,故选②⑤⑥,选D。
D
4.(2021·金华方格外国语学校)下列关于“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]的说法不正确的是( )
A.具有较强的还原性,可使高锰酸钾酸性溶液褪色
B.可用于治疗缺铁性贫血,还可用于制造红色颜料铁红(Fe2O3)、磁性氧化铁(Fe3O4)等
C.加水溶解,再滴加KSCN溶液,若溶液变红色,说明摩尔盐已氧化变质
D.加水溶解,与过量NaOH溶液反应的离子方程式:Fe2++2OH-===Fe(OH)2↓
D
5.某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,然后白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+, 一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
D
解析 加入NaOH溶液,开始时有白色絮状沉淀生成,则不存在Fe3+,否则生成红褐色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,说明含有Fe2+,是亚铁离子的特征性质和反应现象,反应为:Fe2++2OH-===Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3,由于红褐色可掩盖白色,则不能证明是否含有Mg2+。
6.某同学模拟2019年春晚节目《魔壶》进行实验。将“魔壶”中盛有的FeCl3溶液依次倒入分别盛有约1 mL ①KSCN、②AgNO3、③NaOH浓溶液的3个烧杯中,实验现象各异。下列有关说法正确的是( )
A.烧杯①中,有血红色沉淀生成
B.烧杯②中,发生了氧化还原反应
C.烧杯③中,反应后所得分散系属于胶体
D.若用FeCl2溶液代替FeCl3溶液进行上述实验,实验现象各异
D
解析 FeCl3溶液和KSCN溶液反应生成血红色的硫氰化铁溶液,不是沉淀,A错误;FeCl3溶液和AgNO3溶液发生反应生成AgCl沉淀,该反应为复分解反应,不是氧化还原反应,B错误;FeCl3溶液和NaOH溶液反应生成的Fe(OH)3为红褐色沉淀,所以反应后所得分散系为悬浊液,不是胶体,C错误;若用FeCl2溶液代替FeCl3溶液进行上述实验,FeCl2溶液和KSCN溶液不反应,没有现象,FeCl2溶液和AgNO3溶液反应生成AgCl白色沉淀,FeCl2溶液和NaOH溶液反应生成Fe(OH)2白色沉淀,然后迅速变成灰绿色,最后变成红褐色,因此三个烧杯中的现象各异,D正确。
7.在FeCl3、CuCl2和HCl的混合液中加入铁粉,待反应结束,所剩固体滤出后不能被磁铁吸引,则反应后溶液不可能大量存在的阳离子是( )
A.H+ B.Fe3+ C.Fe2+ D.Cu2+
解析 铁粉先和FeCl3反应,再和CuCl2反应,最后再和HCl反应,充分反应后,所剩固体滤出后不能被磁铁吸引,则固体为Cu,因为三价铁离子会和Cu反应生成二价铁,所以一定有Fe2+,一定没有Fe3+;反应没有Fe剩余,所以H+和Cu2+可能过量,所以H+和Cu2+可能有;故不可能大量存在的阳离子是Fe3+。
B
8.富脂食品密封保存往往需要在包装袋内装一小包脱氧剂(有效成分是还原铁粉),某小组为探究脱氧剂中铁粉是否变质,取少量样品溶于稀盐酸,再进行下列实验,下列有关实验现象和结论的说法正确的是( )
A.若加盐酸时有气体产生,则证明脱氧剂未变质
B.若滴加KSCN溶液,无明显变化,再滴加氯水显血红色,则证明脱氧剂未变质
C.若滴加KSCN溶液,溶液显血红色,则证明脱氧剂已变质
D.若加入铜粉充分反应后,溶液呈蓝色,则证明脱氧剂已完全变质
C
解析 若加盐酸时有气体产生,说明样品中还有铁粉,但不证明脱氧剂未变质也可能部分变质,A错误;若滴加KSCN溶液,无明显变化,说明加入盐酸后的溶液中没有Fe3+,这可能是Fe+2Fe3+===3Fe2+,也可能是变质时Fe就被氧化为FeO,再滴加氯水显血红色,故不能证明脱氧剂未变质,B错误;若滴加KSCN溶液,溶液显血红色,说明加入盐酸后的溶液中含有Fe3+,所以证明脱氧剂已变质,C正确;若加入铜粉充分反应后,溶液呈蓝色,说明加入盐酸后的溶液中含有Fe3+,发生Cu+2Fe3+===Cu2++2Fe2+,但不能证明脱氧剂已完全变质,还可能是部分被氧化,D错误。
9.将2.8 g铁粉加入50 mL 3 mol·L-1的氯化铁溶液中,充分反应后,下列有关说法正确的是( )
A.铁粉有剩余,溶液呈浅绿色
B.往溶液中滴入KSCN溶液,不显红色
C.氧化产物和还原产物的物质的量之比为2∶1
D.反应后的溶液中Fe2+和Fe3+物质的量之比为3∶1
D
10.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+;
下列试剂及加入试剂顺序能达到实验目的的是( )
B
试剂 选项 甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
解析 甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。只有酸性KMnO4溶液符合条件,现象是紫色变浅(或褪去)。乙组,在Fe2+存在的条件下,检验Fe3+,用KSCN溶液检验Fe3+,Fe2+无干扰。
11.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为___________________________________________________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________________________________________________。
防止氯化亚铁被氧化
Cl2+2Fe2+===2Fe3++2Cl-
隔离空气(排除氧气对实验的影响)
解析 (1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;(2)氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+===2Fe3++2Cl-;(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响;
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于2支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在I-过量的情况下,溶液中仍含有________(填离子符号)。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________________。
Fe3+
2Fe2++H2O2+2H+===2Fe3++2H2O
解析 (4)①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,反应的离子方程式为:2I-+2Fe3+===2Fe2++I2,②第二支试管中加入1滴KSCN溶液,溶液变红,说明在I-过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+===2Fe3++2H2O。
12.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是___________________________________________________________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:___________________________________________________________。
解析 (1)检验Fe3+常用KSCN溶液,如果溶液变为血红色,说明含有Fe3+,反之不含有;(2)Cu和Fe3+反应的离子反应方程式为Cu+2Fe3+===2Fe2++Cu2+;
KSCN
溶液变成血红色
2Fe3++Cu===2Fe2++Cu2+
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
Fe
HCl
解析 (3)本实验目的是回收铜和制取纯净的FeCl3,向废液中加入过量的铁屑,然后过滤,滤液为FeCl2,滤渣为Cu和Fe,因为铁能与盐酸反应,铜和盐酸不反应,因此滤渣③中加入过量的盐酸,过滤,得到金属铜,两种滤液合并,通入氯气,把Fe2+氧化成Fe3+;
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:
___________________________________________________________。
C
2Fe2++Cl2===2Fe3++2Cl-
解析 (4)检验某溶液中不含Fe3+,含Fe2+,应先加KSCN溶液,溶液不变红,说明不含Fe3+,再加入氧化剂,溶液变红,说明原溶液中含Fe2+,不含Fe3+,氧化剂不能是酸性高锰酸钾溶液,因为高锰酸钾溶液能氧化KSCN,故选项C正确;(5)⑥为氯气,发生的离子反应方程式为2Fe2++Cl2===2Fe3++2Cl-。
13.某兴趣小组进行某补血剂中铁元素含量的测定实验流程如下:
B
14.用FeCl3溶液蚀刻印刷电路板,发生反应:2FeCl3+Cu===2FeCl2+CuCl2。分别取适量蚀刻后的溶液进行实验,下列实验结论一定正确的是( )
A.通入Cl2,再滴入KSCN溶液,溶液变红,说明所得溶液中已不含Fe2+
B.加入铁粉,充分反应,有固体剩余,说明所得溶液中已不含Fe3+
C.滴加足量稀硝酸,充分反应,则所得溶液中n(Fe3+)=2n(Cu2+)
D.滴加足量NaOH溶液,充分反应,则所得沉淀中n[Fe(OH)2]=3n[Cu(OH)2]
B
解析 检验Fe2+先加入KSCN溶液后通入氯气,如果先通入Cl2,Cl2能氧化Fe2+生成Fe3+而干扰Fe2+的检验,而无法判断原溶液是否含有Fe2+,故A错误;加入Fe粉,有固体剩余,无论固体是Fe还是Cu,都能与Fe3+反应,所以只要有固体剩余,反应后的溶液中一定不含Fe3+,故B正确;稀硝酸具有强氧化性,能氧化Fe2+生成Fe3+,但是原来刻蚀液中可能还含有未反应的Fe3+,所以无法判断加入足量硝酸后的溶液中n(Fe3+)、n(Cu2+)关系,故C错误;加入足量NaOH溶液,分别生成Fe(OH)2、Cu(OH)2,根据方程式2FeCl3+Cu===2FeCl2+CuCl2知,最终得到的沉淀n[Fe(OH)2]=2n[Cu(OH)2],故D错误。
15.某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4 b.含有FeSO4和Fe2(SO4)3 c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
序号 操作 现象
ⅰ 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 产生红褐色沉淀
ⅱ 取2 mL溶液X,加入1滴KSCN溶液 溶液显红色
(1)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表达)
______________________________、_________________________________。
(2)由实验ⅱ得出的结论是______________________________________。
解析 (1)FeSO4溶液与氢氧化钠反应生成白色沉淀氢氧化亚铁,氢氧化亚铁易被氧化为氢氧化铁,所以预期现象是产生白色沉淀、后变为灰绿色、最后出现红褐色沉淀。(2)Fe3+遇KSCN溶液变红,溶液X加入1滴KSCN溶液,溶液显红色,说明含有Fe2(SO4)3,则假设a不成立。
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
化肥中肯定有Fe2(SO4)3(假设a不成立)
为进一步验证假设,小组同学进行了以下实验:
序号 操作 现象
ⅲ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL水 溶液显红色
ⅳ 取2 mL溶液X,加入1滴KSCN溶液,再加入1 mL氯水 溶液显红色,
颜色比ⅲ深
(3)实验ⅳ中氯水参加反应的离子方程式是______________________________。
(4)通过以上实验,可得到的结论是
___________________________________________________________。
Cl2+2Fe2+===2Cl-+2Fe3+
化肥成分含有FeSO4和Fe2(SO4)3(假设b成立)
解析 (3)实验ⅳ:溶液X中加入1滴KSCN溶液,再加入1 mL氯水,颜色比ⅲ深,说明Fe2+被氯水氧化为Fe3+,反应的离子方程式是Cl2+2Fe2+===2Cl-+2Fe3+。(4)实验ⅲ,溶液X中加入1滴KSCN溶液,再加入1 mL水,溶液显红色,说明含有Fe3+,综合实验ⅲ、ⅳ,可得到的结论是化肥成分含有FeSO4和Fe2(SO4)3(假设b成立)。
Thanks!
本讲内容结束
