沪教版化学九年级上册 第3章 第3节 物质的组成 课件(共44张PPT)
文档属性
| 名称 | 沪教版化学九年级上册 第3章 第3节 物质的组成 课件(共44张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 13:51:23 | ||
图片预览











文档简介
(共44张PPT)
化学九年级上册 H
第 3章 物质构成的奥秘
第3节 物质的组成
1、化学上用什么来描述物质的组成。
2、写出你所知道物质的化学式
复习提问
1、什么叫化学式?
用元素符号和数字表示物质组成的式子。
阅读思考
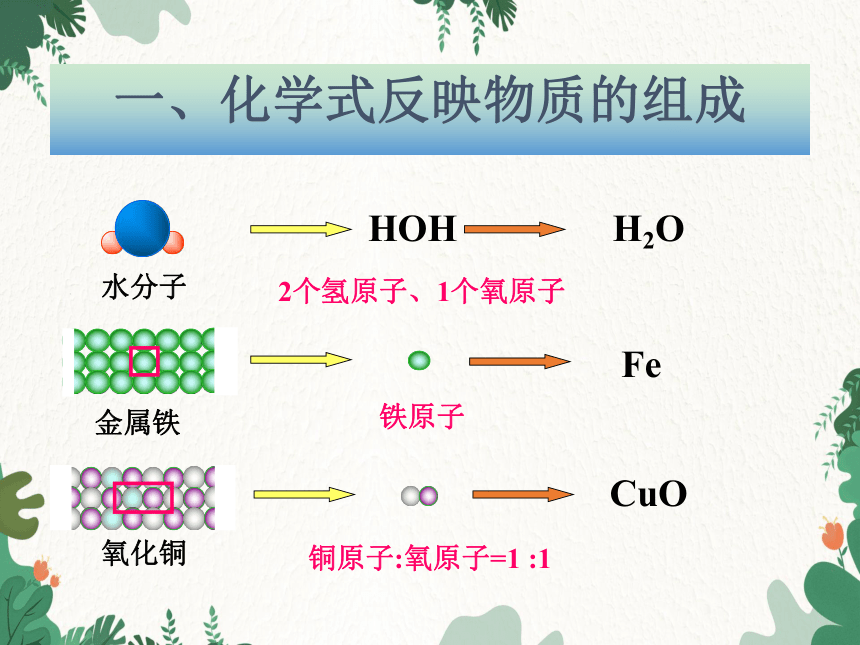
一、化学式反映物质的组成
水分子
金属铁
氧化铜
HOH
H2O
Fe
CuO
铜原子:氧原子=1 :1
铁原子
2个氢原子、1个氧原子
思考:根据物质的化学式你能得到有关物质的组成和构成的哪些信息?
讨论交流
2、化学式的含义
小结点拨
表示物质和物质的组成元素
揭示物质中原子或离子的个数关系
如为“分子式”,则还可表示构成物质的一个分子及其分子的构成。
联想与启示
单质是由同种元素组成的纯净物。请试着书写出铝单质、氦单质、金刚石;氧气、氮气等物质的化学式,体会这些物质的化学式的写法有什么差异,把你的想法与同学们交流。
如何书写物质的化学式(一)
1、单质化学式
(1)直接用元素符号表示单质:
金属单质单质
稀有气体单质
部分固态非金属单质
如:钠(Na)银(Ag)汞(Hg)等
如:氦气(He)氖气(Ne)氩气等
如:金刚石(C)等
(2)用元素符号和数字表示单质:
气态非金属单质:如氢气(H2)、氧气(O2)、氮气(N2)、氟气(F2)、氯气(Cl2)、等。
联想与启示
化合物是由两种或两种以上元素组成的纯净物。请试着书写出水、二氧化碳、过氧化氢;氢氧化钙、碳酸氢铵等物质的化学式,体会化合物的化学式书写要领。
2、化合物的化学式
如何书写物质的化学式(二)
弄清物质的组成元素或原子团
某些元素的原子集合在一起作为一个整体参加化学反应,它所起的作用和一个原子一样,这样的原子集合称为原子团。化学上常用“根”来命名。如氢氧根(OH)、
碳酸根(CO3)铵根(NH4)等
确定元素原子或原子团的个数关系
1.定义:一种元素一定数目的原子与一种元素一定数目的原子化合的性质。
化合价
2.化合价的判断:
金属:易失电子,化合价为正价;一个原子失几个电子,化合价为正几。
非金属:易得电子,化合价为负价;一个原子得几个电子,化合价为负几。
常见元素的化合价:
1.化合物中元素有化合价,且组成元素的正负化合价代数和为零。
2.O为-2价,H一般为+1价
3.金属一般是正价,非金属一般是负价
化合价
4.单质中元素的化合价为零
5、有些元素有几种不同的化合价
如:铁有+2、+3价,碳有+2、+4价
常见元素的化合价(口诀)
一价钾钠氯氢银;二价氧钙钡镁锌;
三铝四硅五价磷;二、三铁,二、四碳;
硫有负二正四六;铜汞二价最常见;
正负变价要分清;莫忘单质都为零。
常见原子团的化合价(口诀)
负一硝酸氢氧根;负二碳酸硫酸根;
负三记住磷酸根;正一价的是铵根。
原子团 名称 原子团的化合价
CO3 碳酸根 -2
SO4 硫酸根 -2
OH 氢氧根 -1
NO3 硝酸根 -1
ClO 次氯酸根 -1
NH4 铵根 +1
SO3 亚硫酸根 -2
1、标出下列物质中各元素的化合价
H2O ZnS Fe H2CO3
化合价的标法
3、按要求用符号表示
(1)+2价的钙元素
(2)氯化钙中钙元素为+2价
2、标出下列物质中各原子团的化合价
NaOH CuSO4 NH4NO3
说出下列符号中“2”的含义:
(1). 2H (2). H2 (3). 2H2
+2
(4). Mg2+ (5). Mg (6).2H2O
+2
(7)2 Mg2+ (8)Mg O
1、什么叫化学式?
2、什么是化合价?说出常见元素及原子团的化合价。
3、说出下列符号的含义
复习提问
+2
+2
2Mg Mg2+ Mg MgCl2
例题:写出氧化铝、氢氧化铝的化学式
先学后用:
1、写出组成元素或原子团的符号
正价在左(前);负价在右(后);
金属在左(前);非金属在右(后);
氢元素在左(前);氧元素在右(后);
2、查出所需元素(或原子团)的化合价,确定原子(或原子团)个数关系
3、将原子(或原子团)个数作下标(个数1省略不写),写出化学式。
化合物的化学式书写要领
根据化合价书写化学式
已知:P为+5价,O为-2价,写出P的氧化物的化学式
1.最小公倍数法:
(1). 根据两种元素的化合价,计算最小公倍数
(2).把最小公倍数除以化合价,得出原子个数
(3).写出化学式
2.交叉法:
注意事项
并尝试写出下列物质的化学式。
(1)氧化钠、氧化钙
(2)硫化氢
(3)氧化铁
(4)氢氧化钾、氢氧化钡
(5)碳酸钙、硫酸铵
(6)碳酸、硫酸
体验练习:
根据化学式推断化合价
1.下列物质中,含有最高化合价元素的是( )
A.H2SO4 B.H3PO4 C.KNO3 D.KMnO4
2.下列物质中,相同元素的化合价相同的是( )
A.H2S,SO2 B.HCl,HClO
C.NH3,NO2 D.FeS,Fe(OH)2
3.在SiO2,K2FeO4中,Si和Fe的化合价为
___和____.
4.将(1)N2O (2)NH3 (3)N2
(4)N2O5 (5)N2O3 (6)NO
(7)NO2几种物质,按N元素化合价由低到高,排列的顺序是________________.
讨论:为什么由碳、氧元素组成的化合物有两种?请写出它们的化学式。
请写出四氧化三铁、五氧化二磷的化学式,体会简单化合物的命名方法
活动与探究
1、两种元素组成的化合物,在两种元素中间用“化”连接;
2、化学式中元素的名称从右往左读,与化学式的写法刚好相反;
3、元素的原子个数在元素之前先读出;
4、含有复杂原子团的化合物,要根据其特征来称呼,不需读出原子或原子团的个数。
简单化合物的命名
1、读出下列化学式
(1)N2O N2O5
(2)H2O H2O2
(3)AlCl3 FeCl2
(4)H2S NH3
(5)Na2SO4 (NH4)2SO4
(6)Fe(OH)3 Cu (OH)2
练习巩固
2、计算下列物质中划线元素的化合价
KMnO4 K2MnO4
3、已知漂白粉的有效成分次氯酸钙的化学式为Ca(ClO)2,试写出次氯酸钾和次氯酸的化学式。
练习巩固
4、利用提供的阴阳离子写出化学式
练习巩固
H+ Fe2+ Al3+
OH-
SO42-
S2-
阳离子
阴离子
已知化学式:硝酸铵 【NH4NO3 】
尿 素 【 CO (NH2)2 】
1、求出物质的相对分子质量
2、说出组成物质的元素种类
3、求出物质中各原子的个数比
复习提问
化合物的化学式不仅表示组成物质的各种元素,而且清楚地展示出其中所含元素的原子个数比。那么,化学式能否告诉我们有关组成元素之间的质量关系呢?
联想与启示
化合物中各元素的质量比
阅读课文P85 “活动与探究” ,小结物质中元素质量比的计算方法。
小结:
明确所求的元素种类
查出元素的相对原子质量
明确元素的原子个数比
计算元素的质量比
练习巩固
计算下列物质中各元素的质量比:
(1) 硝酸铵 【NH4NO3 】
(2) 尿 素 【 CO (NH2)2 】
36g水中含有多少克氢,多少克氧?(从分析化学式中氢、氧元素的质量占总质量的比入手,试着做一做。
交流与讨论
化合物中各元素的质量分数
质量分数
组成物质的各种成分的质量在总质量中所占的比例,成为质量分数,习惯上质量分数用百分数来表示。
这里的“成分”可以是元素(如人体中钙元素的质量分数约为2%);也可以是混合物中的各种组成物质(如生理盐水中氯化钠的质量分数约为0.9%)。
化合物中各元素的质量分数
质量分数的计算
某元素的质量分数
该元素的相对原子质量(Ar)×原子个数
= ×100%
化合物的相对分子质量(Mr)
例题:计算氧化铁(Fe2O3)中铁元素的质量分数。
先学后用:
解:铁元素的质量分数
该元素的相对原子质量(Ar)×原子个数
= ————————————--- ×100%
化合物的相对分子质量(Mr)
56×2
=——————×100%
160
=70%
答:略
练习巩固
计算下列物质中氮元素的质量分数(含氮量):
(1)硝酸铵【NH4NO3 】
(2)尿 素【 CO (NH2)2 】
1. 60千克尿素【 CO (NH2)2 】中含N几千克?
2. 多少千克尿素【 CO (NH2)2 】中含N56千克?
练习巩固
100g硝酸铵【NH4NO3 】含氮元素 多少克? 多少克硝酸铵含氮元素140g?
50kg硝酸铵【NH4NO3 】与多少kg尿素【 CO (NH2)2 】含有的氮元素质量相等?
拓展练习
活动与探究
现有一种尿素 【 CO (NH)2 】样品,测得其中氮元素的质量分数为43.5%,试通过计算说明该尿素样品是纯净物还是混合物?如是混合物该尿素样品中尿素的质量分数是多少?
活动与探究
以下是我省生产的某种加钙食盐包装标签上的部分文字。请仔细阅读后回答问题。
(1)包装标签上钙含量是指 .
(填单质、碳酸钙、钙元素中的一种)
(2)为了检验此盐中是否含有碳酸钙,
在家庭厨房里可以选用的物质是 。
(3)如一成年人每天吃食盐5g,则他相当于补了多少g碘元素,如果食盐中的碘以碘酸钾的形式存在,则相当于食用了多少碘酸钾(KIO3)?
配料表:氯化钠、食用碳酸钙、碘酸钾
净含量:500g
成分表:氯化钠≥88%
钙(以Ca计):(0.5-1.3)%
碘(以I计):(20-50)mg/kg
活动与探究
某碳酸氢铵化肥的外包装袋上部分说明如图所示,请仔细阅读并回答下列问题:
(1)保存该化肥应注意 。
(2)这袋化肥中氮元素的质量为 g。
碳酸氢铵
(NH4HCO3)
净重:50g
含氮量:16.8%
XXX化学工业公司
化学九年级上册 H
第 3章 物质构成的奥秘
第3节 物质的组成
1、化学上用什么来描述物质的组成。
2、写出你所知道物质的化学式
复习提问
1、什么叫化学式?
用元素符号和数字表示物质组成的式子。
阅读思考
一、化学式反映物质的组成
水分子
金属铁
氧化铜
HOH
H2O
Fe
CuO
铜原子:氧原子=1 :1
铁原子
2个氢原子、1个氧原子
思考:根据物质的化学式你能得到有关物质的组成和构成的哪些信息?
讨论交流
2、化学式的含义
小结点拨
表示物质和物质的组成元素
揭示物质中原子或离子的个数关系
如为“分子式”,则还可表示构成物质的一个分子及其分子的构成。
联想与启示
单质是由同种元素组成的纯净物。请试着书写出铝单质、氦单质、金刚石;氧气、氮气等物质的化学式,体会这些物质的化学式的写法有什么差异,把你的想法与同学们交流。
如何书写物质的化学式(一)
1、单质化学式
(1)直接用元素符号表示单质:
金属单质单质
稀有气体单质
部分固态非金属单质
如:钠(Na)银(Ag)汞(Hg)等
如:氦气(He)氖气(Ne)氩气等
如:金刚石(C)等
(2)用元素符号和数字表示单质:
气态非金属单质:如氢气(H2)、氧气(O2)、氮气(N2)、氟气(F2)、氯气(Cl2)、等。
联想与启示
化合物是由两种或两种以上元素组成的纯净物。请试着书写出水、二氧化碳、过氧化氢;氢氧化钙、碳酸氢铵等物质的化学式,体会化合物的化学式书写要领。
2、化合物的化学式
如何书写物质的化学式(二)
弄清物质的组成元素或原子团
某些元素的原子集合在一起作为一个整体参加化学反应,它所起的作用和一个原子一样,这样的原子集合称为原子团。化学上常用“根”来命名。如氢氧根(OH)、
碳酸根(CO3)铵根(NH4)等
确定元素原子或原子团的个数关系
1.定义:一种元素一定数目的原子与一种元素一定数目的原子化合的性质。
化合价
2.化合价的判断:
金属:易失电子,化合价为正价;一个原子失几个电子,化合价为正几。
非金属:易得电子,化合价为负价;一个原子得几个电子,化合价为负几。
常见元素的化合价:
1.化合物中元素有化合价,且组成元素的正负化合价代数和为零。
2.O为-2价,H一般为+1价
3.金属一般是正价,非金属一般是负价
化合价
4.单质中元素的化合价为零
5、有些元素有几种不同的化合价
如:铁有+2、+3价,碳有+2、+4价
常见元素的化合价(口诀)
一价钾钠氯氢银;二价氧钙钡镁锌;
三铝四硅五价磷;二、三铁,二、四碳;
硫有负二正四六;铜汞二价最常见;
正负变价要分清;莫忘单质都为零。
常见原子团的化合价(口诀)
负一硝酸氢氧根;负二碳酸硫酸根;
负三记住磷酸根;正一价的是铵根。
原子团 名称 原子团的化合价
CO3 碳酸根 -2
SO4 硫酸根 -2
OH 氢氧根 -1
NO3 硝酸根 -1
ClO 次氯酸根 -1
NH4 铵根 +1
SO3 亚硫酸根 -2
1、标出下列物质中各元素的化合价
H2O ZnS Fe H2CO3
化合价的标法
3、按要求用符号表示
(1)+2价的钙元素
(2)氯化钙中钙元素为+2价
2、标出下列物质中各原子团的化合价
NaOH CuSO4 NH4NO3
说出下列符号中“2”的含义:
(1). 2H (2). H2 (3). 2H2
+2
(4). Mg2+ (5). Mg (6).2H2O
+2
(7)2 Mg2+ (8)Mg O
1、什么叫化学式?
2、什么是化合价?说出常见元素及原子团的化合价。
3、说出下列符号的含义
复习提问
+2
+2
2Mg Mg2+ Mg MgCl2
例题:写出氧化铝、氢氧化铝的化学式
先学后用:
1、写出组成元素或原子团的符号
正价在左(前);负价在右(后);
金属在左(前);非金属在右(后);
氢元素在左(前);氧元素在右(后);
2、查出所需元素(或原子团)的化合价,确定原子(或原子团)个数关系
3、将原子(或原子团)个数作下标(个数1省略不写),写出化学式。
化合物的化学式书写要领
根据化合价书写化学式
已知:P为+5价,O为-2价,写出P的氧化物的化学式
1.最小公倍数法:
(1). 根据两种元素的化合价,计算最小公倍数
(2).把最小公倍数除以化合价,得出原子个数
(3).写出化学式
2.交叉法:
注意事项
并尝试写出下列物质的化学式。
(1)氧化钠、氧化钙
(2)硫化氢
(3)氧化铁
(4)氢氧化钾、氢氧化钡
(5)碳酸钙、硫酸铵
(6)碳酸、硫酸
体验练习:
根据化学式推断化合价
1.下列物质中,含有最高化合价元素的是( )
A.H2SO4 B.H3PO4 C.KNO3 D.KMnO4
2.下列物质中,相同元素的化合价相同的是( )
A.H2S,SO2 B.HCl,HClO
C.NH3,NO2 D.FeS,Fe(OH)2
3.在SiO2,K2FeO4中,Si和Fe的化合价为
___和____.
4.将(1)N2O (2)NH3 (3)N2
(4)N2O5 (5)N2O3 (6)NO
(7)NO2几种物质,按N元素化合价由低到高,排列的顺序是________________.
讨论:为什么由碳、氧元素组成的化合物有两种?请写出它们的化学式。
请写出四氧化三铁、五氧化二磷的化学式,体会简单化合物的命名方法
活动与探究
1、两种元素组成的化合物,在两种元素中间用“化”连接;
2、化学式中元素的名称从右往左读,与化学式的写法刚好相反;
3、元素的原子个数在元素之前先读出;
4、含有复杂原子团的化合物,要根据其特征来称呼,不需读出原子或原子团的个数。
简单化合物的命名
1、读出下列化学式
(1)N2O N2O5
(2)H2O H2O2
(3)AlCl3 FeCl2
(4)H2S NH3
(5)Na2SO4 (NH4)2SO4
(6)Fe(OH)3 Cu (OH)2
练习巩固
2、计算下列物质中划线元素的化合价
KMnO4 K2MnO4
3、已知漂白粉的有效成分次氯酸钙的化学式为Ca(ClO)2,试写出次氯酸钾和次氯酸的化学式。
练习巩固
4、利用提供的阴阳离子写出化学式
练习巩固
H+ Fe2+ Al3+
OH-
SO42-
S2-
阳离子
阴离子
已知化学式:硝酸铵 【NH4NO3 】
尿 素 【 CO (NH2)2 】
1、求出物质的相对分子质量
2、说出组成物质的元素种类
3、求出物质中各原子的个数比
复习提问
化合物的化学式不仅表示组成物质的各种元素,而且清楚地展示出其中所含元素的原子个数比。那么,化学式能否告诉我们有关组成元素之间的质量关系呢?
联想与启示
化合物中各元素的质量比
阅读课文P85 “活动与探究” ,小结物质中元素质量比的计算方法。
小结:
明确所求的元素种类
查出元素的相对原子质量
明确元素的原子个数比
计算元素的质量比
练习巩固
计算下列物质中各元素的质量比:
(1) 硝酸铵 【NH4NO3 】
(2) 尿 素 【 CO (NH2)2 】
36g水中含有多少克氢,多少克氧?(从分析化学式中氢、氧元素的质量占总质量的比入手,试着做一做。
交流与讨论
化合物中各元素的质量分数
质量分数
组成物质的各种成分的质量在总质量中所占的比例,成为质量分数,习惯上质量分数用百分数来表示。
这里的“成分”可以是元素(如人体中钙元素的质量分数约为2%);也可以是混合物中的各种组成物质(如生理盐水中氯化钠的质量分数约为0.9%)。
化合物中各元素的质量分数
质量分数的计算
某元素的质量分数
该元素的相对原子质量(Ar)×原子个数
= ×100%
化合物的相对分子质量(Mr)
例题:计算氧化铁(Fe2O3)中铁元素的质量分数。
先学后用:
解:铁元素的质量分数
该元素的相对原子质量(Ar)×原子个数
= ————————————--- ×100%
化合物的相对分子质量(Mr)
56×2
=——————×100%
160
=70%
答:略
练习巩固
计算下列物质中氮元素的质量分数(含氮量):
(1)硝酸铵【NH4NO3 】
(2)尿 素【 CO (NH2)2 】
1. 60千克尿素【 CO (NH2)2 】中含N几千克?
2. 多少千克尿素【 CO (NH2)2 】中含N56千克?
练习巩固
100g硝酸铵【NH4NO3 】含氮元素 多少克? 多少克硝酸铵含氮元素140g?
50kg硝酸铵【NH4NO3 】与多少kg尿素【 CO (NH2)2 】含有的氮元素质量相等?
拓展练习
活动与探究
现有一种尿素 【 CO (NH)2 】样品,测得其中氮元素的质量分数为43.5%,试通过计算说明该尿素样品是纯净物还是混合物?如是混合物该尿素样品中尿素的质量分数是多少?
活动与探究
以下是我省生产的某种加钙食盐包装标签上的部分文字。请仔细阅读后回答问题。
(1)包装标签上钙含量是指 .
(填单质、碳酸钙、钙元素中的一种)
(2)为了检验此盐中是否含有碳酸钙,
在家庭厨房里可以选用的物质是 。
(3)如一成年人每天吃食盐5g,则他相当于补了多少g碘元素,如果食盐中的碘以碘酸钾的形式存在,则相当于食用了多少碘酸钾(KIO3)?
配料表:氯化钠、食用碳酸钙、碘酸钾
净含量:500g
成分表:氯化钠≥88%
钙(以Ca计):(0.5-1.3)%
碘(以I计):(20-50)mg/kg
活动与探究
某碳酸氢铵化肥的外包装袋上部分说明如图所示,请仔细阅读并回答下列问题:
(1)保存该化肥应注意 。
(2)这袋化肥中氮元素的质量为 g。
碳酸氢铵
(NH4HCO3)
净重:50g
含氮量:16.8%
XXX化学工业公司
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
