化学人教版(2019)选择性必修1 3.3.1盐类的水解(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.1盐类的水解(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 10.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 17:44:44 | ||
图片预览





文档简介
(共22张PPT)
第三章水溶液中的离子反应与平衡
第三节 盐类的水解
第一课时 盐类的水解
1.知道盐类水解的原理。
2.学会书写盐类水解的方程式。
3.懂得盐类水解的类型和规律。
学习目标
纯碱是哪一种物质
从组成上看是哪类物质 酸、碱、盐?
为什么叫纯碱
问题引入
1.盐的分类(按生成盐的酸、碱的强弱划分):
盐
强酸强碱盐
强酸弱碱盐
③Na2CO3、CH3COONa
④NH4HCO3、CH3COONH4
① NH4Cl、(NH4)2SO4、CuSO4
②NaCl、KNO3
弱酸弱碱盐
强碱弱酸盐
一、盐的分类和盐溶液的酸碱性
问题:下列四组物质各属于哪一类盐?
酸溶液显酸性,碱溶液显碱性,那盐溶液显什么性呢?用什么方法可以测定?
知识回顾:溶液酸碱性的测定方法
①酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
②pH试纸法(定量粗略测量)
又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
③pH计法
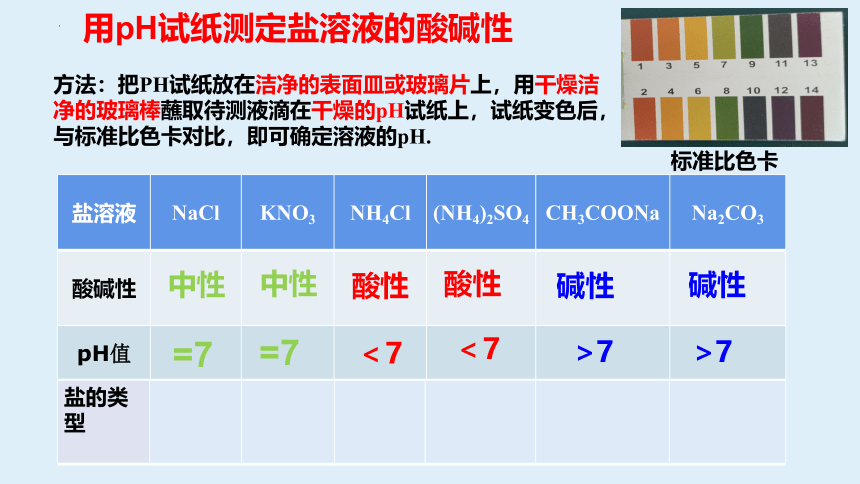
盐溶液 NaCl KNO3 NH4Cl (NH4)2SO4 CH3COONa
Na2CO3
酸碱性
pH值
盐的分类
盐的类型
用pH试纸测定盐溶液的酸碱性
方法:把PH试纸放在洁净的表面皿或玻璃片上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH.
标准比色卡
中性
酸性
碱性
中性
碱性
酸性
=7
>7
<7
=7
>7
<7
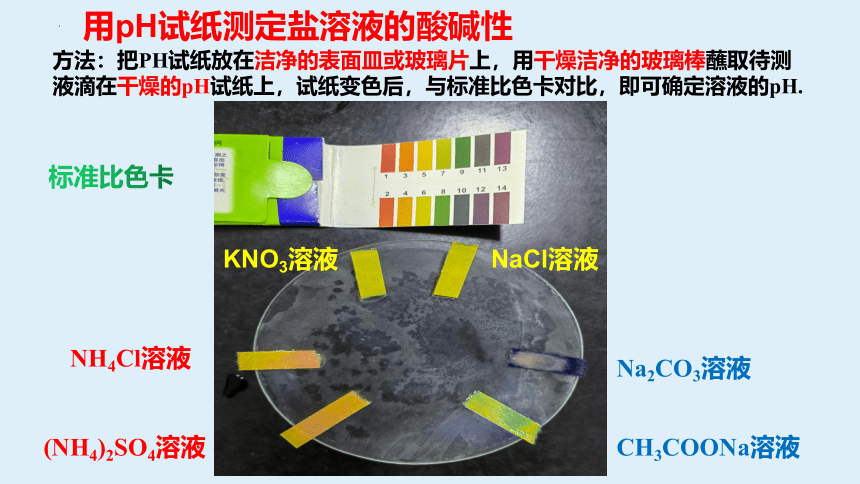
NaCl溶液
KNO3溶液
CH3COONa溶液
Na2CO3溶液
NH4Cl溶液
(NH4)2SO4溶液
标准比色卡
用pH试纸测定盐溶液的酸碱性
方法:把PH试纸放在洁净的表面皿或玻璃片上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH.
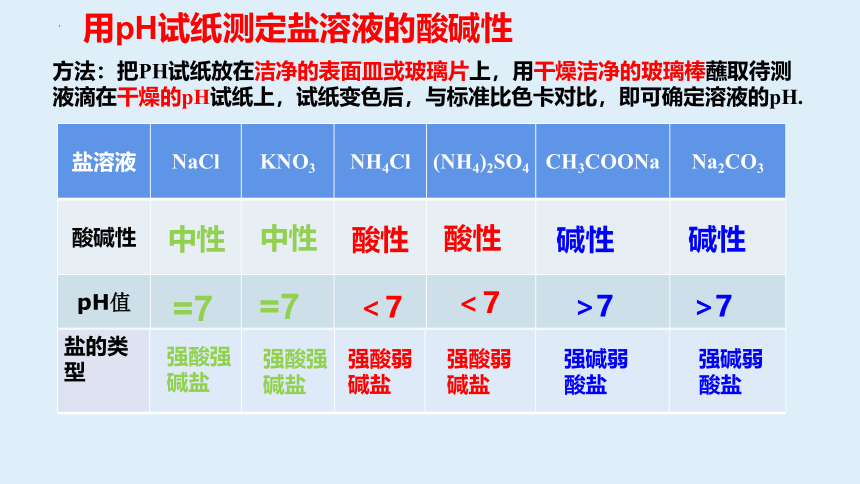
盐溶液 NaCl KNO3 NH4Cl (NH4)2SO4 CH3COONa
Na2CO3
酸碱性
pH值
中性
酸性
碱性
中性
碱性
酸性
=7
>7
<7
=7
>7
<7
盐的分类
盐的类型
用pH试纸测定盐溶液的酸碱性
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
强酸强碱盐
强酸弱碱盐
方法:把PH试纸放在洁净的表面皿或玻璃片上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH.
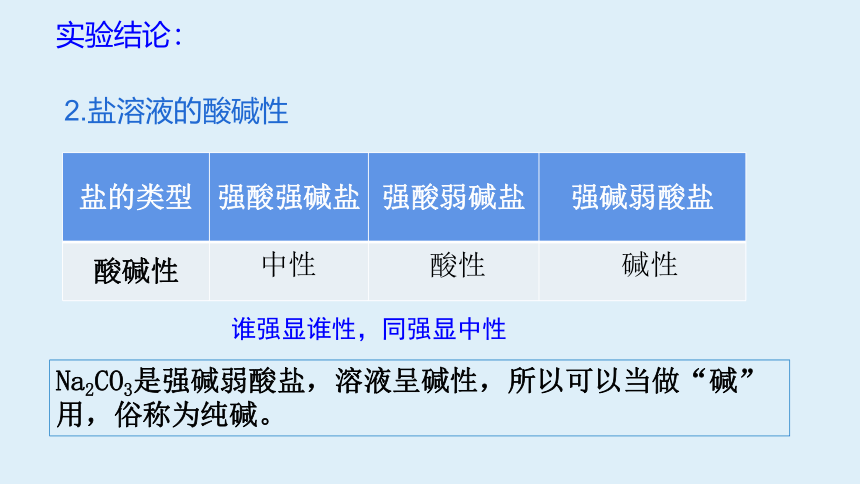
实验结论:
2.盐溶液的酸碱性
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
酸碱性
中性
酸性
碱性
Na2CO3是强碱弱酸盐,溶液呈碱性,所以可以当做“碱”用,俗称为纯碱。
谁强显谁性,同强显中性
二、盐溶液呈现不同酸碱性的原因
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小。
那么是什么原因造成了不同类型的盐溶液中c(H+)与c(OH-)的相对大小不同呢?
对三类不同类型的盐溶液中存在的各种离子,以及离子间的相互作用进行分析,尝试找出不同类型盐溶液呈现不同酸碱性的原因。
盐溶液 NaCl 溶液 NH4Cl 溶液
CH3COONa溶液
溶液中的离子
有无弱电解质生成
C(H+)和C(OH-) 相对大小
CH3COO-, Na+, H+, OH-
Cl-, NH4+, H+, OH-
Cl-, Na+, H+, OH-
有
有
无
C(H+) < C(OH-)
C(H+) = C(OH-)
C(H+) > C(OH-)
思考与讨论:(课本p72)
NH3.H2O
CH3COOH
NH4Cl NH4+ + Cl-
==
H2O OH- + H+
+
NH3·H2O
分析:NH4Cl溶液(强酸弱碱盐)
NH4Cl +H2O NH3.H2O + HCl
NH4+ +H2O NH3.H2O + H+
化学方程式:
离子方程式:
二、盐溶液呈现不同酸碱性的原因
溶液中:C(H+)>C(OH-),呈酸性。
+
CH3COOH
CH3COONa
CH3COO-
Na+ +
H2O
H+
OH- +
溶液中:C(OH-)>C(H+),呈碱性。
CH3COO-+H2O
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
化学方程式:
离子方程式:
分析:CH3COONa溶液(强碱弱酸盐)
二、盐溶液呈现不同酸碱性的原因
分析:NaCl溶液(强酸强碱盐)
H2O OH-+H+,NaCl===Na++Cl-,盐电离出的离子Na+和Cl-不能与H2O电离出的H+或OH-生成________,c(H+)=c(OH-),该盐溶液呈中性。
弱电解质
二、盐溶液呈现不同酸碱性的原因
三、盐类的水解
在水溶液中,盐电离出来的离子与水电离产生的H+或OH-结合生成弱电解质的反应,称为盐类的水解。把它们反应的方程式叫盐类水解的方程式。
1.定义
含有弱碱阳离子或弱酸阴离子
破坏了水的电离平衡(即能水解的盐促进水的电离)
是酸碱中和反应的逆反应,水解的程度一般非常微弱
盐 +水 酸 + 碱 △H > 0
水解
中和
①水解的条件:
②水解的实质:
③水解的特点:
我们把能跟水电离的H+或OH-结合成弱电解质的离子叫弱离子。如弱碱阳离子(NH4+)和弱酸阴离子(CH3COO-)
有弱才水解 无弱不水解
都弱都水解 越弱越水解
谁强显谁性 同强显中性
2.盐类水解规律(资料P72)
四、盐类水解方程式书写(资料P72)
盐类水解是中和反应的逆反应,一般水解程度小,水解产物少。所以常用“ ” ;不写“ == ”、“↑”、“↓”;也不把生成物(如NH3·H2O、H2CO3)写成分解产物的形式。
通常先找“弱”离子:找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子)直接写出弱酸弱碱离子于水反应的离子方程式。
CH3COO- +H2O
CH3COOH+OH-
1.一元强碱弱酸盐水解反应的离子方程式(如CH3COONa)
2.一元强酸弱碱盐水解反应的离子方程式(如NH4Cl)
NH4+ +H2O NH3.H2O + H+
3.多元弱酸盐分步水解,但以第一步水解为主
如Na2CO3
CO32-+H2O HCO3-+ OH-
HCO3-+H2O H2CO3+OH-
(主)
4.多元弱碱盐的水解,常写成一步完成。
如AlCl3
Al3++3H2O Al(OH)3+3H+
四、盐类水解方程式书写(资料P72)
5.多元弱酸的酸式盐
如NaHCO3
HCO3-+H2O H2CO3+OH-
1.写出下列盐水解的反应的离子方程式。
NH4NO3
Na2S
FeCl3
CuSO4
NH4++H2O NH3.H2O +H+
S 2-+H2O HS—+OH—
Fe 3++3H2O Fe(OH)3+3H+
练一练
2.完成资料 P72 提升2
Cu2++2H2O Cu(OH)2+2H+
6.弱酸弱碱盐水解相互促进,水解程度较大且生成气体或沉淀的(称为完全双水解),书写时要用“===”“↑”“↓”;但如果水解仍然较小的,书写仍用“ ”。
如2Al3++3CO32-+3H2O===2Al(OH)3↓+3CO2↑
CH3COO-+NH4++H2O CH3COOH+NH3·H2O。
四、盐类水解方程式书写(资料P72)
能够发生完全双水解之间的离子之间不能大量共存。
常见的能发生完全双水解的离子
Al3+
HCO3-
CO32-
S2-
AlO2-
HS-
SO32-
ClO-
Fe3+
HCO3-
CO32-
AlO2-
AlO2-
SiO32-
NH4+
本节课我们学到了什么?
一、盐的分类和盐溶液的酸碱性
四、盐类水解方程式的书写
三、盐类的水解规律
二、盐溶液呈现不同酸碱性的原因
第三章水溶液中的离子反应与平衡
第三节 盐类的水解
第一课时 盐类的水解
1.知道盐类水解的原理。
2.学会书写盐类水解的方程式。
3.懂得盐类水解的类型和规律。
学习目标
纯碱是哪一种物质
从组成上看是哪类物质 酸、碱、盐?
为什么叫纯碱
问题引入
1.盐的分类(按生成盐的酸、碱的强弱划分):
盐
强酸强碱盐
强酸弱碱盐
③Na2CO3、CH3COONa
④NH4HCO3、CH3COONH4
① NH4Cl、(NH4)2SO4、CuSO4
②NaCl、KNO3
弱酸弱碱盐
强碱弱酸盐
一、盐的分类和盐溶液的酸碱性
问题:下列四组物质各属于哪一类盐?
酸溶液显酸性,碱溶液显碱性,那盐溶液显什么性呢?用什么方法可以测定?
知识回顾:溶液酸碱性的测定方法
①酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
②pH试纸法(定量粗略测量)
又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
③pH计法
盐溶液 NaCl KNO3 NH4Cl (NH4)2SO4 CH3COONa
Na2CO3
酸碱性
pH值
盐的分类
盐的类型
用pH试纸测定盐溶液的酸碱性
方法:把PH试纸放在洁净的表面皿或玻璃片上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH.
标准比色卡
中性
酸性
碱性
中性
碱性
酸性
=7
>7
<7
=7
>7
<7
NaCl溶液
KNO3溶液
CH3COONa溶液
Na2CO3溶液
NH4Cl溶液
(NH4)2SO4溶液
标准比色卡
用pH试纸测定盐溶液的酸碱性
方法:把PH试纸放在洁净的表面皿或玻璃片上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH.
盐溶液 NaCl KNO3 NH4Cl (NH4)2SO4 CH3COONa
Na2CO3
酸碱性
pH值
中性
酸性
碱性
中性
碱性
酸性
=7
>7
<7
=7
>7
<7
盐的分类
盐的类型
用pH试纸测定盐溶液的酸碱性
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
强酸强碱盐
强酸弱碱盐
方法:把PH试纸放在洁净的表面皿或玻璃片上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH.
实验结论:
2.盐溶液的酸碱性
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
酸碱性
中性
酸性
碱性
Na2CO3是强碱弱酸盐,溶液呈碱性,所以可以当做“碱”用,俗称为纯碱。
谁强显谁性,同强显中性
二、盐溶液呈现不同酸碱性的原因
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小。
那么是什么原因造成了不同类型的盐溶液中c(H+)与c(OH-)的相对大小不同呢?
对三类不同类型的盐溶液中存在的各种离子,以及离子间的相互作用进行分析,尝试找出不同类型盐溶液呈现不同酸碱性的原因。
盐溶液 NaCl 溶液 NH4Cl 溶液
CH3COONa溶液
溶液中的离子
有无弱电解质生成
C(H+)和C(OH-) 相对大小
CH3COO-, Na+, H+, OH-
Cl-, NH4+, H+, OH-
Cl-, Na+, H+, OH-
有
有
无
C(H+) < C(OH-)
C(H+) = C(OH-)
C(H+) > C(OH-)
思考与讨论:(课本p72)
NH3.H2O
CH3COOH
NH4Cl NH4+ + Cl-
==
H2O OH- + H+
+
NH3·H2O
分析:NH4Cl溶液(强酸弱碱盐)
NH4Cl +H2O NH3.H2O + HCl
NH4+ +H2O NH3.H2O + H+
化学方程式:
离子方程式:
二、盐溶液呈现不同酸碱性的原因
溶液中:C(H+)>C(OH-),呈酸性。
+
CH3COOH
CH3COONa
CH3COO-
Na+ +
H2O
H+
OH- +
溶液中:C(OH-)>C(H+),呈碱性。
CH3COO-+H2O
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
化学方程式:
离子方程式:
分析:CH3COONa溶液(强碱弱酸盐)
二、盐溶液呈现不同酸碱性的原因
分析:NaCl溶液(强酸强碱盐)
H2O OH-+H+,NaCl===Na++Cl-,盐电离出的离子Na+和Cl-不能与H2O电离出的H+或OH-生成________,c(H+)=c(OH-),该盐溶液呈中性。
弱电解质
二、盐溶液呈现不同酸碱性的原因
三、盐类的水解
在水溶液中,盐电离出来的离子与水电离产生的H+或OH-结合生成弱电解质的反应,称为盐类的水解。把它们反应的方程式叫盐类水解的方程式。
1.定义
含有弱碱阳离子或弱酸阴离子
破坏了水的电离平衡(即能水解的盐促进水的电离)
是酸碱中和反应的逆反应,水解的程度一般非常微弱
盐 +水 酸 + 碱 △H > 0
水解
中和
①水解的条件:
②水解的实质:
③水解的特点:
我们把能跟水电离的H+或OH-结合成弱电解质的离子叫弱离子。如弱碱阳离子(NH4+)和弱酸阴离子(CH3COO-)
有弱才水解 无弱不水解
都弱都水解 越弱越水解
谁强显谁性 同强显中性
2.盐类水解规律(资料P72)
四、盐类水解方程式书写(资料P72)
盐类水解是中和反应的逆反应,一般水解程度小,水解产物少。所以常用“ ” ;不写“ == ”、“↑”、“↓”;也不把生成物(如NH3·H2O、H2CO3)写成分解产物的形式。
通常先找“弱”离子:找出盐类组成中会发生水解的离子(弱酸阴离子或弱碱阳离子)直接写出弱酸弱碱离子于水反应的离子方程式。
CH3COO- +H2O
CH3COOH+OH-
1.一元强碱弱酸盐水解反应的离子方程式(如CH3COONa)
2.一元强酸弱碱盐水解反应的离子方程式(如NH4Cl)
NH4+ +H2O NH3.H2O + H+
3.多元弱酸盐分步水解,但以第一步水解为主
如Na2CO3
CO32-+H2O HCO3-+ OH-
HCO3-+H2O H2CO3+OH-
(主)
4.多元弱碱盐的水解,常写成一步完成。
如AlCl3
Al3++3H2O Al(OH)3+3H+
四、盐类水解方程式书写(资料P72)
5.多元弱酸的酸式盐
如NaHCO3
HCO3-+H2O H2CO3+OH-
1.写出下列盐水解的反应的离子方程式。
NH4NO3
Na2S
FeCl3
CuSO4
NH4++H2O NH3.H2O +H+
S 2-+H2O HS—+OH—
Fe 3++3H2O Fe(OH)3+3H+
练一练
2.完成资料 P72 提升2
Cu2++2H2O Cu(OH)2+2H+
6.弱酸弱碱盐水解相互促进,水解程度较大且生成气体或沉淀的(称为完全双水解),书写时要用“===”“↑”“↓”;但如果水解仍然较小的,书写仍用“ ”。
如2Al3++3CO32-+3H2O===2Al(OH)3↓+3CO2↑
CH3COO-+NH4++H2O CH3COOH+NH3·H2O。
四、盐类水解方程式书写(资料P72)
能够发生完全双水解之间的离子之间不能大量共存。
常见的能发生完全双水解的离子
Al3+
HCO3-
CO32-
S2-
AlO2-
HS-
SO32-
ClO-
Fe3+
HCO3-
CO32-
AlO2-
AlO2-
SiO32-
NH4+
本节课我们学到了什么?
一、盐的分类和盐溶液的酸碱性
四、盐类水解方程式的书写
三、盐类的水解规律
二、盐溶液呈现不同酸碱性的原因
