第一章 第二节 离子反应 第一课时 电解质的电离(共72张ppt)
文档属性
| 名称 | 第一章 第二节 离子反应 第一课时 电解质的电离(共72张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 17:47:37 | ||
图片预览










文档简介
(共72张PPT)
第二节 离子反应
第一课时 电解质的电离
第一章 物质及其变化
【课程标准要求】
1.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
2.能用电离方程式表示某些酸、碱、盐的电离。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
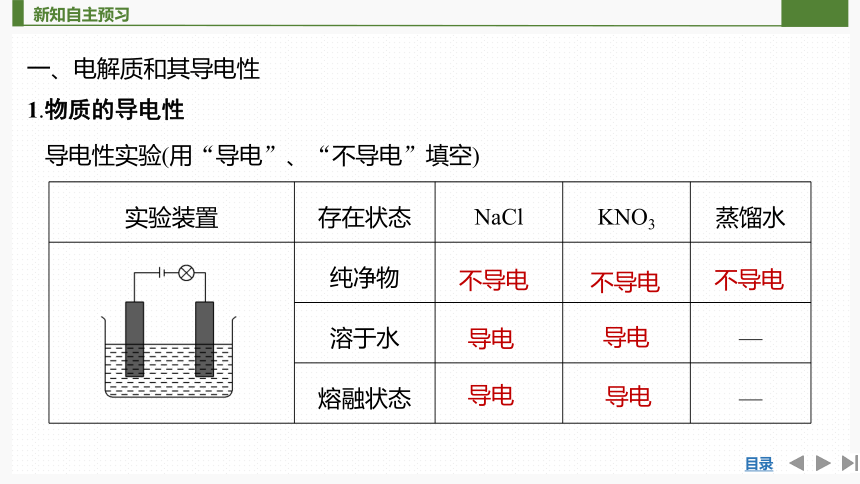
一、电解质和其导电性
1.物质的导电性
导电性实验(用“导电”、“不导电”填空)
实验装置 存在状态 NaCl KNO3 蒸馏水
纯净物
溶于水 —
熔融状态 —
不导电
不导电
不导电
导电
导电
导电
导电
2.结论
(1)①干燥的NaCl、KNO3固体不导电,蒸馏水不导电。
②NaCl、KNO3的水溶液或熔融状态均能导电。
(2)导电条件及原因
固体电解质不导电,只有在水溶液里或受热熔化时才能导电。因为电解质在水溶液里或受热熔化时发生了______,电离出了能__________的阴阳离子,阴阳离子在电场作用下发生______移动。
电离
自由移动
定向
3.电解质与非电解质
(1)电解质:在水溶液里或熔融状态下能够导电的________叫做电解质。如酸、碱、盐等。
(2)非电解质:在水溶液里和熔融状态下均不导电的化合物叫非电解质,如CO、NH3、CO2等。
化合物
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )
(2)液态H2SO4、固态NaCl均不导电,所以H2SO4、NaCl均不是电解质( )
(3)NH3、CO2的水溶液能导电,所以NH3、CO2均是电解质( )
(4)NaCl晶体不能导电,是由于其中不含离子( )
答案 (1)× (2)× (3)× (4)×
二、电解质的电离
1.电离
(1)概念:电解质溶于水或受热熔化时,形成自由移动的______的过程,叫做电离。
(2)表示方法——电离方程式
电解质的电离可以用电离方程式表示,为简便起见,一般仍用离子符号表示水合离子。
离子
(3)实例
写出下列电解质的电离方程式:
①H2SO4:__________________________;
②KNO3:__________________________;
③Ca(OH)2:_________________________。
Ca(OH)2===Ca2++2OH-
2.从电离的角度认识酸、碱、盐
(1)酸
①含义:电离时生成的阳离子全部是______的化合物叫做酸。
②实例
H+
H+
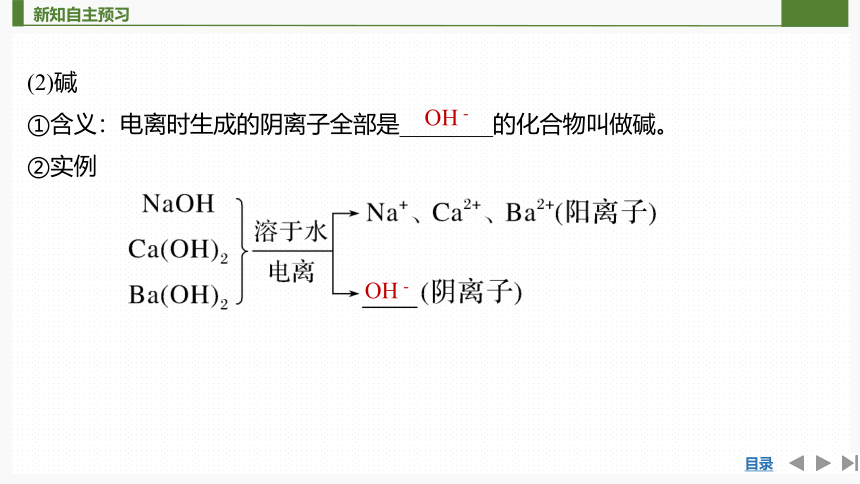
(2)碱
①含义:电离时生成的阴离子全部是________的化合物叫做碱。
②实例
OH-
OH-
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)电解质在通电时才能发生电离( )
(2)NaHSO4溶于水时电离出H+,故NaHSO4属于酸( )
(3)纯碱溶液呈碱性,故纯碱属于碱( )
(4)盐酸属于酸( )
答案 (1)× (2)× (3)× (4)×
二、电解质的电离与导电性
一、电解质、非电解质的比较与判断
一、电解质、非电解质的比较与判断
1.电解质与非电解质的比较
电解质 非电解质
相同点 均为化合物 不同点 在水溶液里或熔融状态下能导电 在水溶液里和熔融状态下都不能导电
本质区别 在水溶液里或熔融状态下自身能发生电离 在水溶液里和熔融状态下自身都不能发生电离
在水溶液里或熔融状态下的存在形式 离子(或离子和分子) 分子
2.常见的电解质与非电解质
(1)
(2)
(1)电解质和非电解质研究的对象都是化合物,单质和混合物既不属于电解质,也不属于非电解质。
(2)电解质导电的条件是在水溶液里或熔融状态下,两个条件具备一个即可。
①有些电解质溶于水能导电,熔融状态不能导电,如所有酸。
②有些电解质只在熔融状态下能导电,如BaSO4,其水溶液不导电是因为BaSO4难溶于水。
③电解质本身不一定能导电,如NaCl固体;能导电的物质不一定是电解质,如石墨和所有金属等。
1.市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是( )
A.Fe B.葡萄糖
C.MgSO4 D.CO2
解析 Fe是单质,既不是电解质,也不是非电解质;葡萄糖、CO2是非电解质,MgSO4属于盐,属于电解质。
C
2.下列说法正确的是( )
A.铜能导电,所以它是电解质
B.氨气的水溶液能导电,所以它是电解质
C.液态H2SO4不能导电,所以它是非电解质
D.酒精在水溶液里和熔融状态下都不能导电,所以它是非电解质
解析 判断物质是否为电解质,一看物质类别必须是化合物(酸、碱、盐、水等),选项A不正确;二看溶于水或熔融状态下能否导电,选项C不正确,选项D正确;三看溶于水时若与水反应,其溶液导电可能是非电解质,选项B不正确。
D
3.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出以下结论正确的是( )
A.硝酸钾固体不是电解质
B.硝酸钾溶液是电解质
C.硝酸钾在水溶液中电离出了可以自由移动的离子
D.在硝酸钾溶液中,水电离出了大量的离子
解析 硝酸钾是电解质,但硝酸钾固体中没有可以自由移动的离子而不导电,硝酸钾溶液是混合物不是电解质。
C
二、电解质的电离与导电性
某兴趣小组同学在测定溶液的导电性实验时,采用如图所示的串联装置,闭合电键时,发现灯泡不亮。
1.判断四个烧杯中所盛溶液溶质的类别各是什么?
提示 醋酸、硝酸属于酸,KOH属于碱、Cu(NO3)2属于盐。
2.小灯泡不亮的原因是什么?怎样才能使灯泡亮起来?
提示 四个烧杯中,只有烧杯C中纯硝酸没有自由移动的离子,不导电,整个装置没有形成闭合回路,灯泡不亮。向烧杯C中加水后,HNO3发生电离而导电,灯泡能亮起来。
3.上述四个烧杯中,哪些烧杯中的物质发生了电离?写出Cu(NO3)2和KOH的电离方程式。
1.电离方程式的书写方法
2.电解质溶液导电的原因
电解质溶液能导电是由于电解质本身能电离出自由移动的离子,例如:
3.电解质溶液的导电能力
(1)电解质的电离是电解质导电的前提条件。电解质溶于水或受热熔化时,电离产生自由移动的离子,此时接入外加电源才能导电,而不是通电后才发生电离。
(2)电解质溶液的导电能力与溶液中单位体积的离子数目、离子所带电荷多少有关,一般来说,单位体积的离子数目越大,离子所带的电荷越多,溶液的导电能力越强。
4.下列水溶液中的电离方程式正确的是( )
A
5.已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。若有一定浓度的Ca(OH)2溶液,向该溶液中逐渐通入CO2。则下列四个图中,能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)的是( )
D
解析 由于通入CO2后溶液中自由移动的单位体积的离子数目逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,反应生成自由移动的单位体积的离子数目逐渐增大,导电能力也逐渐增大,当反应进行完全后,溶液中自由移动的单位体积的离子数目基本保持不变,溶液导电能力基本保持不变,所以选D。
1.(2021·浙江湖州高一期末)下列物质属于电解质的是( )
A.酒精 B.NaCl
C.稀硫酸 D.Cu
解析 A.酒精溶于水不导电,不属于电解质,故A不符合题意;B.NaCl溶于水能导电,属于电解质,故B符合题意;C.稀硫酸是混合物,不属于电解质,故C不符合题意;D.Cu是金属单质,不属于电解质,故D不符合题意。
B
2.(2021·广东广州高一期中)下列说法正确的是( )
A.NaCl在电流的作用下可以电离出钠离子和氯离子
B.CO2溶于水能导电,CO2属于电解质
C.熔融的NaOH属于电解质
D.H2SO4属于电解质,在水溶液和熔融状态下可以导电
C
解析 NaCl在水溶液中自动电离出Na+、Cl-,不需要电流的作用,故A错误;CO2溶于水生成的 H2CO3能发生电离,CO2属于非电解质,故B错误;熔融的NaOH中存在自由移动的离子,能导电,属于电解质,故C正确;H2SO4属于电解质,在水溶液中可以导电,在熔融状态下不能导电,故D错误。
3.下列物质溶于水时,不能电离出酸根离子的是( )
A.NaNO3 B.Ba(OH)2
C.KMnO4 D.KCl
解析 氢氧化钡是碱,电离出的是氢氧根离子,其他三种物质均能电离出酸根离子。
B
4.在水溶液中,下列电离方程式错误的是( )
C
解析 BaCl2的电离方程式为BaCl2===Ba2++2Cl-。
5.现有下列物质:
①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体
⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩胆矾晶体
请用序号填空:
(1)上述状态下可导电的是__________。
(2)属于电解质的是____________。
(3)上述状态下的电解质不能导电的是___________。
(4)④中溶质的电离方程式:____________________________________;
⑦在水溶液中的电离方程式:__________________________________。
②④⑥⑨
①③⑦⑨⑩
①③⑦⑩
解析 化合物中酸(如氯化氢)、碱(如氢氧化钠)、盐(如碳酸钠、胆矾)都是电解质;化合物中非金属氧化物(如二氧化碳)、大部分有机物(如蔗糖)都是非电解质;单质(如铜)和混合物(如稀硫酸、氨水)既不是电解质,也不是非电解质。能导电的物质有金属(如铜)、熔融电解质(如熔融氯化钠)、电解质溶液(如稀硫酸、氨水)。
1.下列物质属于电解质的是( )
A.Zn B.NaOH
C.H2SO4溶液 D.MgCl2溶液
解析 Zn是单质,既不属于电解质又不属于非电解质,A错误;NaOH在水中或者熔融状态下可以电离,是电解质,B正确;H2SO4溶液是混合物,既不属于电解质又不属于非电解质,C错误;MgCl2溶液是混合物,既不属于电解质又不属于非电解质,D错误。
B
2.下列关于酸、碱、盐的各种说法中正确的是( )
A.电离出的阳离子有H+的化合物叫酸
B.电离出OH-的化合物叫碱
C.化合物电离时,生成金属阳离子(或铵根离子)和酸根阴离子的是盐
D.NaHSO4可以电离出H+,因此NaHSO4属于酸
解析 电离时生成的阳离子只有H+的化合物称为酸,生成的阴离子只有OH-的化合物称为碱, A、B项错误; NaHSO4电离的阳离子除H+外还有Na+,不属于酸,NaHSO4应属于酸式盐,D项错误。
C
3.下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )
解析 依据酸的概念——电离产生的阳离子全部是H+的化合物,B符合题意。
B
4.下列四项都能导电,其中一项与其他三项导电原理不同的是( )
A.氯化钠熔化导电
B.液态汞导电
C.硫酸溶液导电
D.熔融状态氢氧化钾导电
解析 电解质硫酸、氯化钠、氢氧化钾溶于水或熔融状态下,都能电离产生自由移动的离子而导电;金属汞是自由电子定向移动而导电。
B
A
5.下列电离方程式不正确的是( )
解析 AlCl3电离方程式为AlCl3===Al3++3Cl-,A错误。
6.今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中,正确的是( )
A.X可以是任何化合物 B.X可能为非电解质
C.X一定是盐类 D.X一定为电解质
解析 X不可能是某些化合物,如CO等,故A项错误;熔化状态或溶于水中能够电离,X不可能为非电解质,故B项错误;X可能是酸、碱、盐,也可能是CaO等金属氧化物,故C项错误;因为X为固体化合物并且在熔化状态或溶于水中能够电离出离子从而导电,所以X一定为电解质,故D项正确。
D
7.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
解析 A项中盐酸是混合物;C项中氨水是混合物,铜既不是电解质也不是非电解质,硫酸钡是电解质;D项中氯气既不是电解质也不是非电解质。B项正确,应注意冰水混合物,只是物质状态不同,成分只有水,是纯净物。
B
纯净物 混合物 电解质 非电解质
A 盐酸 澄清石灰水 硫酸 干冰
B 冰水混合物 酒精溶液 硫酸钡 二氧化碳
C 氨水 盐酸 铜 硫酸钡
D 胆矾 食盐水 氯化铜 氯气
8.在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸
D.硫酸铜中逐滴加入氢氧化钡溶液
D
解析 溶液能否导电,取决于溶液中是否有离子存在;导电性强弱则由单位体积内离子数目大小等因素决定。D选项中,发生反应CuSO4+Ba(OH)2===BaSO4↓+Cu(OH)2↓,溶液中离子数目减小,恰好完全反应在时,溶液中几乎没有离子,继续滴加Ba(OH)2溶液,Ba(OH)2过量,溶液中Ba2+、OH-数目增多,导电能力增强。
9.某化学兴趣小组在实验室中进行化学实验时,按图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl溶液是电解质
B.在通电的条件下,NaCl在水中电离出大量
的离子而导电
C.NaCl固体中无阴阳离子,因此不能导电
D.同一温度下,将乙中的NaCl溶液换成单位体积内离子数目相等的KCl溶液,溶液导电性不变
D
解析 NaCl溶液是混合物,既不是电解质也不是非电解质,故A错误;NaCl在水分子的作用下电离出可以自由移动的离子,而不是在通电的条件下电离,故B错误;NaCl固体中存在阴、阳离子,但是阴、阳离子不能自由移动,所以不导电,故C错误;同一温度下,将乙中的NaCl溶液换成单位体积内离子数目相等的KCl溶液,溶液中电荷数不变,溶液导电性不变,故D正确。
10.向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用如图中的曲线表示的是( )
A.曲线a B.曲线b
C.曲线c D.曲线d
C
解析 开始发生反应:Ba(OH)2+H2SO4===BaSO4↓+2H2O,使自由移动的离子数目逐渐减小,溶液的导电性逐渐减弱。当氢氧化钡和硫酸恰好完全反应时,沉淀达到最大值,这时自由移动的离子数目最小,导电能力最弱。随后,随着硫酸的加入,这时溶液为硫酸溶液,自由移动的离子数目又逐渐增大,导电能力逐渐增强。
11.(1)有下列物质:a.Fe b.CO2 c.Na2O d.Cu(OH)2 e.MgCl2 f.NH4Cl
g.H2SO4 h.C2H5OH(乙醇)(用字母作答)。
①按组成进行分类,属于酸的有________,属于碱的有________,属于盐的有________。
②上述八种物质中,属于电解质的有________________,属于非电解质的有________。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4:________________________________________;
②NaHCO3:________________________________________;
③Al2(SO4)3:_______________________________________。
g
d
e、f
c、d、e、f、g
b、h
12.某课外活动小组根据熔融状态下的NaCl能导电,推测AlCl3在熔融状态下也能导电,可是通过实验发现熔融状态的下AlCl3不能导电,而AlCl3水溶液却能导电,据此回答下列问题。
(1)熔融状态的AlCl3不导电的原因是________________________________
___________________________________________________________。
(2)AlCl3水溶液能导电的原因是________________________________
___________________________________________________________。
熔融状态下氯化铝不发生电离,
以分子形式存在,不存在自由移动的离子
AlCl3在水分子的作用下能电离出自
由移动的离子
(3)电解质溶液导电与金属导电的原理________(填“相同”或“不相同”,若填“相同”,下一空不必填写;若填“不相同”,完成下一空),区别是___________________________________________________________
___________________________________________________________。
(4)分别把58.5 g NaCl和133.5 g AlCl3溶于水配制体积相同的NaCl溶液和AlCl3溶液,____________的导电能力更强,理由是
___________________________________________________________。
不相同
电解质溶液导电是由于阴、阳离子的定向移动,金属导电是由于自由电子的定向移动
AlCl3溶液
AlCl3电离出的离子数目多且所带电荷数多,溶液导电能力更强
13.导体是指电阻率很小且易于传导电流的物质。导体中存在大量可自由移动的带电粒子,这些带电粒子被称为载流子。在外电场作用下,载流子发生定向运动,形成明显的电流。第一类导体是金属,是最常见的一类导体。第二类导体是有电解质的溶液或熔融电解质,其载流子是阳、阴离子。
下列叙述正确的是( )
A.虽然石墨有较好的导电性,但它属于非电解质
B.实验测得CO2的水溶液能导电,所以CO2是电解质
C.实验测得液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D.蔗糖(纯净物)在水溶液中和熔融状态下均不能导电,所以蔗糖属于非电解质
D
解析 石墨能导电,但石墨是单质,既不是电解质也不是非电解质,A错误;CO2的水溶液能导电,但不是CO2自身电离产生自由移动的离子,是CO2与水反应生成的H2CO3电离产生自由移动的离子,故CO2不是电解质,B项错误;液态HCl不能导电,但溶于水时导电,同理NaCl不导电,但溶于水或熔融状态下能导电,因此HCl、NaCl是电解质,C错误;在水溶液中和熔融状态下均不能导电的化合物是非电解质,D正确。
14.下表是常见的几种酸、碱、盐在水溶液中解离出离子的情况,根据表中信息分析正确的是( )
A.在水溶液中电离出H+的物质一定是酸
B.在水溶液中电离出金属阳离子和酸根离子的物质一定是盐
C.盐溶液电离出的阳离子一定是金属阳离子
D.碱溶液电离出的离子一定是金属阳离子和OH-
B
15.(2020·山西长治高一月考)在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入A溶液时,溶液的导电性的变化趋势如图(Ⅱ)所示。
(1)滴加溶液A至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,溶液A中含有的溶质可能是________(填序号)。
①HCl ②H2SO4
③NaHSO4 ④NaHCO3
②
解析 (1)反应特征是反应达到一定程度,溶液导电性最小,几乎不导电,说明反应过程中恰好完全反应生成沉淀和难电离的物质,①HCl 和氢氧化钡反应生成氯化钡溶液为易电离,故①不符合;②H2SO4滴入氢氧化钡溶液中恰好完全反应生成硫酸钡沉淀和水,离子数目几乎为零,不导电,故②符合;③NaHSO4滴入反应生成硫酸钡沉淀、水,同时生成硫酸钠易电离,故③不符合;④NaHCO3滴入氢氧化钡溶液反应生成碳酸钡沉淀,水和碳酸钠,碳酸钠易电离,故④错误;
(2)关于图(Ⅱ)下列说法中错误的是________(填字母)。
A.反应前一段导电能力不断减弱,说明生成的BaSO4是非电解质
B.图(Ⅱ)中最低点导电能力约为零说明溶液中几乎没有自由移动的离子
C.图(Ⅱ)中最低点导电能力约为零时,Ba(OH)2溶液与稀硫酸恰好完全中和
D.Ba(OH)2 、H2SO4 和BaSO4都是电解质
A
解析 (2)A.反应前一段导电能力不断减弱,说明溶液中的离子数目下降,但生成的BaSO4是电解质,故A错误;B.溶液的导电性取决于溶液中单位体积内离子数目的大小,图(Ⅱ)中最低点导电能力约为零说明溶液中自由移动的离子数目接近0,故B正确;C.Ba(OH)2溶液与稀硫酸恰好完全中和时生成硫酸钡和水,溶液中的离子数目最小,导电性接近0,故C正确;D.Ba(OH)2、H2SO4和BaSO4都能自身电离出离子,都是电解质,故D正确;
(3)请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式:
___________________________________________________________。
②NaHSO4属于________(填“酸”、“碱”或“盐”)。
③将NaHSO4溶液中逐滴加入Ba(OH)2溶液能否出现如图(Ⅱ)的导电性曲线________。
A.能 B.否
盐
B
Thanks!
本讲内容结束
第二节 离子反应
第一课时 电解质的电离
第一章 物质及其变化
【课程标准要求】
1.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
2.能用电离方程式表示某些酸、碱、盐的电离。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、电解质和其导电性
1.物质的导电性
导电性实验(用“导电”、“不导电”填空)
实验装置 存在状态 NaCl KNO3 蒸馏水
纯净物
溶于水 —
熔融状态 —
不导电
不导电
不导电
导电
导电
导电
导电
2.结论
(1)①干燥的NaCl、KNO3固体不导电,蒸馏水不导电。
②NaCl、KNO3的水溶液或熔融状态均能导电。
(2)导电条件及原因
固体电解质不导电,只有在水溶液里或受热熔化时才能导电。因为电解质在水溶液里或受热熔化时发生了______,电离出了能__________的阴阳离子,阴阳离子在电场作用下发生______移动。
电离
自由移动
定向
3.电解质与非电解质
(1)电解质:在水溶液里或熔融状态下能够导电的________叫做电解质。如酸、碱、盐等。
(2)非电解质:在水溶液里和熔融状态下均不导电的化合物叫非电解质,如CO、NH3、CO2等。
化合物
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )
(2)液态H2SO4、固态NaCl均不导电,所以H2SO4、NaCl均不是电解质( )
(3)NH3、CO2的水溶液能导电,所以NH3、CO2均是电解质( )
(4)NaCl晶体不能导电,是由于其中不含离子( )
答案 (1)× (2)× (3)× (4)×
二、电解质的电离
1.电离
(1)概念:电解质溶于水或受热熔化时,形成自由移动的______的过程,叫做电离。
(2)表示方法——电离方程式
电解质的电离可以用电离方程式表示,为简便起见,一般仍用离子符号表示水合离子。
离子
(3)实例
写出下列电解质的电离方程式:
①H2SO4:__________________________;
②KNO3:__________________________;
③Ca(OH)2:_________________________。
Ca(OH)2===Ca2++2OH-
2.从电离的角度认识酸、碱、盐
(1)酸
①含义:电离时生成的阳离子全部是______的化合物叫做酸。
②实例
H+
H+
(2)碱
①含义:电离时生成的阴离子全部是________的化合物叫做碱。
②实例
OH-
OH-
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)电解质在通电时才能发生电离( )
(2)NaHSO4溶于水时电离出H+,故NaHSO4属于酸( )
(3)纯碱溶液呈碱性,故纯碱属于碱( )
(4)盐酸属于酸( )
答案 (1)× (2)× (3)× (4)×
二、电解质的电离与导电性
一、电解质、非电解质的比较与判断
一、电解质、非电解质的比较与判断
1.电解质与非电解质的比较
电解质 非电解质
相同点 均为化合物 不同点 在水溶液里或熔融状态下能导电 在水溶液里和熔融状态下都不能导电
本质区别 在水溶液里或熔融状态下自身能发生电离 在水溶液里和熔融状态下自身都不能发生电离
在水溶液里或熔融状态下的存在形式 离子(或离子和分子) 分子
2.常见的电解质与非电解质
(1)
(2)
(1)电解质和非电解质研究的对象都是化合物,单质和混合物既不属于电解质,也不属于非电解质。
(2)电解质导电的条件是在水溶液里或熔融状态下,两个条件具备一个即可。
①有些电解质溶于水能导电,熔融状态不能导电,如所有酸。
②有些电解质只在熔融状态下能导电,如BaSO4,其水溶液不导电是因为BaSO4难溶于水。
③电解质本身不一定能导电,如NaCl固体;能导电的物质不一定是电解质,如石墨和所有金属等。
1.市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是( )
A.Fe B.葡萄糖
C.MgSO4 D.CO2
解析 Fe是单质,既不是电解质,也不是非电解质;葡萄糖、CO2是非电解质,MgSO4属于盐,属于电解质。
C
2.下列说法正确的是( )
A.铜能导电,所以它是电解质
B.氨气的水溶液能导电,所以它是电解质
C.液态H2SO4不能导电,所以它是非电解质
D.酒精在水溶液里和熔融状态下都不能导电,所以它是非电解质
解析 判断物质是否为电解质,一看物质类别必须是化合物(酸、碱、盐、水等),选项A不正确;二看溶于水或熔融状态下能否导电,选项C不正确,选项D正确;三看溶于水时若与水反应,其溶液导电可能是非电解质,选项B不正确。
D
3.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出以下结论正确的是( )
A.硝酸钾固体不是电解质
B.硝酸钾溶液是电解质
C.硝酸钾在水溶液中电离出了可以自由移动的离子
D.在硝酸钾溶液中,水电离出了大量的离子
解析 硝酸钾是电解质,但硝酸钾固体中没有可以自由移动的离子而不导电,硝酸钾溶液是混合物不是电解质。
C
二、电解质的电离与导电性
某兴趣小组同学在测定溶液的导电性实验时,采用如图所示的串联装置,闭合电键时,发现灯泡不亮。
1.判断四个烧杯中所盛溶液溶质的类别各是什么?
提示 醋酸、硝酸属于酸,KOH属于碱、Cu(NO3)2属于盐。
2.小灯泡不亮的原因是什么?怎样才能使灯泡亮起来?
提示 四个烧杯中,只有烧杯C中纯硝酸没有自由移动的离子,不导电,整个装置没有形成闭合回路,灯泡不亮。向烧杯C中加水后,HNO3发生电离而导电,灯泡能亮起来。
3.上述四个烧杯中,哪些烧杯中的物质发生了电离?写出Cu(NO3)2和KOH的电离方程式。
1.电离方程式的书写方法
2.电解质溶液导电的原因
电解质溶液能导电是由于电解质本身能电离出自由移动的离子,例如:
3.电解质溶液的导电能力
(1)电解质的电离是电解质导电的前提条件。电解质溶于水或受热熔化时,电离产生自由移动的离子,此时接入外加电源才能导电,而不是通电后才发生电离。
(2)电解质溶液的导电能力与溶液中单位体积的离子数目、离子所带电荷多少有关,一般来说,单位体积的离子数目越大,离子所带的电荷越多,溶液的导电能力越强。
4.下列水溶液中的电离方程式正确的是( )
A
5.已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。若有一定浓度的Ca(OH)2溶液,向该溶液中逐渐通入CO2。则下列四个图中,能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)的是( )
D
解析 由于通入CO2后溶液中自由移动的单位体积的离子数目逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,反应生成自由移动的单位体积的离子数目逐渐增大,导电能力也逐渐增大,当反应进行完全后,溶液中自由移动的单位体积的离子数目基本保持不变,溶液导电能力基本保持不变,所以选D。
1.(2021·浙江湖州高一期末)下列物质属于电解质的是( )
A.酒精 B.NaCl
C.稀硫酸 D.Cu
解析 A.酒精溶于水不导电,不属于电解质,故A不符合题意;B.NaCl溶于水能导电,属于电解质,故B符合题意;C.稀硫酸是混合物,不属于电解质,故C不符合题意;D.Cu是金属单质,不属于电解质,故D不符合题意。
B
2.(2021·广东广州高一期中)下列说法正确的是( )
A.NaCl在电流的作用下可以电离出钠离子和氯离子
B.CO2溶于水能导电,CO2属于电解质
C.熔融的NaOH属于电解质
D.H2SO4属于电解质,在水溶液和熔融状态下可以导电
C
解析 NaCl在水溶液中自动电离出Na+、Cl-,不需要电流的作用,故A错误;CO2溶于水生成的 H2CO3能发生电离,CO2属于非电解质,故B错误;熔融的NaOH中存在自由移动的离子,能导电,属于电解质,故C正确;H2SO4属于电解质,在水溶液中可以导电,在熔融状态下不能导电,故D错误。
3.下列物质溶于水时,不能电离出酸根离子的是( )
A.NaNO3 B.Ba(OH)2
C.KMnO4 D.KCl
解析 氢氧化钡是碱,电离出的是氢氧根离子,其他三种物质均能电离出酸根离子。
B
4.在水溶液中,下列电离方程式错误的是( )
C
解析 BaCl2的电离方程式为BaCl2===Ba2++2Cl-。
5.现有下列物质:
①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体
⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩胆矾晶体
请用序号填空:
(1)上述状态下可导电的是__________。
(2)属于电解质的是____________。
(3)上述状态下的电解质不能导电的是___________。
(4)④中溶质的电离方程式:____________________________________;
⑦在水溶液中的电离方程式:__________________________________。
②④⑥⑨
①③⑦⑨⑩
①③⑦⑩
解析 化合物中酸(如氯化氢)、碱(如氢氧化钠)、盐(如碳酸钠、胆矾)都是电解质;化合物中非金属氧化物(如二氧化碳)、大部分有机物(如蔗糖)都是非电解质;单质(如铜)和混合物(如稀硫酸、氨水)既不是电解质,也不是非电解质。能导电的物质有金属(如铜)、熔融电解质(如熔融氯化钠)、电解质溶液(如稀硫酸、氨水)。
1.下列物质属于电解质的是( )
A.Zn B.NaOH
C.H2SO4溶液 D.MgCl2溶液
解析 Zn是单质,既不属于电解质又不属于非电解质,A错误;NaOH在水中或者熔融状态下可以电离,是电解质,B正确;H2SO4溶液是混合物,既不属于电解质又不属于非电解质,C错误;MgCl2溶液是混合物,既不属于电解质又不属于非电解质,D错误。
B
2.下列关于酸、碱、盐的各种说法中正确的是( )
A.电离出的阳离子有H+的化合物叫酸
B.电离出OH-的化合物叫碱
C.化合物电离时,生成金属阳离子(或铵根离子)和酸根阴离子的是盐
D.NaHSO4可以电离出H+,因此NaHSO4属于酸
解析 电离时生成的阳离子只有H+的化合物称为酸,生成的阴离子只有OH-的化合物称为碱, A、B项错误; NaHSO4电离的阳离子除H+外还有Na+,不属于酸,NaHSO4应属于酸式盐,D项错误。
C
3.下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离的是( )
解析 依据酸的概念——电离产生的阳离子全部是H+的化合物,B符合题意。
B
4.下列四项都能导电,其中一项与其他三项导电原理不同的是( )
A.氯化钠熔化导电
B.液态汞导电
C.硫酸溶液导电
D.熔融状态氢氧化钾导电
解析 电解质硫酸、氯化钠、氢氧化钾溶于水或熔融状态下,都能电离产生自由移动的离子而导电;金属汞是自由电子定向移动而导电。
B
A
5.下列电离方程式不正确的是( )
解析 AlCl3电离方程式为AlCl3===Al3++3Cl-,A错误。
6.今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中,正确的是( )
A.X可以是任何化合物 B.X可能为非电解质
C.X一定是盐类 D.X一定为电解质
解析 X不可能是某些化合物,如CO等,故A项错误;熔化状态或溶于水中能够电离,X不可能为非电解质,故B项错误;X可能是酸、碱、盐,也可能是CaO等金属氧化物,故C项错误;因为X为固体化合物并且在熔化状态或溶于水中能够电离出离子从而导电,所以X一定为电解质,故D项正确。
D
7.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
解析 A项中盐酸是混合物;C项中氨水是混合物,铜既不是电解质也不是非电解质,硫酸钡是电解质;D项中氯气既不是电解质也不是非电解质。B项正确,应注意冰水混合物,只是物质状态不同,成分只有水,是纯净物。
B
纯净物 混合物 电解质 非电解质
A 盐酸 澄清石灰水 硫酸 干冰
B 冰水混合物 酒精溶液 硫酸钡 二氧化碳
C 氨水 盐酸 铜 硫酸钡
D 胆矾 食盐水 氯化铜 氯气
8.在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸
D.硫酸铜中逐滴加入氢氧化钡溶液
D
解析 溶液能否导电,取决于溶液中是否有离子存在;导电性强弱则由单位体积内离子数目大小等因素决定。D选项中,发生反应CuSO4+Ba(OH)2===BaSO4↓+Cu(OH)2↓,溶液中离子数目减小,恰好完全反应在时,溶液中几乎没有离子,继续滴加Ba(OH)2溶液,Ba(OH)2过量,溶液中Ba2+、OH-数目增多,导电能力增强。
9.某化学兴趣小组在实验室中进行化学实验时,按图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl溶液是电解质
B.在通电的条件下,NaCl在水中电离出大量
的离子而导电
C.NaCl固体中无阴阳离子,因此不能导电
D.同一温度下,将乙中的NaCl溶液换成单位体积内离子数目相等的KCl溶液,溶液导电性不变
D
解析 NaCl溶液是混合物,既不是电解质也不是非电解质,故A错误;NaCl在水分子的作用下电离出可以自由移动的离子,而不是在通电的条件下电离,故B错误;NaCl固体中存在阴、阳离子,但是阴、阳离子不能自由移动,所以不导电,故C错误;同一温度下,将乙中的NaCl溶液换成单位体积内离子数目相等的KCl溶液,溶液中电荷数不变,溶液导电性不变,故D正确。
10.向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用如图中的曲线表示的是( )
A.曲线a B.曲线b
C.曲线c D.曲线d
C
解析 开始发生反应:Ba(OH)2+H2SO4===BaSO4↓+2H2O,使自由移动的离子数目逐渐减小,溶液的导电性逐渐减弱。当氢氧化钡和硫酸恰好完全反应时,沉淀达到最大值,这时自由移动的离子数目最小,导电能力最弱。随后,随着硫酸的加入,这时溶液为硫酸溶液,自由移动的离子数目又逐渐增大,导电能力逐渐增强。
11.(1)有下列物质:a.Fe b.CO2 c.Na2O d.Cu(OH)2 e.MgCl2 f.NH4Cl
g.H2SO4 h.C2H5OH(乙醇)(用字母作答)。
①按组成进行分类,属于酸的有________,属于碱的有________,属于盐的有________。
②上述八种物质中,属于电解质的有________________,属于非电解质的有________。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4:________________________________________;
②NaHCO3:________________________________________;
③Al2(SO4)3:_______________________________________。
g
d
e、f
c、d、e、f、g
b、h
12.某课外活动小组根据熔融状态下的NaCl能导电,推测AlCl3在熔融状态下也能导电,可是通过实验发现熔融状态的下AlCl3不能导电,而AlCl3水溶液却能导电,据此回答下列问题。
(1)熔融状态的AlCl3不导电的原因是________________________________
___________________________________________________________。
(2)AlCl3水溶液能导电的原因是________________________________
___________________________________________________________。
熔融状态下氯化铝不发生电离,
以分子形式存在,不存在自由移动的离子
AlCl3在水分子的作用下能电离出自
由移动的离子
(3)电解质溶液导电与金属导电的原理________(填“相同”或“不相同”,若填“相同”,下一空不必填写;若填“不相同”,完成下一空),区别是___________________________________________________________
___________________________________________________________。
(4)分别把58.5 g NaCl和133.5 g AlCl3溶于水配制体积相同的NaCl溶液和AlCl3溶液,____________的导电能力更强,理由是
___________________________________________________________。
不相同
电解质溶液导电是由于阴、阳离子的定向移动,金属导电是由于自由电子的定向移动
AlCl3溶液
AlCl3电离出的离子数目多且所带电荷数多,溶液导电能力更强
13.导体是指电阻率很小且易于传导电流的物质。导体中存在大量可自由移动的带电粒子,这些带电粒子被称为载流子。在外电场作用下,载流子发生定向运动,形成明显的电流。第一类导体是金属,是最常见的一类导体。第二类导体是有电解质的溶液或熔融电解质,其载流子是阳、阴离子。
下列叙述正确的是( )
A.虽然石墨有较好的导电性,但它属于非电解质
B.实验测得CO2的水溶液能导电,所以CO2是电解质
C.实验测得液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D.蔗糖(纯净物)在水溶液中和熔融状态下均不能导电,所以蔗糖属于非电解质
D
解析 石墨能导电,但石墨是单质,既不是电解质也不是非电解质,A错误;CO2的水溶液能导电,但不是CO2自身电离产生自由移动的离子,是CO2与水反应生成的H2CO3电离产生自由移动的离子,故CO2不是电解质,B项错误;液态HCl不能导电,但溶于水时导电,同理NaCl不导电,但溶于水或熔融状态下能导电,因此HCl、NaCl是电解质,C错误;在水溶液中和熔融状态下均不能导电的化合物是非电解质,D正确。
14.下表是常见的几种酸、碱、盐在水溶液中解离出离子的情况,根据表中信息分析正确的是( )
A.在水溶液中电离出H+的物质一定是酸
B.在水溶液中电离出金属阳离子和酸根离子的物质一定是盐
C.盐溶液电离出的阳离子一定是金属阳离子
D.碱溶液电离出的离子一定是金属阳离子和OH-
B
15.(2020·山西长治高一月考)在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入A溶液时,溶液的导电性的变化趋势如图(Ⅱ)所示。
(1)滴加溶液A至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,溶液A中含有的溶质可能是________(填序号)。
①HCl ②H2SO4
③NaHSO4 ④NaHCO3
②
解析 (1)反应特征是反应达到一定程度,溶液导电性最小,几乎不导电,说明反应过程中恰好完全反应生成沉淀和难电离的物质,①HCl 和氢氧化钡反应生成氯化钡溶液为易电离,故①不符合;②H2SO4滴入氢氧化钡溶液中恰好完全反应生成硫酸钡沉淀和水,离子数目几乎为零,不导电,故②符合;③NaHSO4滴入反应生成硫酸钡沉淀、水,同时生成硫酸钠易电离,故③不符合;④NaHCO3滴入氢氧化钡溶液反应生成碳酸钡沉淀,水和碳酸钠,碳酸钠易电离,故④错误;
(2)关于图(Ⅱ)下列说法中错误的是________(填字母)。
A.反应前一段导电能力不断减弱,说明生成的BaSO4是非电解质
B.图(Ⅱ)中最低点导电能力约为零说明溶液中几乎没有自由移动的离子
C.图(Ⅱ)中最低点导电能力约为零时,Ba(OH)2溶液与稀硫酸恰好完全中和
D.Ba(OH)2 、H2SO4 和BaSO4都是电解质
A
解析 (2)A.反应前一段导电能力不断减弱,说明溶液中的离子数目下降,但生成的BaSO4是电解质,故A错误;B.溶液的导电性取决于溶液中单位体积内离子数目的大小,图(Ⅱ)中最低点导电能力约为零说明溶液中自由移动的离子数目接近0,故B正确;C.Ba(OH)2溶液与稀硫酸恰好完全中和时生成硫酸钡和水,溶液中的离子数目最小,导电性接近0,故C正确;D.Ba(OH)2、H2SO4和BaSO4都能自身电离出离子,都是电解质,故D正确;
(3)请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式:
___________________________________________________________。
②NaHSO4属于________(填“酸”、“碱”或“盐”)。
③将NaHSO4溶液中逐滴加入Ba(OH)2溶液能否出现如图(Ⅱ)的导电性曲线________。
A.能 B.否
盐
B
Thanks!
本讲内容结束
