第一章 第三节 氧化还原反应 第一课时 氧化还原反应(共75张ppt)
文档属性
| 名称 | 第一章 第三节 氧化还原反应 第一课时 氧化还原反应(共75张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 17:49:26 | ||
图片预览









文档简介
(共75张PPT)
第三节 氧化还原反应
第一课时 氧化还原反应
第一章 物质及其变化
【课程标准要求】
1.认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是电子转移。
2.能从元素化合价的角度,依据氧化还原反应原理,预测物质的化学性质和变化。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、从三个不同角度认识氧化还原反应
1.从得失氧的角度
结论:一种物质得到氧发生__________,必然有一种物质失去氧发生__________,氧化反应和还原反应是在一个反应中同时发生的,称为氧化还原反应。
物质 反应物 发生的反应(氧化反应或还原反应)
得到氧的物质
失去氧的物质
C、CO
氧化反应
CuO、Fe2O3
还原反应
氧化反应
还原反应
2.从元素化合价升降的角度
①铜元素化合价______,发生______反应。
②碳元素化合价______,发生______反应。
降低
还原
升高
氧化
(2)对于无氧元素参加的反应:
Fe+CuSO4===FeSO4+Cu。
①铜元素化合价______,发生______反应。
②铁元素化合价______,发生______反应。
(3)结论:反应前后有元素的化合价发生变化是氧化还原反应的重要特征。
降低
还原
升高
氧化
3.从电子转移的角度
①钠原子______最外层1个电子,成为具有稳定结构的Na+,其化合价由0价升高为______价,发生了______反应,被______。
②氯原子最外层______1个电子,成为具有稳定结构的Cl-,其化合价由____价降低为______价,发生了______反应,被______。
③在这个反应中,氯原子和钠原子之间发生了电子的______,分别形成阴离子和阳离子,使元素的化合价发生了变化。
失去
+1
氧化
氧化
得到
0
-1
还原
还原
得失
④反应过程中相应变化关系图
①氢原子和氯原子都不易失去电子,都可______1个电子形成稳定结构,二者只能形成共用电子对,使双方最外电子层都达到稳定结构。
②共用电子对______于吸引力稍强的氯原子,氯元素的化合价由____价降低为______价,被______,氯气发生了______反应。
③共用电子对______于吸引力稍弱的氢原子,氢元素的化合价由____价升高到______价,被______,氢气发生了______反应。
获得
偏向
0
-1
还原
还原
偏离
0
+1
氧化
氧化
④反应过程中相应变化关系图
该反应生成的氯化氢分子因________________,而使元素的化合价发生了变化。
共用电子对偏移
(3)结论:凡是有电子转移(得失或偏移)的反应都是氧化还原反应。失去电子(或电子对偏离)发生______反应,得到电子(或电子对偏向)发生______反应。
氧化
还原
4.氧化还原反应的本质和特征
(1)本质:电子转移(得失或偏移)。
(2)特征:元素____________。
化合价升降
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)氧化还原反应中一定有氧元素参加( )
(2)在氧化还原反应中可能只有元素化合价的升高,而无元素化合价的降低( )
(3)反应中不一定所有元素的化合价都发生变化( )
(4)某元素从游离态变为化合态,该元素一定被氧化( )
答案 (1)× (2)× (3)√ (4)×
二、氧化还原反应与四种基本反应类型的关系
(1)复分解反应均不属于氧化还原反应。
(2)置换反应均属于氧化还原反应。
(3)有单质参加的化合反应一定是氧化还原反应。
(4)有单质生成的分解反应一定是氧化还原反应。
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
答案 (1)× (2)× (3)×
二、氧化还原反应电子转移的表示方法
一、氧化还原反应的基本概念与本质
一、氧化还原反应的基本概念与本质
1.氧化还原反应的两组概念
(1)氧化反应与还原反应
反应类型 化合价变化 电子转移
氧化反应 物质所含元素化合价升高的反应 物质所含元素原子失去电子(或电子对偏离)的反应
还原反应 物质所含元素化合价降低的反应 物质所含元素原子得到电子(或电子对偏向)的反应
2.氧化还原反应概念间的关系
记忆口诀:
升→失→氧→氧→氧
降→得→还→还→还
3.氧化还原反应的特征与本质
1.下列反应中不属于氧化还原反应的是( )
C
解析 由方程式可知,反应前后氢元素和铜元素的化合价发生变化,该反应属于氧化还原反应,故A不选;B.由方程式可知,反应前后碳元素和铁元素的化合价发生变化,该反应属于氧化还原反应,故B不选;C.由方程式可知,反应前后元素的化合价没有变化,该反应不属于氧化还原反应,故C选;D.由方程式可知,反应前后氢元素和铁元素的化合价发生变化,该反应属于氧化还原反应,故D不选。
2.下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
解析 判断氧化还原反应的概念,关键是要紧紧抓住反应中元素的化合价有无变化。Fe3+转化为Fe2+,铁元素的化合价降低,发生的是还原反应。化合价有升降一定是氧化还原反应,但不一定有氧的得失。化合价升高发生的是氧化反应。
A
3.工业上制备硝酸过程的一个重要反应为:4NH3+5O2===4NO+6H2O。下列有关该反应的说法正确的是( )
A.O2在反应中化合价升高 B.NH3在反应中得到电子
C.氮元素被氧化 D.H2O是氧化产物
解析 O2在反应中获得电子,化合价降低,故A错误;NH3中N元素化合价升高,被氧化,则NH3失电子,故B错误;N元素化合价由-3价升高到+2价,则氮元素被氧化,故C正确;O2得到电子,发生还原反应,H2O是还原产物,故D错误。
C
二、氧化还原反应电子转移的表示方法
1.双线桥法
(1)基本步骤
(2)注意事项
①箭头、箭尾必须对应化合价变化的同种元素的原子;
②必须注明“得到”或“失去”;
③电子转移数用a×be-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,可以省略。
④被还原的物质和被氧化的物质得、失电子数守恒。
如
(3)记忆口诀:
先标化合价,再看价变化;起止同元素,桥上标变化。
2.单线桥法
(1)基本步骤
(2)注意事项
①单线桥必须画在反应物中。
②不需要写“失去”或“得到”,只标明电子转移数目。
③箭头由反应物中失电子元素指向得电子元素。
如: 。
氧化还原反应中转移电子总数是得到的电子数或失去的电子数,而不是二者的加和。
4.下列氧化还原反应方程式表示的变化过程中,正确的是( )
D
解析 A、B中得、失电子数目不相等,错误;C中应得失1个电子,错误。
5.下列氧化还原反应中电子转移数目及方向都正确的是( )
B
解析 A项,Cl得到电子,O失去电子,该反应转移12e-,图中转移电子数目不正确,错误;B项,Fe得到电子,I失去电子,该反应转移2e-,正确;C项,F得到电子,O失去电子,该反应转移4e-,图中箭头的方向标反了,错误;D项,Br得到电子,S失去电子,该反应转移2e-,图中箭头的方向标反了,错误。
6.下列反应中,电子转移方向和数目是否正确,不正确的指出错在何处?
答案 (1)错,Fe→FeCl2,应失2e-,2HCl→H2,应得2×e- (2)正确
(3)错,WO3→W,应被还原,3H2→3H2O,应被氧化
1.日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是( )
A.钢铁生锈
B.充有H2的“喜羊羊”娃娃遇明火发生爆炸
C.食物腐败变质
D.石灰石分解
D
解析 A.钢铁生锈,铁单质被氧化为氧化铁,Fe、O元素化合价发生变化,与氧化还原反应有关,故A不选;B.H2与氧气反应,H、O元素的化合价变化,与氧化还原反应有关,故B不选;C.食物腐败变质,与氧化还原反应有关,故C不选;D.石灰石分解,即碳酸钙分解生成CaO和二氧化碳,没有元素化合价发生变化,不涉及氧化还原反应,故D选。
2.下列盐酸参与的反应中,HCl被氧化的是( )
解析 A和C不属于氧化还原反应;B中HCl作氧化剂,被还原;D中HCl中部分Cl由-1价被氧化生成0价的Cl2。
D
3.下列氧化还原反应中,电子得失情况表示不正确的是( )
A
4.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是( )
C
解析 该反应不是氧化还原反应,A错误;CuO―→Cu,铜元素由+2价降到0价,发生还原反应,B错误;Fe―→FeCl2,铁元素由0价升高到+2价,发生氧化反应,C正确;HCl―→H2,氢元素由+1价降到0价,发生还原反应,D错误。
5.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
(1)被氧化的元素是________,被还原的元素是________。
(2)发生氧化反应的物质是________,发生还原反应的物质是________。
(3)用单线桥法表示反应电子得失的方向和数目:___________________________________________________________。
解析 由化学方程式可知铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;铜发生氧化反应,硝酸发生还原反应。
1.日常生活中的许多应用或现象与化学反应有关,下列事实与氧化还原反应无关的是( )
A.电焊工人用氧炔焰切割或焊接金属
B.过期月饼不能食用
C.露置于潮湿环境中的铁器表面生锈
D.用食醋除去水垢
D
解析 电焊工人用氧炔焰切割或焊接金属,燃烧,存在元素化合价的变化,发生氧化还原反应,故A不选;过期月饼不能食用,被氧气氧化,发生氧化还原反应,故B不选;露置于潮湿环境中的铁器表面生锈,Fe元素的化合价升高,O元素的化合价降低,发生氧化还原反应,故C不选;用食醋除去水垢,为复分解反应,无元素化合价变化,则不发生氧化还原反应,故D选。
2.下列反应中,不属于氧化还原反应的是( )
D
3.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,正确的是( )
A
解析 化学反应的分类应按照一定的标准。除分为四种基本类型以外,还可根据有无离子参加分为离子反应、非离子反应,根据有无电子得失分为氧化还原反应、非氧化还原反应。复分解反应和氧化还原反应无交集。
4.下列变化属于氧化反应的是( )
B
5.我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸发生的主要反应为2KNO3+S+3C===K2S+N2↑+3CO2↑,该反应中被还原的元素是( )
A.C B.N C.N和S D.N和C
解析 根据题给化学方程式可知,反应前后氮元素的化合价由+5价→0价,化合价降低,硫元素的化合价由0价→-2价,化合价降低,氮元素和硫元素被还原,C项正确。
C
6.下列反应中,既属于氧化还原反应,又属于置换反应的是( )
A
解析 A项反应属于置换反应,由于Fe、H元素的化合价发生了变化,因此属于氧化还原反应,符合题意;B项反应由于没有元素化合价发生变化,因此不属于氧化还原反应,不符合题意;C项反应不属于任何一种基本反应类型,由于有元素的化合价发生了变化,因此属于氧化还原反应,不符合题意;D项反应属于化合反应,由于有元素的化合价发生了变化,因此属于氧化还原反应,不符合题意。
7.下列化学反应中电子转移的表示方法正确的是( )
解析 A项,电子转移方向错误;B项,电子转移数错误;D项,电子转移方向错误。
C
8.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是( )
解析 C和O元素的化合价发生变化,属于氧化还原反应,但不属于四种基本反应类型的任何一种,故B正确。
B
9.已知CaH2中Ca为+2价,对于CaH2+2H2O===Ca(OH)2+2H2↑,下列说法正确的是( )
A.H2都是还原产物
B.H2都是氧化产物
C.CaH2中的氢元素既被氧化又被还原
D.氧化产物与还原产物的质量比为1∶1
D
10.海水是地球上的资源宝库,含有丰富的资源,海水提溴就是海水资源利用的一个实例。从海水里提取溴的过程中,有如下反应:5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O。
下列反应中与上述反应在原理上最相似的是( )
A.2NaBr+Cl2===Br2+2NaCl
B.2KI+Br2===I2+2KBr
C.2H2S+SO2===3S↓+2H2O
D.Cl2+H2O===HCl+HClO
C
11.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应。有下列反应:
(5)根据你的理解,氧化还原反应的实质是________。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
答案 (1)①④⑧ ⑤ (2)②⑧ (3)⑦ (4)③ (5)C
解析 基本反应类型中,复分解反应不是氧化还原反应;置换反应一定是氧化还原反应;化合反应和分解反应,若元素化合价有变化则是氧化还原反应,若元素化合价无变化则是非氧化还原反应。离子反应是否属于氧化还原反应也要根据元素的化合价在反应前后是否发生变化来判断。
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,该元素发生________反应。
(2)用“双线桥法”表示反应中电子转移的方向和数目。
___________________________________________________________。
解析 在上述反应中铝元素由0价变为+3价,化合价升高,失去电子,被氧化;氮元素由+5价变为0价,化合价降低,得到电子,被还原。
A
14.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.KClO3在反应中失去电子
B.KClO3被氧化
C.H2C2O4在反应中被还原
D.1个KClO3参加反应有1个电子转移
D
解析 Cl元素的化合价由+5价降低为+4价,故KClO3在反应中得到电子,被还原,故A错误、B错误;C元素的化合价由+3升高到+4价,被氧化,则H2C2O4在反应中被氧化,故C错误;因反应中Cl元素的化合价由+5价降低为+4价,则1个KClO3参加反应有1个电子转移,故D正确。
15.过氧化氢(H2O2)可作为采矿业的废液消毒剂,如消除采矿废液中有剧毒的氰化钾(KCN,其中氮元素为-3价),化学方程式为KCN+H2O2+H2O===A+NH3↑(已配平),请回答下列问题:
(1)生成物A的化学式是________。
(2)该反应中发生氧化反应的物质是________,理由是___________________________________________________________。
(3)若生成4分子NH3,转移电子数为________个。
(4)用双线桥表示电子转移的方向和数目
___________________________________________________________。
Thanks!
本讲内容结束
第三节 氧化还原反应
第一课时 氧化还原反应
第一章 物质及其变化
【课程标准要求】
1.认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是电子转移。
2.能从元素化合价的角度,依据氧化还原反应原理,预测物质的化学性质和变化。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、从三个不同角度认识氧化还原反应
1.从得失氧的角度
结论:一种物质得到氧发生__________,必然有一种物质失去氧发生__________,氧化反应和还原反应是在一个反应中同时发生的,称为氧化还原反应。
物质 反应物 发生的反应(氧化反应或还原反应)
得到氧的物质
失去氧的物质
C、CO
氧化反应
CuO、Fe2O3
还原反应
氧化反应
还原反应
2.从元素化合价升降的角度
①铜元素化合价______,发生______反应。
②碳元素化合价______,发生______反应。
降低
还原
升高
氧化
(2)对于无氧元素参加的反应:
Fe+CuSO4===FeSO4+Cu。
①铜元素化合价______,发生______反应。
②铁元素化合价______,发生______反应。
(3)结论:反应前后有元素的化合价发生变化是氧化还原反应的重要特征。
降低
还原
升高
氧化
3.从电子转移的角度
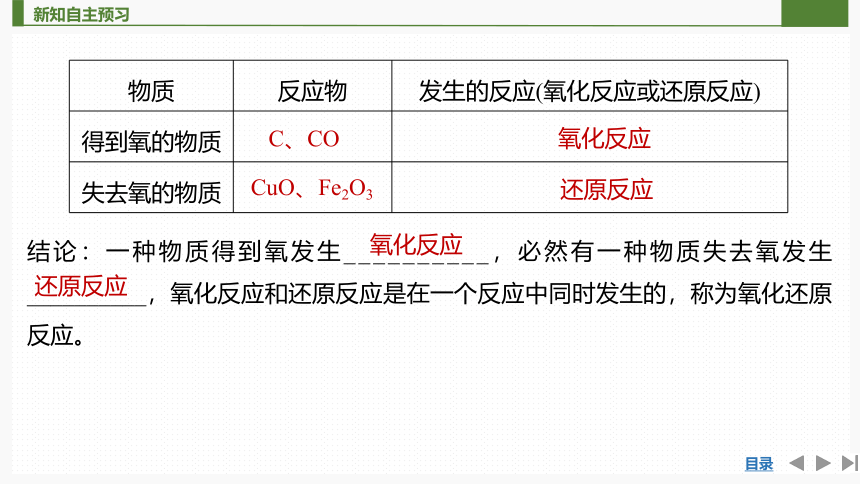
①钠原子______最外层1个电子,成为具有稳定结构的Na+,其化合价由0价升高为______价,发生了______反应,被______。
②氯原子最外层______1个电子,成为具有稳定结构的Cl-,其化合价由____价降低为______价,发生了______反应,被______。
③在这个反应中,氯原子和钠原子之间发生了电子的______,分别形成阴离子和阳离子,使元素的化合价发生了变化。
失去
+1
氧化
氧化
得到
0
-1
还原
还原
得失
④反应过程中相应变化关系图
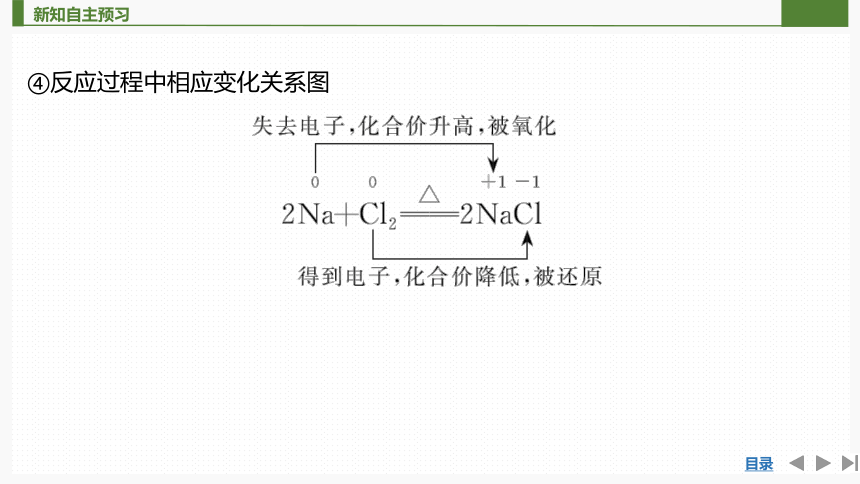
①氢原子和氯原子都不易失去电子,都可______1个电子形成稳定结构,二者只能形成共用电子对,使双方最外电子层都达到稳定结构。
②共用电子对______于吸引力稍强的氯原子,氯元素的化合价由____价降低为______价,被______,氯气发生了______反应。
③共用电子对______于吸引力稍弱的氢原子,氢元素的化合价由____价升高到______价,被______,氢气发生了______反应。
获得
偏向
0
-1
还原
还原
偏离
0
+1
氧化
氧化
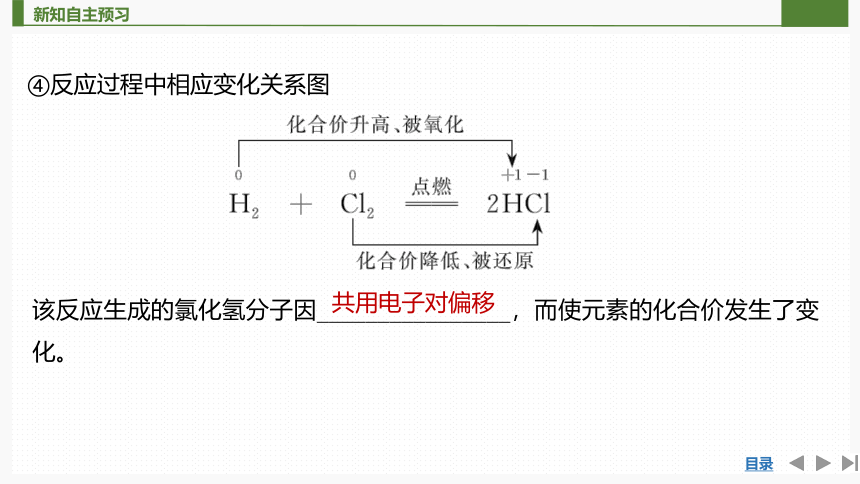
④反应过程中相应变化关系图
该反应生成的氯化氢分子因________________,而使元素的化合价发生了变化。
共用电子对偏移
(3)结论:凡是有电子转移(得失或偏移)的反应都是氧化还原反应。失去电子(或电子对偏离)发生______反应,得到电子(或电子对偏向)发生______反应。
氧化
还原
4.氧化还原反应的本质和特征
(1)本质:电子转移(得失或偏移)。
(2)特征:元素____________。
化合价升降
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)氧化还原反应中一定有氧元素参加( )
(2)在氧化还原反应中可能只有元素化合价的升高,而无元素化合价的降低( )
(3)反应中不一定所有元素的化合价都发生变化( )
(4)某元素从游离态变为化合态,该元素一定被氧化( )
答案 (1)× (2)× (3)√ (4)×
二、氧化还原反应与四种基本反应类型的关系
(1)复分解反应均不属于氧化还原反应。
(2)置换反应均属于氧化还原反应。
(3)有单质参加的化合反应一定是氧化还原反应。
(4)有单质生成的分解反应一定是氧化还原反应。
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
答案 (1)× (2)× (3)×
二、氧化还原反应电子转移的表示方法
一、氧化还原反应的基本概念与本质
一、氧化还原反应的基本概念与本质
1.氧化还原反应的两组概念
(1)氧化反应与还原反应
反应类型 化合价变化 电子转移
氧化反应 物质所含元素化合价升高的反应 物质所含元素原子失去电子(或电子对偏离)的反应
还原反应 物质所含元素化合价降低的反应 物质所含元素原子得到电子(或电子对偏向)的反应
2.氧化还原反应概念间的关系
记忆口诀:
升→失→氧→氧→氧
降→得→还→还→还
3.氧化还原反应的特征与本质
1.下列反应中不属于氧化还原反应的是( )
C
解析 由方程式可知,反应前后氢元素和铜元素的化合价发生变化,该反应属于氧化还原反应,故A不选;B.由方程式可知,反应前后碳元素和铁元素的化合价发生变化,该反应属于氧化还原反应,故B不选;C.由方程式可知,反应前后元素的化合价没有变化,该反应不属于氧化还原反应,故C选;D.由方程式可知,反应前后氢元素和铁元素的化合价发生变化,该反应属于氧化还原反应,故D不选。
2.下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
解析 判断氧化还原反应的概念,关键是要紧紧抓住反应中元素的化合价有无变化。Fe3+转化为Fe2+,铁元素的化合价降低,发生的是还原反应。化合价有升降一定是氧化还原反应,但不一定有氧的得失。化合价升高发生的是氧化反应。
A
3.工业上制备硝酸过程的一个重要反应为:4NH3+5O2===4NO+6H2O。下列有关该反应的说法正确的是( )
A.O2在反应中化合价升高 B.NH3在反应中得到电子
C.氮元素被氧化 D.H2O是氧化产物
解析 O2在反应中获得电子,化合价降低,故A错误;NH3中N元素化合价升高,被氧化,则NH3失电子,故B错误;N元素化合价由-3价升高到+2价,则氮元素被氧化,故C正确;O2得到电子,发生还原反应,H2O是还原产物,故D错误。
C
二、氧化还原反应电子转移的表示方法
1.双线桥法
(1)基本步骤
(2)注意事项
①箭头、箭尾必须对应化合价变化的同种元素的原子;
②必须注明“得到”或“失去”;
③电子转移数用a×be-形式表示,a表示发生氧化或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,可以省略。
④被还原的物质和被氧化的物质得、失电子数守恒。
如
(3)记忆口诀:
先标化合价,再看价变化;起止同元素,桥上标变化。
2.单线桥法
(1)基本步骤
(2)注意事项
①单线桥必须画在反应物中。
②不需要写“失去”或“得到”,只标明电子转移数目。
③箭头由反应物中失电子元素指向得电子元素。
如: 。
氧化还原反应中转移电子总数是得到的电子数或失去的电子数,而不是二者的加和。
4.下列氧化还原反应方程式表示的变化过程中,正确的是( )
D
解析 A、B中得、失电子数目不相等,错误;C中应得失1个电子,错误。
5.下列氧化还原反应中电子转移数目及方向都正确的是( )
B
解析 A项,Cl得到电子,O失去电子,该反应转移12e-,图中转移电子数目不正确,错误;B项,Fe得到电子,I失去电子,该反应转移2e-,正确;C项,F得到电子,O失去电子,该反应转移4e-,图中箭头的方向标反了,错误;D项,Br得到电子,S失去电子,该反应转移2e-,图中箭头的方向标反了,错误。
6.下列反应中,电子转移方向和数目是否正确,不正确的指出错在何处?
答案 (1)错,Fe→FeCl2,应失2e-,2HCl→H2,应得2×e- (2)正确
(3)错,WO3→W,应被还原,3H2→3H2O,应被氧化
1.日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是( )
A.钢铁生锈
B.充有H2的“喜羊羊”娃娃遇明火发生爆炸
C.食物腐败变质
D.石灰石分解
D
解析 A.钢铁生锈,铁单质被氧化为氧化铁,Fe、O元素化合价发生变化,与氧化还原反应有关,故A不选;B.H2与氧气反应,H、O元素的化合价变化,与氧化还原反应有关,故B不选;C.食物腐败变质,与氧化还原反应有关,故C不选;D.石灰石分解,即碳酸钙分解生成CaO和二氧化碳,没有元素化合价发生变化,不涉及氧化还原反应,故D选。
2.下列盐酸参与的反应中,HCl被氧化的是( )
解析 A和C不属于氧化还原反应;B中HCl作氧化剂,被还原;D中HCl中部分Cl由-1价被氧化生成0价的Cl2。
D
3.下列氧化还原反应中,电子得失情况表示不正确的是( )
A
4.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是( )
C
解析 该反应不是氧化还原反应,A错误;CuO―→Cu,铜元素由+2价降到0价,发生还原反应,B错误;Fe―→FeCl2,铁元素由0价升高到+2价,发生氧化反应,C正确;HCl―→H2,氢元素由+1价降到0价,发生还原反应,D错误。
5.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
(1)被氧化的元素是________,被还原的元素是________。
(2)发生氧化反应的物质是________,发生还原反应的物质是________。
(3)用单线桥法表示反应电子得失的方向和数目:___________________________________________________________。
解析 由化学方程式可知铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原;铜发生氧化反应,硝酸发生还原反应。
1.日常生活中的许多应用或现象与化学反应有关,下列事实与氧化还原反应无关的是( )
A.电焊工人用氧炔焰切割或焊接金属
B.过期月饼不能食用
C.露置于潮湿环境中的铁器表面生锈
D.用食醋除去水垢
D
解析 电焊工人用氧炔焰切割或焊接金属,燃烧,存在元素化合价的变化,发生氧化还原反应,故A不选;过期月饼不能食用,被氧气氧化,发生氧化还原反应,故B不选;露置于潮湿环境中的铁器表面生锈,Fe元素的化合价升高,O元素的化合价降低,发生氧化还原反应,故C不选;用食醋除去水垢,为复分解反应,无元素化合价变化,则不发生氧化还原反应,故D选。
2.下列反应中,不属于氧化还原反应的是( )
D
3.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,正确的是( )
A
解析 化学反应的分类应按照一定的标准。除分为四种基本类型以外,还可根据有无离子参加分为离子反应、非离子反应,根据有无电子得失分为氧化还原反应、非氧化还原反应。复分解反应和氧化还原反应无交集。
4.下列变化属于氧化反应的是( )
B
5.我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸发生的主要反应为2KNO3+S+3C===K2S+N2↑+3CO2↑,该反应中被还原的元素是( )
A.C B.N C.N和S D.N和C
解析 根据题给化学方程式可知,反应前后氮元素的化合价由+5价→0价,化合价降低,硫元素的化合价由0价→-2价,化合价降低,氮元素和硫元素被还原,C项正确。
C
6.下列反应中,既属于氧化还原反应,又属于置换反应的是( )
A
解析 A项反应属于置换反应,由于Fe、H元素的化合价发生了变化,因此属于氧化还原反应,符合题意;B项反应由于没有元素化合价发生变化,因此不属于氧化还原反应,不符合题意;C项反应不属于任何一种基本反应类型,由于有元素的化合价发生了变化,因此属于氧化还原反应,不符合题意;D项反应属于化合反应,由于有元素的化合价发生了变化,因此属于氧化还原反应,不符合题意。
7.下列化学反应中电子转移的表示方法正确的是( )
解析 A项,电子转移方向错误;B项,电子转移数错误;D项,电子转移方向错误。
C
8.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是( )
解析 C和O元素的化合价发生变化,属于氧化还原反应,但不属于四种基本反应类型的任何一种,故B正确。
B
9.已知CaH2中Ca为+2价,对于CaH2+2H2O===Ca(OH)2+2H2↑,下列说法正确的是( )
A.H2都是还原产物
B.H2都是氧化产物
C.CaH2中的氢元素既被氧化又被还原
D.氧化产物与还原产物的质量比为1∶1
D
10.海水是地球上的资源宝库,含有丰富的资源,海水提溴就是海水资源利用的一个实例。从海水里提取溴的过程中,有如下反应:5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O。
下列反应中与上述反应在原理上最相似的是( )
A.2NaBr+Cl2===Br2+2NaCl
B.2KI+Br2===I2+2KBr
C.2H2S+SO2===3S↓+2H2O
D.Cl2+H2O===HCl+HClO
C
11.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应。有下列反应:
(5)根据你的理解,氧化还原反应的实质是________。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
答案 (1)①④⑧ ⑤ (2)②⑧ (3)⑦ (4)③ (5)C
解析 基本反应类型中,复分解反应不是氧化还原反应;置换反应一定是氧化还原反应;化合反应和分解反应,若元素化合价有变化则是氧化还原反应,若元素化合价无变化则是非氧化还原反应。离子反应是否属于氧化还原反应也要根据元素的化合价在反应前后是否发生变化来判断。
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,该元素发生________反应。
(2)用“双线桥法”表示反应中电子转移的方向和数目。
___________________________________________________________。
解析 在上述反应中铝元素由0价变为+3价,化合价升高,失去电子,被氧化;氮元素由+5价变为0价,化合价降低,得到电子,被还原。
A
14.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.KClO3在反应中失去电子
B.KClO3被氧化
C.H2C2O4在反应中被还原
D.1个KClO3参加反应有1个电子转移
D
解析 Cl元素的化合价由+5价降低为+4价,故KClO3在反应中得到电子,被还原,故A错误、B错误;C元素的化合价由+3升高到+4价,被氧化,则H2C2O4在反应中被氧化,故C错误;因反应中Cl元素的化合价由+5价降低为+4价,则1个KClO3参加反应有1个电子转移,故D正确。
15.过氧化氢(H2O2)可作为采矿业的废液消毒剂,如消除采矿废液中有剧毒的氰化钾(KCN,其中氮元素为-3价),化学方程式为KCN+H2O2+H2O===A+NH3↑(已配平),请回答下列问题:
(1)生成物A的化学式是________。
(2)该反应中发生氧化反应的物质是________,理由是___________________________________________________________。
(3)若生成4分子NH3,转移电子数为________个。
(4)用双线桥表示电子转移的方向和数目
___________________________________________________________。
Thanks!
本讲内容结束
