第一章 第三节 氧化还原反应 第二课时 氧化剂和还原剂(共86张ppt)
文档属性
| 名称 | 第一章 第三节 氧化还原反应 第二课时 氧化剂和还原剂(共86张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 17:50:21 | ||
图片预览








文档简介
(共86张PPT)
第二课时 氧化剂和还原剂
第一章 物质及其变化
【课程标准要求】
1.知道常见的氧化剂和还原剂。
2.能从元素价态变化的视角说明物质的转化路径。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、氧化剂与还原剂
1.含义和相互关系
降低
得到
升高
失去
(2)相互关系
①在氧化还原反应中,一种物质(还原剂)失去电子(或电子对偏离),必然同时有物质(氧化剂)______ 电子(或电子对偏向)。
②在氧化还原反应中,电子从还原剂转移到氧化剂。
得到
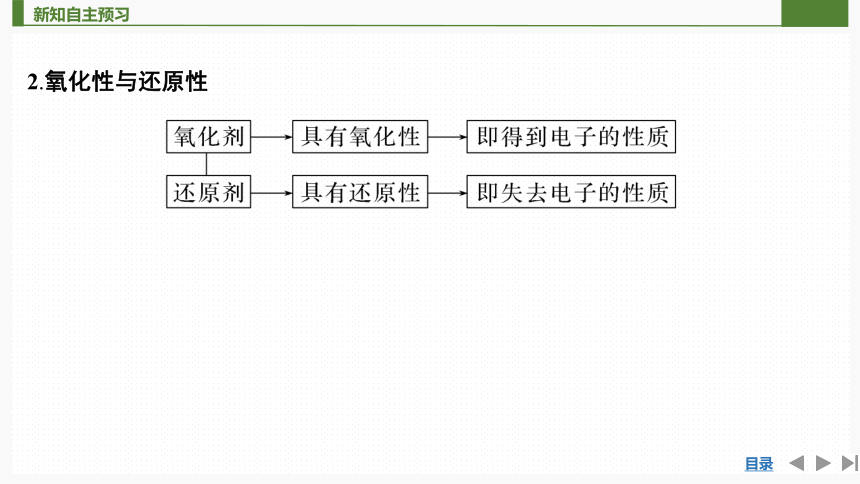
2.氧化性与还原性
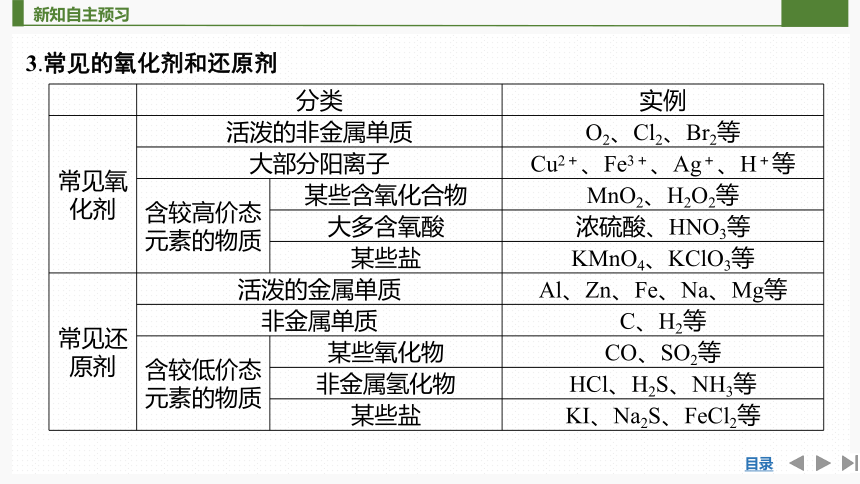
3.常见的氧化剂和还原剂
分类 实例
常见氧化剂 活泼的非金属单质 O2、Cl2、Br2等
大部分阳离子 Cu2+、Fe3+、Ag+、H+等
含较高价态元素的物质 某些含氧化合物 MnO2、H2O2等
大多含氧酸 浓硫酸、HNO3等
某些盐 KMnO4、KClO3等
常见还原剂 活泼的金属单质 Al、Zn、Fe、Na、Mg等
非金属单质 C、H2等
含较低价态元素的物质 某些氧化物 CO、SO2等
非金属氢化物 HCl、H2S、NH3等
某些盐 KI、Na2S、FeCl2等
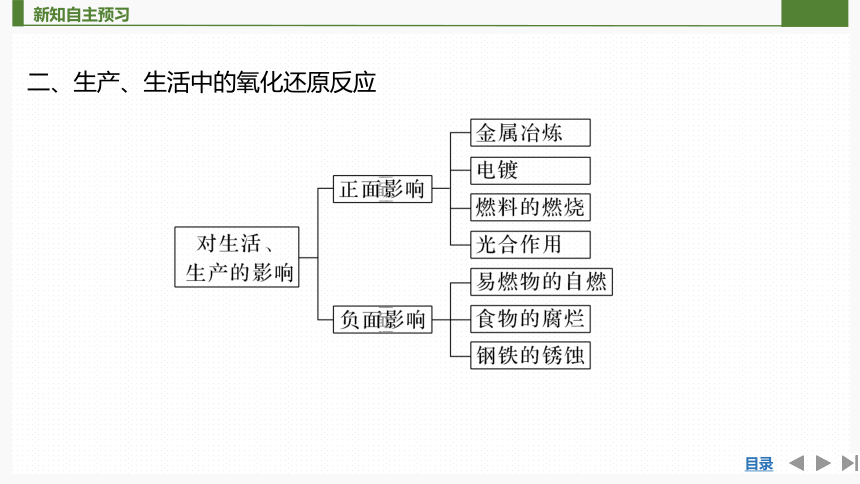
二、生产、生活中的氧化还原反应
【微自测】
答案 (1)× (2)× (3)√ (4)× (5)×
二、氧化还原反应方程式的配平
一、氧化剂和还原剂的判断
一、氧化剂和还原剂的判断
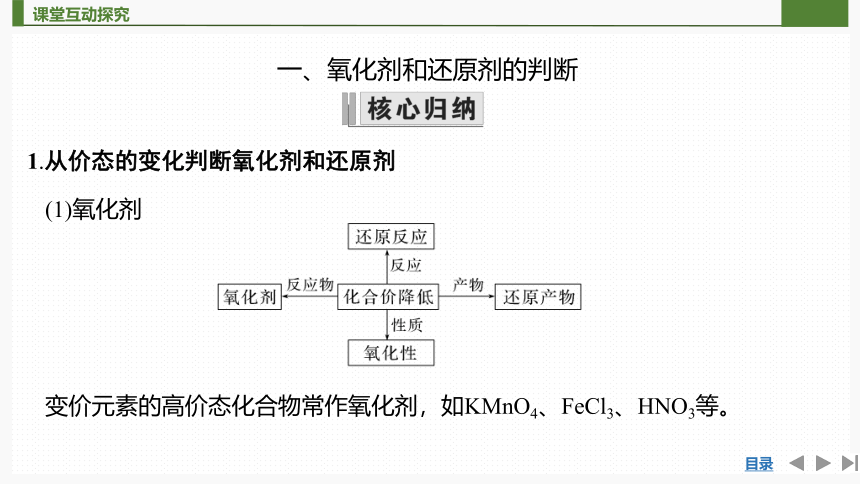
1.从价态的变化判断氧化剂和还原剂
(1)氧化剂
变价元素的高价态化合物常作氧化剂,如KMnO4、FeCl3、HNO3等。
(2)还原剂
含有较低价态元素的化合物常作还原剂,如H2S、CO、SO2等。
2.从物质的类别判断氧化剂和还原剂
(1)活泼性较强的非金属单质(如O2、Cl2等)和过氧化物(如H2O2、Na2O2等)通常作氧化剂。
(2)活泼的金属单质(如Fe、Zn等)和某些非金属单质(如H2、C等)通常作还原剂。
3.氧化还原反应中基本概念之间的关系
(1)氧化剂和还原剂是针对反应物而言的。在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂可以是不同种物质,也可以是同一种物质。
(2)一种元素被氧化,不一定有另一种元素被还原。如反应SO2+2H2S===3S↓+2H2O中,被氧化和被还原的元素都是硫元素;此例还说明,氧化产物和还原产物可以是同一种物质。
1.下列物质不是常见氧化剂的是( )
A.FeCl3 B.KMnO4
C.Fe D.O2
解析 FeCl3中铁元素为+3价,具有氧化性,是常见的氧化剂;KMnO4中锰元素处于最高价态,具有氧化性,是常见的氧化剂;O2具有氧化性,是常见的氧化剂;Fe是金属单质,其中铁元素的化合价为0,处于最低价态,只具有还原性,不是常见的氧化剂。
C
2.(2021·山西太原高一期末)吸进人体内的氧有2%转化为氧化性极强的活性氧,活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.以上均不是
解析 活性氧具有较强的氧化性,亚硒酸钠(Na2SeO3)能消除人体内的活性氧,因此亚硒酸钠具有还原性,与活性氧反应时,亚硒酸钠作还原剂,答案选A。
A
3.高铁酸钾(K2FeO4)作净水剂,既能消毒杀菌,又能吸附水中悬浮物。K2FeO4制备方法为Fe2O3+4KOH+3KClO===2K2FeO4+3KCl+2H2O。下列说法正确的是( )
A.Fe2O3作还原剂
B.KClO发生氧化反应
C.反应后钾元素化合价升高
D.KClO失去电子
A
解析 该反应中铁元素的化合价由+3升高为+6,被氧化,Fe2O3作还原剂,A项正确;氯元素的化合价由+1价降低为-1价,被还原,则制备高铁酸钾用KClO作氧化剂,KClO发生还原反应,B项错误;反应后钾元素化合价不变,C项错误;KClO作氧化剂,在反应中得到电子,D项错误。
二、氧化还原反应方程式的配平
氧化还原方程式的配平
(1)配平原则
(2)配平步骤(建构模型)
(3)配平示例
配平方程式:Zn+HNO3(稀)―→Zn(NO3)2+NO↑+H2O
4.配平下列方程式。
答案 (1)4 5 4 6 (2)3 6 5 1 3 (3)1 4 1 1 2
(4)3 10 3 1 5 (5)3 2 4 3 2 5 (6)5 2 2 5 2 4
5.(1)在酸性条件下,K2Cr2O7与FeSO4反应的离子方程式为
答案 (1)1 6 14 H+ 2 6 7
(2)2 1 2H2O 2 1 4H+
微专题2 探究物质的氧化性或还原性(以过氧化氢为例)
微专题3 物质氧化性、还原性强弱的判断和应用
微专题2 探究物质的氧化性或还原性(以过氧化氢为例)
绿色氧化剂——过氧化氢
过氧化氢,化学式为H2O2,纯过氧化氢是淡蓝色的黏稠液体,
可与水以任意比例混溶,是一种强氧化剂。H2O2水溶液为无色
透明液体,质量分数为3%的H2O2水溶液适用于伤口消毒、环
境消毒和食品消毒。H2O2在通常情况下会缓慢分解成水和氧气,
但分解速率极其慢,加快其反应速率的方法是加入催化剂二氧
化锰等或用短波射线照射。H2O2在不同情况下分别体现氧化性和还原性。
实验探究
[实验目的]
过氧化氢(H2O2)中氧元素的化合价为-1价,处于氧元素的中间价态,过氧化氢是否既具有氧化性,又具有还原性呢?
设计实验证明自己的预测。
[实验用品]
H2O2溶液、酸性KMnO4溶液(紫红色)、KI溶液、淀粉溶液、MnO2粉末、试管、胶头滴管。
[实验原理]
①酸性KMnO4与H2O2反应的化学方程式:
2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4(无色)+5O2↑+8H2O
②H2O2溶液与KI溶液反应的化学方程式:
2KI+H2O2+H2SO4===K2SO4+I2+2H2O[碘(I2)遇淀粉变蓝色]
[实验设计]
实验序号 实验操作 实验现象
① 向试管中加入约1 mL酸性KMnO4溶液,逐滴加入H2O2溶液 有大量无色气泡冒出,溶液紫红色褪去
② 向试管中加入约1 mL的KI溶液,再滴入2~3滴淀粉溶液,逐滴加入H2O2溶液 溶液由无色变成蓝色
③ 向试管中加入约5 mL的H2O2溶液再加入少量MnO2粉末,立即把带火星的木条伸入试管口 有大量无色气泡产生,带火星的木条复燃
1.实验①中产生气泡的成分是什么?在此反应中H2O2体现了什么性质?
提示 气泡的成分是O2;H2O2在反应中氧元素的化合价由-1价升高到0价,故H2O2体现了还原性。
2.实验②中溶液变成蓝色的原因是什么?在此反应中H2O2体现了什么性质?
提示 反应中I-被H2O2氧化成I2,I2使淀粉溶液呈蓝色。H2O2在反应中氧元素的化合价由-1价降低到-2价,故H2O2体现了氧化性。
3.实验③中木条复燃的原因是什么?H2O2在此反应中体现了什么性质?
提示 H2O2在MnO2的催化作用下分解产生O2,O2使木条复燃,H2O2在反应中氧元素的化合价既升高又降低,故H2O2既体现了氧化性,又体现了还原性。
研究物质氧化性或还原性的方法
(1)根据物质中所含元素化合价升或降的可能性,预测物质可能具有还原性或氧化性。若所含某元素的化合价有升高的趋势,说明该物质可能具有还原性;反之,若所含某元素的化合价有降低的趋势,说明该物质可能具有氧化性。
(2)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应验证预测。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验来验证预测。
1.针对以下A~D四个涉及H2O2的反应填空:
D
B
C
A
(2)请用单线桥标出D反应中电子转移的方向和数目:
___________________________________________________________。
反应中氧化剂是________,被氧化的元素是________。
H2O2
Cr
解析 Na2O2和H2O2中氧元素的化合价是-1。A中H2O2不是氧化剂,也不是还原剂;B中H2O2中氧元素的化合价升高,H2O2仅表现还原性;C中H2O2中氧元素的化合价既有升高也有降低,H2O2既表现氧化性,又表现还原性;D中H2O2中氧元素的化合价降低,H2O2只表现氧化性。
2.H2O2有杀菌消毒作用,医疗上常利用它来清洗伤口。
(1)采矿废液中的氰化物(如KCN)一般用H2O2进行无毒化处理,化学方程式为KCN+H2O2+H2O===KHCO3+NH3↑(KCN中N为-3价),该反应中被氧化的元素是________(填元素名称),体现了H2O2的________性。
(2)H2O2被称为“绿色氧化剂”的原因是___________________________
___________________________________________________________。
答案 (1)碳 氧化 (2)H2O2作氧化剂,其还原产物是H2O,无污染
解析 (1)反应中碳元素化合价从+2价升高到+4价,碳元素被氧化。(2)H2O2作氧化剂时,其还原产物是H2O,无污染,因此H2O2被称为“绿色氧化剂”。
3.某一反应体系有反应物和生成物共7种物质:O2、KMnO4、MnSO4、H2SO4、H2O、H2O2、K2SO4。已知该反应中H2O2只发生如下过程:H2O2―→O2,试回答下列问题:
(1)该反应中的氧化剂是________。
(2)该反应中,发生还原反应的过程是_______________________________
___________________________________________________________。
(3)该反应中,氧化产物与还原产物的数量之比是________。
答案 (1)KMnO4
(2)KMnO4―→MnSO4 (3)5∶2
微专题3 物质氧化性、还原性强弱的判断和应用
物质氧化性、还原性强弱的判断方法
(1)根据氧化还原反应的方程式判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
(2)根据元素单质或离子的活动性顺序判断
1.常温下,在溶液中可发生以下反应:
①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2;由此判断下列说法错误的是( )
A.铁元素在反应①和③中均被氧化
B.反应②中当有1个Cl2被还原时,有2个Br-被氧化
C.氧化性强弱顺序为Cl2>Br2>Fe3+>I2
D.还原性强弱顺序为I->Fe2+>Br->Cl-
A
解析 反应①中Fe2+作还原剂,在反应中被氧化,反应③中Fe3+作氧化剂,在反应中被还原,A不正确;反应②中Cl2作氧化剂,当1个Cl2被还原时,有2个Br-被氧化,B正确;由反应①可知,氧化性:Br2>Fe3+,还原性:Fe2+>Br-;由反应②可知,氧化性:Cl2>Br2,还原性:Br->Cl-,由反应③可知,氧化性:Fe3+>I2,还原性:I->Fe2+,故C、D正确。
D
3.已知氧化性:Cl2>Br2>I2。向含有等物质的量浓度的NaBr、KI、NaCl的混合液中通入一定量的氯气,充分反应后将溶液蒸干,并灼烧所得的固体,最后剩余的固体成分可能是( )
A.KCl、Br2 B.NaCl、KCl
C.KI、NaCl D.NaCl、KCl、I2
B
解析 氧化性:Cl2>Br2>I2,根据“强制弱”规律,Cl2能置换出NaBr中的溴、KI中的碘,和NaCl不反应;还原性:KI>NaBr>NaCl,Cl2少量时,Cl2和KI反应生成KCl和I2,Cl2过量时,Cl2和KI反应生成KCl和I2,和NaBr反应生成NaCl和Br2,但Br2、I2加热易挥发,因此灼烧后所得固体只有NaCl和KCl。
4.PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱,下列反应在水溶液中不可能发生的是( )
D
A.NO B.N2 C.CO2 D.CO
解析 反应中,N元素化合价降低,C元素的化合价升高,所含化合价升高被氧化的物质是还原剂,则CO是还原剂,故D正确。
D
2.下列变化过程一定要加入还原剂才能实现的有( )
A.Cl2→Cl- B.Fe3+→Fe2+
C.KClO3→KCl D.KI→I2
解析 A.Cl2→Cl-可通过氯气与氢氧化钠溶液反应实现,氯气既是氧化剂又是还原剂,不需要加入还原剂,故A错误;B.Fe3+→Fe2+,铁元素化合价降低被还原,需要加入还原剂才能实现,故B正确;C.KClO3→KCl,可通过氯酸钾的分解实现,不需要加入还原剂,故C错误;D.KI→I2,I元素化合价升高被氧化,需要加入氧化剂才能实现,故D错误。
B
3.反应3NO2+H2O===2HNO3+NO中,当有6个e-发生转移时,参加反应的还原剂和氧化剂的分子个数之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
解析 在反应中NO2既是氧化剂又是还原剂,3个NO2参与反应,其中2个NO2被氧化,1个被还原,不论有多少电子发生转移,被氧化与被还原的NO2的分子个数之比均为2∶1。故选C。
C
4.(2021·眉山市彭山区第一中学高一月考)人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐(如NaNO2),会导致血红蛋白中Fe2+的转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是( )
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐被还原
A
解析 A.亚硝酸盐会导致血红蛋白中Fe2+被氧化为Fe3+,亚硝酸盐是氧化剂,故A错误;B.维生素C能防止Fe2+被氧化为Fe3+,维生素C是还原剂,故B正确;C.维生素C具有还原性,可以将Fe3+还原为Fe2+,故C正确;D.亚硝酸盐会导致血红蛋白中Fe2+被氧化为Fe3+,亚硝酸盐自身被还原,故D正确。
5.水是生命之源,化学中与水有关的反应也很多:
答案 ①B ②A ③D ④E
6.请配平下列反应方程式:
答案 2 16 2 2 5 8 12
A.Fe B.Fe3O4 C.H2O D.H2
解析 反应中Fe元素化合价升高,被氧化,Fe作为还原剂;H2O中H元素化合价降低,被还原,H2O作为氧化剂。
C
2.NaH可用作生氢剂,反应的化学方程式为NaH+H2O===NaOH+H2↑。该反应中,水的作用是( )
A.溶剂
B.还原剂
C.氧化剂
D.既是还原剂又是氧化剂
解析 NaH+H2O===NaOH+H2↑,H2O得电子,是氧化剂。
C
3.在下列变化中,必须要加入合适的氧化剂才能实现的是( )
A.H2O2→O2 B.FeCl2→FeCl3
C.CaCO3→CO2 D.CuO→Cu
解析 A.H2O2分解可以生成氧气,无需加入氧化剂,故A错误;B.Fe元素化合价升高,应加入氧化剂,故B正确;C.没有元素化合价的变化,不是氧化还原反应,不需要氧化剂,故C错误;D.Cu元素化合价降低,应加入还原剂,故D错误。
B
4.下列说法正确的是( )
A.金属单质在反应中只能作还原剂,非金属单质在反应中只能作氧化剂
B.氧化剂在反应中失去电子,还原剂在反应中得到电子
C.氧化剂具有氧化性,还原剂具有还原性
D.阳离子只有氧化性,阴离子只有还原性
C
5.下列物质中指定元素(括号内的元素)既可体现氧化性又可体现还原性的是( )
A.HCl(Cl) B.H2O2(O)
C.HClO4(Cl) D.KMnO4(Mn)
解析 A.Cl元素处于最低价,该物质只有还原性,不能表现氧化性,A错误;B.O元素的化合价处于中间价,既有氧化性又有还原性,B正确;C.Cl元素的化合价处于最高价态,只有氧化性,C错误;D.Mn元素的化合价处于最高价态,只有氧化性,D错误。
B
6.含有铜元素的物质在以下反应中表现还原性的是( )
A.图①:铜丝在空气中加热
B.图②:氢气与灼热的氧化铜反应
C.图③:硫酸铜溶液中滴加氢氧化钠溶液
D.图④:铁丝插入CuSO4溶液中
A
解析 铜丝在空气中加热生成CuO,表现还原性,A项正确;氢气还原氧化铜,铁丝插入硫酸铜溶液中,+2价的铜均被还原,含铜元素物质表现氧化性,B、D错误;C项为复分解反应,不是氧化还原反应,C项错误。
7.宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2===2Ag2S+2H2O,其中H2S是( )
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
解析 反应中Ag和氧元素的化合价发生变化,而S、H元素的化合价未发生变化,故H2S在反应中既不是氧化剂,又不是还原剂。
D
D
9.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(氧元素为-1价)―→Na2FeO4+Na2O(未配平),下列说法不正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中失去电子
C.配平后为Fe2O3+3Na2O2===2Na2FeO4+Na2O
D.Na2FeO4能消毒杀菌是因其具有强氧化性
A
解析 在反应Fe2O3+Na2O2(氧元素为-1价)―→Na2FeO4+Na2O中,Fe2O3中的铁元素失电子被氧化,化合价由+3价升高到+6价,故Fe2O3是还原剂,Na2O2中氧元素得电子被还原,化合价由-1价降到-2价,故Na2O2是氧化剂;由得失电子守恒和原子守恒配平为Fe2O3+3Na2O2===2Na2FeO4+Na2O;Na2FeO4中Fe处于高价态,具有强氧化性,所以能用于自来水的杀菌消毒。
10.金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
D
解析 第二步反应中NH4NO2既是氧化剂又是还原剂,且该反应中只有氮元素的化合价发生了变化,从四大基本反应类型看,第二步反应是分解反应,所以③④⑤正确,答案为D。
11.已知:①2NaBr+Cl2===2NaCl+Br2;②6FeCl2+3Br2===4FeCl3+2FeBr3。回答下列问题:
(1)反应①中氧化剂是________(填化学式,下同),失电子的元素是________(填元素符号)。
(2)反应②中还原剂是________,氧化产物是______________。
(3)反应②的离子方程式是_______________________________________。
(4)比较Cl2、FeCl3、Br2的氧化性,氧化性由强到弱的顺序是______________。
(5)向FeBr2溶液中通入过量氯气,发生反应的离子方程式是___________________________________________________________。
Cl2
Br
FeCl2
FeCl3和FeBr3
2Fe2++Br2===2Fe3++2Br-
Cl2>Br2>FeCl3
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
12.《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶端分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的发烛就是原始的火柴。K2Cr2O7在工业中用作制造火柴头的氧化剂。
已知反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O
(1)________(填元素名称)元素被氧化,________(填化学式,下同)是氧化剂。
(2)________是氧化产物,________发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸的作用的HCl的质量比为________。
(4)该反应中每生成3分子Cl2转移电子个数为________。
答案 (1)氯 K2Cr2O7 (2)Cl2 HCl (3)3∶4 (4)6
解析 (1)反应中部分氯元素的化合价由-1价升高到0价,被氧化;K2Cr2O7中铬元素的化合价由+6价降低到+3价,被还原,K2Cr2O7作氧化剂。(2)HCl→Cl2,氯元素化合价升高,发生氧化反应,Cl2为氧化产物。(3)14个HCl分子参加反应,有6个HCl分子被氧化,生成3个Cl2分子,另外8个HCl分子起酸的作用,所以起还原剂(被氧化)作用的HCl与起酸的作用的HCl的质量比为6∶8=3∶4。(4)部分氯元素的化合价由-1价变到0价,故生成3分子Cl2转移电子个数为3×2×[0-(-1)]=6。
13.电子安全气囊系统是一种被动安全性的保护系统,它与座椅安全带配合使用,可以为乘员提供有效的防撞保护。汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3―→K2O+Na2O+N2↑(未配平)。对上述反应的描述错误的是( )
A.NaN3是还原剂,KNO3是氧化剂
B.该反应中有两种元素的化合价发生变化
C.配平后物质的化学计量数依次为10、2、1、5、16
D.若生成8分子N2,则转移电子5个
B
解析 由题给反应中氮元素的化合价变化可知,NaN3为还原剂,KNO3为氧化剂,A项正确;该反应中只有氮元素的化合价发生变化,B项错误;根据得失电子守恒及原子守恒配平化学方程式为10NaN3+2KNO3===K2O+5Na2O+16N2↑,C项正确;由10NaN3+2KNO3===K2O+5Na2O+16N2↑可知,生成16分子N2时,转移10个电子,则生成8分子N2时,转移5个电子,D项正确。
C
15.有以下转化关系:
Thanks!
本讲内容结束
第二课时 氧化剂和还原剂
第一章 物质及其变化
【课程标准要求】
1.知道常见的氧化剂和还原剂。
2.能从元素价态变化的视角说明物质的转化路径。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、氧化剂与还原剂
1.含义和相互关系
降低
得到
升高
失去
(2)相互关系
①在氧化还原反应中,一种物质(还原剂)失去电子(或电子对偏离),必然同时有物质(氧化剂)______ 电子(或电子对偏向)。
②在氧化还原反应中,电子从还原剂转移到氧化剂。
得到
2.氧化性与还原性
3.常见的氧化剂和还原剂
分类 实例
常见氧化剂 活泼的非金属单质 O2、Cl2、Br2等
大部分阳离子 Cu2+、Fe3+、Ag+、H+等
含较高价态元素的物质 某些含氧化合物 MnO2、H2O2等
大多含氧酸 浓硫酸、HNO3等
某些盐 KMnO4、KClO3等
常见还原剂 活泼的金属单质 Al、Zn、Fe、Na、Mg等
非金属单质 C、H2等
含较低价态元素的物质 某些氧化物 CO、SO2等
非金属氢化物 HCl、H2S、NH3等
某些盐 KI、Na2S、FeCl2等
二、生产、生活中的氧化还原反应
【微自测】
答案 (1)× (2)× (3)√ (4)× (5)×
二、氧化还原反应方程式的配平
一、氧化剂和还原剂的判断
一、氧化剂和还原剂的判断
1.从价态的变化判断氧化剂和还原剂
(1)氧化剂
变价元素的高价态化合物常作氧化剂,如KMnO4、FeCl3、HNO3等。
(2)还原剂
含有较低价态元素的化合物常作还原剂,如H2S、CO、SO2等。
2.从物质的类别判断氧化剂和还原剂
(1)活泼性较强的非金属单质(如O2、Cl2等)和过氧化物(如H2O2、Na2O2等)通常作氧化剂。
(2)活泼的金属单质(如Fe、Zn等)和某些非金属单质(如H2、C等)通常作还原剂。
3.氧化还原反应中基本概念之间的关系
(1)氧化剂和还原剂是针对反应物而言的。在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂可以是不同种物质,也可以是同一种物质。
(2)一种元素被氧化,不一定有另一种元素被还原。如反应SO2+2H2S===3S↓+2H2O中,被氧化和被还原的元素都是硫元素;此例还说明,氧化产物和还原产物可以是同一种物质。
1.下列物质不是常见氧化剂的是( )
A.FeCl3 B.KMnO4
C.Fe D.O2
解析 FeCl3中铁元素为+3价,具有氧化性,是常见的氧化剂;KMnO4中锰元素处于最高价态,具有氧化性,是常见的氧化剂;O2具有氧化性,是常见的氧化剂;Fe是金属单质,其中铁元素的化合价为0,处于最低价态,只具有还原性,不是常见的氧化剂。
C
2.(2021·山西太原高一期末)吸进人体内的氧有2%转化为氧化性极强的活性氧,活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.以上均不是
解析 活性氧具有较强的氧化性,亚硒酸钠(Na2SeO3)能消除人体内的活性氧,因此亚硒酸钠具有还原性,与活性氧反应时,亚硒酸钠作还原剂,答案选A。
A
3.高铁酸钾(K2FeO4)作净水剂,既能消毒杀菌,又能吸附水中悬浮物。K2FeO4制备方法为Fe2O3+4KOH+3KClO===2K2FeO4+3KCl+2H2O。下列说法正确的是( )
A.Fe2O3作还原剂
B.KClO发生氧化反应
C.反应后钾元素化合价升高
D.KClO失去电子
A
解析 该反应中铁元素的化合价由+3升高为+6,被氧化,Fe2O3作还原剂,A项正确;氯元素的化合价由+1价降低为-1价,被还原,则制备高铁酸钾用KClO作氧化剂,KClO发生还原反应,B项错误;反应后钾元素化合价不变,C项错误;KClO作氧化剂,在反应中得到电子,D项错误。
二、氧化还原反应方程式的配平
氧化还原方程式的配平
(1)配平原则
(2)配平步骤(建构模型)
(3)配平示例
配平方程式:Zn+HNO3(稀)―→Zn(NO3)2+NO↑+H2O
4.配平下列方程式。
答案 (1)4 5 4 6 (2)3 6 5 1 3 (3)1 4 1 1 2
(4)3 10 3 1 5 (5)3 2 4 3 2 5 (6)5 2 2 5 2 4
5.(1)在酸性条件下,K2Cr2O7与FeSO4反应的离子方程式为
答案 (1)1 6 14 H+ 2 6 7
(2)2 1 2H2O 2 1 4H+
微专题2 探究物质的氧化性或还原性(以过氧化氢为例)
微专题3 物质氧化性、还原性强弱的判断和应用
微专题2 探究物质的氧化性或还原性(以过氧化氢为例)
绿色氧化剂——过氧化氢
过氧化氢,化学式为H2O2,纯过氧化氢是淡蓝色的黏稠液体,
可与水以任意比例混溶,是一种强氧化剂。H2O2水溶液为无色
透明液体,质量分数为3%的H2O2水溶液适用于伤口消毒、环
境消毒和食品消毒。H2O2在通常情况下会缓慢分解成水和氧气,
但分解速率极其慢,加快其反应速率的方法是加入催化剂二氧
化锰等或用短波射线照射。H2O2在不同情况下分别体现氧化性和还原性。
实验探究
[实验目的]
过氧化氢(H2O2)中氧元素的化合价为-1价,处于氧元素的中间价态,过氧化氢是否既具有氧化性,又具有还原性呢?
设计实验证明自己的预测。
[实验用品]
H2O2溶液、酸性KMnO4溶液(紫红色)、KI溶液、淀粉溶液、MnO2粉末、试管、胶头滴管。
[实验原理]
①酸性KMnO4与H2O2反应的化学方程式:
2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4(无色)+5O2↑+8H2O
②H2O2溶液与KI溶液反应的化学方程式:
2KI+H2O2+H2SO4===K2SO4+I2+2H2O[碘(I2)遇淀粉变蓝色]
[实验设计]
实验序号 实验操作 实验现象
① 向试管中加入约1 mL酸性KMnO4溶液,逐滴加入H2O2溶液 有大量无色气泡冒出,溶液紫红色褪去
② 向试管中加入约1 mL的KI溶液,再滴入2~3滴淀粉溶液,逐滴加入H2O2溶液 溶液由无色变成蓝色
③ 向试管中加入约5 mL的H2O2溶液再加入少量MnO2粉末,立即把带火星的木条伸入试管口 有大量无色气泡产生,带火星的木条复燃
1.实验①中产生气泡的成分是什么?在此反应中H2O2体现了什么性质?
提示 气泡的成分是O2;H2O2在反应中氧元素的化合价由-1价升高到0价,故H2O2体现了还原性。
2.实验②中溶液变成蓝色的原因是什么?在此反应中H2O2体现了什么性质?
提示 反应中I-被H2O2氧化成I2,I2使淀粉溶液呈蓝色。H2O2在反应中氧元素的化合价由-1价降低到-2价,故H2O2体现了氧化性。
3.实验③中木条复燃的原因是什么?H2O2在此反应中体现了什么性质?
提示 H2O2在MnO2的催化作用下分解产生O2,O2使木条复燃,H2O2在反应中氧元素的化合价既升高又降低,故H2O2既体现了氧化性,又体现了还原性。
研究物质氧化性或还原性的方法
(1)根据物质中所含元素化合价升或降的可能性,预测物质可能具有还原性或氧化性。若所含某元素的化合价有升高的趋势,说明该物质可能具有还原性;反之,若所含某元素的化合价有降低的趋势,说明该物质可能具有氧化性。
(2)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应验证预测。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验来验证预测。
1.针对以下A~D四个涉及H2O2的反应填空:
D
B
C
A
(2)请用单线桥标出D反应中电子转移的方向和数目:
___________________________________________________________。
反应中氧化剂是________,被氧化的元素是________。
H2O2
Cr
解析 Na2O2和H2O2中氧元素的化合价是-1。A中H2O2不是氧化剂,也不是还原剂;B中H2O2中氧元素的化合价升高,H2O2仅表现还原性;C中H2O2中氧元素的化合价既有升高也有降低,H2O2既表现氧化性,又表现还原性;D中H2O2中氧元素的化合价降低,H2O2只表现氧化性。
2.H2O2有杀菌消毒作用,医疗上常利用它来清洗伤口。
(1)采矿废液中的氰化物(如KCN)一般用H2O2进行无毒化处理,化学方程式为KCN+H2O2+H2O===KHCO3+NH3↑(KCN中N为-3价),该反应中被氧化的元素是________(填元素名称),体现了H2O2的________性。
(2)H2O2被称为“绿色氧化剂”的原因是___________________________
___________________________________________________________。
答案 (1)碳 氧化 (2)H2O2作氧化剂,其还原产物是H2O,无污染
解析 (1)反应中碳元素化合价从+2价升高到+4价,碳元素被氧化。(2)H2O2作氧化剂时,其还原产物是H2O,无污染,因此H2O2被称为“绿色氧化剂”。
3.某一反应体系有反应物和生成物共7种物质:O2、KMnO4、MnSO4、H2SO4、H2O、H2O2、K2SO4。已知该反应中H2O2只发生如下过程:H2O2―→O2,试回答下列问题:
(1)该反应中的氧化剂是________。
(2)该反应中,发生还原反应的过程是_______________________________
___________________________________________________________。
(3)该反应中,氧化产物与还原产物的数量之比是________。
答案 (1)KMnO4
(2)KMnO4―→MnSO4 (3)5∶2
微专题3 物质氧化性、还原性强弱的判断和应用
物质氧化性、还原性强弱的判断方法
(1)根据氧化还原反应的方程式判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
(2)根据元素单质或离子的活动性顺序判断
1.常温下,在溶液中可发生以下反应:
①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2;由此判断下列说法错误的是( )
A.铁元素在反应①和③中均被氧化
B.反应②中当有1个Cl2被还原时,有2个Br-被氧化
C.氧化性强弱顺序为Cl2>Br2>Fe3+>I2
D.还原性强弱顺序为I->Fe2+>Br->Cl-
A
解析 反应①中Fe2+作还原剂,在反应中被氧化,反应③中Fe3+作氧化剂,在反应中被还原,A不正确;反应②中Cl2作氧化剂,当1个Cl2被还原时,有2个Br-被氧化,B正确;由反应①可知,氧化性:Br2>Fe3+,还原性:Fe2+>Br-;由反应②可知,氧化性:Cl2>Br2,还原性:Br->Cl-,由反应③可知,氧化性:Fe3+>I2,还原性:I->Fe2+,故C、D正确。
D
3.已知氧化性:Cl2>Br2>I2。向含有等物质的量浓度的NaBr、KI、NaCl的混合液中通入一定量的氯气,充分反应后将溶液蒸干,并灼烧所得的固体,最后剩余的固体成分可能是( )
A.KCl、Br2 B.NaCl、KCl
C.KI、NaCl D.NaCl、KCl、I2
B
解析 氧化性:Cl2>Br2>I2,根据“强制弱”规律,Cl2能置换出NaBr中的溴、KI中的碘,和NaCl不反应;还原性:KI>NaBr>NaCl,Cl2少量时,Cl2和KI反应生成KCl和I2,Cl2过量时,Cl2和KI反应生成KCl和I2,和NaBr反应生成NaCl和Br2,但Br2、I2加热易挥发,因此灼烧后所得固体只有NaCl和KCl。
4.PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱,下列反应在水溶液中不可能发生的是( )
D
A.NO B.N2 C.CO2 D.CO
解析 反应中,N元素化合价降低,C元素的化合价升高,所含化合价升高被氧化的物质是还原剂,则CO是还原剂,故D正确。
D
2.下列变化过程一定要加入还原剂才能实现的有( )
A.Cl2→Cl- B.Fe3+→Fe2+
C.KClO3→KCl D.KI→I2
解析 A.Cl2→Cl-可通过氯气与氢氧化钠溶液反应实现,氯气既是氧化剂又是还原剂,不需要加入还原剂,故A错误;B.Fe3+→Fe2+,铁元素化合价降低被还原,需要加入还原剂才能实现,故B正确;C.KClO3→KCl,可通过氯酸钾的分解实现,不需要加入还原剂,故C错误;D.KI→I2,I元素化合价升高被氧化,需要加入氧化剂才能实现,故D错误。
B
3.反应3NO2+H2O===2HNO3+NO中,当有6个e-发生转移时,参加反应的还原剂和氧化剂的分子个数之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
解析 在反应中NO2既是氧化剂又是还原剂,3个NO2参与反应,其中2个NO2被氧化,1个被还原,不论有多少电子发生转移,被氧化与被还原的NO2的分子个数之比均为2∶1。故选C。
C
4.(2021·眉山市彭山区第一中学高一月考)人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐(如NaNO2),会导致血红蛋白中Fe2+的转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是( )
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐被还原
A
解析 A.亚硝酸盐会导致血红蛋白中Fe2+被氧化为Fe3+,亚硝酸盐是氧化剂,故A错误;B.维生素C能防止Fe2+被氧化为Fe3+,维生素C是还原剂,故B正确;C.维生素C具有还原性,可以将Fe3+还原为Fe2+,故C正确;D.亚硝酸盐会导致血红蛋白中Fe2+被氧化为Fe3+,亚硝酸盐自身被还原,故D正确。
5.水是生命之源,化学中与水有关的反应也很多:
答案 ①B ②A ③D ④E
6.请配平下列反应方程式:
答案 2 16 2 2 5 8 12
A.Fe B.Fe3O4 C.H2O D.H2
解析 反应中Fe元素化合价升高,被氧化,Fe作为还原剂;H2O中H元素化合价降低,被还原,H2O作为氧化剂。
C
2.NaH可用作生氢剂,反应的化学方程式为NaH+H2O===NaOH+H2↑。该反应中,水的作用是( )
A.溶剂
B.还原剂
C.氧化剂
D.既是还原剂又是氧化剂
解析 NaH+H2O===NaOH+H2↑,H2O得电子,是氧化剂。
C
3.在下列变化中,必须要加入合适的氧化剂才能实现的是( )
A.H2O2→O2 B.FeCl2→FeCl3
C.CaCO3→CO2 D.CuO→Cu
解析 A.H2O2分解可以生成氧气,无需加入氧化剂,故A错误;B.Fe元素化合价升高,应加入氧化剂,故B正确;C.没有元素化合价的变化,不是氧化还原反应,不需要氧化剂,故C错误;D.Cu元素化合价降低,应加入还原剂,故D错误。
B
4.下列说法正确的是( )
A.金属单质在反应中只能作还原剂,非金属单质在反应中只能作氧化剂
B.氧化剂在反应中失去电子,还原剂在反应中得到电子
C.氧化剂具有氧化性,还原剂具有还原性
D.阳离子只有氧化性,阴离子只有还原性
C
5.下列物质中指定元素(括号内的元素)既可体现氧化性又可体现还原性的是( )
A.HCl(Cl) B.H2O2(O)
C.HClO4(Cl) D.KMnO4(Mn)
解析 A.Cl元素处于最低价,该物质只有还原性,不能表现氧化性,A错误;B.O元素的化合价处于中间价,既有氧化性又有还原性,B正确;C.Cl元素的化合价处于最高价态,只有氧化性,C错误;D.Mn元素的化合价处于最高价态,只有氧化性,D错误。
B
6.含有铜元素的物质在以下反应中表现还原性的是( )
A.图①:铜丝在空气中加热
B.图②:氢气与灼热的氧化铜反应
C.图③:硫酸铜溶液中滴加氢氧化钠溶液
D.图④:铁丝插入CuSO4溶液中
A
解析 铜丝在空气中加热生成CuO,表现还原性,A项正确;氢气还原氧化铜,铁丝插入硫酸铜溶液中,+2价的铜均被还原,含铜元素物质表现氧化性,B、D错误;C项为复分解反应,不是氧化还原反应,C项错误。
7.宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2===2Ag2S+2H2O,其中H2S是( )
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
解析 反应中Ag和氧元素的化合价发生变化,而S、H元素的化合价未发生变化,故H2S在反应中既不是氧化剂,又不是还原剂。
D
D
9.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(氧元素为-1价)―→Na2FeO4+Na2O(未配平),下列说法不正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中失去电子
C.配平后为Fe2O3+3Na2O2===2Na2FeO4+Na2O
D.Na2FeO4能消毒杀菌是因其具有强氧化性
A
解析 在反应Fe2O3+Na2O2(氧元素为-1价)―→Na2FeO4+Na2O中,Fe2O3中的铁元素失电子被氧化,化合价由+3价升高到+6价,故Fe2O3是还原剂,Na2O2中氧元素得电子被还原,化合价由-1价降到-2价,故Na2O2是氧化剂;由得失电子守恒和原子守恒配平为Fe2O3+3Na2O2===2Na2FeO4+Na2O;Na2FeO4中Fe处于高价态,具有强氧化性,所以能用于自来水的杀菌消毒。
10.金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
D
解析 第二步反应中NH4NO2既是氧化剂又是还原剂,且该反应中只有氮元素的化合价发生了变化,从四大基本反应类型看,第二步反应是分解反应,所以③④⑤正确,答案为D。
11.已知:①2NaBr+Cl2===2NaCl+Br2;②6FeCl2+3Br2===4FeCl3+2FeBr3。回答下列问题:
(1)反应①中氧化剂是________(填化学式,下同),失电子的元素是________(填元素符号)。
(2)反应②中还原剂是________,氧化产物是______________。
(3)反应②的离子方程式是_______________________________________。
(4)比较Cl2、FeCl3、Br2的氧化性,氧化性由强到弱的顺序是______________。
(5)向FeBr2溶液中通入过量氯气,发生反应的离子方程式是___________________________________________________________。
Cl2
Br
FeCl2
FeCl3和FeBr3
2Fe2++Br2===2Fe3++2Br-
Cl2>Br2>FeCl3
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
12.《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶端分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的发烛就是原始的火柴。K2Cr2O7在工业中用作制造火柴头的氧化剂。
已知反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O
(1)________(填元素名称)元素被氧化,________(填化学式,下同)是氧化剂。
(2)________是氧化产物,________发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸的作用的HCl的质量比为________。
(4)该反应中每生成3分子Cl2转移电子个数为________。
答案 (1)氯 K2Cr2O7 (2)Cl2 HCl (3)3∶4 (4)6
解析 (1)反应中部分氯元素的化合价由-1价升高到0价,被氧化;K2Cr2O7中铬元素的化合价由+6价降低到+3价,被还原,K2Cr2O7作氧化剂。(2)HCl→Cl2,氯元素化合价升高,发生氧化反应,Cl2为氧化产物。(3)14个HCl分子参加反应,有6个HCl分子被氧化,生成3个Cl2分子,另外8个HCl分子起酸的作用,所以起还原剂(被氧化)作用的HCl与起酸的作用的HCl的质量比为6∶8=3∶4。(4)部分氯元素的化合价由-1价变到0价,故生成3分子Cl2转移电子个数为3×2×[0-(-1)]=6。
13.电子安全气囊系统是一种被动安全性的保护系统,它与座椅安全带配合使用,可以为乘员提供有效的防撞保护。汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3―→K2O+Na2O+N2↑(未配平)。对上述反应的描述错误的是( )
A.NaN3是还原剂,KNO3是氧化剂
B.该反应中有两种元素的化合价发生变化
C.配平后物质的化学计量数依次为10、2、1、5、16
D.若生成8分子N2,则转移电子5个
B
解析 由题给反应中氮元素的化合价变化可知,NaN3为还原剂,KNO3为氧化剂,A项正确;该反应中只有氮元素的化合价发生变化,B项错误;根据得失电子守恒及原子守恒配平化学方程式为10NaN3+2KNO3===K2O+5Na2O+16N2↑,C项正确;由10NaN3+2KNO3===K2O+5Na2O+16N2↑可知,生成16分子N2时,转移10个电子,则生成8分子N2时,转移5个电子,D项正确。
C
15.有以下转化关系:
Thanks!
本讲内容结束
