第四章 第三节 化学键 第二课时 共价键(共89张ppt)
文档属性
| 名称 | 第四章 第三节 化学键 第二课时 共价键(共89张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 17:57:39 | ||
图片预览










文档简介
(共89张PPT)
第二课时 共价键
第四章 物质结构 元素周期律
【课程标准要求】
1.认识构成物质的微粒之间存在的相互作用,结合典型实例认识共价键的形成,建立化学键概念。
2.知道分子存在一定的空间结构。认识化学键的断裂和形成是化学反应中物质变化的实质及能量变化的主要原因。
3.能判断简单离子化合物和共价化合物中化学键的类型。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、共价键与共价化合物
1.共价键
(1)形成过程(以Cl2形成为例)
用电子式表示:
(2)概念:原子间通过____________所形成的__________。
共用电子对
相互作用
(3)成键粒子:______。
(4)成键元素:同种或不同种________元素化合时能形成共价键。
(5)存在
①非金属元素的多原子单质,如__________________。
②共价化合物,如____________________________。
③某些离子化合物,如____________________________________。
原子
非金属
H2、O2、N2
CO2、HCl、H2SO4
NaOH、Na2CO3、NH4Cl
2.共价键的类型
(1)非极性共价键(非极性键):由同种原子形成的共价键。
(2)极性共价键(极性键):不同种元素的原子形成的共价键。
3.共价化合物
以____________形成分子的化合物。
共用电子对
【微自测】
1.下列描述中,正确的打“√”,错误的打“×”。
(1)离子化合物中一定不存在共价键( )
(2)含有共价键的化合物一定是共价化合物( )
(3)共价化合物中可能含有离子键( )
(4)构成单质分子的粒子一定含有共价键( )
(5)由非金属元素组成的化合物不一定是共价化合物( )
答案 (1)× (2)× (3)× (4)× (5)√
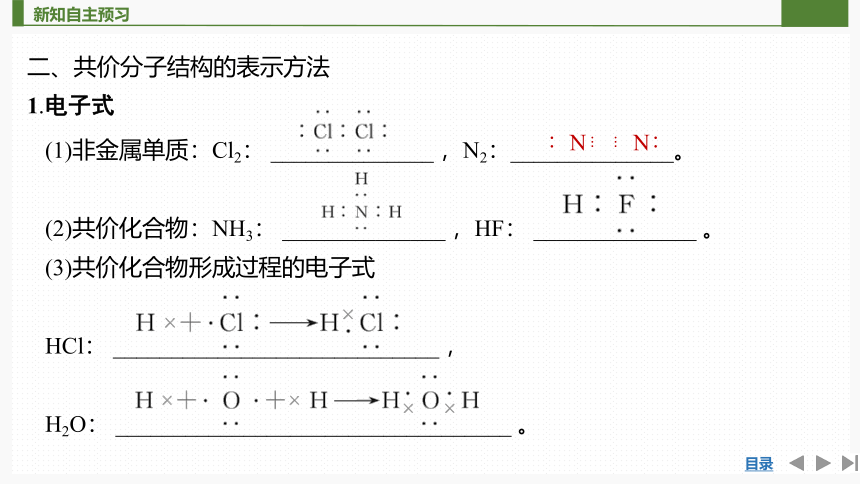
二、共价分子结构的表示方法
1.电子式
(1)非金属单质:Cl2: ______________ ,N2:______________。
(2)共价化合物:NH3: ______________ ,HF: ______________ 。
(3)共价化合物形成过程的电子式
HCl: ____________________________ ,
H2O: __________________________________ 。
∶N N∶
2.结构式
(1)含义
化学上,常用“—”表示1对____________,如氯分子可表示为“Cl—Cl”,这种图示叫做结构式。
共用电子对
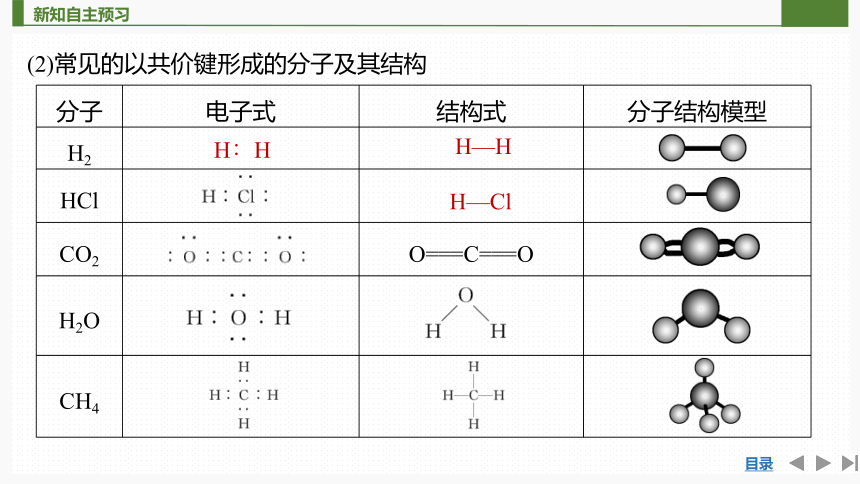
(2)常见的以共价键形成的分子及其结构
分子 电子式 结构式 分子结构模型
H2
HCl
CO2 O===C===O
H2O
CH4
H∶H
H—H
H—Cl
【微自测】
2.下列说法或描述中,正确的打“√”,错误的打“×”。
答案 (1)× (2)× (3)√ (4)×
三、化学键 分子间作用力
1.化学键
(1)概念:相邻的原子之间强烈的相互作用叫化学键。
(2)类型
①原子间价电子的转移——________。
②原子间价电子的共用——________。
(3)化学反应的本质:
一个化学反应的发生,本质上就是旧化学键的______和新化学键______的过程。
离子键
共价键
断裂
形成
2.分子间作用力
(1)概念:分子之间存在一种把______聚集在一起的作用力,叫做分子间作用力,又叫范德华力。
(2)规律:分子间作用力比化学键____得多,对物质的熔点、沸点等有影响。一般来说,对于组成和结构相似的分子,相对分子质量越大,分子间作用力______,物质的熔点、沸点______。
分子
弱
越大
越高
3.氢键
(1)分子间形成的氢键也是一种分子间作用力,它比化学键____,但比范德华力____。
(2)若分子间形成氢键,会使物质的熔点和沸点升高。水结成冰时体积膨胀、DNA的结构等都与氢键有关。
弱
强
【微自测】
3.下列描述中,正确的打“√”,错误的打“×”。
(1)物质中一定存在化学键( )
(2)化学键既可存在于分子内的原子间,又可存在于分子之间( )
(3)氢键是化学键的一种( )
(4)稀有气体不存在化学键( )
答案 (1)× (2)× (3)× (4)√
二、物质变化过程中化学键的变化
一、化学键和化合物类型的判断
一、化学键和化合物类型的判断
如图是氢原子与氯原子形成氯化氢分子的示意图
1.氢原子与氯原子之间通过哪种作用力结合到一起?用电子式表示氯化氢的形成过程。
2.共价化合物中一定存在共价键,是否存在离子键?离子化合物中一定存在离子键,是否存在共价键?
提示 共价化合物中一定存在共价键,一定不存在离子键。离子化合物中一定存在离子键,可能存在共价键。如NaOH中存在Na+与OH-之间的离子键,O、H之间的极性共价键。
3.所有物质中都存在化学键吗?化合物中是否存在非极性键?
提示 并非所有物质中都存在化学键,如稀有气体中不存在化学键;非极性键存在于共价单质(如H2、Cl2等)中,也可能存在于离子化合物(如Na2O2等)或共价化合物(如H2O2等)中。
1.从物质类别角度判断化学键类型
物质类别 所含化学键类型
非金属单质,如Cl2、N2、I2、P4、金刚石等 只有共价键
非金属元素构成的化合物,如H2SO4、CO2、NH3、HCl、CCl4、CS2等 活泼非金属元素与活泼金属元素形成的化合物,如NaCl、CaCl2、K2O等 只有离子键
含有原子团的离子化合物,如Na2SO4、Ba(OH)2、NH4Cl、Na2O2等 既有离子键
又有共价键
稀有气体,如Ne、Ar等 没有化学键
2.离子化合物和共价化合物的三种判断方法
(1)根据化学键的类型来判断:凡含有离子键的化合物一定是离子化合物;只含有共价键的化合物是共价化合物。
(2)根据化合物的类型来判断:大多数碱性氧化物、强碱和大多数盐都属于离子化合物(特例:AlCl3为共价化合物);非金属氢化物、非金属氧化物、含氧酸等都属于共价化合物。
(3)根据化合物的性质来判断:一般熔、沸点较低的化合物是共价化合物;熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导电的化合物是共价化合物,如AlCl3。
1.关于离子键、共价键的下列说法中正确的是( )
A.CaCl2中既有离子键又有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
解析 CaCl2中无共价键,A项错误;非极性键存在于单质分子和化合物中,如H2O2中氧原子间为非极性键,B、D项错误;若有离子键,则属于离子化合物,共价化合物中一定无离子键,C项正确。
C
2.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
解析 A项,MgCl2仅含离子键;C项,HCl含有共价键,是共价化合物;D项,NaOH含有离子键、共价键,是离子化合物。
B
选项 A B C D
物质 MgCl2 CO2 HCl NaOH
所含化学键类型 离子键、共价键 共价键 离子键 离子键、共价键
所属化合物类型 离子化合物 共价化合物 离子化合物 共价化合物
二、物质变化过程中化学键的变化
1.化学反应过程
化学反应过程中反应物一定有旧化学键被破坏和产物中新化学键的形成。如:H2+F2===2HF,H—H键,F—F键均被破坏,形成H—F键。
2.离子化合物的溶解或熔化过程
3.共价化合物的溶解或熔化过程
4.单质的溶解或熔化过程
单质特点 化学键变化 举例
由分子构成的固体单质 熔化时不破坏化学键 P4等
由原子构成的单质(稀有气体除外) 熔化时破坏共价键 金刚石等
能与水反应的某些活泼非金属单质 溶于水后,分子内的共价键被破坏 Cl2、F2等
3.下列变化中,不需要破坏化学键的是( )
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
解析 HCl溶于水时,电离出H+、Cl-,共价键被破坏,A项不符合题意;加热分解KClO3是化学变化,其过程中一定存在旧化学键的断裂和新化学键的形成,B项不符合题意;I2升华是物理变化,I2由固态变成气态,化学键未被破坏,C项符合题意;NaCl溶于水,电离出Na+、Cl-,离子键被破坏,D项不符合题意。
C
4.下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的是( )
C
解析 A项反应中没有离子键的形成,也没有非极性键的断裂和形成,A不符合题意;B项反应中没有离子键的断裂,也没有非极性键的断裂和形成,B不符合题意;C项反应中同时有离子键、极性键和非极性键的断裂和形成,C符合题意;D项反应中没有非极性键的形成,D不符合题意。
5.试分析下列各种情况下微粒间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):
(1)NaCl溶于水时破坏________。
(2)HCl溶于水时破坏________。
(3)SO2溶于水时破坏________。
(4)酒精溶于水时破坏______________。
(5)NaOH和HCl反应时形成________和________。
离子键
极性键
极性键
分子间作用力
离子键
极性键
解析 NaCl、HCl、SO2中分别含有离子键、极性键、极性键,溶于水时被破坏相应的化学键;酒精溶于水时破坏分子间作用力;(8)中Na2O是离子化合物,熔化时破坏离子键。
非极性键
极性键
离子键
离子键
离子键
微专题13 电子总数相同微粒的组成规律
1.等电子微粒
(1)寻找方法
①核外电子总数相等的微粒可以是分子、原子,也可以是离子;可以是单核微粒,也可以是多核微粒。
②以Ne、Ar为基准,联系同周期非金属元素的阴离子及其氢化物,下一周期金属元素的阳离子,并利用分子失去或得到H+后电子数不变,2个9电子基团可组合成1个18电子微粒等方法,可归纳出常见的10电子、18电子微粒。
(2)巧记10电子微粒和18电子微粒
①“10电子”微粒记忆方法
②“18电子”微粒记忆方法
2.“8电子稳定结构”的判断方法
(1)经验规律法
①分子中的氢原子不满足8电子结构;
②一般来说,在ABn型分子中,若某元素原子最外层电子数+|化合价|=8,则该元素原子的最外层满足8电子稳定结构。如CO2分子中,碳元素的化合价为+4,碳原子最外层电子数为4,二者之和为8,则碳原子满足最外层8电子稳定结构,同理知氧原子也满足最外层8电子稳定结构。
(2)成键数目法
若该原子达到所需成键数目,则为8电子结构,若未达到或超过所需成键数目则不为8电子结构,如PCl5中的P,BeCl2中的Be。
1.与OH-具有相同电子总数和质子总数的微粒是( )
A.K+ B.Na+
C.F- D.Ne
解析 OH-的质子数为9,电子数为10。K+的质子数为19,电子数为18,故A错误;Na+的质子数为11,电子数为10,故B错误;F-的质子数为9,电子数为10,故C正确;Ne的质子数为10,电子数为10,故D错误。
C
2.核外电子层结构相同的一组粒子是( )
A.Mg2+、Al3+、Cl-、Ar
B.Na+、F-、S2-、Ne
C.K+、Ca2+、S2-、Ar
D.Mg2+、Na+、Cl-、K+
C
3.下列各组微粒中,具有相同质子数和电子数的一组微粒是( )
A
4.下列分子中所有原子最外层都满足8电子结构的是________(填序号)。
①BeCl2 ②PCl5 ③SF6 ④CS2 ⑤CH4 ⑥SiO2 ⑦CF2Cl2
答案 ④⑥⑦
5.A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子。已知:
1.下列关于共价键的说法正确的是( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同种元素原子之间形成
D.稀有气体分子中存在共价键
B
解析 金属原子与非金属原子之间可能形成共价键,如AlCl3分子中只有共价键,A项错误;非金属元素原子间一般以共价键结合形成分子,可以是同种元素原子之间,如O2,也可以是不同种元素原子之间,如H2S,B项正确,C项错误;稀有气体原子最外层均达到8电子(He为2电子)稳定结构,故稀有气体都是单原子分子,不存在共价键,D项错误。
2.下列化学用语中,正确的是( )
A.次溴酸的结构式:H—O—Br
B.氮气的电子式:∶N∶∶∶N∶
C.CO2分子的电子式:O===C===O
D.用电子式表示氯化氢分子的形成过程:
A
3.(2021·泉州现代中学高一期中)下列化合物全部以共用电子对成键的是( )
A.H2O B.MgCl2
C.NaOH D.NH4Cl
A
4.下列物质中只含有共价键的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
解析 NaCl属于盐类,NaOH是强碱,二者均含有离子键,A项错误;Na2S属于盐类,含有离子键,B项错误;HBr、CO2、H2O、CS2均是由非金属元素组成的化合物,都只含有共价键,C项正确;Na2O2是活泼金属与活泼非金属元素形成的过氧化物,含有离子键,D项错误。
C
5.现有下列物质:①Cl2;②Na2O2;③NaOH;④HCl;⑤H2O2;⑥MgF2;⑦NH4Cl。
(1)只由离子键构成的物质是________(填序号,下同)。
(2)只由极性键构成的物质是________。
(3)只由非极性键构成的物质是________。
(4)只由非金属元素组成的离子化合物是________。
(5)由极性键和非极性键构成的物质是________。
(6)由离子键和极性键构成的物质是________。
(7)由离子键和非极性键构成的物质是________。
(8)属于离子化合物的物质是________。
(9)属于共价化合物的物质是________。
答案 (1)⑥ (2)④ (3)① (4)⑦ (5)⑤ (6)③⑦ (7)② (8)②③⑥⑦ (9)④⑤
解析 对题给的七种物质的结构要清楚,同时要理解离子键与共价键、极性键与非极性键、共价化合物与离子化合物等概念之间的区别与联系。Cl2中只含非极性键;Na2O2中含离子键、非极性键;NaOH中含离子键、极性键;HCl中只含极性键:H2O2中含极性键、非极性键;MgF2中只含离子键;NH4Cl中含离子键、极性键。
1.下列说法中,错误的是( )
A.同种原子形成的分子,两个原子之间的化学键一定是共价键
B.两个非金属元素的原子之间形成的化学键一定是共价键
C.不论含氧酸还是无氧酸,分子内原子间的化学键都是共价键
D.凡是不含金属元素的化合物一定只含有共价键
D
解析 A.同种原子形成的分子,两个原子之间不存在电子的得失,形成的化学键一定是共价键,A正确;B.两个非金属元素的原子之间只能通过共用电子对形成化学键,因此一定是共价键,B正确;C.不论含氧酸还是无氧酸,均是共价化合物,因此分子内原子间的化学键都是共价键,C正确;D.凡是不含金属元素的化合物不一定只含有共价键,例如铵盐等含有离子键,D错误。
2.下列叙述正确的是( )
A.O2分子间存在着非极性共价键
B.SO2和H2O反应的产物是离子化合物
C.CO2分子内存在着极性共价键
D.盐酸中含有H+和Cl-,故HCl是离子化合物
解析 O2分子内存在着非极性共价键,分子间只有范德华力,A项不正确;SO2和H2O反应的产物亚硫酸是共价化合物,B项不正确;CO2分子内有碳氧双键,故其存在着极性共价键,C项正确;HCl分子中只存在共价键,故其为共价化合物,D项不正确。
C
3.下列关于电子式的书写或相关描述中,正确的是( )
A
4.化学键使得一百多种元素组成了世界的万物。关于化学键的下列叙述中,正确的是( )
A.离子化合物中一定含有共价键,共价化合物中不含离子键
B.共价化合物中可能含离子键,离子化合物中只含离子键
C.构成单质的分子中一定含有共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
解析 离子化合物中必含离子键,不一定含有共价键,共价化合物中必含共价键,一定不含离子键,A、B错误;稀有气体分子内不含共价键,C错误。
D
5.下列化合物中,只含共价键的是( )
A.CH4 B.KCl
C.CaF2 D.NaOH
解析 CH4中氢原子和碳原子之间只含共价键,选项A正确;氯化钾中只存在离子键,选项B错误;氟化钙中只存在离子键,选项C错误;氢氧化钠中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,选项D错误。
A
6.意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4气体分子。N4分子结构模型如图所示,下列说法正确的是( )
A.N4分子属于一种新型的化合物
B.N4分子中只含有非极性键
C.1 mol N4分子所含共价键数为4NA
D.N4沸点比P4(白磷)高
B
解析 N4是单质不是化合物,A项错误;由同种元素原子形成的共价键为非极性键,B项正确;由图可知,1 mol N4中含有6 mol N—N键,所以含有6NA个共价键,C项错误;相同条件下,气体的沸点比固体低,故沸点P4>N4,D项错误。
7.下列过程中,共价键被破坏的是( )
①甲烷燃烧 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤碘升华 ⑥NH4Cl受热分解 ⑦氢氧化钠熔化 ⑧Na2SO4溶于水
A.②④⑥ B.④⑤⑥
C.①④⑧ D.①④⑥
D
8.(2021·西南大学附中高一月考)下列有关表述正确的是( )
B
9.下列说法正确的是( )
①离子化合物中一定含离子键,也可能含共价键
②共价化合物中可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤构成单质分子的粒子不一定存在共价键
⑥多原子分子里的化学键一定是极性键
⑦有化学键断裂的变化属于化学变化
A.①③⑤ B.②④⑥ C.①③④ D.③⑤⑦
A
解析 离子化合物一定含离子键,也可能含极性键或非极性键,如NaOH中含离子键和O—H极性键,过氧化钠中含有离子键和O—O非极性键,①正确;共价化合物一定含共价键,一定不含离子键,含离子键的一定为离子化合物,②错误;含金属元素的化合物不一定是离子化合物,如氯化铝为共价化合物,③正确;由非金属元素组成的化合物不一定是共价化合物,如铵盐为离子化合物,④错误;由分子构成的单质中不一定存在共价键,如稀有气体中不含化学键,⑤正确;多原子分子里的化学键,同种元素之间形成的是非极性共价键,不同种元素之间形成的是极性共价键,⑥错误;有旧化学键断裂和新化学键生成的变化属于化学变化,有化学键断裂的变化不一定属于化学变化,如HCl溶于水,H—Cl键断裂,属于物理变化,⑦错误。
10.(2020·山东临沂高一期末)活泼金属氢化物是火箭燃料的重要供氢剂,如氢化钠、氢化钙等。其中氢化钙的供氢原理是CaH2+2H2O===Ca(OH)2+2H2↑,下列分析正确的是( )
A.氢化钙中含共价键,水中含非极性键
B.水分子和氢分子中都存在氢氢非极性共价键
C.氢氧化钙只存在离子键
D.该反应断裂离子键和共价键,生成离子键和共价键
D
解析 CaH2由Ca2+和H-构成,只含离子键;H2O分子中含有极性键,A项错误。水分子中只存在H—O极性键,B项错误。Ca(OH)2由Ca2+和OH-构成,存在离子键和极性键,C项错误。H2O和H2中含有共价键,CaH2和Ca(OH)2中含有离子键,故该反应中存在离子键和共价键的断裂及生成,D项正确。
11.A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)由A、E、F三种元素形成的化合物的化学式为________,含有的化学键有________(填写完整化学键类型),属于________化合物。
(2)B的最高价是________,由A、B组成的化合物中与D2相对分子质量相等的物质的化学式是B2A4,含有的化学键有________(填写完整化学键类型),有________对共用电子对。
答案 (1)NaOH 离子键和极性共价键 离子
(2)+4 极性共价键和非极性共价键 6
解析 A、F同主族,且A与其他非金属元素化合时易形成共价键,但F与其他非金属元素化合时易形成离子键,则为第ⅠA族元素,则A为氢元素。F+与E2-核外电子排布相同,则F为Na,E为O。由BE和D2具有相同电子数,且B、D、E原子序数递增知B为C,D为N,E、G同主族,且为短周期元素,则G为S。(1)NaOH中既有离子键又有极性共价键,属于离子化合物。(2)C的最高化合价为+4;C2H4中既有极性共价键(C—H)又有非极性共价键(C===C)。
12.A、B、X、Y、Z是原子序数依次增大的短周期主族元素,其中A与Y同主族,X与Z同主族,X、B与A均可形成10电子化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,所得溶液可使酚酞溶液变红。
请回答下列问题:
(1)元素Z的原子结构示意图为___________;化合物BA4的电子式为___________。
(2)化合物Y2X2中含有的化学键类型为________(填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
AC
(3)化合物A2X和A2Z中,沸点较高的是________(填化学式),其主要原因是___________________________________________________________。
(4)A与X、Z均能形成18电子化合物,则这两种化合物发生氧化还原反应的化学方程式为______________________________________________________。
H2O
H2O分子之间存在氢键
H2O2+H2S===2H2O+S↓
解析 由Y2X2与水反应生成X的单质,所得溶液可使酚酞溶液变红知,Y为Na,X为O;又X与Z同主族,则Z为S;B与Z的最外层电子数之比为2∶3,则B为C;由X、B与A均可形成10电子化合物,A与Y同主族知,A为H。(1)BA4为CH4。(2)Y2X2为Na2O2,既含有离子键又含有非极性键。(3)H2O和H2S相比,H2O分子间存在氢键,H2O的沸点较高。(4)H2O2与H2S反应生成H2O和S。
13.食盐(NaCl)是生活中常用的调味品,胃酸的主要成分是盐酸。下列关于两种物质的说法正确的是( )
A
14.小芳同学阅读课外资料时,看到有关乙醇的下列信息:
B
解析 乙醇只由非金属元素组成,为有机物,属于共价化合物,A项正确;分析可知墨迹覆盖的部分是一对电子,分子中的C—H键、C—O键和O—H键都是极性键(共7个),而C—C键(1个)是非极性键,故B项错误、C项正确;生成物中不含碳碳键和碳氢键,说明这些键完全断裂,故D正确。
15.(1)请用下列4种物质的序号填空:①O2、②NH4NO3、③K2O2、④NH3。其中既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若
XY2为常见元素形成的离子化合物,其电子式为_____________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是__________________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是
___________________________________________________________。
②
共价化合物
熔融状态下不导电
(4)现有a~g 7种短周期元素,它们在元素周期表中的位置如下,请据此回答下列问题:
①元素的原子间反应最容易形成离子键的是________。(填序号)
A.c和f B.b和g C.d和g D.b和e
②d与g元素形成的分子中所有原子都________(填“满足”或“不满足”)最外层为8电子结构。
B
满足
Thanks!
本讲内容结束
第二课时 共价键
第四章 物质结构 元素周期律
【课程标准要求】
1.认识构成物质的微粒之间存在的相互作用,结合典型实例认识共价键的形成,建立化学键概念。
2.知道分子存在一定的空间结构。认识化学键的断裂和形成是化学反应中物质变化的实质及能量变化的主要原因。
3.能判断简单离子化合物和共价化合物中化学键的类型。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、共价键与共价化合物
1.共价键
(1)形成过程(以Cl2形成为例)
用电子式表示:
(2)概念:原子间通过____________所形成的__________。
共用电子对
相互作用
(3)成键粒子:______。
(4)成键元素:同种或不同种________元素化合时能形成共价键。
(5)存在
①非金属元素的多原子单质,如__________________。
②共价化合物,如____________________________。
③某些离子化合物,如____________________________________。
原子
非金属
H2、O2、N2
CO2、HCl、H2SO4
NaOH、Na2CO3、NH4Cl
2.共价键的类型
(1)非极性共价键(非极性键):由同种原子形成的共价键。
(2)极性共价键(极性键):不同种元素的原子形成的共价键。
3.共价化合物
以____________形成分子的化合物。
共用电子对
【微自测】
1.下列描述中,正确的打“√”,错误的打“×”。
(1)离子化合物中一定不存在共价键( )
(2)含有共价键的化合物一定是共价化合物( )
(3)共价化合物中可能含有离子键( )
(4)构成单质分子的粒子一定含有共价键( )
(5)由非金属元素组成的化合物不一定是共价化合物( )
答案 (1)× (2)× (3)× (4)× (5)√
二、共价分子结构的表示方法
1.电子式
(1)非金属单质:Cl2: ______________ ,N2:______________。
(2)共价化合物:NH3: ______________ ,HF: ______________ 。
(3)共价化合物形成过程的电子式
HCl: ____________________________ ,
H2O: __________________________________ 。
∶N N∶
2.结构式
(1)含义
化学上,常用“—”表示1对____________,如氯分子可表示为“Cl—Cl”,这种图示叫做结构式。
共用电子对
(2)常见的以共价键形成的分子及其结构
分子 电子式 结构式 分子结构模型
H2
HCl
CO2 O===C===O
H2O
CH4
H∶H
H—H
H—Cl
【微自测】
2.下列说法或描述中,正确的打“√”,错误的打“×”。
答案 (1)× (2)× (3)√ (4)×
三、化学键 分子间作用力
1.化学键
(1)概念:相邻的原子之间强烈的相互作用叫化学键。
(2)类型
①原子间价电子的转移——________。
②原子间价电子的共用——________。
(3)化学反应的本质:
一个化学反应的发生,本质上就是旧化学键的______和新化学键______的过程。
离子键
共价键
断裂
形成
2.分子间作用力
(1)概念:分子之间存在一种把______聚集在一起的作用力,叫做分子间作用力,又叫范德华力。
(2)规律:分子间作用力比化学键____得多,对物质的熔点、沸点等有影响。一般来说,对于组成和结构相似的分子,相对分子质量越大,分子间作用力______,物质的熔点、沸点______。
分子
弱
越大
越高
3.氢键
(1)分子间形成的氢键也是一种分子间作用力,它比化学键____,但比范德华力____。
(2)若分子间形成氢键,会使物质的熔点和沸点升高。水结成冰时体积膨胀、DNA的结构等都与氢键有关。
弱
强
【微自测】
3.下列描述中,正确的打“√”,错误的打“×”。
(1)物质中一定存在化学键( )
(2)化学键既可存在于分子内的原子间,又可存在于分子之间( )
(3)氢键是化学键的一种( )
(4)稀有气体不存在化学键( )
答案 (1)× (2)× (3)× (4)√
二、物质变化过程中化学键的变化
一、化学键和化合物类型的判断
一、化学键和化合物类型的判断
如图是氢原子与氯原子形成氯化氢分子的示意图
1.氢原子与氯原子之间通过哪种作用力结合到一起?用电子式表示氯化氢的形成过程。
2.共价化合物中一定存在共价键,是否存在离子键?离子化合物中一定存在离子键,是否存在共价键?
提示 共价化合物中一定存在共价键,一定不存在离子键。离子化合物中一定存在离子键,可能存在共价键。如NaOH中存在Na+与OH-之间的离子键,O、H之间的极性共价键。
3.所有物质中都存在化学键吗?化合物中是否存在非极性键?
提示 并非所有物质中都存在化学键,如稀有气体中不存在化学键;非极性键存在于共价单质(如H2、Cl2等)中,也可能存在于离子化合物(如Na2O2等)或共价化合物(如H2O2等)中。
1.从物质类别角度判断化学键类型
物质类别 所含化学键类型
非金属单质,如Cl2、N2、I2、P4、金刚石等 只有共价键
非金属元素构成的化合物,如H2SO4、CO2、NH3、HCl、CCl4、CS2等 活泼非金属元素与活泼金属元素形成的化合物,如NaCl、CaCl2、K2O等 只有离子键
含有原子团的离子化合物,如Na2SO4、Ba(OH)2、NH4Cl、Na2O2等 既有离子键
又有共价键
稀有气体,如Ne、Ar等 没有化学键
2.离子化合物和共价化合物的三种判断方法
(1)根据化学键的类型来判断:凡含有离子键的化合物一定是离子化合物;只含有共价键的化合物是共价化合物。
(2)根据化合物的类型来判断:大多数碱性氧化物、强碱和大多数盐都属于离子化合物(特例:AlCl3为共价化合物);非金属氢化物、非金属氧化物、含氧酸等都属于共价化合物。
(3)根据化合物的性质来判断:一般熔、沸点较低的化合物是共价化合物;熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导电的化合物是共价化合物,如AlCl3。
1.关于离子键、共价键的下列说法中正确的是( )
A.CaCl2中既有离子键又有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
解析 CaCl2中无共价键,A项错误;非极性键存在于单质分子和化合物中,如H2O2中氧原子间为非极性键,B、D项错误;若有离子键,则属于离子化合物,共价化合物中一定无离子键,C项正确。
C
2.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
解析 A项,MgCl2仅含离子键;C项,HCl含有共价键,是共价化合物;D项,NaOH含有离子键、共价键,是离子化合物。
B
选项 A B C D
物质 MgCl2 CO2 HCl NaOH
所含化学键类型 离子键、共价键 共价键 离子键 离子键、共价键
所属化合物类型 离子化合物 共价化合物 离子化合物 共价化合物
二、物质变化过程中化学键的变化
1.化学反应过程
化学反应过程中反应物一定有旧化学键被破坏和产物中新化学键的形成。如:H2+F2===2HF,H—H键,F—F键均被破坏,形成H—F键。
2.离子化合物的溶解或熔化过程
3.共价化合物的溶解或熔化过程
4.单质的溶解或熔化过程
单质特点 化学键变化 举例
由分子构成的固体单质 熔化时不破坏化学键 P4等
由原子构成的单质(稀有气体除外) 熔化时破坏共价键 金刚石等
能与水反应的某些活泼非金属单质 溶于水后,分子内的共价键被破坏 Cl2、F2等
3.下列变化中,不需要破坏化学键的是( )
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
解析 HCl溶于水时,电离出H+、Cl-,共价键被破坏,A项不符合题意;加热分解KClO3是化学变化,其过程中一定存在旧化学键的断裂和新化学键的形成,B项不符合题意;I2升华是物理变化,I2由固态变成气态,化学键未被破坏,C项符合题意;NaCl溶于水,电离出Na+、Cl-,离子键被破坏,D项不符合题意。
C
4.下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的是( )
C
解析 A项反应中没有离子键的形成,也没有非极性键的断裂和形成,A不符合题意;B项反应中没有离子键的断裂,也没有非极性键的断裂和形成,B不符合题意;C项反应中同时有离子键、极性键和非极性键的断裂和形成,C符合题意;D项反应中没有非极性键的形成,D不符合题意。
5.试分析下列各种情况下微粒间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):
(1)NaCl溶于水时破坏________。
(2)HCl溶于水时破坏________。
(3)SO2溶于水时破坏________。
(4)酒精溶于水时破坏______________。
(5)NaOH和HCl反应时形成________和________。
离子键
极性键
极性键
分子间作用力
离子键
极性键
解析 NaCl、HCl、SO2中分别含有离子键、极性键、极性键,溶于水时被破坏相应的化学键;酒精溶于水时破坏分子间作用力;(8)中Na2O是离子化合物,熔化时破坏离子键。
非极性键
极性键
离子键
离子键
离子键
微专题13 电子总数相同微粒的组成规律
1.等电子微粒
(1)寻找方法
①核外电子总数相等的微粒可以是分子、原子,也可以是离子;可以是单核微粒,也可以是多核微粒。
②以Ne、Ar为基准,联系同周期非金属元素的阴离子及其氢化物,下一周期金属元素的阳离子,并利用分子失去或得到H+后电子数不变,2个9电子基团可组合成1个18电子微粒等方法,可归纳出常见的10电子、18电子微粒。
(2)巧记10电子微粒和18电子微粒
①“10电子”微粒记忆方法
②“18电子”微粒记忆方法
2.“8电子稳定结构”的判断方法
(1)经验规律法
①分子中的氢原子不满足8电子结构;
②一般来说,在ABn型分子中,若某元素原子最外层电子数+|化合价|=8,则该元素原子的最外层满足8电子稳定结构。如CO2分子中,碳元素的化合价为+4,碳原子最外层电子数为4,二者之和为8,则碳原子满足最外层8电子稳定结构,同理知氧原子也满足最外层8电子稳定结构。
(2)成键数目法
若该原子达到所需成键数目,则为8电子结构,若未达到或超过所需成键数目则不为8电子结构,如PCl5中的P,BeCl2中的Be。
1.与OH-具有相同电子总数和质子总数的微粒是( )
A.K+ B.Na+
C.F- D.Ne
解析 OH-的质子数为9,电子数为10。K+的质子数为19,电子数为18,故A错误;Na+的质子数为11,电子数为10,故B错误;F-的质子数为9,电子数为10,故C正确;Ne的质子数为10,电子数为10,故D错误。
C
2.核外电子层结构相同的一组粒子是( )
A.Mg2+、Al3+、Cl-、Ar
B.Na+、F-、S2-、Ne
C.K+、Ca2+、S2-、Ar
D.Mg2+、Na+、Cl-、K+
C
3.下列各组微粒中,具有相同质子数和电子数的一组微粒是( )
A
4.下列分子中所有原子最外层都满足8电子结构的是________(填序号)。
①BeCl2 ②PCl5 ③SF6 ④CS2 ⑤CH4 ⑥SiO2 ⑦CF2Cl2
答案 ④⑥⑦
5.A+、B+、C-、D、E五种粒子(分子或离子)中,每个粒子均有10个电子。已知:
1.下列关于共价键的说法正确的是( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同种元素原子之间形成
D.稀有气体分子中存在共价键
B
解析 金属原子与非金属原子之间可能形成共价键,如AlCl3分子中只有共价键,A项错误;非金属元素原子间一般以共价键结合形成分子,可以是同种元素原子之间,如O2,也可以是不同种元素原子之间,如H2S,B项正确,C项错误;稀有气体原子最外层均达到8电子(He为2电子)稳定结构,故稀有气体都是单原子分子,不存在共价键,D项错误。
2.下列化学用语中,正确的是( )
A.次溴酸的结构式:H—O—Br
B.氮气的电子式:∶N∶∶∶N∶
C.CO2分子的电子式:O===C===O
D.用电子式表示氯化氢分子的形成过程:
A
3.(2021·泉州现代中学高一期中)下列化合物全部以共用电子对成键的是( )
A.H2O B.MgCl2
C.NaOH D.NH4Cl
A
4.下列物质中只含有共价键的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
解析 NaCl属于盐类,NaOH是强碱,二者均含有离子键,A项错误;Na2S属于盐类,含有离子键,B项错误;HBr、CO2、H2O、CS2均是由非金属元素组成的化合物,都只含有共价键,C项正确;Na2O2是活泼金属与活泼非金属元素形成的过氧化物,含有离子键,D项错误。
C
5.现有下列物质:①Cl2;②Na2O2;③NaOH;④HCl;⑤H2O2;⑥MgF2;⑦NH4Cl。
(1)只由离子键构成的物质是________(填序号,下同)。
(2)只由极性键构成的物质是________。
(3)只由非极性键构成的物质是________。
(4)只由非金属元素组成的离子化合物是________。
(5)由极性键和非极性键构成的物质是________。
(6)由离子键和极性键构成的物质是________。
(7)由离子键和非极性键构成的物质是________。
(8)属于离子化合物的物质是________。
(9)属于共价化合物的物质是________。
答案 (1)⑥ (2)④ (3)① (4)⑦ (5)⑤ (6)③⑦ (7)② (8)②③⑥⑦ (9)④⑤
解析 对题给的七种物质的结构要清楚,同时要理解离子键与共价键、极性键与非极性键、共价化合物与离子化合物等概念之间的区别与联系。Cl2中只含非极性键;Na2O2中含离子键、非极性键;NaOH中含离子键、极性键;HCl中只含极性键:H2O2中含极性键、非极性键;MgF2中只含离子键;NH4Cl中含离子键、极性键。
1.下列说法中,错误的是( )
A.同种原子形成的分子,两个原子之间的化学键一定是共价键
B.两个非金属元素的原子之间形成的化学键一定是共价键
C.不论含氧酸还是无氧酸,分子内原子间的化学键都是共价键
D.凡是不含金属元素的化合物一定只含有共价键
D
解析 A.同种原子形成的分子,两个原子之间不存在电子的得失,形成的化学键一定是共价键,A正确;B.两个非金属元素的原子之间只能通过共用电子对形成化学键,因此一定是共价键,B正确;C.不论含氧酸还是无氧酸,均是共价化合物,因此分子内原子间的化学键都是共价键,C正确;D.凡是不含金属元素的化合物不一定只含有共价键,例如铵盐等含有离子键,D错误。
2.下列叙述正确的是( )
A.O2分子间存在着非极性共价键
B.SO2和H2O反应的产物是离子化合物
C.CO2分子内存在着极性共价键
D.盐酸中含有H+和Cl-,故HCl是离子化合物
解析 O2分子内存在着非极性共价键,分子间只有范德华力,A项不正确;SO2和H2O反应的产物亚硫酸是共价化合物,B项不正确;CO2分子内有碳氧双键,故其存在着极性共价键,C项正确;HCl分子中只存在共价键,故其为共价化合物,D项不正确。
C
3.下列关于电子式的书写或相关描述中,正确的是( )
A
4.化学键使得一百多种元素组成了世界的万物。关于化学键的下列叙述中,正确的是( )
A.离子化合物中一定含有共价键,共价化合物中不含离子键
B.共价化合物中可能含离子键,离子化合物中只含离子键
C.构成单质的分子中一定含有共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
解析 离子化合物中必含离子键,不一定含有共价键,共价化合物中必含共价键,一定不含离子键,A、B错误;稀有气体分子内不含共价键,C错误。
D
5.下列化合物中,只含共价键的是( )
A.CH4 B.KCl
C.CaF2 D.NaOH
解析 CH4中氢原子和碳原子之间只含共价键,选项A正确;氯化钾中只存在离子键,选项B错误;氟化钙中只存在离子键,选项C错误;氢氧化钠中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,选项D错误。
A
6.意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4气体分子。N4分子结构模型如图所示,下列说法正确的是( )
A.N4分子属于一种新型的化合物
B.N4分子中只含有非极性键
C.1 mol N4分子所含共价键数为4NA
D.N4沸点比P4(白磷)高
B
解析 N4是单质不是化合物,A项错误;由同种元素原子形成的共价键为非极性键,B项正确;由图可知,1 mol N4中含有6 mol N—N键,所以含有6NA个共价键,C项错误;相同条件下,气体的沸点比固体低,故沸点P4>N4,D项错误。
7.下列过程中,共价键被破坏的是( )
①甲烷燃烧 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤碘升华 ⑥NH4Cl受热分解 ⑦氢氧化钠熔化 ⑧Na2SO4溶于水
A.②④⑥ B.④⑤⑥
C.①④⑧ D.①④⑥
D
8.(2021·西南大学附中高一月考)下列有关表述正确的是( )
B
9.下列说法正确的是( )
①离子化合物中一定含离子键,也可能含共价键
②共价化合物中可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤构成单质分子的粒子不一定存在共价键
⑥多原子分子里的化学键一定是极性键
⑦有化学键断裂的变化属于化学变化
A.①③⑤ B.②④⑥ C.①③④ D.③⑤⑦
A
解析 离子化合物一定含离子键,也可能含极性键或非极性键,如NaOH中含离子键和O—H极性键,过氧化钠中含有离子键和O—O非极性键,①正确;共价化合物一定含共价键,一定不含离子键,含离子键的一定为离子化合物,②错误;含金属元素的化合物不一定是离子化合物,如氯化铝为共价化合物,③正确;由非金属元素组成的化合物不一定是共价化合物,如铵盐为离子化合物,④错误;由分子构成的单质中不一定存在共价键,如稀有气体中不含化学键,⑤正确;多原子分子里的化学键,同种元素之间形成的是非极性共价键,不同种元素之间形成的是极性共价键,⑥错误;有旧化学键断裂和新化学键生成的变化属于化学变化,有化学键断裂的变化不一定属于化学变化,如HCl溶于水,H—Cl键断裂,属于物理变化,⑦错误。
10.(2020·山东临沂高一期末)活泼金属氢化物是火箭燃料的重要供氢剂,如氢化钠、氢化钙等。其中氢化钙的供氢原理是CaH2+2H2O===Ca(OH)2+2H2↑,下列分析正确的是( )
A.氢化钙中含共价键,水中含非极性键
B.水分子和氢分子中都存在氢氢非极性共价键
C.氢氧化钙只存在离子键
D.该反应断裂离子键和共价键,生成离子键和共价键
D
解析 CaH2由Ca2+和H-构成,只含离子键;H2O分子中含有极性键,A项错误。水分子中只存在H—O极性键,B项错误。Ca(OH)2由Ca2+和OH-构成,存在离子键和极性键,C项错误。H2O和H2中含有共价键,CaH2和Ca(OH)2中含有离子键,故该反应中存在离子键和共价键的断裂及生成,D项正确。
11.A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)由A、E、F三种元素形成的化合物的化学式为________,含有的化学键有________(填写完整化学键类型),属于________化合物。
(2)B的最高价是________,由A、B组成的化合物中与D2相对分子质量相等的物质的化学式是B2A4,含有的化学键有________(填写完整化学键类型),有________对共用电子对。
答案 (1)NaOH 离子键和极性共价键 离子
(2)+4 极性共价键和非极性共价键 6
解析 A、F同主族,且A与其他非金属元素化合时易形成共价键,但F与其他非金属元素化合时易形成离子键,则为第ⅠA族元素,则A为氢元素。F+与E2-核外电子排布相同,则F为Na,E为O。由BE和D2具有相同电子数,且B、D、E原子序数递增知B为C,D为N,E、G同主族,且为短周期元素,则G为S。(1)NaOH中既有离子键又有极性共价键,属于离子化合物。(2)C的最高化合价为+4;C2H4中既有极性共价键(C—H)又有非极性共价键(C===C)。
12.A、B、X、Y、Z是原子序数依次增大的短周期主族元素,其中A与Y同主族,X与Z同主族,X、B与A均可形成10电子化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,所得溶液可使酚酞溶液变红。
请回答下列问题:
(1)元素Z的原子结构示意图为___________;化合物BA4的电子式为___________。
(2)化合物Y2X2中含有的化学键类型为________(填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
AC
(3)化合物A2X和A2Z中,沸点较高的是________(填化学式),其主要原因是___________________________________________________________。
(4)A与X、Z均能形成18电子化合物,则这两种化合物发生氧化还原反应的化学方程式为______________________________________________________。
H2O
H2O分子之间存在氢键
H2O2+H2S===2H2O+S↓
解析 由Y2X2与水反应生成X的单质,所得溶液可使酚酞溶液变红知,Y为Na,X为O;又X与Z同主族,则Z为S;B与Z的最外层电子数之比为2∶3,则B为C;由X、B与A均可形成10电子化合物,A与Y同主族知,A为H。(1)BA4为CH4。(2)Y2X2为Na2O2,既含有离子键又含有非极性键。(3)H2O和H2S相比,H2O分子间存在氢键,H2O的沸点较高。(4)H2O2与H2S反应生成H2O和S。
13.食盐(NaCl)是生活中常用的调味品,胃酸的主要成分是盐酸。下列关于两种物质的说法正确的是( )
A
14.小芳同学阅读课外资料时,看到有关乙醇的下列信息:
B
解析 乙醇只由非金属元素组成,为有机物,属于共价化合物,A项正确;分析可知墨迹覆盖的部分是一对电子,分子中的C—H键、C—O键和O—H键都是极性键(共7个),而C—C键(1个)是非极性键,故B项错误、C项正确;生成物中不含碳碳键和碳氢键,说明这些键完全断裂,故D正确。
15.(1)请用下列4种物质的序号填空:①O2、②NH4NO3、③K2O2、④NH3。其中既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若
XY2为常见元素形成的离子化合物,其电子式为_____________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是__________________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是
___________________________________________________________。
②
共价化合物
熔融状态下不导电
(4)现有a~g 7种短周期元素,它们在元素周期表中的位置如下,请据此回答下列问题:
①元素的原子间反应最容易形成离子键的是________。(填序号)
A.c和f B.b和g C.d和g D.b和e
②d与g元素形成的分子中所有原子都________(填“满足”或“不满足”)最外层为8电子结构。
B
满足
Thanks!
本讲内容结束
