化学人教版(2019)必修第一册2.1.3 海水中的重要元素 --碳酸钠与碳酸氢钠(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.3 海水中的重要元素 --碳酸钠与碳酸氢钠(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 16.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 21:33:37 | ||
图片预览







文档简介
(共24张PPT)
第二章 第一节
钠及其化合物
第三课时 碳酸钠与碳酸氢钠
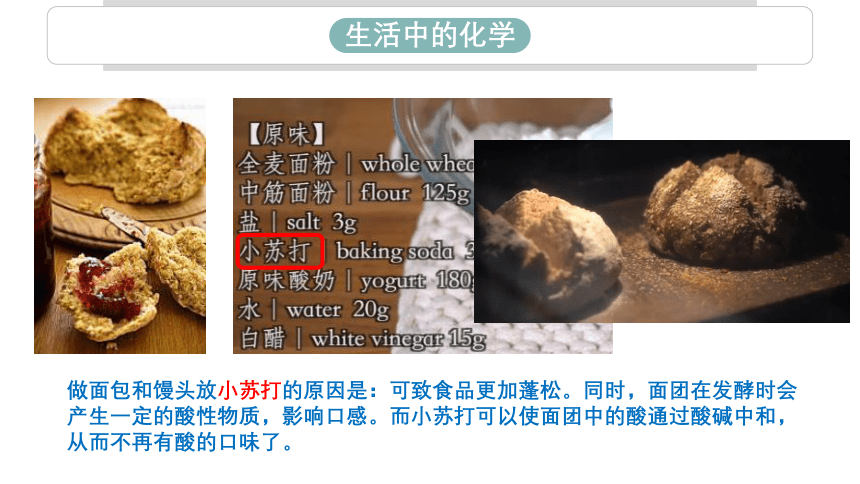
生活中的化学
做面包和馒头放小苏打的原因是:可致食品更加蓬松。同时,面团在发酵时会产生一定的酸性物质,影响口感。而小苏打可以使面团中的酸通过酸碱中和,从而不再有酸的口味了。
生活中的化学
碳酸钠
(苏打)
碳酸氢钠
(小苏打)
硫代硫酸钠(大苏打)
碳酸钠与碳酸氢钠
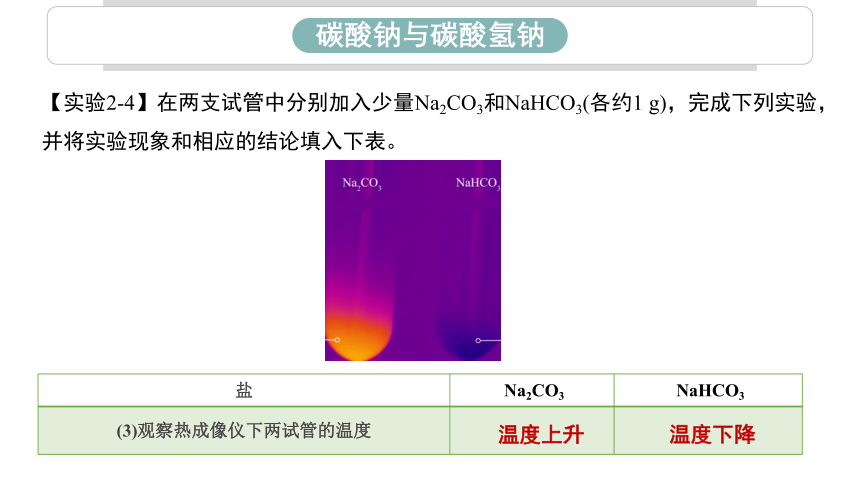
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
白色粉末
白色细小晶体
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象
结块变成晶体
部分溶解
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(3)观察热成像仪下两试管的温度
温度上升
温度下降
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(4)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
振荡后全部溶解
仍有部分未溶解
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(5)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
溶液变红(较深)
溶液微红
热稳定性
【思考与讨论1】
(1)碳酸钠与碳酸氢钠的热稳定性如何呢?请设计实验验证
【实验2-5】如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
【现象】加热碳酸钠,澄清石灰水不变浑浊;加热碳酸氢钠,试管口有小液滴出现,澄清石灰水变浑浊。
2NaHCO3 = Na2CO3+H2O+CO2
△
【思考与讨论1】
(2)上述实验是否严谨?如何进行改进?
下图装置为本实验的改进装置“套管实验”
(3)碳酸钠和碳酸氢钠的位置可以对调吗?
热稳定性
1.碳酸氢钠干粉灭火剂不能用来灭钠起火。为什么?
热稳定性的应用
碳酸氢钠干粉灭火剂是利用受热分解得到的二氧化碳灭火,而钠或钠的燃烧产物过氧化钠都可以和二氧化碳反应。所以碳酸氢钠干粉灭火剂不能用来灭钠起火。
2.碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,我们发现,加入发酵粉的面团加热焙烤后体积比原来大了好多。你知道原因是什么吗?请用化学方程式解析。
2NaHCO3 = Na2CO3+H2O+CO2
△
热稳定性
通入CO2
【思考与讨论2】如果反过来向碳酸钠溶液中通入CO2能否又得到碳酸氢钠?实验现象如何?并给出解释。
【现象】溶液变浑浊或有晶体析出
【解析】生成的碳酸氢钠溶解度比碳酸钠小,所以会析出碳酸氢钠晶体
【结论】Na2CO3 + CO2 + H2O = 2NaHCO3
【实验2-5】在两支试管中分别加入相同质量的Na2CO3和NaHCO3,再向试管中同时加入等量的盐酸,试管上套入气球,完成下列实验,观察实验现象并得出相应的结论。
通过该实验,我们还发现碳酸氢钠与盐酸反应更快,用它做胃药,见效也更快。
盐 Na2CO3 NaHCO3
现象
微观解析(离子反应)
反应较剧烈,有气泡产生
反应很剧烈,迅速有气泡产生
CO32-+H+=HCO3-
HCO3-+ H+=H2O+CO2
HCO3-+ H+=H2O+CO2
与酸反应
Na2CO3
NaHCO3
与碱反应
【思考与讨论4】
(1)碳酸钠、碳酸氢钠能与氢氧化钠溶液反应吗?请写出化学方程式和离子方程式
HCO3-+ OH-=H2O+ CO32-
NaHCO3+ NaOH=H2O+Na2 CO3
Na2 CO3不与NaOH反应
(2)初中的时候,我们已经知道碳酸钠可以和澄清石灰水反应,写出该反应方程式。
(3)类比碳酸钠,你认为碳酸氢钠能与澄清石灰水反应吗?该如何验证?
与碱反应
【实验2-6】
(1)向盛有少量碳酸氢钠溶液的试管里滴入澄清石灰水,观察现象,并用方程式进行解析。
【现象】有白色沉淀生成。
NaHCO3+Ca(OH)2=NaOH+CaCO3↓+H2O
(2)若向过量碳酸氢钠溶液里滴入澄清石灰水,现象又如何,请用方程式进行解析。
【现象】有白色沉淀生成。
2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+2H2O
与碱反应
(3)上述反应能不能用于鉴别碳酸钠和碳酸氢钠?是否有其他试剂可以用于鉴别碳酸钠和碳酸氢钠?
不能。可以用氯化钙或氯化钡代替氢氧化钙来鉴别。
碳酸氢钠与氯化钡不反应。
碳酸钠与氯化钡反应,有白色沉淀生成。
化学观念建构
通过钠的学习,我们发现条件不同,产物就会不同,如钠和氧气反应;通过碳酸钠和碳酸氢钠的对比学习,我们发现反应物用量配比不同,产物也会不同,如碳酸钠与盐酸的反应、碳酸氢钠和澄清石灰水的反应。由此可见,我们可根据生产生活的需要,对反应条件进行控制。
拓展与应用
加热
加适量的NaOH
通入足量CO2
如何除去以下情境中的杂质?
将混合气通过饱和NaHCO3溶液洗气
小结
根据上题,请设计实验区分碳酸钠与碳酸氢钠。
焰色试验
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
焰色试验
焰色试验
【颜色试验的操作步骤】
因为金属氧化物与盐酸反应生成的氯化物在灼烧时易气化而挥发;若用硫酸,由于生成的硫酸盐的沸点很高,少量杂质不易被除去而干扰火焰的颜色。
做焰色反应严格来说只能用铂丝,因为铂是惰性金属,不容易和其他物质发生反应,且熔点高,其焰色为无色。但有时也可用纯净的铁丝或钨丝作临时替代品。
焰色试验
(1)因酒精灯火焰略带黄色(因为玻璃中含钠元素),因此本实验中火源最好用酒精喷灯或煤气灯,它们的火焰无色(不是所有的金属都能发生焰色反应如Fe、Pt,所以本实验采用铂丝,也可采用铁丝,用酒精喷灯理由也是如此)。
(2)做钾元素的焰色试验时,要透过蓝色钴玻璃片进行观察。因为蓝色钴玻璃能吸收黄光,排除钠及其化合物的焰色干扰。
(3)焰色试验属于物理变化。
知识拓展
焰色试验
(1) 焰火(烟花)
节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。
(2) 检验金属元素
由于钠盐、钾盐易溶于水,在溶液中又无色,无法通过其他反应进行检验Na+和K+ ,所以常常利用焰色试验来检验。
焰色试验的应用
研究与实践
【研究目的】
【研究任务】
【结果与讨论】
纯碱是一种重要的化工原料,具有广泛的用途。通过查阅资料,了解纯碱的生产历史,感受化学工业发展过程中技术进步的重要性,以及建设生态文明的意义。
(1)从科学家对纯碱生产的研究中,你得到什么启示
(2)以纯碱的生产为线索,完成研究报告,并与同学讨论。
(1)查阅资料,了解路布兰制碱法、索尔维制碱法、侯氏制碱法的原理。
(2)根据所查阅的资料,分析后一种制碱法与前一种制碱法相比所具有的优势。
(3)从生态文明建设的角度,思考侯氏制碱法的意义。
第二章 第一节
钠及其化合物
第三课时 碳酸钠与碳酸氢钠
生活中的化学
做面包和馒头放小苏打的原因是:可致食品更加蓬松。同时,面团在发酵时会产生一定的酸性物质,影响口感。而小苏打可以使面团中的酸通过酸碱中和,从而不再有酸的口味了。
生活中的化学
碳酸钠
(苏打)
碳酸氢钠
(小苏打)
硫代硫酸钠(大苏打)
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述
白色粉末
白色细小晶体
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象
结块变成晶体
部分溶解
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(3)观察热成像仪下两试管的温度
温度上升
温度下降
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(4)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
振荡后全部溶解
仍有部分未溶解
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(5)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
溶液变红(较深)
溶液微红
热稳定性
【思考与讨论1】
(1)碳酸钠与碳酸氢钠的热稳定性如何呢?请设计实验验证
【实验2-5】如图2-7所示,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
【现象】加热碳酸钠,澄清石灰水不变浑浊;加热碳酸氢钠,试管口有小液滴出现,澄清石灰水变浑浊。
2NaHCO3 = Na2CO3+H2O+CO2
△
【思考与讨论1】
(2)上述实验是否严谨?如何进行改进?
下图装置为本实验的改进装置“套管实验”
(3)碳酸钠和碳酸氢钠的位置可以对调吗?
热稳定性
1.碳酸氢钠干粉灭火剂不能用来灭钠起火。为什么?
热稳定性的应用
碳酸氢钠干粉灭火剂是利用受热分解得到的二氧化碳灭火,而钠或钠的燃烧产物过氧化钠都可以和二氧化碳反应。所以碳酸氢钠干粉灭火剂不能用来灭钠起火。
2.碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,我们发现,加入发酵粉的面团加热焙烤后体积比原来大了好多。你知道原因是什么吗?请用化学方程式解析。
2NaHCO3 = Na2CO3+H2O+CO2
△
热稳定性
通入CO2
【思考与讨论2】如果反过来向碳酸钠溶液中通入CO2能否又得到碳酸氢钠?实验现象如何?并给出解释。
【现象】溶液变浑浊或有晶体析出
【解析】生成的碳酸氢钠溶解度比碳酸钠小,所以会析出碳酸氢钠晶体
【结论】Na2CO3 + CO2 + H2O = 2NaHCO3
【实验2-5】在两支试管中分别加入相同质量的Na2CO3和NaHCO3,再向试管中同时加入等量的盐酸,试管上套入气球,完成下列实验,观察实验现象并得出相应的结论。
通过该实验,我们还发现碳酸氢钠与盐酸反应更快,用它做胃药,见效也更快。
盐 Na2CO3 NaHCO3
现象
微观解析(离子反应)
反应较剧烈,有气泡产生
反应很剧烈,迅速有气泡产生
CO32-+H+=HCO3-
HCO3-+ H+=H2O+CO2
HCO3-+ H+=H2O+CO2
与酸反应
Na2CO3
NaHCO3
与碱反应
【思考与讨论4】
(1)碳酸钠、碳酸氢钠能与氢氧化钠溶液反应吗?请写出化学方程式和离子方程式
HCO3-+ OH-=H2O+ CO32-
NaHCO3+ NaOH=H2O+Na2 CO3
Na2 CO3不与NaOH反应
(2)初中的时候,我们已经知道碳酸钠可以和澄清石灰水反应,写出该反应方程式。
(3)类比碳酸钠,你认为碳酸氢钠能与澄清石灰水反应吗?该如何验证?
与碱反应
【实验2-6】
(1)向盛有少量碳酸氢钠溶液的试管里滴入澄清石灰水,观察现象,并用方程式进行解析。
【现象】有白色沉淀生成。
NaHCO3+Ca(OH)2=NaOH+CaCO3↓+H2O
(2)若向过量碳酸氢钠溶液里滴入澄清石灰水,现象又如何,请用方程式进行解析。
【现象】有白色沉淀生成。
2NaHCO3+Ca(OH)2=Na2CO3+CaCO3↓+2H2O
与碱反应
(3)上述反应能不能用于鉴别碳酸钠和碳酸氢钠?是否有其他试剂可以用于鉴别碳酸钠和碳酸氢钠?
不能。可以用氯化钙或氯化钡代替氢氧化钙来鉴别。
碳酸氢钠与氯化钡不反应。
碳酸钠与氯化钡反应,有白色沉淀生成。
化学观念建构
通过钠的学习,我们发现条件不同,产物就会不同,如钠和氧气反应;通过碳酸钠和碳酸氢钠的对比学习,我们发现反应物用量配比不同,产物也会不同,如碳酸钠与盐酸的反应、碳酸氢钠和澄清石灰水的反应。由此可见,我们可根据生产生活的需要,对反应条件进行控制。
拓展与应用
加热
加适量的NaOH
通入足量CO2
如何除去以下情境中的杂质?
将混合气通过饱和NaHCO3溶液洗气
小结
根据上题,请设计实验区分碳酸钠与碳酸氢钠。
焰色试验
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
焰色试验
焰色试验
【颜色试验的操作步骤】
因为金属氧化物与盐酸反应生成的氯化物在灼烧时易气化而挥发;若用硫酸,由于生成的硫酸盐的沸点很高,少量杂质不易被除去而干扰火焰的颜色。
做焰色反应严格来说只能用铂丝,因为铂是惰性金属,不容易和其他物质发生反应,且熔点高,其焰色为无色。但有时也可用纯净的铁丝或钨丝作临时替代品。
焰色试验
(1)因酒精灯火焰略带黄色(因为玻璃中含钠元素),因此本实验中火源最好用酒精喷灯或煤气灯,它们的火焰无色(不是所有的金属都能发生焰色反应如Fe、Pt,所以本实验采用铂丝,也可采用铁丝,用酒精喷灯理由也是如此)。
(2)做钾元素的焰色试验时,要透过蓝色钴玻璃片进行观察。因为蓝色钴玻璃能吸收黄光,排除钠及其化合物的焰色干扰。
(3)焰色试验属于物理变化。
知识拓展
焰色试验
(1) 焰火(烟花)
节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。
(2) 检验金属元素
由于钠盐、钾盐易溶于水,在溶液中又无色,无法通过其他反应进行检验Na+和K+ ,所以常常利用焰色试验来检验。
焰色试验的应用
研究与实践
【研究目的】
【研究任务】
【结果与讨论】
纯碱是一种重要的化工原料,具有广泛的用途。通过查阅资料,了解纯碱的生产历史,感受化学工业发展过程中技术进步的重要性,以及建设生态文明的意义。
(1)从科学家对纯碱生产的研究中,你得到什么启示
(2)以纯碱的生产为线索,完成研究报告,并与同学讨论。
(1)查阅资料,了解路布兰制碱法、索尔维制碱法、侯氏制碱法的原理。
(2)根据所查阅的资料,分析后一种制碱法与前一种制碱法相比所具有的优势。
(3)从生态文明建设的角度,思考侯氏制碱法的意义。
