化学人教版(2019)必修第一册1.3.1氧化还原反应(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.1氧化还原反应(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-01 21:36:37 | ||
图片预览



文档简介
(共17张PPT)
1.3.1 氧化还原反应
(氧化还原反应 第1课时)
第二节
第一章 物质及其变化
必修 1
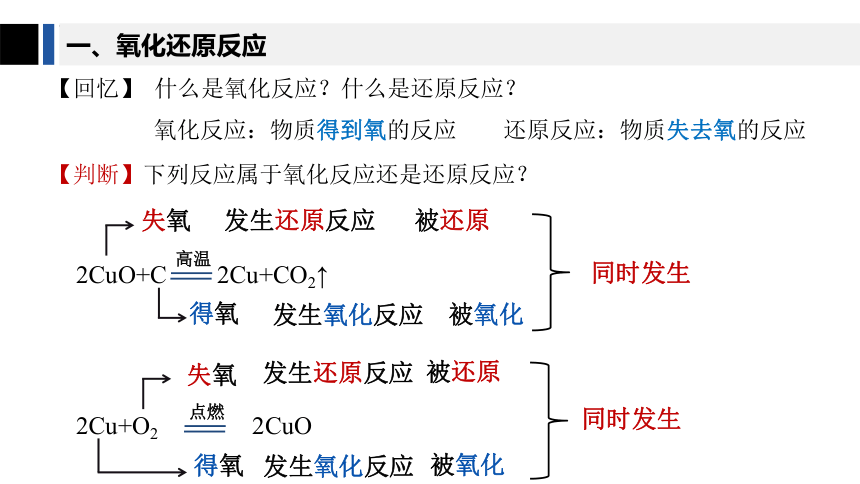
一、氧化还原反应
氧化反应:物质得到氧的反应 还原反应:物质失去氧的反应
【回忆】 什么是氧化反应?什么是还原反应?
【判断】下列反应属于氧化反应还是还原反应?
2CuO+C 2Cu+CO2↑
高温
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
2Cu+O2 2CuO
点燃
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
同时发生
同时发生
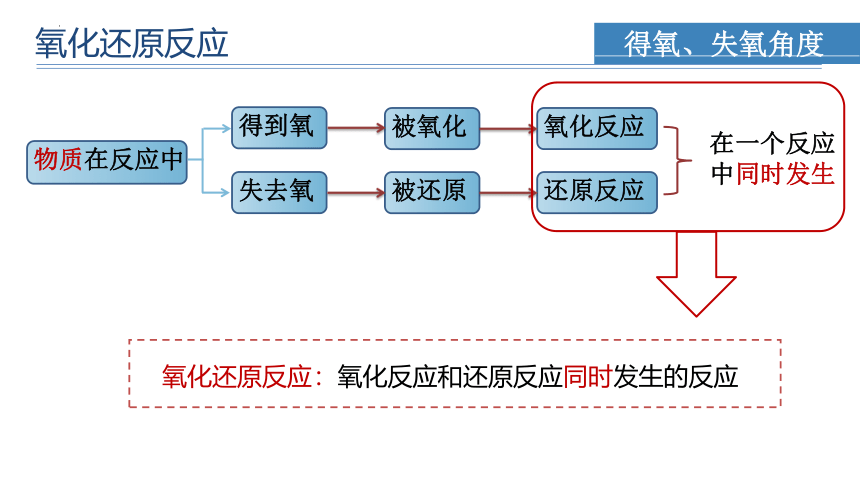
氧化还原反应:氧化反应和还原反应同时发生的反应
得氧、失氧角度
物质在反应中
得到氧
失去氧
被氧化
被还原
氧化反应
还原反应
在一个反应
中同时发生
判断:下列反应哪些属于氧化还原反应?
Cu+O2 === 2 CuO
C + 2 CuO === 2Cu + CO2 ↑
Fe + CuSO4 === FeSO4 + Cu
2NaOH + CuSO4 === Cu(OH)2 ↓ + Na2SO4
H2+CuO Cu + H2O
请认真观察铜元素反应前后的变化,找出其中的规律。
得氧、失氧角度
高温
点燃
①②③⑤
你找出了哪些规律?
Cu+O2 === 2 CuO
C + 2 CuO === CO2 + 2 Cu
Fe + CuSO4 === FeSO4 + Cu
2NaOH + CuSO4 === Cu(OH)2 ↓ + Na2SO4
H2+CuO Cu + H2O
化合价变化角度
高温
点燃
0
+2
0
+2
+2
+2
+2
0
0
+2
1.氧化还原反应前后,有的元素化合价升高
2.氧化还原反应前后,有的元素化合价降低
3.氧化还原反应前后,有的元素化合价不变
氧化还原反应的重要特征:反应前后,有元素化合价变化
化合价升高总数=化合价降低总数
4.反应前后,所有元素化合价都没有变化的反应不是氧化还原反应
化合价变化角度
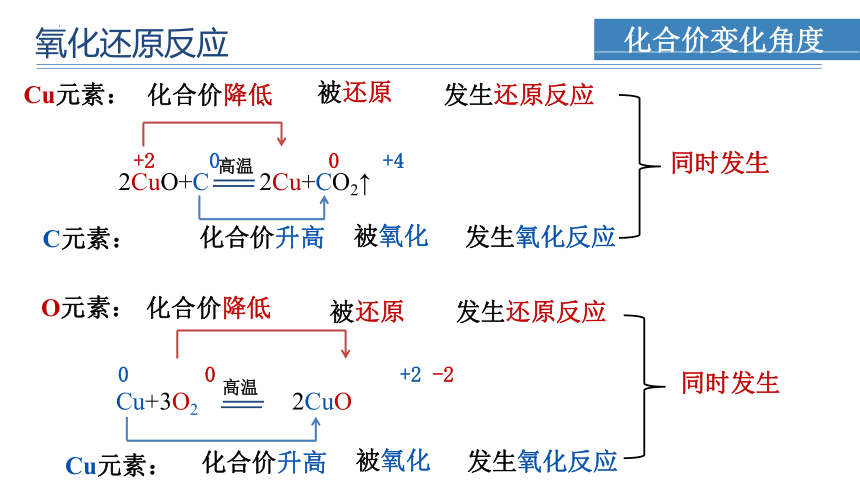
2CuO+C 2Cu+CO2↑
高温
+2 0 0 +4
化合价降低
化合价升高
Cu元素:
被还原
发生还原反应
C元素:
被氧化
发生氧化反应
同时发生
Cu+3O2 2CuO
高温
0 0 +2 -2
化合价降低
O元素:
被还原
发生还原反应
化合价升高
Cu元素:
被氧化
发生氧化反应
同时发生
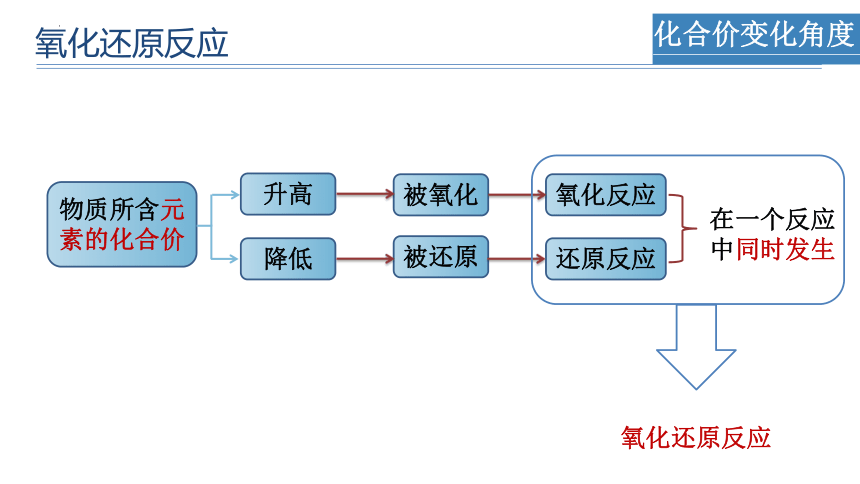
化合价变化角度
物质所含元素的化合价
升高
降低
被氧化
被还原
氧化反应
还原反应
在一个反应
中同时发生
氧化还原反应
常见元素化合价
一价钾钠氢氯银,二价氧钙钡镁锌,
三铝四硅五价磷,可变价态也不难,
二三铁,二四碳,二四六硫都齐全,
铜汞二价最常见,莫忘单质价为零。
(1)CuO Cu2O Fe2O3 Na2O CaCO3 CO FeO
(2)KMnO4 K2MnO4 MnO2 MnCl2
(3)Cl2 HCl KCl KClO3 NaClO
(4)H2S SO2 H2SO3 H2SO4 H2O2 H2O
(5)NH3 N2O NO NO2 NH4NO3
+2
+1
+3
+1
+2
+7
+6
+4
+2
0
-1
+1
+5
+1
-2
+4
+4
+6
-1
-3
+1
+2
+4
-3
+5
-2
+4
+2
+2
微观角度
以Na与Cl2反应为例
2 Na+ Cl2 === 2 NaCl
点燃
+11
8
2
Na+
失1个电子
+17
8
2
7
Cl
化合价升高,被氧化 氧化反应
0 0 +1 -1
化合价降低,被还原 还原反应
e-
+11
8
2
1
Na
得电子
失电子
Cl
-
得1个电子
+17
8
2
8
微观角度
以H2与Cl2反应为例
H2+Cl2 2HCl
点燃
0 0 +1 -1
化合价升高
电子对偏离
被氧化,发生氧化反应
化合价降低
被还原,发生还原反应
电子对偏向
+17
Cl
+1
H
1
2
8
7
H和Cl都不易失去电子,都可获得1个电子形成稳定的结构,
二者只能形成共用电子对,使双方最外层都达到稳定结构。
+17
+1
HCl
共用电子
失去电子或
电子对偏离
得到电子或
电子对偏向
氧化反应
还原反应
氧化还原反应的本质:氧化还原反应中一定有电子的转移(得失或偏移)
化合价升高
化合价降低
升 失 氧
降 得 还
电子的转移
(电子得失或偏移)
化合价的升降
本质
特征
氧化还原反应的判断方法
微观角度
氧化还原反应
同时发生
年代 化学重大突破
18世纪末
19世纪中
19世纪末
氧化还原反应的认识发展
发现氧气
定义了
化合价
发现电子
对氧化还原反应的认识角度
①得失氧
②化合价升降
③电子转移
得氧
失氧
初步认识
氧化反应
还原反应
地位
化合价升高
化合价降低
特征
失去电子或电子对偏离
得到电子或电子对偏向
本质
科学史话
对化学反应进行分类
化学反应
根据反应物和生成物的类别以及反应前后物质的种类的多少
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
根据化合价升降
非氧化还原反应
反应类型的关系
反应类型的关系
反应类型 表达式 举例
化合反应
分解反应
置换反应
复分解反应
AB=A+B
A+BC=B+AC
AB+CD=AD+CB
A+B=AB
CaO+H2O=Ca(OH)2
2KClO3 2KCl+3O2↑
△
MnO2
Fe+CuSO4= FeSO4+ Cu
NaOH+HCl=NaCl+H2O
氧化还原反应与四种基本反应类型有什么关联?
化合反应
分解反应
反应类型的关系
氧化还原反应
置换反应
复分解反应
有单质生成的分解反应
有单质参加的化合反应
分解
化合
氧化还原反应
置换
复分解反应
小结
总结
电子的转移
氧化还原反应
概念
特征
(判断依据)
本质
与四种基本反应类型的关系
一定是非氧化还原反应
化合反应、分解反应
复分解反应
反应前后,有元素化合价的变化
置换反应
氧化反应和还原反应同时发生的反应
一定是氧化还原反应
有单质参与的属于氧化还原反应
1.3.1 氧化还原反应
(氧化还原反应 第1课时)
第二节
第一章 物质及其变化
必修 1
一、氧化还原反应
氧化反应:物质得到氧的反应 还原反应:物质失去氧的反应
【回忆】 什么是氧化反应?什么是还原反应?
【判断】下列反应属于氧化反应还是还原反应?
2CuO+C 2Cu+CO2↑
高温
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
2Cu+O2 2CuO
点燃
失氧
发生还原反应
得氧
发生氧化反应
被还原
被氧化
同时发生
同时发生
氧化还原反应:氧化反应和还原反应同时发生的反应
得氧、失氧角度
物质在反应中
得到氧
失去氧
被氧化
被还原
氧化反应
还原反应
在一个反应
中同时发生
判断:下列反应哪些属于氧化还原反应?
Cu+O2 === 2 CuO
C + 2 CuO === 2Cu + CO2 ↑
Fe + CuSO4 === FeSO4 + Cu
2NaOH + CuSO4 === Cu(OH)2 ↓ + Na2SO4
H2+CuO Cu + H2O
请认真观察铜元素反应前后的变化,找出其中的规律。
得氧、失氧角度
高温
点燃
①②③⑤
你找出了哪些规律?
Cu+O2 === 2 CuO
C + 2 CuO === CO2 + 2 Cu
Fe + CuSO4 === FeSO4 + Cu
2NaOH + CuSO4 === Cu(OH)2 ↓ + Na2SO4
H2+CuO Cu + H2O
化合价变化角度
高温
点燃
0
+2
0
+2
+2
+2
+2
0
0
+2
1.氧化还原反应前后,有的元素化合价升高
2.氧化还原反应前后,有的元素化合价降低
3.氧化还原反应前后,有的元素化合价不变
氧化还原反应的重要特征:反应前后,有元素化合价变化
化合价升高总数=化合价降低总数
4.反应前后,所有元素化合价都没有变化的反应不是氧化还原反应
化合价变化角度
2CuO+C 2Cu+CO2↑
高温
+2 0 0 +4
化合价降低
化合价升高
Cu元素:
被还原
发生还原反应
C元素:
被氧化
发生氧化反应
同时发生
Cu+3O2 2CuO
高温
0 0 +2 -2
化合价降低
O元素:
被还原
发生还原反应
化合价升高
Cu元素:
被氧化
发生氧化反应
同时发生
化合价变化角度
物质所含元素的化合价
升高
降低
被氧化
被还原
氧化反应
还原反应
在一个反应
中同时发生
氧化还原反应
常见元素化合价
一价钾钠氢氯银,二价氧钙钡镁锌,
三铝四硅五价磷,可变价态也不难,
二三铁,二四碳,二四六硫都齐全,
铜汞二价最常见,莫忘单质价为零。
(1)CuO Cu2O Fe2O3 Na2O CaCO3 CO FeO
(2)KMnO4 K2MnO4 MnO2 MnCl2
(3)Cl2 HCl KCl KClO3 NaClO
(4)H2S SO2 H2SO3 H2SO4 H2O2 H2O
(5)NH3 N2O NO NO2 NH4NO3
+2
+1
+3
+1
+2
+7
+6
+4
+2
0
-1
+1
+5
+1
-2
+4
+4
+6
-1
-3
+1
+2
+4
-3
+5
-2
+4
+2
+2
微观角度
以Na与Cl2反应为例
2 Na+ Cl2 === 2 NaCl
点燃
+11
8
2
Na+
失1个电子
+17
8
2
7
Cl
化合价升高,被氧化 氧化反应
0 0 +1 -1
化合价降低,被还原 还原反应
e-
+11
8
2
1
Na
得电子
失电子
Cl
-
得1个电子
+17
8
2
8
微观角度
以H2与Cl2反应为例
H2+Cl2 2HCl
点燃
0 0 +1 -1
化合价升高
电子对偏离
被氧化,发生氧化反应
化合价降低
被还原,发生还原反应
电子对偏向
+17
Cl
+1
H
1
2
8
7
H和Cl都不易失去电子,都可获得1个电子形成稳定的结构,
二者只能形成共用电子对,使双方最外层都达到稳定结构。
+17
+1
HCl
共用电子
失去电子或
电子对偏离
得到电子或
电子对偏向
氧化反应
还原反应
氧化还原反应的本质:氧化还原反应中一定有电子的转移(得失或偏移)
化合价升高
化合价降低
升 失 氧
降 得 还
电子的转移
(电子得失或偏移)
化合价的升降
本质
特征
氧化还原反应的判断方法
微观角度
氧化还原反应
同时发生
年代 化学重大突破
18世纪末
19世纪中
19世纪末
氧化还原反应的认识发展
发现氧气
定义了
化合价
发现电子
对氧化还原反应的认识角度
①得失氧
②化合价升降
③电子转移
得氧
失氧
初步认识
氧化反应
还原反应
地位
化合价升高
化合价降低
特征
失去电子或电子对偏离
得到电子或电子对偏向
本质
科学史话
对化学反应进行分类
化学反应
根据反应物和生成物的类别以及反应前后物质的种类的多少
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
根据化合价升降
非氧化还原反应
反应类型的关系
反应类型的关系
反应类型 表达式 举例
化合反应
分解反应
置换反应
复分解反应
AB=A+B
A+BC=B+AC
AB+CD=AD+CB
A+B=AB
CaO+H2O=Ca(OH)2
2KClO3 2KCl+3O2↑
△
MnO2
Fe+CuSO4= FeSO4+ Cu
NaOH+HCl=NaCl+H2O
氧化还原反应与四种基本反应类型有什么关联?
化合反应
分解反应
反应类型的关系
氧化还原反应
置换反应
复分解反应
有单质生成的分解反应
有单质参加的化合反应
分解
化合
氧化还原反应
置换
复分解反应
小结
总结
电子的转移
氧化还原反应
概念
特征
(判断依据)
本质
与四种基本反应类型的关系
一定是非氧化还原反应
化合反应、分解反应
复分解反应
反应前后,有元素化合价的变化
置换反应
氧化反应和还原反应同时发生的反应
一定是氧化还原反应
有单质参与的属于氧化还原反应
