3.2.5+溶液(第5课时+物质从溶液中析出)-2022-2023学年九年级化学第一册同步精品课堂(沪教版·上海)(课件29页)
文档属性
| 名称 | 3.2.5+溶液(第5课时+物质从溶液中析出)-2022-2023学年九年级化学第一册同步精品课堂(沪教版·上海)(课件29页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-03 00:00:00 | ||
图片预览





文档简介
(共29张PPT)
第三章 走进溶液世界
GO INTO THE WORLD OF SOLUTIONS
(沪教版)九年级 第一学期
3.2 溶液
第5课时
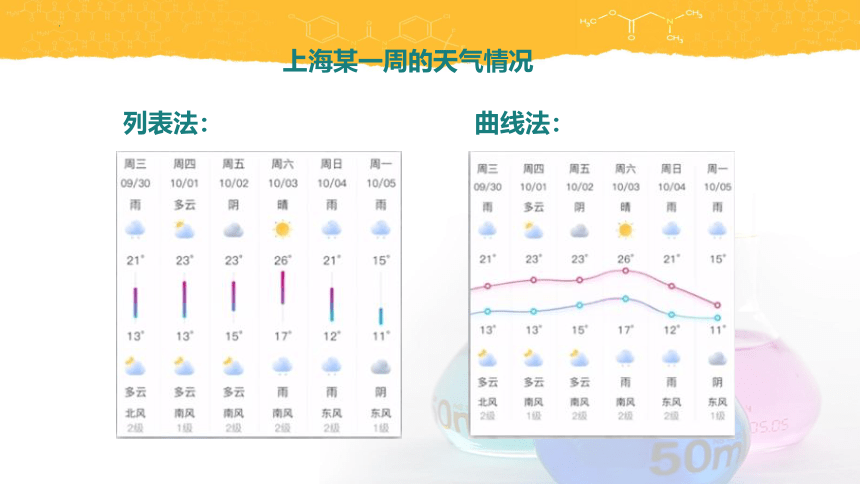
上海某一周的天气情况
列表法:
曲线法:
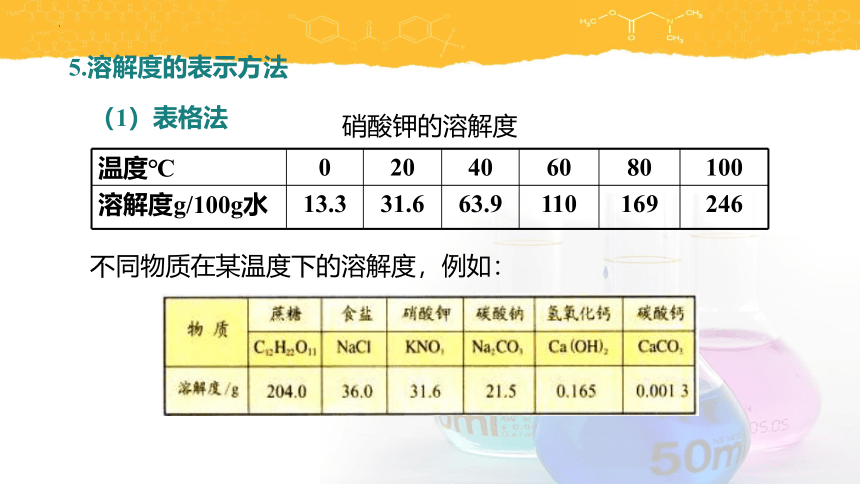
5.溶解度的表示方法
温度℃ 0 20 40 60 80 100
溶解度g/100g水 13.3 31.6 63.9 110 169 246
硝酸钾的溶解度
(1)表格法
不同物质在某温度下的溶解度,例如:
注意:气体的溶解度还可以用1体积水中溶解气体体积的最大量来表示,例如标准大气压和零摄氏度下,不同气体的溶解度:
气体种类 NH3 HCl SO2 Cl2 CO2
1体积水溶解气体的体积(v/v) 700 500 40 2 0.88
你觉得表格法有什么优点和缺点?
想一想
读取数据直观、快捷;但是数据的变化不直观,未列出的数据不能确定。
升高相同的温度,溶解度增大幅度一致吗?
T (℃)
S (g/100g水)
0
20
40
60
80
100
20
40
60
80
100
120
140
160
温度℃ 溶解度
g/100g水
0 13.3
20 31.6
40 63.9
60 110
80 169
100 246
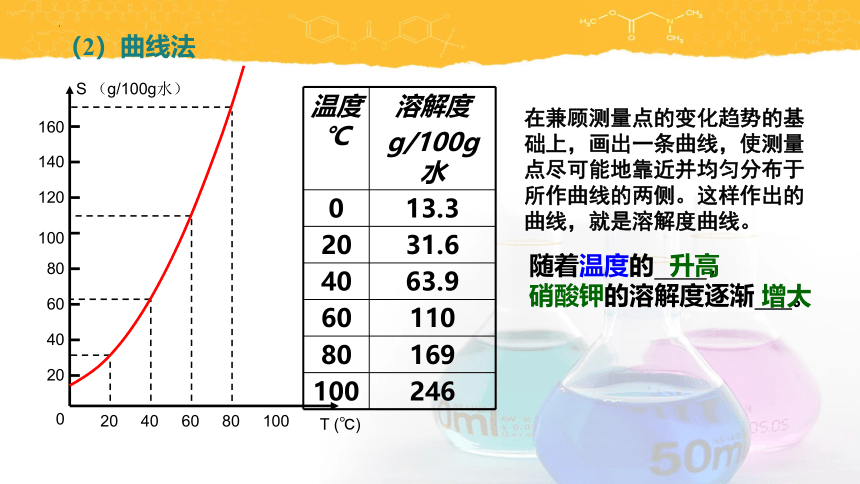
(2)曲线法
在兼顾测量点的变化趋势的基础上,画出一条曲线,使测量点尽可能地靠近并均匀分布于所作曲线的两侧。这样作出的曲线,就是溶解度曲线。
随着温度的 ,
硝酸钾的溶解度逐渐 。
升高
增大
说一说
列表法和曲线法
你更喜欢哪种表示方法?
表格法:读取数据直观、快捷;
但是数据的变化不直观,
未列出的数据不能确定。
曲线法:能读取任意温度下的溶解度,
能直观地观察到数据的变化情况;
但是数据读取比较繁琐。
硝酸钾溶解度曲线
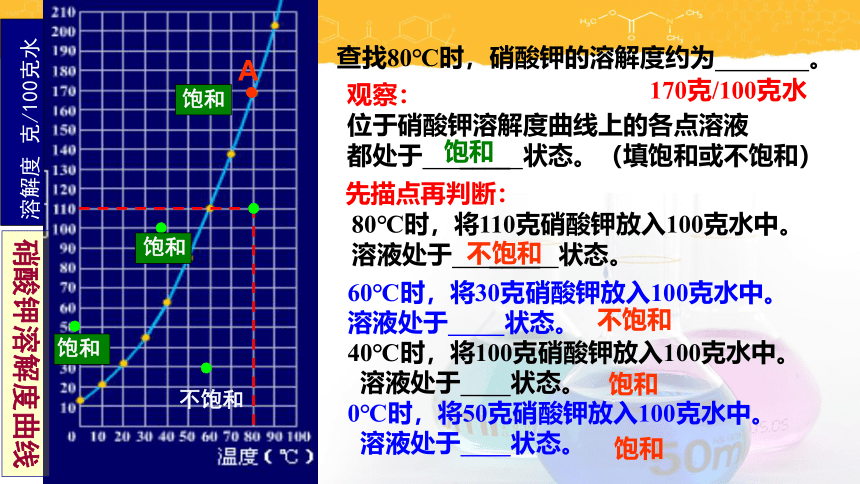
查找80℃时,硝酸钾的溶解度约为 。
先描点再判断:
80℃时,将110克硝酸钾放入100克水中。
溶液处于 ____ 状态。
170克/100克水
不饱和
溶解度 克/100克水
A
观察:
位于硝酸钾溶解度曲线上的各点溶液
都处于 ____ 状态。(填饱和或不饱和)
饱和
饱和
不饱和
饱和
饱和
60℃时,将30克硝酸钾放入100克水中。
溶液处于 状态。
40℃时,将100克硝酸钾放入100克水中。
溶液处于 状态。
0℃时,将50克硝酸钾放入100克水中。
溶液处于 状态。
饱和
饱和
不饱和
A
B
KNO3溶解度/克
0 10 20 30 40 50
80
70
60
50
40
30
20
10
A 该温度下,KNO3的饱和溶液(溶液中有晶体存在)
B、D、E 该温度下,KNO3的饱和溶液(刚好饱和状态)
C、F 该温度下,KNO3的不饱和溶液
C
2.图中各点表示的硝酸钾溶液的C%大小比较_______________________
3.G点表示的硝酸钾溶液处于什么状态 G点C%与其他各点相比呢?
1.图中各点分别表示的硝酸钾溶液处于
什么状态
溶解度
温度℃
F
D
E
G
(3)曲线法的应用
几种固体物质的溶解度曲线
a
思考:
1、a点(交点)的意义是什么
2、KNO3……的溶解度随温度变化情况
68℃时,硝酸钾和硝酸钠的溶解度相等,约为140克。
3、 30℃时,硝酸钠、硝酸钾和氯化铵的溶解度的大小
NaNO3
>
>
KNO3
NH4Cl
b
1.可以判断固体物质的溶解度受温度影响的变化情况;
2.可以比较不同物质在同一温度时溶解度的大小;
3.可以查出同一种物质在不同温度时的溶解度。
曲线法的应用:
H
I
t1 t2 t3
1.将H、I溶液降温,有固体析出?
2.将H、I饱和溶液降温,有固体析出?
谁析出固体多?
3.将H、I饱和溶液从t3降温至t1,何种物质析出多?
4.将各100g 的H、I饱和溶液从t3降温至t1,何种物质析出多?
降温结晶析出晶体的多少与:
溶液量、温度变化、溶解度变化趋势有关
讨论:固体物质溶解度受温度变化影响情况:
①大多数固体物质溶解度随温度升高而增大,
例如:硝酸钠、氯化铵等。
②少数固体物质溶解度受温度影响不大,
例如:食盐。
③极少数固体物质溶解度随温度升高反而减小,
例如:熟石灰。
熟石灰的溶解度曲线
气体的溶解度与什么有关系呢?
实验1:
在两支试管中都倒入约20mL汽水,然后分别放入盛有冷水和热水的烧杯中,观察现象。
实验前
实验后
结论1:CO2的溶解度随T升高而减小
实验2:
先往针筒中抽入约40mL可乐。静置到没有气泡从溶液中冒出,把针筒口堵住。用力把针筒的活塞向下拉,观察现象。一会后,松开活塞,活塞回原处后,再用力把针筒的活塞向下拉,观察现象。
结论2:CO2的溶解度随P减小而减小
实验前
实验后
各种气体
相同温度,气体的溶解度随着P的增大而增大。
相同压强,气体的溶解度随着T的升高而减小。
6.溶解度的影响因素
气体
T↑,S↑
T↑,S↓
P↑,S↑
内因:
溶质和溶剂的性质。
外因:
温度:
甚至个别随温度升高而减小,如:熟石灰、所有气体。
一般物质的溶解度随温度升高而增大
个别不受影响或影响不大
压强:
只对气体溶质有影响,压强越大,气体的溶解度越大。
T↑,S 几乎不变
T↑,S↓
五、物质从溶液中析出
生活中有时需要将物质溶解于水,有时需要将物质从水中提取出来。
思考:食盐从海水中提取出来的原理是什么?
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
人们利用以下原理从海水中提取食盐,并得到含有大量化工原料的母液(叫做苦卤),其大致过程如下:
思考:还有什么方法能使溶质从溶剂中析出呢?
1.物质的结晶
溶质从饱和溶液中析出的过程叫做物质的结晶。
蒸发结晶:采用蒸发溶剂的方法使溶质结晶
冷却热饱和溶液结晶(降温结晶)
(1)定义:
(2)物质结晶的方法
适用于 S 受温度影响小的固体物质。
例如:食盐等
例如:KNO3等
一般适用于 S 受温度影响比较大的固体物质.
(3)结晶的应用:
①能用来从饱和溶液中提取溶质.
②能用来对物质进行分离提纯.
思考:根据下图两种物质的溶解度随温度变化的曲线图回答下列问题:
①要使NaCl物质结晶的方法是__________,因为_________________________。
②要使KNO3结晶的方法是________________,因为____________________________。
例如:根据上述曲线图可知:
KNO3中混有少量NaCl,要提纯KNO3,用什么方法?简述操作
要提纯某种物质,就是要使该物质结晶,应使晶体为纯净物。
蒸发溶剂
NaCl S 随温度变化不明显
冷却热饱和溶液
KNO3溶解度随温度变化明显
KNO3
NaCl
NaCl中混有少量KNO3,要提纯NaCl,用什么方法?简述操作
思考1:结晶后要将晶体与母液分离,应该采用______方法。
思考2:过滤分离出来的母液______(含有/不含)溶质,而且该母液
是______(饱和/ 不饱和)溶液,所以母液通常要循环使用,不
要随意丢弃(节约资源),KNO3中还有少量NaCl怎么办?
思考3:溶液中析出的固体与一般的固体有何不同呢?
实验:用放大镜分别观察食盐晶体、蔗糖晶体。
用显微镜观察面粉、硝酸钾晶体、硫酸铜晶体
食盐
蔗糖
硝酸钾
胆矾
水晶
雪花
过滤
含哪些溶质呢?
2.晶体与非晶体
具有规则的几何形状的固体叫做晶体。
非晶体:即不具备规则的几何形状的固体。
如面粉,硫酸铜粉末等
(1)定义:
(2)晶体的分类:
一部分不带结晶水,例如氯化钠、硝酸钾晶体等。
一部分带结晶水,例如:胆矾( CuSO4·5H2O ),明矾【KAl(SO4)2·12H2O 】,石碱( Na2CO3·10H2O )等。
石英
黄铁矿
方解石
思考:还有什么方法能使溶质从溶剂中析出呢?
实验:将热的饱和硝酸钾、硫酸铜溶液插入冰水中,观察现象。
一段时间后发现试管里有固体析出。
做一做
思考:该实验中的溶质为何会从饱和溶液中析出呢?
饱和溶液温度降低,溶质的溶解度减小,故有多余的溶质析出。
硝酸钾晶体
例1:10 °C,硝酸钾的S=20.9克/100克水,20 °C,食盐的
S=36克/100克水,所以,食盐比硝酸钾易溶于水,对吗?
不对,无法比较
例2:气体的溶解度是指在一定温度和压强下,某气体在1体积水里达到饱和状态时所溶解的体积。为比较温度对气体溶解度的影响,查得101kPa时,M、N两种气体在不同温度下的溶解度数值:SM,20℃=0.023L/LH2O, SN,40℃=0.023L/LH2O 。则在101kPa、30℃时,M、N两种气体溶解度大小关系正确的是( )
A、SM < SN B、SM = SN C、SM > SN D、无法比较
A
1. 20℃时,某 溶液浓度为20%,求其溶解度S。
饱和
2. t℃时,将100g 的KNO3溶液蒸发10g 水析出5g 晶体,继续蒸发
10g 水,析出6g 晶体,求其t℃时溶解度S。
3. t℃时,将100g KNO3溶液等分成2份,将其中一份蒸发10g 水,
析出5g 晶体,另一份蒸发20g 水,析出11g 晶体,求t℃时其S。
4. t℃时,将100g KNO3溶液等分成2份,向其中一份溶解6g KNO3
恰好饱和,另一份恒温蒸发10g 水恰好变饱和,求t℃时其S。
5. 将KNO3饱和溶液降温,请你完成以下4张图。
向KNO3饱和溶液中加KNO3
向CuSO4饱和溶液中加CuSO4 粉末
向Ca(OH)2饱和溶液中加CaO粉末
冷却时间
时间
时间
时间
m质
m剂
C%
第三章 走进溶液世界
GO INTO THE WORLD OF SOLUTIONS
(沪教版)九年级 第一学期
3.2 溶液
第5课时
上海某一周的天气情况
列表法:
曲线法:
5.溶解度的表示方法
温度℃ 0 20 40 60 80 100
溶解度g/100g水 13.3 31.6 63.9 110 169 246
硝酸钾的溶解度
(1)表格法
不同物质在某温度下的溶解度,例如:
注意:气体的溶解度还可以用1体积水中溶解气体体积的最大量来表示,例如标准大气压和零摄氏度下,不同气体的溶解度:
气体种类 NH3 HCl SO2 Cl2 CO2
1体积水溶解气体的体积(v/v) 700 500 40 2 0.88
你觉得表格法有什么优点和缺点?
想一想
读取数据直观、快捷;但是数据的变化不直观,未列出的数据不能确定。
升高相同的温度,溶解度增大幅度一致吗?
T (℃)
S (g/100g水)
0
20
40
60
80
100
20
40
60
80
100
120
140
160
温度℃ 溶解度
g/100g水
0 13.3
20 31.6
40 63.9
60 110
80 169
100 246
(2)曲线法
在兼顾测量点的变化趋势的基础上,画出一条曲线,使测量点尽可能地靠近并均匀分布于所作曲线的两侧。这样作出的曲线,就是溶解度曲线。
随着温度的 ,
硝酸钾的溶解度逐渐 。
升高
增大
说一说
列表法和曲线法
你更喜欢哪种表示方法?
表格法:读取数据直观、快捷;
但是数据的变化不直观,
未列出的数据不能确定。
曲线法:能读取任意温度下的溶解度,
能直观地观察到数据的变化情况;
但是数据读取比较繁琐。
硝酸钾溶解度曲线
查找80℃时,硝酸钾的溶解度约为 。
先描点再判断:
80℃时,将110克硝酸钾放入100克水中。
溶液处于 ____ 状态。
170克/100克水
不饱和
溶解度 克/100克水
A
观察:
位于硝酸钾溶解度曲线上的各点溶液
都处于 ____ 状态。(填饱和或不饱和)
饱和
饱和
不饱和
饱和
饱和
60℃时,将30克硝酸钾放入100克水中。
溶液处于 状态。
40℃时,将100克硝酸钾放入100克水中。
溶液处于 状态。
0℃时,将50克硝酸钾放入100克水中。
溶液处于 状态。
饱和
饱和
不饱和
A
B
KNO3溶解度/克
0 10 20 30 40 50
80
70
60
50
40
30
20
10
A 该温度下,KNO3的饱和溶液(溶液中有晶体存在)
B、D、E 该温度下,KNO3的饱和溶液(刚好饱和状态)
C、F 该温度下,KNO3的不饱和溶液
C
2.图中各点表示的硝酸钾溶液的C%大小比较_______________________
3.G点表示的硝酸钾溶液处于什么状态 G点C%与其他各点相比呢?
1.图中各点分别表示的硝酸钾溶液处于
什么状态
溶解度
温度℃
F
D
E
G
(3)曲线法的应用
几种固体物质的溶解度曲线
a
思考:
1、a点(交点)的意义是什么
2、KNO3……的溶解度随温度变化情况
68℃时,硝酸钾和硝酸钠的溶解度相等,约为140克。
3、 30℃时,硝酸钠、硝酸钾和氯化铵的溶解度的大小
NaNO3
>
>
KNO3
NH4Cl
b
1.可以判断固体物质的溶解度受温度影响的变化情况;
2.可以比较不同物质在同一温度时溶解度的大小;
3.可以查出同一种物质在不同温度时的溶解度。
曲线法的应用:
H
I
t1 t2 t3
1.将H、I溶液降温,有固体析出?
2.将H、I饱和溶液降温,有固体析出?
谁析出固体多?
3.将H、I饱和溶液从t3降温至t1,何种物质析出多?
4.将各100g 的H、I饱和溶液从t3降温至t1,何种物质析出多?
降温结晶析出晶体的多少与:
溶液量、温度变化、溶解度变化趋势有关
讨论:固体物质溶解度受温度变化影响情况:
①大多数固体物质溶解度随温度升高而增大,
例如:硝酸钠、氯化铵等。
②少数固体物质溶解度受温度影响不大,
例如:食盐。
③极少数固体物质溶解度随温度升高反而减小,
例如:熟石灰。
熟石灰的溶解度曲线
气体的溶解度与什么有关系呢?
实验1:
在两支试管中都倒入约20mL汽水,然后分别放入盛有冷水和热水的烧杯中,观察现象。
实验前
实验后
结论1:CO2的溶解度随T升高而减小
实验2:
先往针筒中抽入约40mL可乐。静置到没有气泡从溶液中冒出,把针筒口堵住。用力把针筒的活塞向下拉,观察现象。一会后,松开活塞,活塞回原处后,再用力把针筒的活塞向下拉,观察现象。
结论2:CO2的溶解度随P减小而减小
实验前
实验后
各种气体
相同温度,气体的溶解度随着P的增大而增大。
相同压强,气体的溶解度随着T的升高而减小。
6.溶解度的影响因素
气体
T↑,S↑
T↑,S↓
P↑,S↑
内因:
溶质和溶剂的性质。
外因:
温度:
甚至个别随温度升高而减小,如:熟石灰、所有气体。
一般物质的溶解度随温度升高而增大
个别不受影响或影响不大
压强:
只对气体溶质有影响,压强越大,气体的溶解度越大。
T↑,S 几乎不变
T↑,S↓
五、物质从溶液中析出
生活中有时需要将物质溶解于水,有时需要将物质从水中提取出来。
思考:食盐从海水中提取出来的原理是什么?
海水
贮水池
蒸发池
结晶池
食盐
母液
氯化钠
多种化工产品
人们利用以下原理从海水中提取食盐,并得到含有大量化工原料的母液(叫做苦卤),其大致过程如下:
思考:还有什么方法能使溶质从溶剂中析出呢?
1.物质的结晶
溶质从饱和溶液中析出的过程叫做物质的结晶。
蒸发结晶:采用蒸发溶剂的方法使溶质结晶
冷却热饱和溶液结晶(降温结晶)
(1)定义:
(2)物质结晶的方法
适用于 S 受温度影响小的固体物质。
例如:食盐等
例如:KNO3等
一般适用于 S 受温度影响比较大的固体物质.
(3)结晶的应用:
①能用来从饱和溶液中提取溶质.
②能用来对物质进行分离提纯.
思考:根据下图两种物质的溶解度随温度变化的曲线图回答下列问题:
①要使NaCl物质结晶的方法是__________,因为_________________________。
②要使KNO3结晶的方法是________________,因为____________________________。
例如:根据上述曲线图可知:
KNO3中混有少量NaCl,要提纯KNO3,用什么方法?简述操作
要提纯某种物质,就是要使该物质结晶,应使晶体为纯净物。
蒸发溶剂
NaCl S 随温度变化不明显
冷却热饱和溶液
KNO3溶解度随温度变化明显
KNO3
NaCl
NaCl中混有少量KNO3,要提纯NaCl,用什么方法?简述操作
思考1:结晶后要将晶体与母液分离,应该采用______方法。
思考2:过滤分离出来的母液______(含有/不含)溶质,而且该母液
是______(饱和/ 不饱和)溶液,所以母液通常要循环使用,不
要随意丢弃(节约资源),KNO3中还有少量NaCl怎么办?
思考3:溶液中析出的固体与一般的固体有何不同呢?
实验:用放大镜分别观察食盐晶体、蔗糖晶体。
用显微镜观察面粉、硝酸钾晶体、硫酸铜晶体
食盐
蔗糖
硝酸钾
胆矾
水晶
雪花
过滤
含哪些溶质呢?
2.晶体与非晶体
具有规则的几何形状的固体叫做晶体。
非晶体:即不具备规则的几何形状的固体。
如面粉,硫酸铜粉末等
(1)定义:
(2)晶体的分类:
一部分不带结晶水,例如氯化钠、硝酸钾晶体等。
一部分带结晶水,例如:胆矾( CuSO4·5H2O ),明矾【KAl(SO4)2·12H2O 】,石碱( Na2CO3·10H2O )等。
石英
黄铁矿
方解石
思考:还有什么方法能使溶质从溶剂中析出呢?
实验:将热的饱和硝酸钾、硫酸铜溶液插入冰水中,观察现象。
一段时间后发现试管里有固体析出。
做一做
思考:该实验中的溶质为何会从饱和溶液中析出呢?
饱和溶液温度降低,溶质的溶解度减小,故有多余的溶质析出。
硝酸钾晶体
例1:10 °C,硝酸钾的S=20.9克/100克水,20 °C,食盐的
S=36克/100克水,所以,食盐比硝酸钾易溶于水,对吗?
不对,无法比较
例2:气体的溶解度是指在一定温度和压强下,某气体在1体积水里达到饱和状态时所溶解的体积。为比较温度对气体溶解度的影响,查得101kPa时,M、N两种气体在不同温度下的溶解度数值:SM,20℃=0.023L/LH2O, SN,40℃=0.023L/LH2O 。则在101kPa、30℃时,M、N两种气体溶解度大小关系正确的是( )
A、SM < SN B、SM = SN C、SM > SN D、无法比较
A
1. 20℃时,某 溶液浓度为20%,求其溶解度S。
饱和
2. t℃时,将100g 的KNO3溶液蒸发10g 水析出5g 晶体,继续蒸发
10g 水,析出6g 晶体,求其t℃时溶解度S。
3. t℃时,将100g KNO3溶液等分成2份,将其中一份蒸发10g 水,
析出5g 晶体,另一份蒸发20g 水,析出11g 晶体,求t℃时其S。
4. t℃时,将100g KNO3溶液等分成2份,向其中一份溶解6g KNO3
恰好饱和,另一份恒温蒸发10g 水恰好变饱和,求t℃时其S。
5. 将KNO3饱和溶液降温,请你完成以下4张图。
向KNO3饱和溶液中加KNO3
向CuSO4饱和溶液中加CuSO4 粉末
向Ca(OH)2饱和溶液中加CaO粉末
冷却时间
时间
时间
时间
m质
m剂
C%
