化学人教版(2019)选择性必修一3.3.2盐类水解的影响因素(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修一3.3.2盐类水解的影响因素(共19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 399.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-02 20:22:14 | ||
图片预览






文档简介
(共19张PPT)
第三章水溶液中的离子反应与平衡
第三节 盐类的水解
第二课时 盐类的水解的影响因素
1.了解影响盐类水解平衡的因素。
2.能举例说明盐类水解在生产、生活中的应用。
3.会判断溶液中粒子浓度的大小关系。
4.知道水解常数。
学习目标
同样为强碱弱酸盐溶液,CH3COONa、Na2CO3、 NaHCO3却表现出不同的碱性,这是为什么?
影响盐类水解有哪些因素?
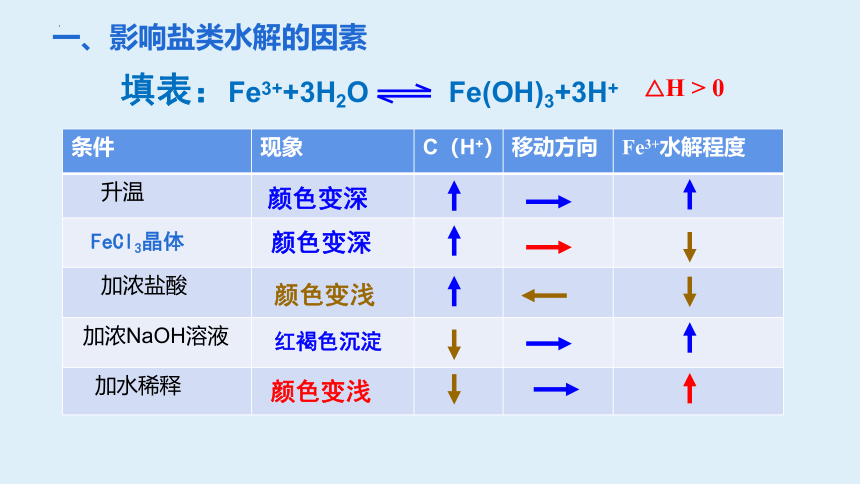
一、影响盐类水解的因素
Fe3++3H2O ? Fe(OH)3+3H+
探究:反应条件对FeCl3水解平衡的影响(课本P75)
1.提出问题:
(1)FeCl3溶液呈酸性还是碱性?写出FeCl3水解的离子方程式
(2)从反应条件考虑,影响FeCl3水解平衡的因素有哪些?
现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴;
0.01mol/L的FeCl3溶液、FeCl3晶体、浓盐酸、浓氢氧化钠溶液。
请根据所提供实验用品,参照下表设计实验,完成实验并记录现象,应用平衡移动原理对实验现象进行解释。
一、影响盐类水解的因素
2.实验探究
影响因素 实验步骤 实验现象 解释
温度
反应物的浓度
生成物的浓度
条件 现象 C(H+) 移动方向 Fe3+水解程度
升温
加浓盐酸
加浓NaOH溶液
加水稀释
颜色变深
颜色变浅
填表:Fe3++3H2O Fe(OH)3+3H+
△H > 0
颜色变浅
红褐色沉淀
一、影响盐类水解的因素
FeCl3晶体
颜色变深
(符合勒夏特列原理)
1.内因
盐的本性 :组成盐的酸或碱越弱,水解程度越大。越弱越水解.
2.外因
水解反应△H>0
升高温度促进水解.越热越水解
浓度:
温度:
盐溶液浓度越小,水解程度越大。越稀越水解
溶液的酸、碱性:
加酸、
加碱、
或加盐
一、影响盐类水解的因素
试填下表:氯化铵水解平衡移动。
+H2O NH3·H2O+H+(正反应为吸热反应)。
加热 加水 加NH3 加NH4Cl 加HCl 加
) ____ ____ ____ ____ ____ ____
c(NH3·H2O) ____ ____ ____ ____ ____ ____
c(H+) ____ ____ ____ ____ ____ ____
c(OH-) ____ ____ ____ ____ ____ ____
pH ____ ____ ____ ____ ____ ____
水解程度 ____ ____ ____ ____ ____ ____
降低
降低
降低
降低
降低
降低
升高
降低
降低
降低
降低
降低
降低
降低
升高
升高
升高
升高
升高
升高
升高
升高
降低
升高
升高
升高
升高
升高
升高
升高
增大
增大
增大
减小
减小
减小
1.写出强碱弱酸盐(MA)的水解离子方程式,写出该水解平衡常数表达式(Kh)
c(HA)·c(OH-)
c(A-)
Kh =
A- + H2O HA + OH-
2.写出弱酸(HA)的电离平衡常数表达式(Ka),找出Ka与该弱酸强碱盐(MA)的水解平衡常数(Kh)之间的关系
一元弱酸中存在以下关系:
HA A- + H+
c(A-)·c(H+)
c( HA)
Ka =
Ka 与Kh 之间有什么关系?
Kh 的大小只与温度有关
二、水解平衡常数 P77
Ka· Kh =Kw
同理:强酸弱碱盐 M+ +H2O MOH +H+
Kh=
c (MOH).c(H+ )
c(M+)
=
c ( MOH)
c(M+).c(OH- )
二、水解平衡常数 P77
Kb
一元弱碱中存在以下关系:
MOH M+ + OH-
Kb· Kh =Kw
Kb 与Kh 之间的关系
Kh =
Kw
Ka
Ka· Kh =Kw
Kb· Kh =Kw
Ka越小,酸越难电离(酸性越弱),对应的盐水解程度越大;
Kb越小,碱越难电离(碱性越弱),对应的盐水解程度越大;
结论:越弱越水解!
所有平衡常数都只受温度影响,温度不变平衡常数不变
Kh =
Kw
Kb
三、盐类水解的应用
1.分析判断盐溶液的酸碱性(pH)及其强弱,试剂的保存。
问题2:相同条件,相同物质的量浓度的下列溶液:Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、等溶液,pH值由大到小的顺序为:
NaClO>Na2CO3>NaHCO3>NaAc>Na2SO4
问题1:为什么Na2CO3,Na3PO4,Na2SiO3等溶液不能贮存在磨口玻璃试剂瓶中?
2.配制和保存易水解的盐溶液,应加少量的同种酸,如FeCl3, FeCl2,SnCl2,CuSO4溶液等。
3.判定离子能否大量共存,完全双水解的离子不能大量共存。
4.盐作净化剂的原理:明矾、FeCl3 等
Al 3+ + 3H2O Al(OH)3 (胶体) + 3H +
Fe 3+ + 3H2O Fe (OH)3 (胶体) + 3H +
三、盐类水解的应用
5.无机化合物制备。
用TiCl4制备TiO2
TiCl4+(x+2)H2O==TiO2 ·x H2O↓ +4HCl
制备时加大量的水,同时加热,使水解趋于完全用所得的TiO2 ·x H2O进行焙烧,得到TiO2 。类似方法也可制SnO、Sn2O、Sn2O3
AlCl3溶液
蒸干
Al(OH)3
灼烧
Al2O3
MgCl2· 6H2O
Mg(OH)2
MgO
△
△
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
三、盐类水解的应用
TiO2化学性质稳定,为一种白色颜料,广泛用于涂料、橡胶、造纸行业
Fe2(SO4)3 溶液
Na2SO3 溶液
练一练 下面溶液蒸干后得到什么固体物质?
Fe2(SO4)3
Na2SO4
三、盐类水解的应用
6. 泡沫灭火器的原理
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
7.纯碱溶液和肥皂水洗涤油污的原理
Na2CO3+H2O NaHCO3+NaOH
C17H35COONa+H2O C17H35COOH+NaOH
加热,促进水解,去污能力增强
三、盐类水解的应用
草木灰的成分:K2CO3,水解呈碱性。
CO32-+H2O HCO3- +OH-,
HCO3-+H2O H2CO3 +OH-,
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+,
发生双水解,产生的NH3·H2O分解,氨气逸出
三、盐类水解的应用
8.化肥的使用。如草木灰不宜与铵态氮肥混合施用
本节课我们学到了什么?
一、影响盐类水解的因素
三、盐类水解的应用
二、水解平衡常数
第三章水溶液中的离子反应与平衡
第三节 盐类的水解
第二课时 盐类的水解的影响因素
1.了解影响盐类水解平衡的因素。
2.能举例说明盐类水解在生产、生活中的应用。
3.会判断溶液中粒子浓度的大小关系。
4.知道水解常数。
学习目标
同样为强碱弱酸盐溶液,CH3COONa、Na2CO3、 NaHCO3却表现出不同的碱性,这是为什么?
影响盐类水解有哪些因素?
一、影响盐类水解的因素
Fe3++3H2O ? Fe(OH)3+3H+
探究:反应条件对FeCl3水解平衡的影响(课本P75)
1.提出问题:
(1)FeCl3溶液呈酸性还是碱性?写出FeCl3水解的离子方程式
(2)从反应条件考虑,影响FeCl3水解平衡的因素有哪些?
现有以下实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴;
0.01mol/L的FeCl3溶液、FeCl3晶体、浓盐酸、浓氢氧化钠溶液。
请根据所提供实验用品,参照下表设计实验,完成实验并记录现象,应用平衡移动原理对实验现象进行解释。
一、影响盐类水解的因素
2.实验探究
影响因素 实验步骤 实验现象 解释
温度
反应物的浓度
生成物的浓度
条件 现象 C(H+) 移动方向 Fe3+水解程度
升温
加浓盐酸
加浓NaOH溶液
加水稀释
颜色变深
颜色变浅
填表:Fe3++3H2O Fe(OH)3+3H+
△H > 0
颜色变浅
红褐色沉淀
一、影响盐类水解的因素
FeCl3晶体
颜色变深
(符合勒夏特列原理)
1.内因
盐的本性 :组成盐的酸或碱越弱,水解程度越大。越弱越水解.
2.外因
水解反应△H>0
升高温度促进水解.越热越水解
浓度:
温度:
盐溶液浓度越小,水解程度越大。越稀越水解
溶液的酸、碱性:
加酸、
加碱、
或加盐
一、影响盐类水解的因素
试填下表:氯化铵水解平衡移动。
+H2O NH3·H2O+H+(正反应为吸热反应)。
加热 加水 加NH3 加NH4Cl 加HCl 加
) ____ ____ ____ ____ ____ ____
c(NH3·H2O) ____ ____ ____ ____ ____ ____
c(H+) ____ ____ ____ ____ ____ ____
c(OH-) ____ ____ ____ ____ ____ ____
pH ____ ____ ____ ____ ____ ____
水解程度 ____ ____ ____ ____ ____ ____
降低
降低
降低
降低
降低
降低
升高
降低
降低
降低
降低
降低
降低
降低
升高
升高
升高
升高
升高
升高
升高
升高
降低
升高
升高
升高
升高
升高
升高
升高
增大
增大
增大
减小
减小
减小
1.写出强碱弱酸盐(MA)的水解离子方程式,写出该水解平衡常数表达式(Kh)
c(HA)·c(OH-)
c(A-)
Kh =
A- + H2O HA + OH-
2.写出弱酸(HA)的电离平衡常数表达式(Ka),找出Ka与该弱酸强碱盐(MA)的水解平衡常数(Kh)之间的关系
一元弱酸中存在以下关系:
HA A- + H+
c(A-)·c(H+)
c( HA)
Ka =
Ka 与Kh 之间有什么关系?
Kh 的大小只与温度有关
二、水解平衡常数 P77
Ka· Kh =Kw
同理:强酸弱碱盐 M+ +H2O MOH +H+
Kh=
c (MOH).c(H+ )
c(M+)
=
c ( MOH)
c(M+).c(OH- )
二、水解平衡常数 P77
Kb
一元弱碱中存在以下关系:
MOH M+ + OH-
Kb· Kh =Kw
Kb 与Kh 之间的关系
Kh =
Kw
Ka
Ka· Kh =Kw
Kb· Kh =Kw
Ka越小,酸越难电离(酸性越弱),对应的盐水解程度越大;
Kb越小,碱越难电离(碱性越弱),对应的盐水解程度越大;
结论:越弱越水解!
所有平衡常数都只受温度影响,温度不变平衡常数不变
Kh =
Kw
Kb
三、盐类水解的应用
1.分析判断盐溶液的酸碱性(pH)及其强弱,试剂的保存。
问题2:相同条件,相同物质的量浓度的下列溶液:Na2CO3、NaClO、NaAc、Na2SO4、NaHCO3、等溶液,pH值由大到小的顺序为:
NaClO>Na2CO3>NaHCO3>NaAc>Na2SO4
问题1:为什么Na2CO3,Na3PO4,Na2SiO3等溶液不能贮存在磨口玻璃试剂瓶中?
2.配制和保存易水解的盐溶液,应加少量的同种酸,如FeCl3, FeCl2,SnCl2,CuSO4溶液等。
3.判定离子能否大量共存,完全双水解的离子不能大量共存。
4.盐作净化剂的原理:明矾、FeCl3 等
Al 3+ + 3H2O Al(OH)3 (胶体) + 3H +
Fe 3+ + 3H2O Fe (OH)3 (胶体) + 3H +
三、盐类水解的应用
5.无机化合物制备。
用TiCl4制备TiO2
TiCl4+(x+2)H2O==TiO2 ·x H2O↓ +4HCl
制备时加大量的水,同时加热,使水解趋于完全用所得的TiO2 ·x H2O进行焙烧,得到TiO2 。类似方法也可制SnO、Sn2O、Sn2O3
AlCl3溶液
蒸干
Al(OH)3
灼烧
Al2O3
MgCl2· 6H2O
Mg(OH)2
MgO
△
△
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
三、盐类水解的应用
TiO2化学性质稳定,为一种白色颜料,广泛用于涂料、橡胶、造纸行业
Fe2(SO4)3 溶液
Na2SO3 溶液
练一练 下面溶液蒸干后得到什么固体物质?
Fe2(SO4)3
Na2SO4
三、盐类水解的应用
6. 泡沫灭火器的原理
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
7.纯碱溶液和肥皂水洗涤油污的原理
Na2CO3+H2O NaHCO3+NaOH
C17H35COONa+H2O C17H35COOH+NaOH
加热,促进水解,去污能力增强
三、盐类水解的应用
草木灰的成分:K2CO3,水解呈碱性。
CO32-+H2O HCO3- +OH-,
HCO3-+H2O H2CO3 +OH-,
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+,
发生双水解,产生的NH3·H2O分解,氨气逸出
三、盐类水解的应用
8.化肥的使用。如草木灰不宜与铵态氮肥混合施用
本节课我们学到了什么?
一、影响盐类水解的因素
三、盐类水解的应用
二、水解平衡常数
