第二章 第一节 钠及其化合物 第一课时 钠和钠的氧化物(共76张ppt)
文档属性
| 名称 | 第二章 第一节 钠及其化合物 第一课时 钠和钠的氧化物(共76张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-02 21:36:10 | ||
图片预览










文档简介
(共76张PPT)
第一节 钠及其化合物
第一课时 钠和钠的氧化物
第二章 海水中的重要元素——钠和氯
【课程标准要求】
1.结合真实情境中的应用实例或通过实验探究,了解钠及其氧化物的主要性质。
2.了解钠及其氧化物在生产、生活中的应用。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、活泼的金属单质——钠
1.物理性质
钠是一种______色固体,具有金属光泽,硬度______ (可切割),密度比煤油____。
银白
较小
大
2.原子结构
钠原子的最外电子层上只有____个电子,在化学反应中易______电子,因此钠的化学性质很活泼,表现出很强的______性。
1
失去
还原
3.化学性质
(1)与氧气反应
①将新切开的金属钠置于空气中,其表面发生的变化是__________,反应的化学方程式是4Na+O2===2Na2O。
很快变暗
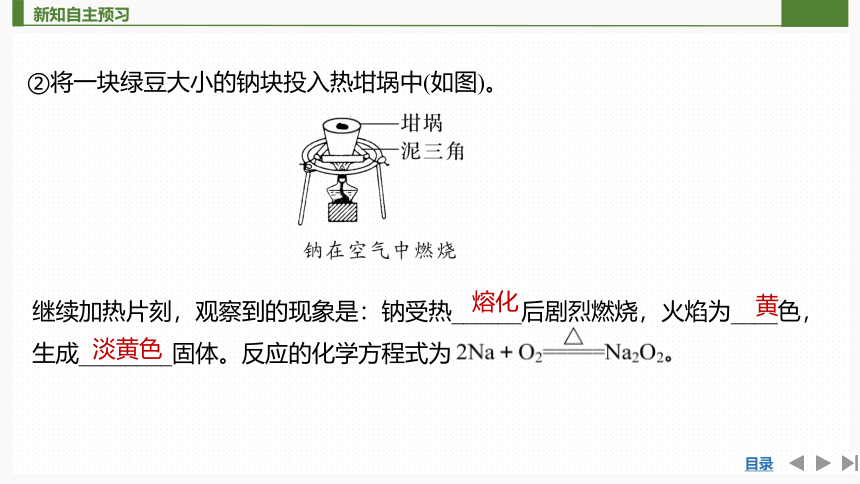
②将一块绿豆大小的钠块投入热坩埚中(如图)。
继续加热片刻,观察到的现象是:钠受热______后剧烈燃烧,火焰为____色,生成________固体。反应的化学方程式为
熔化
黄
淡黄色
(2)与水反应
①实验探究
实验操作 实验现象 结论或解释
钠____在水面上 钠的密度比水____
钠______成小球 钠的熔点____,反应放热
小球在水面上__________ 反应产生的______推动小球运动
钠表面发出“嘶嘶”声,逐渐变小,最后消失 钠与水______反应,产生气体
反应后溶液的颜色逐渐变____ 有______物质(__________)生成
浮
小
熔化
低
迅速游动
氢气
剧烈
红
碱性
氢氧化钠
②实验结论:
钠与水剧烈反应,生成NaOH和H2,反应的化学方程式为
_________________________________,反应中水作氧化剂,钠作________。
2Na+2H2O===2NaOH+H2↑
还原剂
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)钠与氧气反应时,条件不同,产物也不同( )
(2)Na与H2O发生的是置换反应( )
(3)实验室钠着火时,不能用水灭火,而要用干沙土灭火( )
(4)钠的密度比水大( )
答案 (1)√ (2)√ (3)√ (4)×
二、氧化钠和过氧化钠
1.氧化钠的性质
氧化钠是一种白色固体物质。属于______氧化物,与水反应:
__________________________________。
碱性
Na2O+H2O===2NaOH
2.过氧化钠的性质
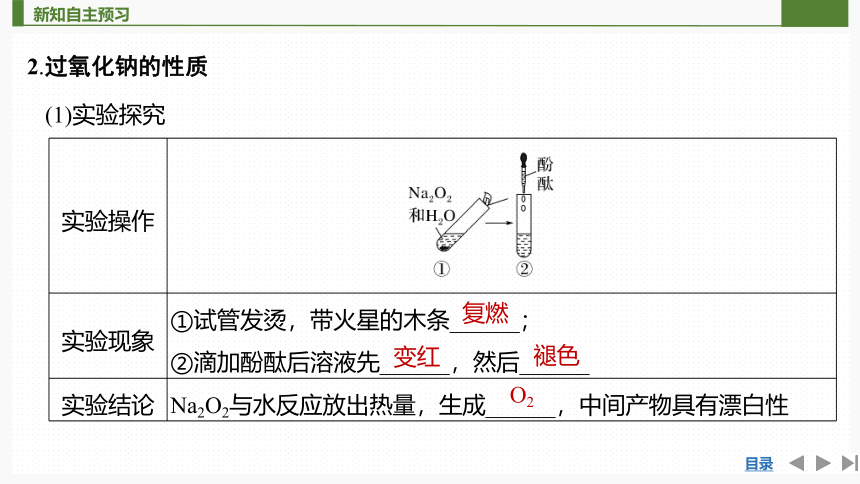
(1)实验探究
实验操作
实验现象 ①试管发烫,带火星的木条______;
②滴加酚酞后溶液先______,然后______
实验结论 Na2O2与水反应放出热量,生成______,中间产物具有漂白性
复燃
变红
褪色
O2
(2)写出下列反应的化学方程式:
①与H2O反应:
________________________________________________;
②与CO2反应:
________________________________________________。
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2CO2===2Na2CO3+O2
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)Na2O和Na2O2均为白色固体,属碱性氧化物( )
(2)Na2O与Na2O2中氧元素的化合价不相同,钠元素的化合价相同( )
(3)将Na2O2投入滴有酚酞溶液的水中,溶液变成红色,产生大量气泡( )
(4)将Na2O投入盛有水(滴有酚酞溶液)的试管中,溶液变成红色,振荡试管后溶液褪色( )
答案 (1)× (2)√ (3)× (4)×
二、过氧化钠的性质
一、钠与酸、碱、盐溶液的反应
一、钠与酸、碱、盐溶液的反应
用如图所示装置进行钠与水、盐溶液反应的实验,并可收集、检验生成的气体,按图所示向U形管中添加煤油和水,待液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,观察实验现象。
1.加入金属钠后,钠块所处的位置在图中的什么位置?反应一段时间后,U形管中的液面如何变化?其原因是什么?
提示 钠处于煤油和水的界面位置;由于钠与水反应有大量气体产生,故U形管中右管液面下降,左管液体上升进入漏斗中。
2.如何通过实验证明钠与水反应产生的气体是H2?写出钠与水反应的离子方程式,并指出反应的氧化剂和还原剂。
提示 反应结束后,打开活塞A,用小试管收集一试管气体,拇指堵住管口,倾斜着靠近酒精灯的火焰,移开拇指,若产生爆鸣声,则证明产生的气体是H2。2Na+2H2O===2Na++2OH-+H2↑,其中Na是还原剂,H2O是氧化剂。
3.将装置中的水换成稀盐酸或CuSO4溶液与钠与水的反应相比现象有什么不同?
提示 钠与稀盐酸反应更剧烈。钠与CuSO4溶液反应生成气体和蓝色沉淀。
1.钠与酸、碱、盐溶液的反应
(1)反应实质:钠与任何水溶液(如酸、碱、盐的水溶液)反应时,实质是钠与溶液中的H+反应,产生H2。
(2)具体反应
反应类型 反应分析
与酸溶 液反应 把钠投入酸溶液中时,钠先与酸电离产生的H+反应,当酸反应完后,再与水反应,即“先酸后水”。如钠与盐酸的反应依次为2Na+2HCl===2NaCl+H2↑、2Na+2H2O===2NaOH+H2↑。钠与酸溶液的反应比钠与水的反应更剧烈
与碱溶液反应 钠与碱溶液反应的实质是钠与水的反应
与盐溶 液反应 当钠加到盐的水溶液中时,首先是钠与水反应,如果生成的NaOH能够和盐反应,则反应继续进行,即“先水后盐”。如Na与CuSO4溶液、FeCl3溶液的反应。如果把钠投入NaCl溶液或K2SO4溶液中,则只发生钠和水的反应
2.反应现象总结
(1)共性。因为钠与不同的水溶液均能发生剧烈的反应,故有共同的现象产生。
①浮:钠浮在液面上;
②熔:钠熔化成光亮的小球;
③游:钠在液面上不停地游动直至反应完全;
④响:反应中发出“嘶嘶”的响声。
(2)差异性。钠与酸溶液反应比与水反应剧烈,导致钠可能在液面上燃烧;与盐溶液反应时,还可能会生成沉淀(如难溶性碱)、有刺激性气味的气体(如NH3)等。
1.钠的下列性质中与钠和水反应时的现象无关的是( )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
解析 钠浮在水面上是其密度比水小;钠熔化是其熔点很低,与水反应放出的热量让其熔化;钠与水反应比较剧烈是其还原性很强;硬度大小与反应现象无关。
C
2.将一块金属钠投入足量的下列溶液中,既能生成气体,又能生成白色沉淀的是( )
A.稀硫酸 B.Ba(OH)2稀溶液
C.MgCl2溶液 D.CuSO4溶液
解析 Na投入稀硫酸、Ba(OH)2稀溶液中,只有气体产生;Na投入MgCl2溶液中,发生反应:2Na+2H2O===2NaOH+H2↑,MgCl2+2NaOH===Mg(OH)2↓+2NaCl,Mg(OH)2为白色沉淀;Na投入CuSO4溶液中,发生反应:2Na+2H2O===2NaOH+H2↑,CuSO4+2NaOH===Cu(OH)2↓+Na2SO4,Cu(OH)2为蓝色沉淀。
C
3.向一烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入绿豆粒大小的金属钠,可能观察到的现象与图中相符的是( )
解析 钠与煤油不反应,由密度ρ水>ρNa>ρ煤油可知A项正确。
A
二、过氧化钠的性质
1.氧化钠与过氧化钠的比较
氧化钠(Na2O) 过氧化钠(Na2O2)
颜色状态 白色固体 淡黄色固体
类别 碱性氧化物 过氧化物,不属于碱性氧化物
氧元素化合价 -2 -1
生成条件 在空气中缓慢氧化 燃烧Na或加热Na2O
稳定性 Na2O2>Na2O 2.Na2O2与H2O、CO2反应的特点
(1)电子转移特点
Na2O2与水、CO2的反应中,Na2O2既作氧化剂又作还原剂,二者比例为1∶1,切记H2O不是还原剂。反应中每产生1个O2分子转移2个电子,或Na2O2与转移电子数目比为1∶1。
(2)分子个数特点
无论是CO2、H2O还是二者的混合物,通过足量Na2O2时CO2或H2O与放出O2的分子个数比均为2∶1。
(1)Na2O2与H2O反应原理
Na2O2与水的反应实质上可以分成两个过程:
①Na2O2+2H2O===2NaOH+H2O2
②2H2O2===2H2O+O2↑
①×2+②得:2Na2O2+2H2O===4NaOH+O2↑。
(2)Na2O2是一种强氧化剂,具有漂白性,能使某些有色物质褪色。
4.把Na2O2投入下列各物质的稀溶液中,充分反应后可能有浑浊产生的是( )
A.HCl B.NaOH C.Na2CO3 D.CuSO4
解析 A项,过氧化钠与盐酸反应生成氯化钠和水,不产生沉淀,不符合题意;过氧化钠投入碱、盐溶液,首先过氧化钠与水反应生成氢氧化钠和氧气,然后氢氧化钠再与各溶液中的溶质发生反应, B、C项氢氧化钠与溶液中溶质不反应,D项产生氢氧化铜沉淀。
D
5.下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
C
解析 Na2O2与酸反应时除了生成盐和水外,还生成了O2,故Na2O2不属于碱性氧化物,故A项错;Na2O2是淡黄色固体,故B项错;Na2O2与CO2和H2O反应时,是Na2O2中的氧元素之间发生了氧化还原反应,CO2、H2O既不是氧化剂又不是还原剂,Na2O2既作氧化剂又作还原剂,故C项正确; Na2O与水反应中无氧气产生,不能作供氧剂,D项错误。
6.(2021·龙岩高一检测)如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
A.气球a变大
B.试管b内有气泡冒出
C.U形管内红色褪去
D.U形管水位d高于c
C
解析 反应生成氧气,则气球a变大,故A正确;反应生成气体,则试管b中有气泡冒出,故B正确;由于浅红色的水是在U形管中而非试管中,则U形管内的红水不褪色,故C错误;产生O2使气球膨胀,该反应放出大量热量,使锥形瓶中空气受热膨胀而出现U形管中水位d>c,故D正确。
1.下列关于钠的叙述正确的是( )
A.钠为银白色固体密度比水大
B.钠在空气中燃烧,生成淡黄色的过氧化钠
C.钠可保存在水中
D.钠与CuSO4溶液反应,可置换出单质铜
B
解析 钠的密度比水小,故A错误;钠与氧气在点燃条件下生成过氧化钠,过氧化钠为淡黄色,故B正确;钠能与水发生反应,则钠不能保存在水中,故C错误;钠与硫酸铜溶液反应时,钠先与水发生置换反应生成氢气和氢氧化钠,氢氧化钠再与硫酸铜发生复分解反应生成氢氧化铜沉淀,则钠不能从硫酸铜溶液中置换出铜单质,故D错误。
2.关于钠元素的单质及其化合物的叙述不正确的是( )
A.钠质软,熔点相对较低
B.大量的钠着火时可以用沙子扑灭,少量的钠应保存在煤油中
C.金属钠在空气中长期放置,最终变为碳酸钠
D.氧化钠和过氧化钠都是白色固体
D
解析 根据金属钠的物理性质可以判断钠质软,熔点相对较低,选项A正确;钠着火时可以用沙子灭火,不能用水或CO2灭火,在实验室中少量的钠保存在煤油中,以隔绝空气,选项B正确;钠在空气中长时间放置时,发生Na→Na2O→NaOH→Na2CO3等一系列变化,最终生成Na2CO3,选项C正确;Na2O是白色固体,而Na2O2是淡黄色固体,选项D不正确。
3.(2021·兰州高一检测)下列反应中,水既不做氧化剂又不做还原剂的氧化还原反应是( )
A.钠与水反应
B.氧化钠与水反应
C.过氧化钠与水反应
D.二氧化碳与水反应
C
解析 A项反应中,Na元素失去电子做还原剂,水中H元素得到电子做氧化剂,A错误;B项反应中,各元素化合价没有发生变化,故该反应不是氧化还原反应,B错误;C项反应中,过氧化钠中的一个O得到电子生成氢氧化钠做氧化剂,另一个O失去电子生成氧气做还原剂,故在反应中水既不做氧化剂又不做还原剂,C正确;D项反应中,各元素化合价没有发生变化,故该反应不是氧化还原反应,D错误。
4.下列叙述中正确的是( )
A.过氧化钠是淡黄色固体,久置于空气中变成白色氢氧化钠固体
B.氧化钠和过氧化钠都是碱性氧化物
C.用过氧化钠漂白织物、麦秆等日久又逐渐变成黄色
D.相同温度下,含Na元素质量相同的Na2O与Na2O2和相同体积的水完全反应,形成的溶液质量分数相同
D
解析 过氧化钠久置于空气中变成白色碳酸钠固体,A错误;氧化钠是碱性氧化物,过氧化钠不属于碱性氧化物,B错误;过氧化钠漂白是由于它的氧化性将有色物质永久漂白,C错误;根据发生反应的方程式:Na2O+H2O===2NaOH,2Na2O2+2H2O===4NaOH+O2↑,可知,含Na元素质量相同的Na2O与Na2O2与水反应溶液增加的质量相同,生成的NaOH的量也相同,形成的溶液质量分数必定相同,D正确。
5.Na2O2能与CO2反应生成氧气,在潜水艇中用作制氧剂。某学生以足量的大理石、足量的盐酸和Na2O2样品为原料,验证Na2O2能与CO2反应生成O2,设计出如下实验装置:
(1)装置B中发生反应的离子方程式是_______________________________。
(2)装置D中反应的化学方程式是________________________________。
(3)若E中的石灰水出现轻微白色浑浊,原因可能是
___________________________________________________________。
(4)如何验证Na2O2能与CO2反应生成O2:____________________________。
1.关于钠的叙述中,正确的是( )
A.钠的硬度很大
B.将金属钠放在坩埚里用酒精灯加热,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体氧化钠
C.金属钠在空气中燃烧,生成过氧化钠
D.金属钠的熔点很高
解析 钠是一种硬度小、熔点低的银白色金属,块状钠燃烧时会熔化成闪亮的小球,燃烧火焰为黄色,生成物是过氧化钠。
C
2.下列有关钠的存在、保存及取用方法的描述正确的是( )
A.钠在自然界中主要以化合态形式存在,少量以游离态形式存在
B.钠需要密封保存在四氯化碳中
C.实验室中可直接用药匙取用钠
D.实验室中取用后剩余的钠要放回原试剂瓶中
解析 钠在自然界中只能以化合态形式存在,A项错误;四氯化碳的密度比钠大,不能用来保存钠,B项错误;实验室中用镊子和小刀取用钠,C项错误;取用后剩余的钠必须放回原试剂瓶中,D项正确。
D
3.在坩埚中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法中不正确的是( )
A.上述反应是置换反应
B.上述反应放出热量
C.上述反应中无水CuSO4表现了还原性
D.加热且无水条件下,Na可以与CuSO4反应并生成Cu
解析 反应中CuSO4被还原为Cu,无水CuSO4表现的是氧化性。
C
4.(2021·淄博高一检测)钠露置在空气中,其变质过程中不可能产生的物质是( )
A.Na2O B.NaOH
C.NaHCO3 D.Na2CO3
解析 钠露置在空气中的变化过程为Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3,不可能会有NaHCO3生成。
C
5.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
解析 紫色石蕊溶液中加入过量Na2O2粉末,首先会与水反应生成NaOH和O2,生成的NaOH使紫色石蕊溶液变蓝色;由于反应过程中会生成过氧化氢,H2O2具有强氧化性会慢慢将有机色素氧化为无色物质,所以最后溶液变为无色。
B
6.等质量的两块钠,第一块在足量氧气中加热,第二块在氧气中(常温下)充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的生成物质量最大
D.两块钠的生成物质量一样大
解析 等质量的两块钠与足量的氧气反应,不论生成Na2O或Na2O2,两块钠失去的电子一样多;等质量的两块钠与足量氧气反应,生成含Na+数目相同的Na2O和Na2O2,生成Na2O2的质量大于Na2O的质量。
B
7.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗―→“出汗”―→变成白色固体(粉末),下列有关叙述中正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的H2O在表面形成了溶液
C.最后变成碳酸钠晶体
D.该过程中的所有化学反应均为氧化还原反应
B
解析 钠露置在空气中表面迅速变暗,是因为Na与O2反应生成了Na2O,A项错误;Na2O与水反应生成NaOH,NaOH又吸收空气中的H2O和CO2,生成Na2CO3·10H2O,Na2CO3·10H2O逐渐风化脱水,最后变成Na2CO3粉末,B正确,C错误;该过程中只有钠的氧化是氧化还原反应,D项错误。
8.将一小块金属钠投入滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生 ③反应后溶液变红色
④钠熔化成光亮的小球
⑤小球在水面上迅速游动 ⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤ C.②④⑤⑥ D.③④⑥
解析 钠投入水中,不是沉入水底,而是浮在水面上;钠与水反应生成NaOH,溶液呈碱性,使紫色石蕊试液变蓝。
C
9.下列关于Na2O和Na2O2的说法不正确的是( )
A.Na2O2可作供氧剂
B.Na2O和Na2O2中阴、阳离子数目之比均为1∶2
C.在Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂
D.Na2O2和Na2O均为碱性氧化物
D
10.下列关于钠及其化合物的叙述正确的是( )
A.Na2O和Na2O2都能与CO2反应,且产物相同
B.用钠与空气反应制纯净的Na2O2,空气必须经过固体NaOH处理后,才能与钠反应
C.Na、Na2O、Na2O2都具有强还原性
D.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
B
解析 Na2O与CO2反应生成Na2CO3,而Na2O2与CO2反应除生成Na2CO3,还有O2生成,A不正确。用Na与空气反应制Na2O2,空气中的CO2和水可与生成的Na2O2反应引入杂质,所以空气必须经NaOH处理,故B正确。钠原子最外层只有一个电子,容易失去最外层电子形成钠离子,表现强还原性,而钠离子具有稳定的电子层结构,不具有还原性,只具有弱氧化性,故Na2O、Na2O2不具有强还原性,C不正确。D项反应中,氧化剂和还原剂均为Na2O2,故D不正确。
11.某银白色固体A在空气中点燃,并生成淡黄色固体B,将A在空气中露置,最后变成白色固体C。将A、B投入水中都生成D;B与D都能与二氧化碳反应。则:
(1)A是________;B是________;C是________;D是________。
(2)B与H2O反应的化学方程式为____________________________________。
(3)B与CO2反应的化学方程式为___________________________________。
(4)A与H2O反应的化学方程式为___________________________________。
答案 (1)Na Na2O2 Na2CO3 NaOH (2)2Na2O2+2H2O===4NaOH+O2↑
(3)2Na2O2+2CO2===2Na2CO3+O2 (4)2Na+2H2O===2NaOH+H2↑
解析 银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B,可知A为钠、B为过氧化钠;钠在空气中露置,经过Na―→Na2O―→NaOH―→Na2CO3,最后变成白色固体C,则C为Na2CO3,钠、过氧化钠与水反应都生成NaOH,D为NaOH;过氧化钠与水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O===4NaOH+O2↑;过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2+2CO2===2Na2CO3+O2;钠与水反应生成氢氧化钠和氢气,方程式为2Na+2H2O===2NaOH+H2↑。
(1)保存金属钠的正确方法是________。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式_____________________________________,
生成物的颜色为________。
D
淡黄色
(3)Na、NaOH久置空气中最终都是变为________(填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为
___________________________________________________________。
解析 (3)Na、NaOH久置空气中最终都是变为碳酸钠,化学式为Na2CO3。(4)将一小块金属钠投入CuCl2溶液中,首先钠与水反应生成氢氧化钠和氢气,然后氢氧化钠与氯化铜发生复分解反应,发生反应的方程式为2Na+CuCl2+2H2O===Cu(OH)2↓+H2↑+2NaCl。
Na2CO3
2Na+CuCl2+2H2O===Cu(OH)2↓+H2↑+2NaCl
13.在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.9∶4 B.1∶1
C.7∶6 D.6∶7
D
解析 由反应2Na2O2+2CO2===2Na2CO3+O2,可知混合物在常温下跟足量的Na2O2固体反应,生成的固体为Na2CO3固体,78 g Na2O2生成106 g Na2CO3,质量增加28 g,恰好为CO的质量,固体增重14 g,说明原混合气体中CO为14 g,则O2为26 g-14 g=12 g,所以原混合气体中O2和CO的质量比为12 g∶14 g=6∶7,D项正确。
14.(2021·邯郸高一检测)向Na2O2与H2O反应后所得溶液中滴加酚酞溶液,酚酞先变红后褪色。某小组欲探究其原因,进行如图所示实验:①取反应后的溶液加入MnO2后迅速产生大量气体且该气体能使带火星的木条复燃;实验②③中红色均不褪去。下列分析错误的是( )
A.Na2O2与H2O反应产生的气体为O2
B.Na2O2与H2O反应不需要催化剂
C.实验②③证明使酚酞褪色的是NaOH
和O2
D.Na2O2与H2O反应可能生成了具有强氧化性的H2O2
C
解析 Na2O2与H2O反应产生的气体为O2,A项正确;Na2O2与H2O反应不需要催化剂,双氧水分解需要MnO2作催化剂,B项正确;实验②③作为对照实验,能证明使酚酞褪色的不是NaOH和O2,C项错误;根据向反应后所得溶液中加入MnO2后迅速产生大量气体且该气体能使带火星的木条复燃,可判断Na2O2与H2O反应可能生成了具有强氧化性的H2O2,D项正确。
15.室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
①甲装置中盛放稀盐酸的仪器名称是__________,乙装置中应加入的试剂是饱和NaHCO3溶液,目的是_________________________________________。
②装置甲中反应的离子方程式为___________________________________。
分液漏斗
除去二氧化碳中的HCl气体
CaCO3+2H+===Ca2++H2O + CO2↑
解析 (1)①甲装置中盛放稀盐酸的仪器名称为:分液漏斗;乙中装的是饱和NaHCO3溶液,目的是除去二氧化碳中的HCl气体;②装置甲是实验室制备二氧化碳的发生装置,其反应的离子方程式为:CaCO3+2H+===Ca2++H2O + CO2↑;
(2)按照下面的装置图进行实验(夹持装置略)。
①先组装仪器,然后_________________________________________,
再用注射器1抽取100 mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是___________________________________________________________。
实验过程中,需缓慢推入CO2,其目的是__________________________,
反应的化学方程式为________________________________________。
检查装置的气密性
固体由淡黄色渐渐变为白色,注射器2中活塞向外移动
使CO2充分反应
2Na2O2+2CO2===2Na2CO3+ O2
解析 (2)①先组装仪器,然后检查装置的气密性,再用注射器1 抽取100 mL 纯净的CO2,将其连接在K1处,注射器2 的活塞推到底后连接在K2处,具支U 形管中装入足量的Na2O2粉末与玻璃珠;②二氧化碳与过氧化钠反应生成碳酸钠和氧气,则U形管中的过氧化钠淡黄色粉末逐渐变为白色,生成的氧气进入注射器2中,所以注射器2的活塞向外移动;实验过程中,需缓慢推入CO2,其目的是使反应进行得更充分,反应的化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。
Thanks!
本讲内容结束
第一节 钠及其化合物
第一课时 钠和钠的氧化物
第二章 海水中的重要元素——钠和氯
【课程标准要求】
1.结合真实情境中的应用实例或通过实验探究,了解钠及其氧化物的主要性质。
2.了解钠及其氧化物在生产、生活中的应用。
新知自主预习
课堂互动探究
目
录
CONTENTS
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、活泼的金属单质——钠
1.物理性质
钠是一种______色固体,具有金属光泽,硬度______ (可切割),密度比煤油____。
银白
较小
大
2.原子结构
钠原子的最外电子层上只有____个电子,在化学反应中易______电子,因此钠的化学性质很活泼,表现出很强的______性。
1
失去
还原
3.化学性质
(1)与氧气反应
①将新切开的金属钠置于空气中,其表面发生的变化是__________,反应的化学方程式是4Na+O2===2Na2O。
很快变暗
②将一块绿豆大小的钠块投入热坩埚中(如图)。
继续加热片刻,观察到的现象是:钠受热______后剧烈燃烧,火焰为____色,生成________固体。反应的化学方程式为
熔化
黄
淡黄色
(2)与水反应
①实验探究
实验操作 实验现象 结论或解释
钠____在水面上 钠的密度比水____
钠______成小球 钠的熔点____,反应放热
小球在水面上__________ 反应产生的______推动小球运动
钠表面发出“嘶嘶”声,逐渐变小,最后消失 钠与水______反应,产生气体
反应后溶液的颜色逐渐变____ 有______物质(__________)生成
浮
小
熔化
低
迅速游动
氢气
剧烈
红
碱性
氢氧化钠
②实验结论:
钠与水剧烈反应,生成NaOH和H2,反应的化学方程式为
_________________________________,反应中水作氧化剂,钠作________。
2Na+2H2O===2NaOH+H2↑
还原剂
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
(1)钠与氧气反应时,条件不同,产物也不同( )
(2)Na与H2O发生的是置换反应( )
(3)实验室钠着火时,不能用水灭火,而要用干沙土灭火( )
(4)钠的密度比水大( )
答案 (1)√ (2)√ (3)√ (4)×
二、氧化钠和过氧化钠
1.氧化钠的性质
氧化钠是一种白色固体物质。属于______氧化物,与水反应:
__________________________________。
碱性
Na2O+H2O===2NaOH
2.过氧化钠的性质
(1)实验探究
实验操作
实验现象 ①试管发烫,带火星的木条______;
②滴加酚酞后溶液先______,然后______
实验结论 Na2O2与水反应放出热量,生成______,中间产物具有漂白性
复燃
变红
褪色
O2
(2)写出下列反应的化学方程式:
①与H2O反应:
________________________________________________;
②与CO2反应:
________________________________________________。
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2CO2===2Na2CO3+O2
【微自测】
2.判断正误,正确的打“√”,错误的打“×”。
(1)Na2O和Na2O2均为白色固体,属碱性氧化物( )
(2)Na2O与Na2O2中氧元素的化合价不相同,钠元素的化合价相同( )
(3)将Na2O2投入滴有酚酞溶液的水中,溶液变成红色,产生大量气泡( )
(4)将Na2O投入盛有水(滴有酚酞溶液)的试管中,溶液变成红色,振荡试管后溶液褪色( )
答案 (1)× (2)√ (3)× (4)×
二、过氧化钠的性质
一、钠与酸、碱、盐溶液的反应
一、钠与酸、碱、盐溶液的反应
用如图所示装置进行钠与水、盐溶液反应的实验,并可收集、检验生成的气体,按图所示向U形管中添加煤油和水,待液体物质添加完毕后,关闭活塞A,向煤油中加入一小块钠,立即塞好胶塞,观察实验现象。
1.加入金属钠后,钠块所处的位置在图中的什么位置?反应一段时间后,U形管中的液面如何变化?其原因是什么?
提示 钠处于煤油和水的界面位置;由于钠与水反应有大量气体产生,故U形管中右管液面下降,左管液体上升进入漏斗中。
2.如何通过实验证明钠与水反应产生的气体是H2?写出钠与水反应的离子方程式,并指出反应的氧化剂和还原剂。
提示 反应结束后,打开活塞A,用小试管收集一试管气体,拇指堵住管口,倾斜着靠近酒精灯的火焰,移开拇指,若产生爆鸣声,则证明产生的气体是H2。2Na+2H2O===2Na++2OH-+H2↑,其中Na是还原剂,H2O是氧化剂。
3.将装置中的水换成稀盐酸或CuSO4溶液与钠与水的反应相比现象有什么不同?
提示 钠与稀盐酸反应更剧烈。钠与CuSO4溶液反应生成气体和蓝色沉淀。
1.钠与酸、碱、盐溶液的反应
(1)反应实质:钠与任何水溶液(如酸、碱、盐的水溶液)反应时,实质是钠与溶液中的H+反应,产生H2。
(2)具体反应
反应类型 反应分析
与酸溶 液反应 把钠投入酸溶液中时,钠先与酸电离产生的H+反应,当酸反应完后,再与水反应,即“先酸后水”。如钠与盐酸的反应依次为2Na+2HCl===2NaCl+H2↑、2Na+2H2O===2NaOH+H2↑。钠与酸溶液的反应比钠与水的反应更剧烈
与碱溶液反应 钠与碱溶液反应的实质是钠与水的反应
与盐溶 液反应 当钠加到盐的水溶液中时,首先是钠与水反应,如果生成的NaOH能够和盐反应,则反应继续进行,即“先水后盐”。如Na与CuSO4溶液、FeCl3溶液的反应。如果把钠投入NaCl溶液或K2SO4溶液中,则只发生钠和水的反应
2.反应现象总结
(1)共性。因为钠与不同的水溶液均能发生剧烈的反应,故有共同的现象产生。
①浮:钠浮在液面上;
②熔:钠熔化成光亮的小球;
③游:钠在液面上不停地游动直至反应完全;
④响:反应中发出“嘶嘶”的响声。
(2)差异性。钠与酸溶液反应比与水反应剧烈,导致钠可能在液面上燃烧;与盐溶液反应时,还可能会生成沉淀(如难溶性碱)、有刺激性气味的气体(如NH3)等。
1.钠的下列性质中与钠和水反应时的现象无关的是( )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
解析 钠浮在水面上是其密度比水小;钠熔化是其熔点很低,与水反应放出的热量让其熔化;钠与水反应比较剧烈是其还原性很强;硬度大小与反应现象无关。
C
2.将一块金属钠投入足量的下列溶液中,既能生成气体,又能生成白色沉淀的是( )
A.稀硫酸 B.Ba(OH)2稀溶液
C.MgCl2溶液 D.CuSO4溶液
解析 Na投入稀硫酸、Ba(OH)2稀溶液中,只有气体产生;Na投入MgCl2溶液中,发生反应:2Na+2H2O===2NaOH+H2↑,MgCl2+2NaOH===Mg(OH)2↓+2NaCl,Mg(OH)2为白色沉淀;Na投入CuSO4溶液中,发生反应:2Na+2H2O===2NaOH+H2↑,CuSO4+2NaOH===Cu(OH)2↓+Na2SO4,Cu(OH)2为蓝色沉淀。
C
3.向一烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入绿豆粒大小的金属钠,可能观察到的现象与图中相符的是( )
解析 钠与煤油不反应,由密度ρ水>ρNa>ρ煤油可知A项正确。
A
二、过氧化钠的性质
1.氧化钠与过氧化钠的比较
氧化钠(Na2O) 过氧化钠(Na2O2)
颜色状态 白色固体 淡黄色固体
类别 碱性氧化物 过氧化物,不属于碱性氧化物
氧元素化合价 -2 -1
生成条件 在空气中缓慢氧化 燃烧Na或加热Na2O
稳定性 Na2O2>Na2O 2.Na2O2与H2O、CO2反应的特点
(1)电子转移特点
Na2O2与水、CO2的反应中,Na2O2既作氧化剂又作还原剂,二者比例为1∶1,切记H2O不是还原剂。反应中每产生1个O2分子转移2个电子,或Na2O2与转移电子数目比为1∶1。
(2)分子个数特点
无论是CO2、H2O还是二者的混合物,通过足量Na2O2时CO2或H2O与放出O2的分子个数比均为2∶1。
(1)Na2O2与H2O反应原理
Na2O2与水的反应实质上可以分成两个过程:
①Na2O2+2H2O===2NaOH+H2O2
②2H2O2===2H2O+O2↑
①×2+②得:2Na2O2+2H2O===4NaOH+O2↑。
(2)Na2O2是一种强氧化剂,具有漂白性,能使某些有色物质褪色。
4.把Na2O2投入下列各物质的稀溶液中,充分反应后可能有浑浊产生的是( )
A.HCl B.NaOH C.Na2CO3 D.CuSO4
解析 A项,过氧化钠与盐酸反应生成氯化钠和水,不产生沉淀,不符合题意;过氧化钠投入碱、盐溶液,首先过氧化钠与水反应生成氢氧化钠和氧气,然后氢氧化钠再与各溶液中的溶质发生反应, B、C项氢氧化钠与溶液中溶质不反应,D项产生氢氧化铜沉淀。
D
5.下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
C
解析 Na2O2与酸反应时除了生成盐和水外,还生成了O2,故Na2O2不属于碱性氧化物,故A项错;Na2O2是淡黄色固体,故B项错;Na2O2与CO2和H2O反应时,是Na2O2中的氧元素之间发生了氧化还原反应,CO2、H2O既不是氧化剂又不是还原剂,Na2O2既作氧化剂又作还原剂,故C项正确; Na2O与水反应中无氧气产生,不能作供氧剂,D项错误。
6.(2021·龙岩高一检测)如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
A.气球a变大
B.试管b内有气泡冒出
C.U形管内红色褪去
D.U形管水位d高于c
C
解析 反应生成氧气,则气球a变大,故A正确;反应生成气体,则试管b中有气泡冒出,故B正确;由于浅红色的水是在U形管中而非试管中,则U形管内的红水不褪色,故C错误;产生O2使气球膨胀,该反应放出大量热量,使锥形瓶中空气受热膨胀而出现U形管中水位d>c,故D正确。
1.下列关于钠的叙述正确的是( )
A.钠为银白色固体密度比水大
B.钠在空气中燃烧,生成淡黄色的过氧化钠
C.钠可保存在水中
D.钠与CuSO4溶液反应,可置换出单质铜
B
解析 钠的密度比水小,故A错误;钠与氧气在点燃条件下生成过氧化钠,过氧化钠为淡黄色,故B正确;钠能与水发生反应,则钠不能保存在水中,故C错误;钠与硫酸铜溶液反应时,钠先与水发生置换反应生成氢气和氢氧化钠,氢氧化钠再与硫酸铜发生复分解反应生成氢氧化铜沉淀,则钠不能从硫酸铜溶液中置换出铜单质,故D错误。
2.关于钠元素的单质及其化合物的叙述不正确的是( )
A.钠质软,熔点相对较低
B.大量的钠着火时可以用沙子扑灭,少量的钠应保存在煤油中
C.金属钠在空气中长期放置,最终变为碳酸钠
D.氧化钠和过氧化钠都是白色固体
D
解析 根据金属钠的物理性质可以判断钠质软,熔点相对较低,选项A正确;钠着火时可以用沙子灭火,不能用水或CO2灭火,在实验室中少量的钠保存在煤油中,以隔绝空气,选项B正确;钠在空气中长时间放置时,发生Na→Na2O→NaOH→Na2CO3等一系列变化,最终生成Na2CO3,选项C正确;Na2O是白色固体,而Na2O2是淡黄色固体,选项D不正确。
3.(2021·兰州高一检测)下列反应中,水既不做氧化剂又不做还原剂的氧化还原反应是( )
A.钠与水反应
B.氧化钠与水反应
C.过氧化钠与水反应
D.二氧化碳与水反应
C
解析 A项反应中,Na元素失去电子做还原剂,水中H元素得到电子做氧化剂,A错误;B项反应中,各元素化合价没有发生变化,故该反应不是氧化还原反应,B错误;C项反应中,过氧化钠中的一个O得到电子生成氢氧化钠做氧化剂,另一个O失去电子生成氧气做还原剂,故在反应中水既不做氧化剂又不做还原剂,C正确;D项反应中,各元素化合价没有发生变化,故该反应不是氧化还原反应,D错误。
4.下列叙述中正确的是( )
A.过氧化钠是淡黄色固体,久置于空气中变成白色氢氧化钠固体
B.氧化钠和过氧化钠都是碱性氧化物
C.用过氧化钠漂白织物、麦秆等日久又逐渐变成黄色
D.相同温度下,含Na元素质量相同的Na2O与Na2O2和相同体积的水完全反应,形成的溶液质量分数相同
D
解析 过氧化钠久置于空气中变成白色碳酸钠固体,A错误;氧化钠是碱性氧化物,过氧化钠不属于碱性氧化物,B错误;过氧化钠漂白是由于它的氧化性将有色物质永久漂白,C错误;根据发生反应的方程式:Na2O+H2O===2NaOH,2Na2O2+2H2O===4NaOH+O2↑,可知,含Na元素质量相同的Na2O与Na2O2与水反应溶液增加的质量相同,生成的NaOH的量也相同,形成的溶液质量分数必定相同,D正确。
5.Na2O2能与CO2反应生成氧气,在潜水艇中用作制氧剂。某学生以足量的大理石、足量的盐酸和Na2O2样品为原料,验证Na2O2能与CO2反应生成O2,设计出如下实验装置:
(1)装置B中发生反应的离子方程式是_______________________________。
(2)装置D中反应的化学方程式是________________________________。
(3)若E中的石灰水出现轻微白色浑浊,原因可能是
___________________________________________________________。
(4)如何验证Na2O2能与CO2反应生成O2:____________________________。
1.关于钠的叙述中,正确的是( )
A.钠的硬度很大
B.将金属钠放在坩埚里用酒精灯加热,金属钠剧烈燃烧,产生黄色火焰,生成淡黄色固体氧化钠
C.金属钠在空气中燃烧,生成过氧化钠
D.金属钠的熔点很高
解析 钠是一种硬度小、熔点低的银白色金属,块状钠燃烧时会熔化成闪亮的小球,燃烧火焰为黄色,生成物是过氧化钠。
C
2.下列有关钠的存在、保存及取用方法的描述正确的是( )
A.钠在自然界中主要以化合态形式存在,少量以游离态形式存在
B.钠需要密封保存在四氯化碳中
C.实验室中可直接用药匙取用钠
D.实验室中取用后剩余的钠要放回原试剂瓶中
解析 钠在自然界中只能以化合态形式存在,A项错误;四氯化碳的密度比钠大,不能用来保存钠,B项错误;实验室中用镊子和小刀取用钠,C项错误;取用后剩余的钠必须放回原试剂瓶中,D项正确。
D
3.在坩埚中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法中不正确的是( )
A.上述反应是置换反应
B.上述反应放出热量
C.上述反应中无水CuSO4表现了还原性
D.加热且无水条件下,Na可以与CuSO4反应并生成Cu
解析 反应中CuSO4被还原为Cu,无水CuSO4表现的是氧化性。
C
4.(2021·淄博高一检测)钠露置在空气中,其变质过程中不可能产生的物质是( )
A.Na2O B.NaOH
C.NaHCO3 D.Na2CO3
解析 钠露置在空气中的变化过程为Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3,不可能会有NaHCO3生成。
C
5.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
解析 紫色石蕊溶液中加入过量Na2O2粉末,首先会与水反应生成NaOH和O2,生成的NaOH使紫色石蕊溶液变蓝色;由于反应过程中会生成过氧化氢,H2O2具有强氧化性会慢慢将有机色素氧化为无色物质,所以最后溶液变为无色。
B
6.等质量的两块钠,第一块在足量氧气中加热,第二块在氧气中(常温下)充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的生成物质量最大
D.两块钠的生成物质量一样大
解析 等质量的两块钠与足量的氧气反应,不论生成Na2O或Na2O2,两块钠失去的电子一样多;等质量的两块钠与足量氧气反应,生成含Na+数目相同的Na2O和Na2O2,生成Na2O2的质量大于Na2O的质量。
B
7.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗―→“出汗”―→变成白色固体(粉末),下列有关叙述中正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的H2O在表面形成了溶液
C.最后变成碳酸钠晶体
D.该过程中的所有化学反应均为氧化还原反应
B
解析 钠露置在空气中表面迅速变暗,是因为Na与O2反应生成了Na2O,A项错误;Na2O与水反应生成NaOH,NaOH又吸收空气中的H2O和CO2,生成Na2CO3·10H2O,Na2CO3·10H2O逐渐风化脱水,最后变成Na2CO3粉末,B正确,C错误;该过程中只有钠的氧化是氧化还原反应,D项错误。
8.将一小块金属钠投入滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生 ③反应后溶液变红色
④钠熔化成光亮的小球
⑤小球在水面上迅速游动 ⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤ C.②④⑤⑥ D.③④⑥
解析 钠投入水中,不是沉入水底,而是浮在水面上;钠与水反应生成NaOH,溶液呈碱性,使紫色石蕊试液变蓝。
C
9.下列关于Na2O和Na2O2的说法不正确的是( )
A.Na2O2可作供氧剂
B.Na2O和Na2O2中阴、阳离子数目之比均为1∶2
C.在Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂
D.Na2O2和Na2O均为碱性氧化物
D
10.下列关于钠及其化合物的叙述正确的是( )
A.Na2O和Na2O2都能与CO2反应,且产物相同
B.用钠与空气反应制纯净的Na2O2,空气必须经过固体NaOH处理后,才能与钠反应
C.Na、Na2O、Na2O2都具有强还原性
D.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
B
解析 Na2O与CO2反应生成Na2CO3,而Na2O2与CO2反应除生成Na2CO3,还有O2生成,A不正确。用Na与空气反应制Na2O2,空气中的CO2和水可与生成的Na2O2反应引入杂质,所以空气必须经NaOH处理,故B正确。钠原子最外层只有一个电子,容易失去最外层电子形成钠离子,表现强还原性,而钠离子具有稳定的电子层结构,不具有还原性,只具有弱氧化性,故Na2O、Na2O2不具有强还原性,C不正确。D项反应中,氧化剂和还原剂均为Na2O2,故D不正确。
11.某银白色固体A在空气中点燃,并生成淡黄色固体B,将A在空气中露置,最后变成白色固体C。将A、B投入水中都生成D;B与D都能与二氧化碳反应。则:
(1)A是________;B是________;C是________;D是________。
(2)B与H2O反应的化学方程式为____________________________________。
(3)B与CO2反应的化学方程式为___________________________________。
(4)A与H2O反应的化学方程式为___________________________________。
答案 (1)Na Na2O2 Na2CO3 NaOH (2)2Na2O2+2H2O===4NaOH+O2↑
(3)2Na2O2+2CO2===2Na2CO3+O2 (4)2Na+2H2O===2NaOH+H2↑
解析 银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B,可知A为钠、B为过氧化钠;钠在空气中露置,经过Na―→Na2O―→NaOH―→Na2CO3,最后变成白色固体C,则C为Na2CO3,钠、过氧化钠与水反应都生成NaOH,D为NaOH;过氧化钠与水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O===4NaOH+O2↑;过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2+2CO2===2Na2CO3+O2;钠与水反应生成氢氧化钠和氢气,方程式为2Na+2H2O===2NaOH+H2↑。
(1)保存金属钠的正确方法是________。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式_____________________________________,
生成物的颜色为________。
D
淡黄色
(3)Na、NaOH久置空气中最终都是变为________(填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为
___________________________________________________________。
解析 (3)Na、NaOH久置空气中最终都是变为碳酸钠,化学式为Na2CO3。(4)将一小块金属钠投入CuCl2溶液中,首先钠与水反应生成氢氧化钠和氢气,然后氢氧化钠与氯化铜发生复分解反应,发生反应的方程式为2Na+CuCl2+2H2O===Cu(OH)2↓+H2↑+2NaCl。
Na2CO3
2Na+CuCl2+2H2O===Cu(OH)2↓+H2↑+2NaCl
13.在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.9∶4 B.1∶1
C.7∶6 D.6∶7
D
解析 由反应2Na2O2+2CO2===2Na2CO3+O2,可知混合物在常温下跟足量的Na2O2固体反应,生成的固体为Na2CO3固体,78 g Na2O2生成106 g Na2CO3,质量增加28 g,恰好为CO的质量,固体增重14 g,说明原混合气体中CO为14 g,则O2为26 g-14 g=12 g,所以原混合气体中O2和CO的质量比为12 g∶14 g=6∶7,D项正确。
14.(2021·邯郸高一检测)向Na2O2与H2O反应后所得溶液中滴加酚酞溶液,酚酞先变红后褪色。某小组欲探究其原因,进行如图所示实验:①取反应后的溶液加入MnO2后迅速产生大量气体且该气体能使带火星的木条复燃;实验②③中红色均不褪去。下列分析错误的是( )
A.Na2O2与H2O反应产生的气体为O2
B.Na2O2与H2O反应不需要催化剂
C.实验②③证明使酚酞褪色的是NaOH
和O2
D.Na2O2与H2O反应可能生成了具有强氧化性的H2O2
C
解析 Na2O2与H2O反应产生的气体为O2,A项正确;Na2O2与H2O反应不需要催化剂,双氧水分解需要MnO2作催化剂,B项正确;实验②③作为对照实验,能证明使酚酞褪色的不是NaOH和O2,C项错误;根据向反应后所得溶液中加入MnO2后迅速产生大量气体且该气体能使带火星的木条复燃,可判断Na2O2与H2O反应可能生成了具有强氧化性的H2O2,D项正确。
15.室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
①甲装置中盛放稀盐酸的仪器名称是__________,乙装置中应加入的试剂是饱和NaHCO3溶液,目的是_________________________________________。
②装置甲中反应的离子方程式为___________________________________。
分液漏斗
除去二氧化碳中的HCl气体
CaCO3+2H+===Ca2++H2O + CO2↑
解析 (1)①甲装置中盛放稀盐酸的仪器名称为:分液漏斗;乙中装的是饱和NaHCO3溶液,目的是除去二氧化碳中的HCl气体;②装置甲是实验室制备二氧化碳的发生装置,其反应的离子方程式为:CaCO3+2H+===Ca2++H2O + CO2↑;
(2)按照下面的装置图进行实验(夹持装置略)。
①先组装仪器,然后_________________________________________,
再用注射器1抽取100 mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是___________________________________________________________。
实验过程中,需缓慢推入CO2,其目的是__________________________,
反应的化学方程式为________________________________________。
检查装置的气密性
固体由淡黄色渐渐变为白色,注射器2中活塞向外移动
使CO2充分反应
2Na2O2+2CO2===2Na2CO3+ O2
解析 (2)①先组装仪器,然后检查装置的气密性,再用注射器1 抽取100 mL 纯净的CO2,将其连接在K1处,注射器2 的活塞推到底后连接在K2处,具支U 形管中装入足量的Na2O2粉末与玻璃珠;②二氧化碳与过氧化钠反应生成碳酸钠和氧气,则U形管中的过氧化钠淡黄色粉末逐渐变为白色,生成的氧气进入注射器2中,所以注射器2的活塞向外移动;实验过程中,需缓慢推入CO2,其目的是使反应进行得更充分,反应的化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。
Thanks!
本讲内容结束
