第二章 第一节 钠及其化合物 第二课时 碳酸钠和碳酸氢钠 焰色试验(共95张ppt)
文档属性
| 名称 | 第二章 第一节 钠及其化合物 第二课时 碳酸钠和碳酸氢钠 焰色试验(共95张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-02 21:38:00 | ||
图片预览








文档简介
(共95张PPT)
第二课时 碳酸钠和碳酸
第二章 海水中的重要元素——钠和氯
氢钠 焰色试验
【课程标准要求】
1.结合真实情境中应用实例或通过实验探究,了解碳酸钠和碳酸氢钠的主要性质。
2.了解碳酸钠和碳酸氢钠在生产、生活中的应用。
3.了解焰色试验及操作过程。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
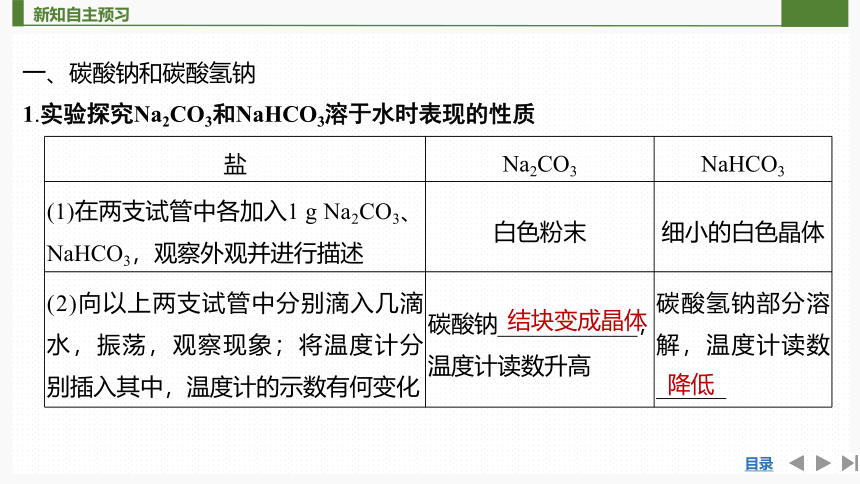
一、碳酸钠和碳酸氢钠
1.实验探究Na2CO3和NaHCO3溶于水时表现的性质
盐 Na2CO3 NaHCO3
(1)在两支试管中各加入1 g Na2CO3、NaHCO3,观察外观并进行描述 白色粉末 细小的白色晶体
(2)向以上两支试管中分别滴入几滴 水,振荡,观察现象;将温度计分 别插入其中,温度计的示数有何变化 碳酸钠____________,温度计读数升高 碳酸氢钠部分溶解,温度计读数______
结块变成晶体
降低
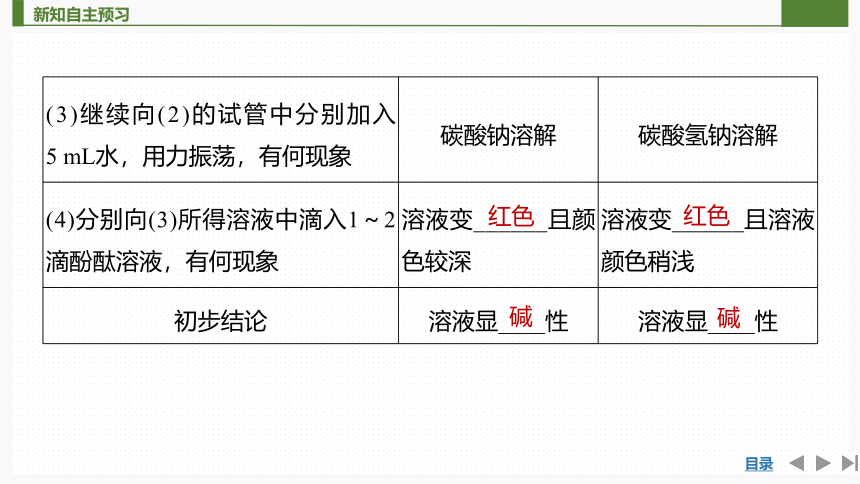
(3)继续向(2)的试管中分别加入 5 mL水,用力振荡,有何现象 碳酸钠溶解 碳酸氢钠溶解
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象 溶液变______且颜色较深 溶液变______且溶液颜色稍浅
初步结论 溶液显____性 溶液显____性
红色
红色
碱
碱
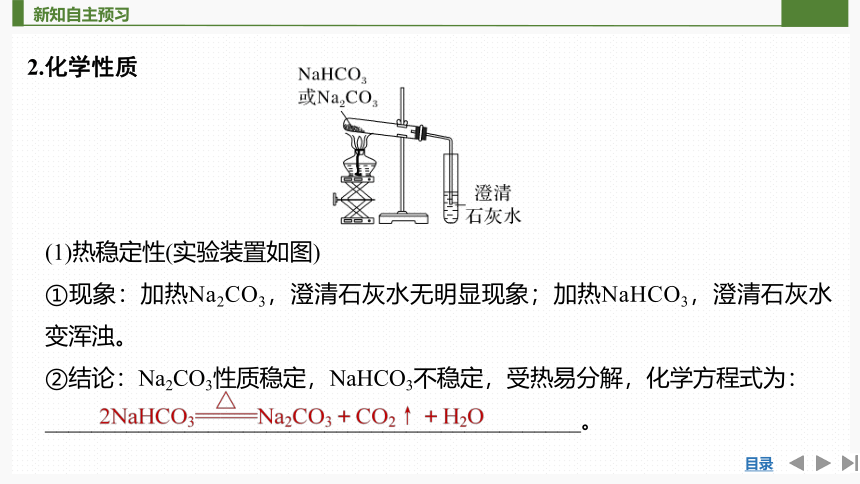
2.化学性质
(1)热稳定性(实验装置如图)
①现象:加热Na2CO3,澄清石灰水无明显现象;加热NaHCO3,澄清石灰水变浑浊。
②结论:Na2CO3性质稳定,NaHCO3不稳定,受热易分解,化学方程式为:
______________________________________________。
(2)与酸(足量盐酸)反应(写出相应的离子方程式):
①Na2CO3:____________________________________。
②NaHCO3:____________________________________。
(3)与碱(氢氧化钠溶液)反应:
①Na2CO3与NaOH不反应。
②NaHCO3(写离子方程式):__________________________________。
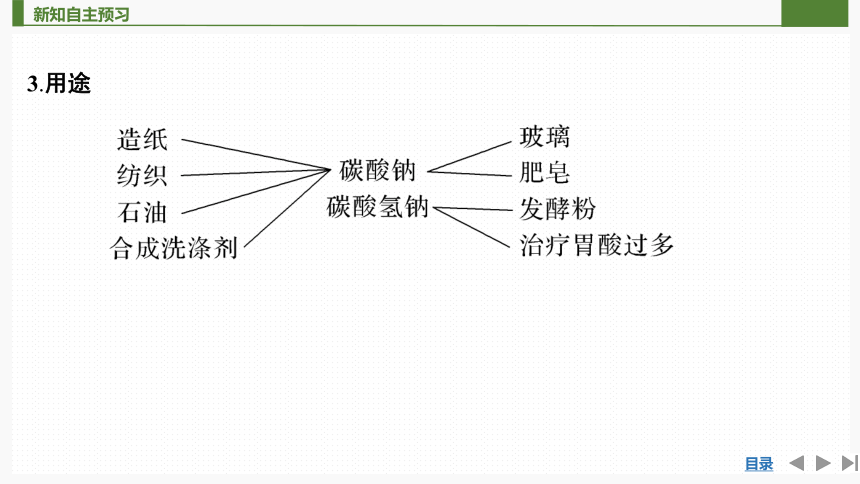
3.用途
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
答案 (1)× (2)× (3)√ (4)×
二、焰色试验
1.含义
根据火焰呈现的特征颜色,可以判断试样所含的______元素,化学上把这样的定性分析操作称为焰色试验。
金属
2.操作
(1)将______ (或光洁无锈的铁丝)用______洗净后,放在酒精灯外焰上灼烧至与原来的火焰颜色相同为止。
(2)蘸取试样在酒精灯外焰上灼烧,观察火焰的颜色;观察钾的焰色时要透过蓝色钴玻璃来观察,其目的是:______________,避免其中的钠盐造成干扰。
(3)用盐酸洗净铂丝,并在外焰上灼烧至与原来的火焰颜色相同,再检验下一个试样。
铂丝
盐酸
滤去黄色的光
3.常见金属的焰色
钠:____色;钾:____色(透过蓝色钴玻璃观察);
铜:____色;钡:______色;钙:______色。
黄
紫
绿
黄绿
砖红
【微自测】
2.下列描述中,正确的打“√”,错误的打“×”。
(1)焰色试验的铂丝可用稀硫酸洗( )
(2)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液( )
(3)若某无色溶液的焰色试验观察到焰色为黄色,说明该溶液只含Na+,无K+( )
(4)焰色试验是金属元素的化学性质( )
答案 (1)× (2)√ (3)× (4)×
二、碳酸钠和碳酸氢钠的鉴别与除杂
一、碳酸钠和碳酸氢钠性质的差别
一、碳酸钠和碳酸氢钠性质的差别
[实验Ⅰ]
分别向溶质质量分数相等的Na2CO3和NaHCO3溶液中滴加稀盐酸
1.分析产生上述相同现象的原因是什么?写出相关反应的离子方程式。
[实验Ⅱ]
分别向溶质的质量分数相等的Na2CO3和NaHCO3溶液中滴加澄清石灰水。
2.分析产生上述相同现象的原因是什么?写出相关反应的离子方程式。
[实验Ⅲ]
分别向溶质质量分数相等的Na2CO3和NaHCO3稀溶液中滴加BaCl2稀溶液。
3.分析产生上述不同现象的原因是什么?写出相关反应的离子方程式。
碳酸钠和碳酸氢钠性质的比较
与盐酸 反应 Na2CO3+2HCl===2NaCl+CO2↑+H2O 若逐滴滴加盐酸,反应先后顺序为:Na2CO3+HCl===NaCl+NaHCO3 NaHCO3+HCl===NaCl+CO2↑+H2O NaHCO3+HCl===NaCl+CO2↑+H2O
NaHCO3与盐酸的反应比Na2CO3与盐酸的反应剧烈
与NaOH 溶液反应 不反应 NaHCO3+NaOH===
Na2CO3+H2O
与Ca(OH)2 溶液反应 产生白色沉淀 Na2CO3+Ca(OH)2 ===CaCO3↓+2NaOH 产生白色沉淀
2NaHCO3+Ca(OH)2===
CaCO3↓+Na2CO3+2H2O
与CaCl2、BaCl2或Ba(NO3)2等稀溶液反应 产生白色沉淀 Na2CO3+CaCl2=== CaCO3↓+2NaCl 不反应
1.下列有关Na2CO3与NaHCO3的性质比较中不正确的是( )
A.相同溶质质量分数两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同溶质质量分数的稀硫酸反应放出气泡的速率:NaHCO3D.热稳定性:NaHCO3C
解析 根据相同溶质质量分数的Na2CO3和NaHCO3溶液中,滴加酚酞溶液后的颜色变化,可得出结论:相同溶质质量分数的Na2CO3和NaHCO3溶液,Na2CO3溶液的碱性较强,A项正确;常温下,Na2CO3的溶解度大于NaHCO3的溶解度,B项正确;Na2CO3与稀H2SO4反应需要2步结合H+才能放出CO2,而NaHCO3与稀H2SO4反应只需要1步结合H+就能放出CO2,所以Na2CO3和NaHCO3与相同溶质质量分数的稀H2SO4反应,放出气泡的速率:NaHCO3>Na2CO3,C项错误;NaHCO3受热容易分解,Na2CO3受热不易分解,所以稳定性:Na2CO3>NaHCO3,D项正确。
2.膨松剂指食品加工中添加于生产焙烤食品的主要原料小麦粉中,使面坯起发,形成致密多孔组织,从而使制品具有膨松、柔软或酥脆的一类物质。为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,因为它①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子。其中合理的是( )
A.②③ B.①③ C.①④ D.③④
解析 从题意中面包松软可口,做膨松剂可得出热稳定性差,产生二氧化碳气体,故B正确。
B
二、碳酸钠和碳酸氢钠的鉴别与除杂
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。
某位同学的妈妈将盛放两种物品的瓶子弄混了,请同学帮助区分鉴别。
鉴别方案设计
同学们根据Na2CO3和NaHCO3性质的差异,提出了三个鉴别方案,请评价各个方案是否合理?
1.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
提示 否。纯碱受热不分解,小苏打受热分解生成碳酸钠,故两种样品都会有残留。
2.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打
提示 是。小苏打中的碳酸氢根与醋酸反应的速率较快。
3.分别取少量的两种样品于两只小玻璃杯中,加入少量澄清石灰水,能产生白色沉淀的是纯碱
提示 否。两种物质都可以与澄清石灰水发生反应生成沉淀。
1.Na2CO3、NaHCO3的鉴别
(1)利用热稳定性不同
①鉴别方法
②常用装置
(2)利用和酸反应生成气体的速率不同(相同条件下)
(3)利用与BaCl2或CaCl2溶液反应
(4)利用溶液的碱性强弱
2.Na2CO3与NaHCO3的提纯
混合物(括号内的为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
3.Na2CO3与NaHCO3的相互转化
1.鉴别Na2CO3和NaHCO3不能用Ba(OH)2[或Ca(OH)2]溶液,原因是二者均能与之反应生成沉淀。
2.互滴法是指当两种溶液反应时有两个不同的反应过程,且这两个过程的实验现象各不相同,则可以通过滴加顺序不同,利用产生的现象不同进行鉴别。如盐酸与Na2CO3溶液反应。
3.有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
C
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀者为Na2CO3
B 分别加入相同溶质质量分数的稀盐酸 反应较剧烈者为Na2CO3
C 分别加入CaCl2溶液 产生沉淀者为Na2CO3
D 逐滴加入相同溶质质量分数的盐酸 立即产生气泡者为Na2CO3
解析 A项,有关反应为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,Ca(OH)2+2NaHCO3===CaCO3↓+Na2CO3+2H2O。两者产生白色沉淀现象相同,A不正确;B项,滴加相同溶质质量分数的稀盐酸时,NaHCO3溶液反应更剧烈,B不正确;C项,Na2CO3与CaCl2反应生成CaCO3白色沉淀,NaHCO3与CaCl2不反应,C正确;D项,逐滴加入盐酸时,NaHCO3立即产生气泡,Na2CO3开始无明显现象,后有无色气体放出,D不正确。
4.下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
解析 溶于水滴加澄清石灰水时NaHCO3也会产生白色沉淀,所以只能滴加BaCl2或CaCl2溶液。
C
微专题4 纯碱的工业制备
1.索尔维制碱法(氨碱法)
(1)原料:食盐、氨、二氧化碳等。
(2)
(3)生产原理流程
(4)索尔维制碱法具有原料易获取,价格便宜,损失少,实现了连续性生产等优点。
2.侯氏(联合)制碱法
(1)原料:氨、氯化钠溶液、二氧化碳。
(2)
(3)生产原理流程
1.下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是Na2CO3·10H2O
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
C
2.侯氏制碱法是我国化学工程专家侯德榜于1943年独立发明,它打破了当时外国的技术封锁。某化学小组模拟侯氏制碱法,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl。然后再将NaHCO3制成Na2CO3。
(1)装置乙的作用是____________________________________________。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________、洗涤、灼烧。NaHCO3制取Na2CO3的化学方程式为
___________________________________________________________。
(3)已知NH3极易溶于水,生成氨水可以吸收CO2。侯氏制碱法制取NaHCO3时,应先通NH3,后通CO2,目的是_________________________________________。
1.下列有关焰色试验的叙述正确的是( )
A.可用铜丝代替铂丝进行试验
B.观察钾的焰色试验要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
解析 铜丝在灼烧时有颜色,不能用铜丝代替铂丝,A项错误;实验结束后,用盐酸洗净铂丝,C项错误;焰色试验是指金属元素在灼烧时火焰呈现特殊的颜色,不是化学性质,D项错误。
B
2.下列反应的离子方程式错误的是( )
B
解析 碳酸氢钠溶液与少量澄清石灰水反应生成碳酸钙沉淀、碳酸钠和水,碳酸氢钠溶液与过量澄清石灰水反应生成碳酸钙沉淀、氢氧化钠和水,与氢氧化钠溶液反应生成碳酸钠和水,故A正确、B错误;碳酸钠溶液与澄清石灰水反应生成碳酸钙沉淀和氢氧化钠,碳酸钠溶液与氯化钡溶液反应生成碳酸钡沉淀和氯化钠,故C、D正确。
3.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有同学为鉴别它们采用以下四种不同的方法,其中不可行的是( )
A.分别将它们配制成溶液,再加入澄清石灰水中
B.分别将它们配制成溶液,再逐滴加入相同溶质质量分数的稀盐酸
C.分别将它们配制成稀溶液,再分别加入CaCl2稀溶液
D.分别加热,再用澄清石灰水检验是否有CO2产生
解析 将Na2CO3溶液、NaHCO3溶液分别加入澄清石灰水中,均会产生白色沉淀,无法鉴别,A项不可行。
A
4.下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验装置(夹持装置省略)并分析实验原理,判断下列说法错误的是( )
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明物质受热能产生水,可在两支试管
内塞上沾有无水硫酸铜粉末的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
B
解析 用酒精灯加热时,外管温度高,内管温度低,NaHCO3受热易分解,Na2CO3受热不易分解,故将Na2CO3放在外管中,温度高却未分解,NaHCO3放在内管中,温度低却分解,证明Na2CO3热稳定性强于NaHCO3,NaHCO3受热分解产生CO2,可使澄清石灰水变浑浊。甲为小苏打(NaHCO3),乙为纯碱(Na2CO3),故A项正确,B项错误;NaHCO3分解产生的水可以使无水硫酸铜变蓝色,故C项正确;Na2CO3不会分解产生CO2,故不能使丙中澄清石灰水变浑浊,故D项正确。
5.Na2CO3和NaHCO3是重要的化工原料,请回答:
(1)两物质的水溶液分别与足量盐酸混合,反应的离子方程式分别为
_____________________________、_____________________________。
(2)除去NaHCO3溶液中少量Na2CO3的方法,写出化学方程式
___________________________________________________________。
(3)两物质的焰色试验分别为________色、________色。
(4)检验某盐中含有钾元素的方法是___________,具体操作为
___________________________________________________________
___________________________________________________________ 。
Na2CO3+CO2+H2O ===2NaHCO3
黄
黄
焰色试验
用洁净的铂丝蘸取样品,在无色火焰灼烧,透过蓝色钴玻璃观察,有紫色火焰则证明样品含有钾元素。
解析 (1)碳酸钠和碳酸氢钠与盐酸反应都生成二氧化碳、氯化钠和水,根据离子方程式的书写原则书写离子方程式;(2)碳酸钠溶液中通入二氧化碳反应生成碳酸氢钠;(3)钠元素的焰色试验的火焰为黄色;(4)利用焰色试验证明钾元素的存在。
1.进行焰色试验时,通常用来洗涤铂丝的是( )
A.硫酸 B.烧碱溶液
C.稀盐酸 D.蒸馏水
解析 清洗是为了洗去杂质氧化膜,用稀盐酸洗过之后通常都要在酒精灯火焰上灼烧,因为金属氯化物沸点低,容易气化,易挥发,所以杂质离子就一并挥发了。而硫酸是难挥发性酸,不能达到去除干扰的目的。故选C。
C
2.小明同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )
解析 钠元素的焰色试验为黄色,钾元素的焰色试验为紫色,观察钾元素的焰色试验时必须透过蓝色钴玻璃。根据题中现象只能确定有Na+,而不能确定K+的存在。
D
3.关于NaHCO3的性质,下列说法正确的是( )
A.热稳定性比Na2CO3强
B.相同温度下溶解度比Na2CO3要大
C.NaHCO3只能和酸作用不能和碱作用
D.和酸反应放出等质量的CO2所消耗的酸比Na2CO3少
D
4.下列实验方法能达到实验目的的是( )
A.加热可除去NaHCO3固体中少量的Na2CO3
B.用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液
C.用NaOH溶液鉴别BaCl2溶液和MgCl2溶液
D.用闻气味的方法鉴别CO2和CO
C
解析 NaHCO3固体受热易分解,Na2CO3受热不分解,故不能用加热的方法除去NaHCO3固体中少量的Na2CO3,故A错误;碳酸钠和碳酸氢钠均可与澄清石灰水反应生成白色沉淀,现象相同,不能鉴别,故B错误;MgCl2溶液与NaOH反应生成白色沉淀,BaCl2溶液与NaOH不反应,现象不同可鉴别,故C正确; CO2和CO都无味,CO还有毒,不能用闻气味的方法鉴别,故D错误。
5.焰色试验实验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧到火焰无色,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
C
解析 取一根铂丝,用盐酸洗净后,放在酒精灯上灼烧至无色,再蘸取被检验物质,进行焰色试验,故A正确;在观测钾的焰色试验时要透过蓝色钴玻璃片,滤去钠的黄光的干扰,故B正确;为了能够更加突出被检验试剂的颜色,选用本身颜色较浅的火焰,最大限度减少火焰本身颜色的干扰,故C错误;洁净的细铁丝,放在酒精灯上灼烧至无色,本身无颜色,故可用铁丝进行焰色试验,故D正确。
6.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
A.均为白色固体,均溶于水
B.均与足量盐酸反应产生CO2
C.受热均易分解
D.其水溶液均能使酚酞溶液变红
解析 Na2CO3和NaHCO3均为白色固体,是可溶性盐,均溶于水,故A正确;盐酸足量,Na2CO3和NaHCO3均与盐酸反应产生CO2,故B正确;碳酸氢钠受热易分解,碳酸钠受热不分解,故C错误;Na2CO3和NaHCO3水溶液都呈碱性,均能使酚酞溶液变红,故D正确。
C
7.除去Na2CO3固体中的NaHCO3,最合适的试剂或方法是( )
A.H2SO4 B.NaOH C.加热 D.通入CO2
解析 硫酸和碳酸钠、碳酸氢钠均可以反应,故A错误;若加入过量的氢氧化钠,会引入新的杂质,故B错误;加热可使碳酸氢钠分解,生成碳酸钠、水和二氧化碳,故C正确;通入二氧化碳,碳酸钠会反应生成碳酸氢钠,达不到除杂的效果,故D错误。
C
8.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a先通入CO2,然后b通入NH3,c中放碱石灰
B.a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b先通入NH3,然后a通入CO2,c中放碱石灰
D.b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
B
解析 “侯氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3,为防止倒吸,a管通NH3,b管通CO2;由于CO2在水中的溶解度较小,而NH3的溶解度较大,所以要先通NH3,再通CO2,否则CO2通入后会从水中逸出,等再通NH3时溶液中CO2的量就很少了,这样得到的产品也很少,氨气是碱性气体,可以用蘸稀硫酸的脱脂棉吸收,防止污染空气。
9.加热42 g NaHCO3和Na2CO3的固体混合物至没有气体放出时,剩余固体的质量是35.8 g。那么原固体混合物中Na2CO3的质量是( )
A.25.2 g B.16.8 g C.10.6 g D.24.8 g
A
10.以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是( )
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应等
B
11.(2021·榆林高一检测)有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
(1)W、X、Y、Z的化学式分别是:W________、X________、Y________、Z________。
(2)以上4个化学反应中,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个反应的化学方程式:
离子方程式:_____________________________________________。
化学方程式:_____________________________________________。
12.食盐(NaCl)、纯碱(Na2CO3)和小苏打(NaHCO3)是日常家庭厨房中常见用品。请回答下列问题:
(1)有关食盐(NaCl)、纯碱(Na2CO3)和小苏打(NaHCO3)的说法正确的是________(填字母)。
A.食盐属于盐、纯碱属于碱、小苏打属于酸
B.分别取三种物质做焰色试验,火焰颜色均呈现黄色
C.用三支小试管取适量三种物质加入少量水溶解,用手轻轻触摸试管,温度升高的是纯碱,温度明显降低的是小苏打
D.用三支试管取适量三种物质加入少量水溶解,滴加少量酚酞溶液,溶液变红的只有纯碱
BC
(2)用化学方法鉴别三种物质有很多种方法。
①用三支小试管取适量三种物质分别加热,有使澄清石灰水变浑浊的气体产生的是小苏打。写出小苏打加热分解的化学方程式
___________________________________________________________。
若所取小苏打的质量是8.4 g,充分加热后固体质量减少了________ g。
②用三支小试管取适量三种物质加水溶解配制成的溶液,加入少量NaOH溶液,均没有现象,但是有同学认为有一个试管中发生了化学反应,写出其离子方程式___________________________________________________。
3.1
13.在试管①中加入1 g Na2CO3,试管②中加入1 g NaHCO3进行如下实验,下列对①、②中的变化说法不正确的是( )
C
A 分别滴入少量水,触摸试管底部 ①变热 ②变凉
B 分别加10 mL水,滴入两滴酚酞 ①变红 ②变浅红 C 加热试管①和②中的固体,都可以放出使澄清石灰水变浑浊的气体 D 分别用铂丝蘸取少量①和②中的固体,进行焰色试验,火焰均为黄色 解析 碳酸钠溶于水放热,碳酸氢钠溶于水吸热,所以①变热,②变凉,A项正确;碳酸钠溶液的碱性强于碳酸氢钠溶液,B项正确;C项,碳酸钠稳定,受热不易分解,错误;D项,钠元素焰色呈黄色,所以①、②火焰均为黄色,正确。
14.现有两瓶失去标签的相同溶质质量分数的Na2CO3和NaHCO3无色溶液,请提出简便的鉴别方法,其中不合理的是( )
A.检验溶液的碱性,碱性强的是Na2CO3
B.取同量的溶液于两支试管中,各滴入酚酞溶液,红色较深的是Na2CO3
C.取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
D.取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
C
解析 A项,Na2CO3、NaHCO3溶液均呈碱性,同温度相同溶质质量分数两溶液,Na2CO3溶液的碱性强,正确;B项,因Na2CO3溶液的碱性强,分别滴加酚酞溶液,红色较深的是Na2CO3溶液,正确;C项,取同量的溶液于两支试管中,加热,均没有气体生成,错误;D项,同浓度的两溶液中,分别逐滴加入稀盐酸,NaHCO3开始就有气体放出,正确。
15.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为__________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是________(填字母)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式)。
Ⅱ
D
NaHCO3
Thanks!
本讲内容结束
第二课时 碳酸钠和碳酸
第二章 海水中的重要元素——钠和氯
氢钠 焰色试验
【课程标准要求】
1.结合真实情境中应用实例或通过实验探究,了解碳酸钠和碳酸氢钠的主要性质。
2.了解碳酸钠和碳酸氢钠在生产、生活中的应用。
3.了解焰色试验及操作过程。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
一、碳酸钠和碳酸氢钠
1.实验探究Na2CO3和NaHCO3溶于水时表现的性质
盐 Na2CO3 NaHCO3
(1)在两支试管中各加入1 g Na2CO3、NaHCO3,观察外观并进行描述 白色粉末 细小的白色晶体
(2)向以上两支试管中分别滴入几滴 水,振荡,观察现象;将温度计分 别插入其中,温度计的示数有何变化 碳酸钠____________,温度计读数升高 碳酸氢钠部分溶解,温度计读数______
结块变成晶体
降低
(3)继续向(2)的试管中分别加入 5 mL水,用力振荡,有何现象 碳酸钠溶解 碳酸氢钠溶解
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象 溶液变______且颜色较深 溶液变______且溶液颜色稍浅
初步结论 溶液显____性 溶液显____性
红色
红色
碱
碱
2.化学性质
(1)热稳定性(实验装置如图)
①现象:加热Na2CO3,澄清石灰水无明显现象;加热NaHCO3,澄清石灰水变浑浊。
②结论:Na2CO3性质稳定,NaHCO3不稳定,受热易分解,化学方程式为:
______________________________________________。
(2)与酸(足量盐酸)反应(写出相应的离子方程式):
①Na2CO3:____________________________________。
②NaHCO3:____________________________________。
(3)与碱(氢氧化钠溶液)反应:
①Na2CO3与NaOH不反应。
②NaHCO3(写离子方程式):__________________________________。
3.用途
【微自测】
1.判断正误,正确的打“√”,错误的打“×”。
答案 (1)× (2)× (3)√ (4)×
二、焰色试验
1.含义
根据火焰呈现的特征颜色,可以判断试样所含的______元素,化学上把这样的定性分析操作称为焰色试验。
金属
2.操作
(1)将______ (或光洁无锈的铁丝)用______洗净后,放在酒精灯外焰上灼烧至与原来的火焰颜色相同为止。
(2)蘸取试样在酒精灯外焰上灼烧,观察火焰的颜色;观察钾的焰色时要透过蓝色钴玻璃来观察,其目的是:______________,避免其中的钠盐造成干扰。
(3)用盐酸洗净铂丝,并在外焰上灼烧至与原来的火焰颜色相同,再检验下一个试样。
铂丝
盐酸
滤去黄色的光
3.常见金属的焰色
钠:____色;钾:____色(透过蓝色钴玻璃观察);
铜:____色;钡:______色;钙:______色。
黄
紫
绿
黄绿
砖红
【微自测】
2.下列描述中,正确的打“√”,错误的打“×”。
(1)焰色试验的铂丝可用稀硫酸洗( )
(2)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液( )
(3)若某无色溶液的焰色试验观察到焰色为黄色,说明该溶液只含Na+,无K+( )
(4)焰色试验是金属元素的化学性质( )
答案 (1)× (2)√ (3)× (4)×
二、碳酸钠和碳酸氢钠的鉴别与除杂
一、碳酸钠和碳酸氢钠性质的差别
一、碳酸钠和碳酸氢钠性质的差别
[实验Ⅰ]
分别向溶质质量分数相等的Na2CO3和NaHCO3溶液中滴加稀盐酸
1.分析产生上述相同现象的原因是什么?写出相关反应的离子方程式。
[实验Ⅱ]
分别向溶质的质量分数相等的Na2CO3和NaHCO3溶液中滴加澄清石灰水。
2.分析产生上述相同现象的原因是什么?写出相关反应的离子方程式。
[实验Ⅲ]
分别向溶质质量分数相等的Na2CO3和NaHCO3稀溶液中滴加BaCl2稀溶液。
3.分析产生上述不同现象的原因是什么?写出相关反应的离子方程式。
碳酸钠和碳酸氢钠性质的比较
与盐酸 反应 Na2CO3+2HCl===2NaCl+CO2↑+H2O 若逐滴滴加盐酸,反应先后顺序为:Na2CO3+HCl===NaCl+NaHCO3 NaHCO3+HCl===NaCl+CO2↑+H2O NaHCO3+HCl===NaCl+CO2↑+H2O
NaHCO3与盐酸的反应比Na2CO3与盐酸的反应剧烈
与NaOH 溶液反应 不反应 NaHCO3+NaOH===
Na2CO3+H2O
与Ca(OH)2 溶液反应 产生白色沉淀 Na2CO3+Ca(OH)2 ===CaCO3↓+2NaOH 产生白色沉淀
2NaHCO3+Ca(OH)2===
CaCO3↓+Na2CO3+2H2O
与CaCl2、BaCl2或Ba(NO3)2等稀溶液反应 产生白色沉淀 Na2CO3+CaCl2=== CaCO3↓+2NaCl 不反应
1.下列有关Na2CO3与NaHCO3的性质比较中不正确的是( )
A.相同溶质质量分数两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同溶质质量分数的稀硫酸反应放出气泡的速率:NaHCO3
解析 根据相同溶质质量分数的Na2CO3和NaHCO3溶液中,滴加酚酞溶液后的颜色变化,可得出结论:相同溶质质量分数的Na2CO3和NaHCO3溶液,Na2CO3溶液的碱性较强,A项正确;常温下,Na2CO3的溶解度大于NaHCO3的溶解度,B项正确;Na2CO3与稀H2SO4反应需要2步结合H+才能放出CO2,而NaHCO3与稀H2SO4反应只需要1步结合H+就能放出CO2,所以Na2CO3和NaHCO3与相同溶质质量分数的稀H2SO4反应,放出气泡的速率:NaHCO3>Na2CO3,C项错误;NaHCO3受热容易分解,Na2CO3受热不易分解,所以稳定性:Na2CO3>NaHCO3,D项正确。
2.膨松剂指食品加工中添加于生产焙烤食品的主要原料小麦粉中,使面坯起发,形成致密多孔组织,从而使制品具有膨松、柔软或酥脆的一类物质。为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,因为它①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子。其中合理的是( )
A.②③ B.①③ C.①④ D.③④
解析 从题意中面包松软可口,做膨松剂可得出热稳定性差,产生二氧化碳气体,故B正确。
B
二、碳酸钠和碳酸氢钠的鉴别与除杂
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。
某位同学的妈妈将盛放两种物品的瓶子弄混了,请同学帮助区分鉴别。
鉴别方案设计
同学们根据Na2CO3和NaHCO3性质的差异,提出了三个鉴别方案,请评价各个方案是否合理?
1.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
提示 否。纯碱受热不分解,小苏打受热分解生成碳酸钠,故两种样品都会有残留。
2.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打
提示 是。小苏打中的碳酸氢根与醋酸反应的速率较快。
3.分别取少量的两种样品于两只小玻璃杯中,加入少量澄清石灰水,能产生白色沉淀的是纯碱
提示 否。两种物质都可以与澄清石灰水发生反应生成沉淀。
1.Na2CO3、NaHCO3的鉴别
(1)利用热稳定性不同
①鉴别方法
②常用装置
(2)利用和酸反应生成气体的速率不同(相同条件下)
(3)利用与BaCl2或CaCl2溶液反应
(4)利用溶液的碱性强弱
2.Na2CO3与NaHCO3的提纯
混合物(括号内的为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
3.Na2CO3与NaHCO3的相互转化
1.鉴别Na2CO3和NaHCO3不能用Ba(OH)2[或Ca(OH)2]溶液,原因是二者均能与之反应生成沉淀。
2.互滴法是指当两种溶液反应时有两个不同的反应过程,且这两个过程的实验现象各不相同,则可以通过滴加顺序不同,利用产生的现象不同进行鉴别。如盐酸与Na2CO3溶液反应。
3.有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
C
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀者为Na2CO3
B 分别加入相同溶质质量分数的稀盐酸 反应较剧烈者为Na2CO3
C 分别加入CaCl2溶液 产生沉淀者为Na2CO3
D 逐滴加入相同溶质质量分数的盐酸 立即产生气泡者为Na2CO3
解析 A项,有关反应为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,Ca(OH)2+2NaHCO3===CaCO3↓+Na2CO3+2H2O。两者产生白色沉淀现象相同,A不正确;B项,滴加相同溶质质量分数的稀盐酸时,NaHCO3溶液反应更剧烈,B不正确;C项,Na2CO3与CaCl2反应生成CaCO3白色沉淀,NaHCO3与CaCl2不反应,C正确;D项,逐滴加入盐酸时,NaHCO3立即产生气泡,Na2CO3开始无明显现象,后有无色气体放出,D不正确。
4.下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
解析 溶于水滴加澄清石灰水时NaHCO3也会产生白色沉淀,所以只能滴加BaCl2或CaCl2溶液。
C
微专题4 纯碱的工业制备
1.索尔维制碱法(氨碱法)
(1)原料:食盐、氨、二氧化碳等。
(2)
(3)生产原理流程
(4)索尔维制碱法具有原料易获取,价格便宜,损失少,实现了连续性生产等优点。
2.侯氏(联合)制碱法
(1)原料:氨、氯化钠溶液、二氧化碳。
(2)
(3)生产原理流程
1.下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是Na2CO3·10H2O
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
C
2.侯氏制碱法是我国化学工程专家侯德榜于1943年独立发明,它打破了当时外国的技术封锁。某化学小组模拟侯氏制碱法,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl。然后再将NaHCO3制成Na2CO3。
(1)装置乙的作用是____________________________________________。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有________、洗涤、灼烧。NaHCO3制取Na2CO3的化学方程式为
___________________________________________________________。
(3)已知NH3极易溶于水,生成氨水可以吸收CO2。侯氏制碱法制取NaHCO3时,应先通NH3,后通CO2,目的是_________________________________________。
1.下列有关焰色试验的叙述正确的是( )
A.可用铜丝代替铂丝进行试验
B.观察钾的焰色试验要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
解析 铜丝在灼烧时有颜色,不能用铜丝代替铂丝,A项错误;实验结束后,用盐酸洗净铂丝,C项错误;焰色试验是指金属元素在灼烧时火焰呈现特殊的颜色,不是化学性质,D项错误。
B
2.下列反应的离子方程式错误的是( )
B
解析 碳酸氢钠溶液与少量澄清石灰水反应生成碳酸钙沉淀、碳酸钠和水,碳酸氢钠溶液与过量澄清石灰水反应生成碳酸钙沉淀、氢氧化钠和水,与氢氧化钠溶液反应生成碳酸钠和水,故A正确、B错误;碳酸钠溶液与澄清石灰水反应生成碳酸钙沉淀和氢氧化钠,碳酸钠溶液与氯化钡溶液反应生成碳酸钡沉淀和氯化钠,故C、D正确。
3.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有同学为鉴别它们采用以下四种不同的方法,其中不可行的是( )
A.分别将它们配制成溶液,再加入澄清石灰水中
B.分别将它们配制成溶液,再逐滴加入相同溶质质量分数的稀盐酸
C.分别将它们配制成稀溶液,再分别加入CaCl2稀溶液
D.分别加热,再用澄清石灰水检验是否有CO2产生
解析 将Na2CO3溶液、NaHCO3溶液分别加入澄清石灰水中,均会产生白色沉淀,无法鉴别,A项不可行。
A
4.下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验装置(夹持装置省略)并分析实验原理,判断下列说法错误的是( )
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明物质受热能产生水,可在两支试管
内塞上沾有无水硫酸铜粉末的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
B
解析 用酒精灯加热时,外管温度高,内管温度低,NaHCO3受热易分解,Na2CO3受热不易分解,故将Na2CO3放在外管中,温度高却未分解,NaHCO3放在内管中,温度低却分解,证明Na2CO3热稳定性强于NaHCO3,NaHCO3受热分解产生CO2,可使澄清石灰水变浑浊。甲为小苏打(NaHCO3),乙为纯碱(Na2CO3),故A项正确,B项错误;NaHCO3分解产生的水可以使无水硫酸铜变蓝色,故C项正确;Na2CO3不会分解产生CO2,故不能使丙中澄清石灰水变浑浊,故D项正确。
5.Na2CO3和NaHCO3是重要的化工原料,请回答:
(1)两物质的水溶液分别与足量盐酸混合,反应的离子方程式分别为
_____________________________、_____________________________。
(2)除去NaHCO3溶液中少量Na2CO3的方法,写出化学方程式
___________________________________________________________。
(3)两物质的焰色试验分别为________色、________色。
(4)检验某盐中含有钾元素的方法是___________,具体操作为
___________________________________________________________
___________________________________________________________ 。
Na2CO3+CO2+H2O ===2NaHCO3
黄
黄
焰色试验
用洁净的铂丝蘸取样品,在无色火焰灼烧,透过蓝色钴玻璃观察,有紫色火焰则证明样品含有钾元素。
解析 (1)碳酸钠和碳酸氢钠与盐酸反应都生成二氧化碳、氯化钠和水,根据离子方程式的书写原则书写离子方程式;(2)碳酸钠溶液中通入二氧化碳反应生成碳酸氢钠;(3)钠元素的焰色试验的火焰为黄色;(4)利用焰色试验证明钾元素的存在。
1.进行焰色试验时,通常用来洗涤铂丝的是( )
A.硫酸 B.烧碱溶液
C.稀盐酸 D.蒸馏水
解析 清洗是为了洗去杂质氧化膜,用稀盐酸洗过之后通常都要在酒精灯火焰上灼烧,因为金属氯化物沸点低,容易气化,易挥发,所以杂质离子就一并挥发了。而硫酸是难挥发性酸,不能达到去除干扰的目的。故选C。
C
2.小明同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )
解析 钠元素的焰色试验为黄色,钾元素的焰色试验为紫色,观察钾元素的焰色试验时必须透过蓝色钴玻璃。根据题中现象只能确定有Na+,而不能确定K+的存在。
D
3.关于NaHCO3的性质,下列说法正确的是( )
A.热稳定性比Na2CO3强
B.相同温度下溶解度比Na2CO3要大
C.NaHCO3只能和酸作用不能和碱作用
D.和酸反应放出等质量的CO2所消耗的酸比Na2CO3少
D
4.下列实验方法能达到实验目的的是( )
A.加热可除去NaHCO3固体中少量的Na2CO3
B.用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液
C.用NaOH溶液鉴别BaCl2溶液和MgCl2溶液
D.用闻气味的方法鉴别CO2和CO
C
解析 NaHCO3固体受热易分解,Na2CO3受热不分解,故不能用加热的方法除去NaHCO3固体中少量的Na2CO3,故A错误;碳酸钠和碳酸氢钠均可与澄清石灰水反应生成白色沉淀,现象相同,不能鉴别,故B错误;MgCl2溶液与NaOH反应生成白色沉淀,BaCl2溶液与NaOH不反应,现象不同可鉴别,故C正确; CO2和CO都无味,CO还有毒,不能用闻气味的方法鉴别,故D错误。
5.焰色试验实验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧到火焰无色,再蘸取被检验物质
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
C
解析 取一根铂丝,用盐酸洗净后,放在酒精灯上灼烧至无色,再蘸取被检验物质,进行焰色试验,故A正确;在观测钾的焰色试验时要透过蓝色钴玻璃片,滤去钠的黄光的干扰,故B正确;为了能够更加突出被检验试剂的颜色,选用本身颜色较浅的火焰,最大限度减少火焰本身颜色的干扰,故C错误;洁净的细铁丝,放在酒精灯上灼烧至无色,本身无颜色,故可用铁丝进行焰色试验,故D正确。
6.下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
A.均为白色固体,均溶于水
B.均与足量盐酸反应产生CO2
C.受热均易分解
D.其水溶液均能使酚酞溶液变红
解析 Na2CO3和NaHCO3均为白色固体,是可溶性盐,均溶于水,故A正确;盐酸足量,Na2CO3和NaHCO3均与盐酸反应产生CO2,故B正确;碳酸氢钠受热易分解,碳酸钠受热不分解,故C错误;Na2CO3和NaHCO3水溶液都呈碱性,均能使酚酞溶液变红,故D正确。
C
7.除去Na2CO3固体中的NaHCO3,最合适的试剂或方法是( )
A.H2SO4 B.NaOH C.加热 D.通入CO2
解析 硫酸和碳酸钠、碳酸氢钠均可以反应,故A错误;若加入过量的氢氧化钠,会引入新的杂质,故B错误;加热可使碳酸氢钠分解,生成碳酸钠、水和二氧化碳,故C正确;通入二氧化碳,碳酸钠会反应生成碳酸氢钠,达不到除杂的效果,故D错误。
C
8.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a先通入CO2,然后b通入NH3,c中放碱石灰
B.a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b先通入NH3,然后a通入CO2,c中放碱石灰
D.b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
B
解析 “侯氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3,为防止倒吸,a管通NH3,b管通CO2;由于CO2在水中的溶解度较小,而NH3的溶解度较大,所以要先通NH3,再通CO2,否则CO2通入后会从水中逸出,等再通NH3时溶液中CO2的量就很少了,这样得到的产品也很少,氨气是碱性气体,可以用蘸稀硫酸的脱脂棉吸收,防止污染空气。
9.加热42 g NaHCO3和Na2CO3的固体混合物至没有气体放出时,剩余固体的质量是35.8 g。那么原固体混合物中Na2CO3的质量是( )
A.25.2 g B.16.8 g C.10.6 g D.24.8 g
A
10.以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是( )
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应等
B
11.(2021·榆林高一检测)有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
(1)W、X、Y、Z的化学式分别是:W________、X________、Y________、Z________。
(2)以上4个化学反应中,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若反应④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个反应的化学方程式:
离子方程式:_____________________________________________。
化学方程式:_____________________________________________。
12.食盐(NaCl)、纯碱(Na2CO3)和小苏打(NaHCO3)是日常家庭厨房中常见用品。请回答下列问题:
(1)有关食盐(NaCl)、纯碱(Na2CO3)和小苏打(NaHCO3)的说法正确的是________(填字母)。
A.食盐属于盐、纯碱属于碱、小苏打属于酸
B.分别取三种物质做焰色试验,火焰颜色均呈现黄色
C.用三支小试管取适量三种物质加入少量水溶解,用手轻轻触摸试管,温度升高的是纯碱,温度明显降低的是小苏打
D.用三支试管取适量三种物质加入少量水溶解,滴加少量酚酞溶液,溶液变红的只有纯碱
BC
(2)用化学方法鉴别三种物质有很多种方法。
①用三支小试管取适量三种物质分别加热,有使澄清石灰水变浑浊的气体产生的是小苏打。写出小苏打加热分解的化学方程式
___________________________________________________________。
若所取小苏打的质量是8.4 g,充分加热后固体质量减少了________ g。
②用三支小试管取适量三种物质加水溶解配制成的溶液,加入少量NaOH溶液,均没有现象,但是有同学认为有一个试管中发生了化学反应,写出其离子方程式___________________________________________________。
3.1
13.在试管①中加入1 g Na2CO3,试管②中加入1 g NaHCO3进行如下实验,下列对①、②中的变化说法不正确的是( )
C
A 分别滴入少量水,触摸试管底部 ①变热 ②变凉
B 分别加10 mL水,滴入两滴酚酞 ①变红 ②变浅红 C 加热试管①和②中的固体,都可以放出使澄清石灰水变浑浊的气体 D 分别用铂丝蘸取少量①和②中的固体,进行焰色试验,火焰均为黄色 解析 碳酸钠溶于水放热,碳酸氢钠溶于水吸热,所以①变热,②变凉,A项正确;碳酸钠溶液的碱性强于碳酸氢钠溶液,B项正确;C项,碳酸钠稳定,受热不易分解,错误;D项,钠元素焰色呈黄色,所以①、②火焰均为黄色,正确。
14.现有两瓶失去标签的相同溶质质量分数的Na2CO3和NaHCO3无色溶液,请提出简便的鉴别方法,其中不合理的是( )
A.检验溶液的碱性,碱性强的是Na2CO3
B.取同量的溶液于两支试管中,各滴入酚酞溶液,红色较深的是Na2CO3
C.取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
D.取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3
C
解析 A项,Na2CO3、NaHCO3溶液均呈碱性,同温度相同溶质质量分数两溶液,Na2CO3溶液的碱性强,正确;B项,因Na2CO3溶液的碱性强,分别滴加酚酞溶液,红色较深的是Na2CO3溶液,正确;C项,取同量的溶液于两支试管中,加热,均没有气体生成,错误;D项,同浓度的两溶液中,分别逐滴加入稀盐酸,NaHCO3开始就有气体放出,正确。
15.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为__________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是________(填字母)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式)。
Ⅱ
D
NaHCO3
Thanks!
本讲内容结束
