第三章 第二节 金属材料 第二课时 物质的量在化学方程式计算中的应用(共85张ppt)
文档属性
| 名称 | 第三章 第二节 金属材料 第二课时 物质的量在化学方程式计算中的应用(共85张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-10-02 21:41:40 | ||
图片预览











文档简介
(共85张PPT)
第二课时 物质的量在化
第三章 铁 金属材料
学方程式计算
中的应用
【课程标准要求】
1.掌握物质的量在化学方程式计算中的应用。
2.学会化学方程式计算的一般方法和步骤。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
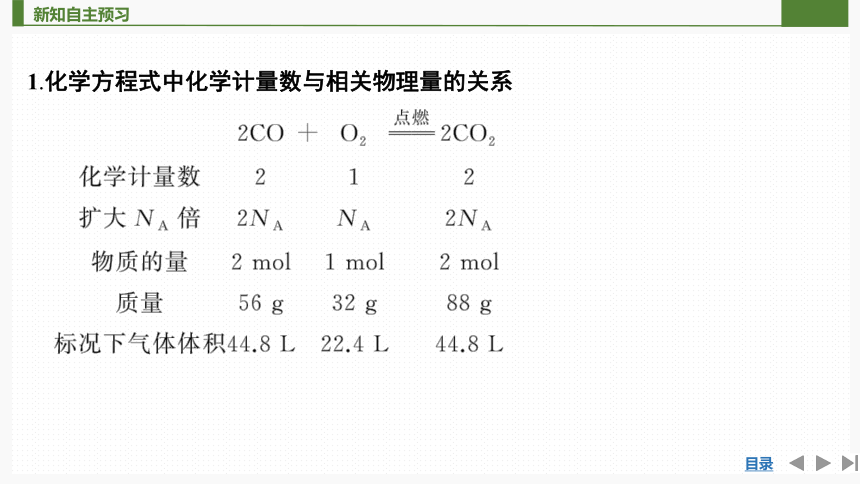
1.化学方程式中化学计量数与相关物理量的关系
结论:
(1)化学方程式中各物质的化学计量数之比等于其__________之比,等于其__________之比。
(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其______之比。
粒子数目
物质的量
体积
2.物质的量应用于化学方程式计算的解题步骤
3.物质的量应用于化学方程式计算的要求与方法
(1)书写格式规范化——计算的过程中,各物理量、物质对象、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化——计算时,如果已知的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)过量判断简捷化——如果两种反应物的量都是已知的,用已知量与对应计量数比值(比值大过量)先判断哪种物质过量,然后根据不足量的物质求解某种产物的量。
【微自测】
标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是( )
A.Zn+2HCl===ZnCl2+H2↑
1 mol 1 mol
3.25 g x L
B.Zn+2HCl===ZnCl2+H2↑
65 g 22.4 L
3.25 g x L
C.Zn+2HCl===ZnCl2+H2↑
1 mol 2 g
0.05 mol x L
D.Zn+2HCl===ZnCl2+H2↑
65 g 2 g
3.25 g x
答案 B
解析 列比例关系时应注意单位要“上下一致,左右相当”。
二、化学计算中的常用技巧
一、铝与盐酸、NaOH溶液反应的计算
一、铝与盐酸、NaOH溶液反应的计算
反应原理
铝与盐酸、NaOH溶液反应的化学方程式分别为
①2Al+6HCl===2AlCl3+3H2↑
②2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
1.等量的铝分别与足量的盐酸和NaOH溶液反应,消耗HCl和NaOH的物质的量有什么关系?
提示 等量的Al分别与足量的盐酸和NaOH溶液反应,消耗HCl和NaOH的物质的量之比为3∶1。
2.等量的铝分别与足量的盐酸和NaOH溶液反应,生成H2的量有什么关系?
提示 相同状况下,产生H2的体积比为1∶1。
3.等物质的量的盐酸和NaOH与足量的铝反应,生成H2的量又有什么关系?
提示 等物质的量的HCl和NaOH与足量的铝反应,相同状况下产生H2的体积比为1∶3。
1.铝与酸、碱溶液反应生成H2的定量关系
2.重要关系判断
一定量的铝分别与相等物质的量的盐酸和氢氧化钠溶液反应,若产生的氢气的体积比为1∶31.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1∶1 B.2∶1 C.3∶1 D.1∶3
C
2.甲、乙两烧杯中分别装有等体积、等物质的量浓度的硫酸和氢氧化钠溶液,现向两烧杯中各加入等物质的量的铝,在相同状况下生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
B
解析 设Al与硫酸、氢氧化钠溶液反应生成氢气的体积分别为V甲、V乙,由化学方程式2Al+3H2SO4===Al2(SO4)3+3H2↑和2Al+2NaOH+2H2O===2NaAlO2+3H2↑可知,若两个烧杯中铝均不足,则铝完全反应,产生氢气的体积比V甲∶V乙=1∶1;若两种情况下铝均过量,则硫酸和氢氧化钠均完全反应,产生氢气的体积比V甲∶V乙=2∶3;现在氢气的体积比V甲∶V乙=5∶6,则甲烧杯中铝过量,硫酸完全反应,乙烧杯中铝完全反应,氢氧化钠过量。
3.甲、乙两烧杯中分别盛有100 mL浓度均为3 mol/L的盐酸与NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得同温同压下生成气体的体积之比为1∶2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
A
二、化学计算中的常用技巧
方法一 关系式法
当已知物和未知物之间是靠多个反应来联系时,可通过直接确定已知量和未知量之间的比例关系即“关系式”进行计算。
(1)根据多步反应的化学方程式确定关系式
写出发生反应的化学方程式,根据“中间”物质物质的量的关系写出关系式。
方法二 差量法
方法三 守恒法
(1)电子守恒:氧化还原反应中得到电子总数等于失去电子总数。
(2)电荷守恒:电解质溶液中,阳离子所带正电荷总数=阴离子所带负电荷总数;离子方程式中,反应物所带电荷总数=生成物所带电荷总数。
A.14 g B.42 g C.56 g D.28 g
D
5.在室温下,向100 mL CuSO4饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应:
答案 0.125 mol/L
(1)现取5.00 g混合物X,充分加热后混合物质量减少了0.31 g,则原混合物中碳酸钠的质量为________。
(2)现取5.00 g混合物Y,充分加热至恒重,把放出的气体通入足量澄清石灰水中,生成2.00 g沉淀,则原混合物中碳酸氢钠的质量分数为________。
答案 (1)4.16 g (2)67.2%
微专题10 合金成分的测定
1.合金成分的测定方法
合金成分的测定分为定性和定量两个方面
(1)定性分析时,可通过观察合金的颜色或测定合金的密度大致判断金属的种类。
(2)定量分析时,可通过加酸、碱溶液验证合金的种类,对合金的成分作精确判断,再通过气体、沉淀的测量实现合金成分的定量测定。在加酸检验合金的成分时,常用的分析过程为:
2.有关合金成分的计算
解答这类问题要明确金属的性质(与酸、碱反应放出氢气等)。如Mg—Al合金在稀酸中溶解,这就要熟记Mg、Al与稀酸的反应:由Mg+2H+===Mg2++H2↑知Mg~H2,由2Al+6H+===2Al3++3H2↑知2Al~3H2,根据放出H2的量与金属的对应比例,可迅速作答。特别是铝合金溶于NaOH溶液中这类问题,首先明确Al与NaOH溶液的反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,2Al~3H2,可由这一关系得出Al的量,然后再确定铝合金中其他成分的量。
1.合金的性能往往优于组成金属,因而用途非常广泛。
(1)钠钾合金可在核反应堆中用作导热剂。5.05 g钠钾合金溶于200 mL水生成0.075 mol氢气。计算并确定该钠钾合金的化学式为________。
(2)镁铝合金广泛用于火箭、导弹和飞机制造业等。取不同质量的镁铝合金样品分别和30 mL相同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下)如下表所示:
实验序号 A B C
合金质量/mg 510 765 918
气体体积/mL 560 672 672
计算镁铝合金中镁、铝的质量之比为________。
NaK2
8∶9
解析 (1)假设在5.05 g钠钾合金中含有K、Na的物质的量分别是x、y;根据二者的质量关系可得39x+23y=5.05 g;根据失去电子的物质的量可得x+y=0.15 mol。解得x=0.1 mol,y=0.05 mol,所以n(Na)∶n(K)=1∶2,因此该钠钾合金化学式是NaK2。(2)根据表格的数据可知A组实验金属不过量,盐酸过量,金属完全反应,C组盐酸不足量,金属过量,未完全反应,所以应该以A组物质为标准。假设在510 mg镁铝合金中镁、铝的物质的量分别是m、n,则根据质量关系可得24m+27n=0.51 g;根据电子守恒可得2m+3n=(0.56 L÷22.4 L·mol-1)×2=0.05 mol。解得m=0.01 mol,n=0.01 mol,所以镁铝合金中镁、铝的质量之比为0.24∶0.27=8∶9。
2.某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色试验呈绿色)。
Ⅰ.外观暗灰色,表皮光滑;
Ⅱ.在酒精灯火焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
Ⅲ.取刮去表皮的合金10 g,放入足量的稀硫酸,收集到标准状况下的H2 8.96 L。
Ⅳ.另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
(1)试据此判断,该合金中一定含有的元素是________(填元素符号);可能含有下列元素中的________(填序号)。
A.Ag B.Mg C.Na D.Fe
(2)如果该合金中只含2种元素,则二者的质量比是________。
答案 (1)Cu、Al A (2)m(Al)∶m(Cu)=18∶7
3.化学学习小组对某镁铝合金进行了如下实验探究,请你参与并完成有关问题。
[实验药品]
12.6 g镁铝合金,200 mL a mol/L稀硫酸,520 mL 4 mol/L NaOH溶液。
[实验步骤]
①将12.6 g镁铝合金与200 mL a mol/L的稀硫酸在如图所示装置中充分反应至反应完毕,并收集生成的全部气体。
②向b内混合液中逐滴加入520 mL 4 mol/L氢氧化钠溶液并充分混合,当氢氧化钠溶液加至500 mL时生成的沉淀量最大。
[问题讨论]
(1)仪器b的名称是________。
(2)根据实验目的可知,12.6 g镁铝合金与200 mL a mol/L的稀硫酸反应时,过量的物质应该是________(填“镁铝合金”或“稀硫酸”),以保证另一种物质能够完全反应无剩余;若标准状况下,由实验步骤①得到的气体为13.44 L,则合金中镁的质量分数为________(精确到0.1%)。
答案 (1)圆底烧瓶 (2)稀硫酸 57.1%
1.6.5 g的锌片置于足量的稀盐酸中完全反应方程式为Zn+2HCl===ZnCl2+H2↑,产生的气体在标准状况下的体积是( )
A.2.24 mL B.22.4 mL C.224 mL D.2 240 mL
D
2.常温下,将0.23 g金属钠投入100 mL水中充分反应。下列说法正确的是( )
A.0.23 g金属钠中所含电子的总物质的量为0.01 mol
B.消耗水的质量为0.36 g
C.所得NaOH的物质的量为0.01 mol
D.生成气体的体积为0.112 L
C
3.等物质的量的Na、Mg、Al分别与足量的稀盐酸反应,同温同压下,产生气体的体积比为( )
A.1∶2∶3 B.3∶2∶1 C.6∶3∶2 D.1∶1∶1
解析 由化合价升降守恒知,2Na~H2、Mg~H2、2Al~3H2,假设消耗的Na、Mg、Al分别为1 mol,则生成的H2分别为0.5 mol、1 mol、1.5 mol,则三者比例关系为1∶2∶3,同温同压下,产生气体的体积比为1∶2∶3,A选项符合题意。
A
4.1.15 g金属钠与水反应,得到100 mL溶液,试计算:
(1)生成的气体在标准状况下的体积。
(2)反应后所得溶液的物质的量浓度。
答案 (1)0.56 L (2)0.5 mol/L
1.在同温同压下,50 mL气体A2跟100 mL气体B2化合生成50 mL气体C,则C的化学式是( )
A.AB2 B.A2B C.AB3 D.A2B4
解析 利用化学方程式中物质的量之比等于相同条件下气体的体积之比都等于化学计量数之比,写出该反应的化学方程式为A2+2B2===C,又根据质量守恒(原子个数守恒),可知C的化学式为A2B4。
D
2.1.6 g NaOH恰好与20 mL的盐酸完全反应,则盐酸的物质的量浓度为( )
A.0.2 mol/L B.2 mol/L C.0.5 mol/L D.1 mol/L
B
3.等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A.1∶1 B.3∶4 C.2∶3 D.4∶3
B
4.将5.0 g某合金放入足量的稀盐酸中,共收集氢气的体积(标准状况下)为2.24 L,则该合金可能是( )
A.Mg-Al合金 B.Fe-Al合金
C.Fe-Zn合金 D.Cu-Zn合金
解析 由题意知,n(H2)=0.1 mol,即产生0.1 mol H2消耗该合金5.0 g,则产生1 mol H2消耗该合金50 g,满足此条件的合金的要求是产生1 mol H2时消耗一种成分金属的质量大于50 g,另一种成分金属的质量小于50 g。对于给出的金属,产生1 mol H2时消耗各金属的质量分别为m(Mg)=24 g,m(Al)=18 g,m(Fe)=56 g,m(Zn)=65 g,Cu与稀盐酸不反应;故选B。
B
5.(2021·吉林长春高一期末)250 mL 2 mol/L的稀盐酸与一定量的铁屑充分反应,铁屑全部溶解,生成标准状况下1.12 L的氢气,则参加反应的铁屑的质量是( )
A.2.8 g B.5.6 g
C.11.2 g D.78.4 g
A
6.已知由盐酸、氯化铜、氯化铁组成的混合溶液中各阳离子的物质的量浓度相等,氯离子的总物质的量浓度为6 mol·L-1,则该100 mL混合溶液最多可以溶解铁粉的质量为( )
A.5.6 g B.16.8 g
C.11.2 g D.33.6 g
C
解析 溶液中各阳离子物质的量浓度相等,设均为x mol·L-1,氯离子总物质的量浓度为6 mol·L-1,则x+2x+3x=6 mol·L-1,解得x=1 mol·L-1,混合溶液100 mL,则盐酸、氯化铜、氯化铁的物质的量均为0.1 mol,由Fe~2HCl、Fe~CuCl2、Fe~2FeCl3可知,此溶液中最多可以溶解铁粉的质量为(0.05 mol+0.1 mol+0.05 mol)×56 g·mol-1=11.2 g。
7.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为( )
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
B
8.(2020·福建高一检测)向10.4 g Fe3O4、Fe2O3、Cu的混合物中加入1 mol·L-1的硫酸溶液140 mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的H2在高温下还原相同质量的原混合物,固体减少的质量为( )
A.1.12 g B.2.24 g
C.3.24 g D.6.42 g
B
解析 10.4 g Fe3O4、Fe2O3、Cu的混合物与H2SO4溶液恰好完全溶解,所得溶液中不含Fe3+,则溶液中的溶质为FeSO4和CuSO4,H2SO4中H元素与金属氧化物中O元素结合生成H2O,故有n(O)=n(H2SO4)=1 mol·L-1×0.14 L=0.14 mol。若用过量H2在高温下还原相同质量的原混合物,固体减少的质量等于混合物中O元素的质量,即0.14 mol×16 g·mol-1=2.24 g。
9.A、B两个烧杯中分别盛有浓度和体积均相同(100 mL 3 mol/L)的稀盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为A∶B=3∶8,则加入铝粉的质量为( )
A.2.7 g B.3.6 g
C.5.4 g D.7.2 g
D
10.把V L含有MgSO4、K2SO4的混合溶液分为两等份,一份加入a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含有b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子的浓度为( )
B
11.把CO还原Fe2O3所生成的CO2通入足量澄清石灰水中生成沉淀,若将沉淀过滤、烘干后称得质量为m g。
(1)写出CO与沉淀物质的关系式。
(2)需要通入CO的物质的量最少是多少?
12.如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容。某同学从该试剂瓶中取出24.0 g固体,配成1 L溶液,请计算:
(1)所得氢氧化钠溶液的物质的量浓度。
(2)从所得氢氧化钠溶液中取出200 mL于一烧杯中,投入足量的金属铝,完全反应后,产生的气体在标准状况下的体积。(写出解答步骤)
氢氧化钠 化学纯(CP)
500 g
品名:氢氧化钠
化学式:NaOH
相对分子质量:40
13.由FeO、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量之比为21∶8,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能为( )
A.1∶2∶2 B.1∶2∶3
C.1∶3∶1 D.1∶1∶3
D
14.向500 mL 2 mol/L的CuSO4溶液中插入一铁片,反应片刻后取出铁片,洗涤、烘干,称其质量比原来增加2.0 g。下列说法错误的是(设反应后溶液的体积不变)( )
A.参加反应的铁的质量是14 g
B.析出的铜的物质的量是0.25 mol
C.反应后溶液中c(CuSO4)=1.5 mol/L
D.反应后溶液中c(FeSO4)=1.5 mol/L
D
15.(1)等物质的量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为________。
(2)等质量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为________。
(3)将物质的量均为0.2 mol的钠、镁、铝分别投入100 mL 1 mol/L的盐酸中,三者产生的氢气在相同条件下的体积比为________。
Thanks!
本讲内容结束
第二课时 物质的量在化
第三章 铁 金属材料
学方程式计算
中的应用
【课程标准要求】
1.掌握物质的量在化学方程式计算中的应用。
2.学会化学方程式计算的一般方法和步骤。
新知自主预习
课堂互动探究
微专题
目
录
CONTENTS
///////
///////
///////
课后巩固训练
///////
课堂达标训练
///////
1.化学方程式中化学计量数与相关物理量的关系
结论:
(1)化学方程式中各物质的化学计量数之比等于其__________之比,等于其__________之比。
(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其______之比。
粒子数目
物质的量
体积
2.物质的量应用于化学方程式计算的解题步骤
3.物质的量应用于化学方程式计算的要求与方法
(1)书写格式规范化——计算的过程中,各物理量、物质对象、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(2)单位运用对应化——计算时,如果已知的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。
(3)过量判断简捷化——如果两种反应物的量都是已知的,用已知量与对应计量数比值(比值大过量)先判断哪种物质过量,然后根据不足量的物质求解某种产物的量。
【微自测】
标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是( )
A.Zn+2HCl===ZnCl2+H2↑
1 mol 1 mol
3.25 g x L
B.Zn+2HCl===ZnCl2+H2↑
65 g 22.4 L
3.25 g x L
C.Zn+2HCl===ZnCl2+H2↑
1 mol 2 g
0.05 mol x L
D.Zn+2HCl===ZnCl2+H2↑
65 g 2 g
3.25 g x
答案 B
解析 列比例关系时应注意单位要“上下一致,左右相当”。
二、化学计算中的常用技巧
一、铝与盐酸、NaOH溶液反应的计算
一、铝与盐酸、NaOH溶液反应的计算
反应原理
铝与盐酸、NaOH溶液反应的化学方程式分别为
①2Al+6HCl===2AlCl3+3H2↑
②2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
1.等量的铝分别与足量的盐酸和NaOH溶液反应,消耗HCl和NaOH的物质的量有什么关系?
提示 等量的Al分别与足量的盐酸和NaOH溶液反应,消耗HCl和NaOH的物质的量之比为3∶1。
2.等量的铝分别与足量的盐酸和NaOH溶液反应,生成H2的量有什么关系?
提示 相同状况下,产生H2的体积比为1∶1。
3.等物质的量的盐酸和NaOH与足量的铝反应,生成H2的量又有什么关系?
提示 等物质的量的HCl和NaOH与足量的铝反应,相同状况下产生H2的体积比为1∶3。
1.铝与酸、碱溶液反应生成H2的定量关系
2.重要关系判断
一定量的铝分别与相等物质的量的盐酸和氢氧化钠溶液反应,若产生的氢气的体积比为1∶3
A.1∶1 B.2∶1 C.3∶1 D.1∶3
C
2.甲、乙两烧杯中分别装有等体积、等物质的量浓度的硫酸和氢氧化钠溶液,现向两烧杯中各加入等物质的量的铝,在相同状况下生成氢气的体积比为5∶6,则甲、乙两烧杯中的反应情况可能是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
B
解析 设Al与硫酸、氢氧化钠溶液反应生成氢气的体积分别为V甲、V乙,由化学方程式2Al+3H2SO4===Al2(SO4)3+3H2↑和2Al+2NaOH+2H2O===2NaAlO2+3H2↑可知,若两个烧杯中铝均不足,则铝完全反应,产生氢气的体积比V甲∶V乙=1∶1;若两种情况下铝均过量,则硫酸和氢氧化钠均完全反应,产生氢气的体积比V甲∶V乙=2∶3;现在氢气的体积比V甲∶V乙=5∶6,则甲烧杯中铝过量,硫酸完全反应,乙烧杯中铝完全反应,氢氧化钠过量。
3.甲、乙两烧杯中分别盛有100 mL浓度均为3 mol/L的盐酸与NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得同温同压下生成气体的体积之比为1∶2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
A
二、化学计算中的常用技巧
方法一 关系式法
当已知物和未知物之间是靠多个反应来联系时,可通过直接确定已知量和未知量之间的比例关系即“关系式”进行计算。
(1)根据多步反应的化学方程式确定关系式
写出发生反应的化学方程式,根据“中间”物质物质的量的关系写出关系式。
方法二 差量法
方法三 守恒法
(1)电子守恒:氧化还原反应中得到电子总数等于失去电子总数。
(2)电荷守恒:电解质溶液中,阳离子所带正电荷总数=阴离子所带负电荷总数;离子方程式中,反应物所带电荷总数=生成物所带电荷总数。
A.14 g B.42 g C.56 g D.28 g
D
5.在室温下,向100 mL CuSO4饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反应:
答案 0.125 mol/L
(1)现取5.00 g混合物X,充分加热后混合物质量减少了0.31 g,则原混合物中碳酸钠的质量为________。
(2)现取5.00 g混合物Y,充分加热至恒重,把放出的气体通入足量澄清石灰水中,生成2.00 g沉淀,则原混合物中碳酸氢钠的质量分数为________。
答案 (1)4.16 g (2)67.2%
微专题10 合金成分的测定
1.合金成分的测定方法
合金成分的测定分为定性和定量两个方面
(1)定性分析时,可通过观察合金的颜色或测定合金的密度大致判断金属的种类。
(2)定量分析时,可通过加酸、碱溶液验证合金的种类,对合金的成分作精确判断,再通过气体、沉淀的测量实现合金成分的定量测定。在加酸检验合金的成分时,常用的分析过程为:
2.有关合金成分的计算
解答这类问题要明确金属的性质(与酸、碱反应放出氢气等)。如Mg—Al合金在稀酸中溶解,这就要熟记Mg、Al与稀酸的反应:由Mg+2H+===Mg2++H2↑知Mg~H2,由2Al+6H+===2Al3++3H2↑知2Al~3H2,根据放出H2的量与金属的对应比例,可迅速作答。特别是铝合金溶于NaOH溶液中这类问题,首先明确Al与NaOH溶液的反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,2Al~3H2,可由这一关系得出Al的量,然后再确定铝合金中其他成分的量。
1.合金的性能往往优于组成金属,因而用途非常广泛。
(1)钠钾合金可在核反应堆中用作导热剂。5.05 g钠钾合金溶于200 mL水生成0.075 mol氢气。计算并确定该钠钾合金的化学式为________。
(2)镁铝合金广泛用于火箭、导弹和飞机制造业等。取不同质量的镁铝合金样品分别和30 mL相同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下)如下表所示:
实验序号 A B C
合金质量/mg 510 765 918
气体体积/mL 560 672 672
计算镁铝合金中镁、铝的质量之比为________。
NaK2
8∶9
解析 (1)假设在5.05 g钠钾合金中含有K、Na的物质的量分别是x、y;根据二者的质量关系可得39x+23y=5.05 g;根据失去电子的物质的量可得x+y=0.15 mol。解得x=0.1 mol,y=0.05 mol,所以n(Na)∶n(K)=1∶2,因此该钠钾合金化学式是NaK2。(2)根据表格的数据可知A组实验金属不过量,盐酸过量,金属完全反应,C组盐酸不足量,金属过量,未完全反应,所以应该以A组物质为标准。假设在510 mg镁铝合金中镁、铝的物质的量分别是m、n,则根据质量关系可得24m+27n=0.51 g;根据电子守恒可得2m+3n=(0.56 L÷22.4 L·mol-1)×2=0.05 mol。解得m=0.01 mol,n=0.01 mol,所以镁铝合金中镁、铝的质量之比为0.24∶0.27=8∶9。
2.某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色试验呈绿色)。
Ⅰ.外观暗灰色,表皮光滑;
Ⅱ.在酒精灯火焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
Ⅲ.取刮去表皮的合金10 g,放入足量的稀硫酸,收集到标准状况下的H2 8.96 L。
Ⅳ.另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
(1)试据此判断,该合金中一定含有的元素是________(填元素符号);可能含有下列元素中的________(填序号)。
A.Ag B.Mg C.Na D.Fe
(2)如果该合金中只含2种元素,则二者的质量比是________。
答案 (1)Cu、Al A (2)m(Al)∶m(Cu)=18∶7
3.化学学习小组对某镁铝合金进行了如下实验探究,请你参与并完成有关问题。
[实验药品]
12.6 g镁铝合金,200 mL a mol/L稀硫酸,520 mL 4 mol/L NaOH溶液。
[实验步骤]
①将12.6 g镁铝合金与200 mL a mol/L的稀硫酸在如图所示装置中充分反应至反应完毕,并收集生成的全部气体。
②向b内混合液中逐滴加入520 mL 4 mol/L氢氧化钠溶液并充分混合,当氢氧化钠溶液加至500 mL时生成的沉淀量最大。
[问题讨论]
(1)仪器b的名称是________。
(2)根据实验目的可知,12.6 g镁铝合金与200 mL a mol/L的稀硫酸反应时,过量的物质应该是________(填“镁铝合金”或“稀硫酸”),以保证另一种物质能够完全反应无剩余;若标准状况下,由实验步骤①得到的气体为13.44 L,则合金中镁的质量分数为________(精确到0.1%)。
答案 (1)圆底烧瓶 (2)稀硫酸 57.1%
1.6.5 g的锌片置于足量的稀盐酸中完全反应方程式为Zn+2HCl===ZnCl2+H2↑,产生的气体在标准状况下的体积是( )
A.2.24 mL B.22.4 mL C.224 mL D.2 240 mL
D
2.常温下,将0.23 g金属钠投入100 mL水中充分反应。下列说法正确的是( )
A.0.23 g金属钠中所含电子的总物质的量为0.01 mol
B.消耗水的质量为0.36 g
C.所得NaOH的物质的量为0.01 mol
D.生成气体的体积为0.112 L
C
3.等物质的量的Na、Mg、Al分别与足量的稀盐酸反应,同温同压下,产生气体的体积比为( )
A.1∶2∶3 B.3∶2∶1 C.6∶3∶2 D.1∶1∶1
解析 由化合价升降守恒知,2Na~H2、Mg~H2、2Al~3H2,假设消耗的Na、Mg、Al分别为1 mol,则生成的H2分别为0.5 mol、1 mol、1.5 mol,则三者比例关系为1∶2∶3,同温同压下,产生气体的体积比为1∶2∶3,A选项符合题意。
A
4.1.15 g金属钠与水反应,得到100 mL溶液,试计算:
(1)生成的气体在标准状况下的体积。
(2)反应后所得溶液的物质的量浓度。
答案 (1)0.56 L (2)0.5 mol/L
1.在同温同压下,50 mL气体A2跟100 mL气体B2化合生成50 mL气体C,则C的化学式是( )
A.AB2 B.A2B C.AB3 D.A2B4
解析 利用化学方程式中物质的量之比等于相同条件下气体的体积之比都等于化学计量数之比,写出该反应的化学方程式为A2+2B2===C,又根据质量守恒(原子个数守恒),可知C的化学式为A2B4。
D
2.1.6 g NaOH恰好与20 mL的盐酸完全反应,则盐酸的物质的量浓度为( )
A.0.2 mol/L B.2 mol/L C.0.5 mol/L D.1 mol/L
B
3.等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A.1∶1 B.3∶4 C.2∶3 D.4∶3
B
4.将5.0 g某合金放入足量的稀盐酸中,共收集氢气的体积(标准状况下)为2.24 L,则该合金可能是( )
A.Mg-Al合金 B.Fe-Al合金
C.Fe-Zn合金 D.Cu-Zn合金
解析 由题意知,n(H2)=0.1 mol,即产生0.1 mol H2消耗该合金5.0 g,则产生1 mol H2消耗该合金50 g,满足此条件的合金的要求是产生1 mol H2时消耗一种成分金属的质量大于50 g,另一种成分金属的质量小于50 g。对于给出的金属,产生1 mol H2时消耗各金属的质量分别为m(Mg)=24 g,m(Al)=18 g,m(Fe)=56 g,m(Zn)=65 g,Cu与稀盐酸不反应;故选B。
B
5.(2021·吉林长春高一期末)250 mL 2 mol/L的稀盐酸与一定量的铁屑充分反应,铁屑全部溶解,生成标准状况下1.12 L的氢气,则参加反应的铁屑的质量是( )
A.2.8 g B.5.6 g
C.11.2 g D.78.4 g
A
6.已知由盐酸、氯化铜、氯化铁组成的混合溶液中各阳离子的物质的量浓度相等,氯离子的总物质的量浓度为6 mol·L-1,则该100 mL混合溶液最多可以溶解铁粉的质量为( )
A.5.6 g B.16.8 g
C.11.2 g D.33.6 g
C
解析 溶液中各阳离子物质的量浓度相等,设均为x mol·L-1,氯离子总物质的量浓度为6 mol·L-1,则x+2x+3x=6 mol·L-1,解得x=1 mol·L-1,混合溶液100 mL,则盐酸、氯化铜、氯化铁的物质的量均为0.1 mol,由Fe~2HCl、Fe~CuCl2、Fe~2FeCl3可知,此溶液中最多可以溶解铁粉的质量为(0.05 mol+0.1 mol+0.05 mol)×56 g·mol-1=11.2 g。
7.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为( )
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
B
8.(2020·福建高一检测)向10.4 g Fe3O4、Fe2O3、Cu的混合物中加入1 mol·L-1的硫酸溶液140 mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的H2在高温下还原相同质量的原混合物,固体减少的质量为( )
A.1.12 g B.2.24 g
C.3.24 g D.6.42 g
B
解析 10.4 g Fe3O4、Fe2O3、Cu的混合物与H2SO4溶液恰好完全溶解,所得溶液中不含Fe3+,则溶液中的溶质为FeSO4和CuSO4,H2SO4中H元素与金属氧化物中O元素结合生成H2O,故有n(O)=n(H2SO4)=1 mol·L-1×0.14 L=0.14 mol。若用过量H2在高温下还原相同质量的原混合物,固体减少的质量等于混合物中O元素的质量,即0.14 mol×16 g·mol-1=2.24 g。
9.A、B两个烧杯中分别盛有浓度和体积均相同(100 mL 3 mol/L)的稀盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为A∶B=3∶8,则加入铝粉的质量为( )
A.2.7 g B.3.6 g
C.5.4 g D.7.2 g
D
10.把V L含有MgSO4、K2SO4的混合溶液分为两等份,一份加入a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含有b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子的浓度为( )
B
11.把CO还原Fe2O3所生成的CO2通入足量澄清石灰水中生成沉淀,若将沉淀过滤、烘干后称得质量为m g。
(1)写出CO与沉淀物质的关系式。
(2)需要通入CO的物质的量最少是多少?
12.如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容。某同学从该试剂瓶中取出24.0 g固体,配成1 L溶液,请计算:
(1)所得氢氧化钠溶液的物质的量浓度。
(2)从所得氢氧化钠溶液中取出200 mL于一烧杯中,投入足量的金属铝,完全反应后,产生的气体在标准状况下的体积。(写出解答步骤)
氢氧化钠 化学纯(CP)
500 g
品名:氢氧化钠
化学式:NaOH
相对分子质量:40
13.由FeO、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量之比为21∶8,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能为( )
A.1∶2∶2 B.1∶2∶3
C.1∶3∶1 D.1∶1∶3
D
14.向500 mL 2 mol/L的CuSO4溶液中插入一铁片,反应片刻后取出铁片,洗涤、烘干,称其质量比原来增加2.0 g。下列说法错误的是(设反应后溶液的体积不变)( )
A.参加反应的铁的质量是14 g
B.析出的铜的物质的量是0.25 mol
C.反应后溶液中c(CuSO4)=1.5 mol/L
D.反应后溶液中c(FeSO4)=1.5 mol/L
D
15.(1)等物质的量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为________。
(2)等质量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为________。
(3)将物质的量均为0.2 mol的钠、镁、铝分别投入100 mL 1 mol/L的盐酸中,三者产生的氢气在相同条件下的体积比为________。
Thanks!
本讲内容结束
